新型多金属氧酸盐光催化降解苯酚废水
2016-11-15郑旭朱秀华王炜盛峰
郑旭,朱秀华,王炜,盛峰
(大连交通大学 环境与化学工程学院,辽宁 大连 116028)
新型多金属氧酸盐光催化降解苯酚废水
郑旭,朱秀华,王炜,盛峰
(大连交通大学 环境与化学工程学院,辽宁 大连 116028)
选取苯酚为目标降解物,采用正交实验法,以1∶11系列Keggin型新型多金属氧酸盐K6TiW11O39SnⅡ(TiW11Sn)、K6ZrW11O39SnⅡ(ZrW11Sn)、K8SiW11O39SnⅡ(SiW11Sn),与商品化的1∶12系列多金属氧酸盐H3PW12O40与H4SiW12O40为光催化剂,在阳光辐照下,研究了均相溶液中上述催化剂对苯酚水溶液光催化降解效果.结果表明,阳光辐照下,上述5种光催化剂对苯酚水溶液皆有降解作用,实验条件不同,降解效果差异较大.正交实验结果表明,苯酚溶液初始浓度、初始pH值、光照时间、催化剂种类及催化剂投加量均对其降解效果产生影响.上述影响因素重要性顺序为:光催化剂种类>光照时间>苯酚溶液初始pH值>苯酚溶液初始浓度>POM催化剂投加量.其中,TiW11Sn光催化苯酚降解效果最好.当苯酚溶液初始浓度为3.05 mg/L,初始pH值为5,光照时间为5 h,溶液中TiW11Sn浓度为0.25 g/L时,苯酚降解率为51.72%,其光催化降解反应遵循Langmuir-Hinshelwood准一级动力学方程.
苯酚水溶液;阳光;光催化;正交实验
0 引言
含酚废水具有广泛的来源,如焦化废水,煤气化废水,石油化工业废水,高分子材料生产废水.制药、农药生产等行业也产生大量的高浓度含酚废水.一般国家标准规定的水体中含酚的最高允许浓度极低(我国饮用水水体≤0.002 mg/L,美国≤0.001 mg/L)[1].含酚废水对人、畜、农作物都有一定的危害性,可以使人的神经系统受到损害,危害鱼类产卵,使农作物减产甚至枯死等.含酚废水中主要含甲酚、苯酚和硝基甲酚等酚基化合物.苯酚是常见的酚类化合物,化学式为C6H5OH,无色针状晶体,具有特殊气味.苯酚对皮肤,粘膜有强烈的腐蚀作用,可抑制中枢神经或损害肝肾功能[2].因此含酚废水的治理是一项具有普遍性的重要课题.
目前已有的含酚废水的处理方法有化学法、生化法和物化法三大类[3].化学法虽氧化能力强,但对于高浓度含酚废水为初级处理,出水难达标排放,实验条件难控制并且费用较高.生化法能耗低、二次污染小,但其操作管理条件高,不同体系可生化能力差异大,其推广受到一定限制.物化法所需设备庞大,设备数量较多,条件控制较严,费用高.近年来,光催化氧化技术作为一种新型发展起来的水污染治理技术,具有环保、经济、易行等优点[4].
多金属氧酸盐(POM)是一类多功能新型催化材料,具有配合物和金属氧化物的结构特征,能同时传递质子和电子,兼具酸催化和氧化还原催化特性,催化活性高,可以作为均相催化剂[5],经固载后,还可以进行非均相催化.正交实验设计是一种节约时间与成本的高效率实验设计方法,可用部分实验来代替全面实验,通过对部分实验结果的分析,以了解全面实验的情况[6].本实验选取苯酚为目标降解物,以太阳光为光源,以本课题组制备的新型1∶11系列Keggin型多金属氧酸盐(POM):K6TiW11O39SnⅡ(TiW11Sn)[7]、K6ZrW11O39SnⅡ(ZrW11Sn)[8]、K8SiW11O39SnⅡ(SiW11Sn)[9]与商品化H3PW12O40和H4SiW12O40为光催化剂,采用正交实验法设计光催化降解苯酚水溶液的实验,研究上述催化剂对苯酚水溶液的光催化降解活性.
1 实验部分
1.1 主要试剂和仪器
主要试剂:钛钨锡;锆钨锡;硅钨锡(本实验室制备);磷钨酸(湘中地质实验研究所,AR);硅钨酸(沈阳试剂厂,AR);苯酚(天津市大茂化学试剂厂,AR);氢氧化钠(天津市博迪化工有限公司,AR);高氯酸(天津市新亚化工厂,AR);4-氨基安替比林(天津市光复精细化工研究所,AR);铁氰化钾(天津市光复科技发展有限公司,AR);氯化铵(天津南开化工厂,AR);无水乙醇(天津市富宇精细化工有限公司,AR).
主要仪器:1815D摩尔超纯水机(上海摩勒科学仪器有限公司);棱光722型可见光分光光度计(上海精密科学有限公司);PHS-3C型数显酸度计(杭州雷磁);AL104电子分析天平(梅特勒-托利多仪器上海有限公司);DF-101S恒温磁力搅拌器(上海第二分析仪器厂);SHZ-D(III)循环水式真空泵(巩义市英峪予华仪器厂).
1.2 实验方法
苯酚储备液的配置:称量1.00 g苯酚用超纯水溶解于1 L容量瓶中,稀释至标线,使用前进行标定.
苯酚溶液吸光度的测定:4-氨基安替比林法[10].原理:酚类化合物在pH值为10 ± 0.2的介质中,用铁氰化钾作氧化剂,与4-氨基安替比林反应生成红色的吲哚酚安替比林染料,其水溶液在510 nm波长处有最大吸收.用光程为20 mm比色皿测量时,酚的最低检出浓度为0.1 mg/L.
苯酚去除率的测定:
(1)苯酚直接光降解实验:取一定浓度,体积为40 mL的苯酚溶液测其光照反应前后溶液吸光度分别为A1和A2.
(2)光催化苯酚降解实验:取与(1)同样浓度和体积的苯酚溶液,加入一定量催化剂与(1)在相同实验条件下,阳光辐照进行光解实验,测此苯酚溶液光照反应前后吸光度为A3、A4.以超纯水为试剂空白样测其吸光度为A0.
苯酚直接光解降解率:DR1(%)=(A1-A2)/(A1-A0);
催化剂光催化苯酚降解率:DR2(%)=(A3-A4)/(A3-A0);
光催化苯酚降解率:DR(%)=DR2-DR1.
苯酚光催化正交实验:
以太阳光为光源,采用正交实验方法设计实验反应条件,研究苯酚光催化降解情况.本研究选择5个影响因素:苯酚溶液初始pH值(A)、POM催化剂投加量(B)、光照时间(C)、苯酚溶液初始浓度(D)及催化剂的种类(E),每个因素选取5个水平实验条件,见表1.据表1,选择L25(55)正交表进行实验条件设计,共进行25组实验,每组光催化反应具体条件详见表2.

表1 各因素水平选取表
表2中各因素下方的 1、2、3、4、5 数字分别代表每个因素的各自水平的实验条件(见表1).从表2可见,所设计的实验,任一列(因素)的各水平都涵盖了,因此使得部分实验中包括了所有因素的所有水平.任两列(因素)的所有水平组合都包括了,使任意两因素间的实验组合为全面实验.
2 结果与讨论
2.1 苯酚溶液标准曲线
标准曲线绘制:分别取V (mL):0、0.10、0.20、0.30、0.40、0.50、0.60、0.65的苯酚储备液 (1.2215 mg/mL) 于50 mL的比色管中,用去离子水稀释,配成浓度 C(mg/L):0、2.44、4.89、7.33、9.77、12.22、14.66、15.88的苯酚溶液,用4-氨基安替比林法测其吸光度,经空白校正后,绘制曲线,如图1所示.
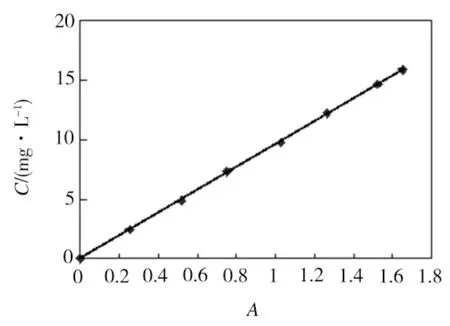
图1 苯酚溶液吸光度-浓度标准曲线
由图1可知,当苯酚溶液的浓度在2.44 ~ 15.88 mg/L之间,其吸光度与浓度呈较好的线性关系,线性相关系数,R2= 0.999 8,相关方程如下[11]:
C = 9.6332A-0.0137
(1)
因此,可据苯酚溶液光解前后吸光度变化反映其浓度改变,求出苯酚溶液的降解率,DR.
2.2 对照实验
为了排除苯酚直接光解和无光照情况下催化剂对苯酚溶液降解的影响,进行了两组对照实验:
(1)光对照实验为12.22 mg/L,40 mL的苯酚溶液,不加催化剂,在与光催化其它实验条件相同情况下同时进行,光照120 min,苯酚溶液的降解率为0;
(2)暗对照实验为12.22 mg/L,40 mL的苯酚溶液加POM催化剂,在其它实验条件相同条件下避光120 min,溶液的降解率为0.由此可见,无催化剂与光照时,苯酚溶液性质较稳定,不会被降解[12].
2.3 正交实验结果分析
根据正交实验表2设计的苯酚溶液均相光催化降解实验结果分析见表3.
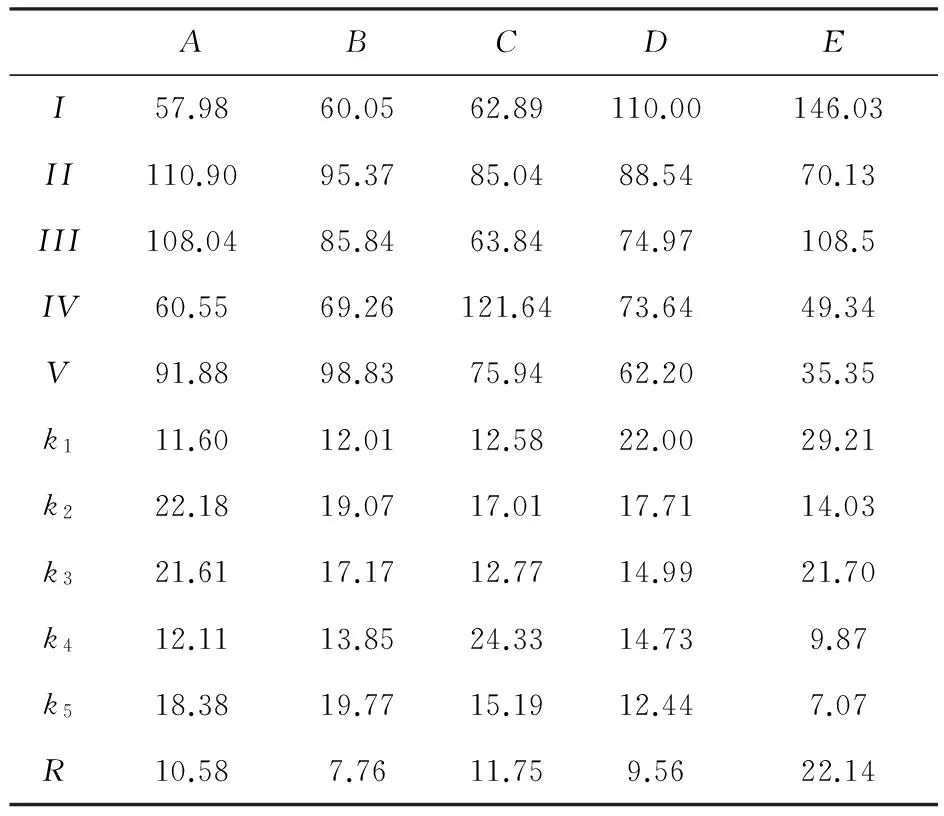
表3 正交实验数据分析
表3中,Ij代表第j列因素第1水平所对应的实验指标和,IIj代表第j列因素第2水平所对应的实验指标和,IIIj代表第j列因素第3水平所对应的实验指标和,IVj代表第j列因素第4水平所对应的实验指标和,Vj代表第j列因素第5水平所对应的实验指标和.kim代表Iim的平均值.由kim的大小可以判断第j列因素优水平和优组合.
A因素1水平对实验指标的影响获取.A1(A因素1水平)的影响反映在第1、2、3、4、5号实验中,则A1所对应的实验指标之和为:I = y1+y2+y3+y4+y5=57.98(y为每组实验的苯酚降解率),k1=I/5=11.60.同理,A2的实验指标之和为110.90,平均值为22.18.A3的实验指标之和为108.04,平均值为21.61.A4的实验指标之和为60.55,平均值为12.11.A5的实验指标之和为91.88,平均值为18.38.同理可计算出B、C、D、E各因素实验指标和以及平均值.
实验因素的优水平确定:根据正交设计的特性,对A1、A2、A3、A4、A5来说,五组实验的实验条件是完全一样的(综合可比性),可进行直接比较.如果因素A对实验指标无影响时,则k1、k2、k3、k4、k5应该相等,但经过计算可知,k1、k2、k3、k4、k5实际上不相等.说明,A因素的水平变动对实验结果有影响.根据k1、k2、k3、k4、k5的大小可以判断A1、A2、A3、A4、A5对实验指标的影响大小,由于实验指标为苯酚降解率,而k3>k5>k2>k4>k1,所以可断定A3为A因素的优水平,即苯酚溶液初始pH值为6时,为苯酚溶液初始pH值的优水平.同理:B、C、D、E因素各水平对实验指标的影响依次类推,可得出B3(POM投加量为0.015 g,即其在溶液中浓度为:0.375 g/L)、C4(光解反应5 h)、D1(苯酚溶液初始浓度为3.05 mg/L)、E1(以TiW11Sn为光催化剂),分别为各因素的优水平.
各影响因素的重要性大小确定:Rj为第j列因素的极差,反映了第j列因素水平波动时,实验指标的变动幅度.Rj越大,说明该因素对实验指标的影响越大.根据Rj大小,可以判断影响因素的主次顺序.由表3可知, RE>RC>RA>RD>RB,即对苯酚光催化降解影响因素的主次顺序是:光催化剂种类>光照时间>苯酚溶液初始pH值>苯酚溶液初始浓度>POM催化剂投加量.
2.4 均相苯酚水溶液光催化降解效果
根据正交实验表2设计的反应条件进行苯酚溶液光催化降解实验,对其光照反应前后吸光度分别进行测定,根据测定的吸光度计算出苯酚光催化的降解率,结果如图2所示.

图2 均相光催化苯酚降解率
由图2可知,不同的光催化实验条件,苯酚降解效果不同,对苯酚光催化降解效果较好的实验条件为图2中第8、12、15、24组,其具体实验条件见表4.
由表4可见,第8、15、24三组实验条件所用的光催化剂均为TiW11Sn,仅第12组实验条件所用的光催化剂为ZrW11Sn;第12组苯酚溶液初始浓度低于其它三组实验;史福有[7]研究表明TiW11Sn对活性红24模拟染料废水光催化降解最佳pH值为5,为进一步确定苯酚水溶液最佳光催化降解条件,我们进行了以下三组对比实验研究,具体实验条件见表5.

表4 苯酚光催化降解效果较好的实验条件

表5 对比实验
由表5可见,当其它实验条件完全相同情况下,以TiW11Sn为光催化剂对苯酚水溶液光催化降解效果(45.98%)优于ZrW11Sn(42.53%);当除苯酚水溶液初始pH值不同,其它实验条件完全相同情况下,其pH值为5 时,苯酚光催化降解效果(51.72%)优于pH值为6 时,苯酚光催化降解效果(45.98%).综上可知,对初始浓度为3.05 mg/L 的苯酚水溶液,最佳光催化条件为:其初始 pH值为5, 以TiW11Sn为光催化剂,溶液中催化剂的浓度为0.25 g/L,光解5 h.
2.5 苯酚光催化反应动力学
Mylonas[13]和Ozer[14]实验发现,对于均相光催化体系,其光催化氧化速率遵循Langmuir-Hinshelwood (L-H) 动力学方程式[15-16]:
(1)
式中,r为有机物在反应装置中的总反应速率(mg/(L·h)),Ct为t时刻反应物的浓度(mg/L),C0为反应物的初始浓度(mg/L),K为L-H表观吸附平衡常数(L/mg),k为反应速率常数(mg/( L·h)).
当KC0≪ 1时,表现为一级反应,可将式(1)简为如下:
(2)
式中,K′(h-1)为表观一级反应速率常数.
根据2.4节实验结果,本节对初始浓度为3.05 mg/L,初始pH值为5的苯酚水溶液(溶液中TiW11Sn浓度为0.25 g/L) 进行了其光催化降解动力学研究,阳光下光解6 h,每隔1 h取样、分析,以其ln(C0/Ct) 对光解时间 t的作图,结果表明,ln(C0/Ct) 与光解时间t呈较好的线性相关性,反应动力学方程为,ln(C0/Ct) =0.1046t - 0.0542, R2=0.9515, 表观反应速度常数K′= 0.104 6 h-1,光解半衰期t1/2=6.63 h.上述研究结果表明,阳光下,TiW11Sn均相光催化苯酚降解反应遵循L-H准一级动力学方程.
3 结论
(1) TiW11Sn、ZrW11Sn、SiW11Sn、H3PW12O40和H4SiW12O40,5种催化剂对苯酚降解皆有光催化降解作用.
(2) 根据均相正交实验结果分析,影响苯酚降解效果各因素的优水平分别为:苯酚溶液初始pH值为6、溶液中催化剂浓度为0.375 g/L、光解5 h、苯酚溶液初始浓度为3.05 mg/L、光催化剂为TiW11Sn.根据实验结果中极差大小可以判断,影响苯酚降解效果因素的主次顺序为:光催化剂种类>光照时间>苯酚溶液初始pH值>苯酚溶液初始浓度>POM催化剂投加量.
(3)对初始浓度为3.05 mg/L,初始pH值为5的苯酚水溶液(溶液中TiW11Sn浓度为0.25 g/L),其光催化降解动力学遵循Langmuir-Hinshelwood准一级动力学方程.
[1]雷乐成,汪大翚.水处理高级氧化技术[M].北京:化学工业出版社,2001.
[2]吴勇民,李甫,黄咸雨.含酚废水处理新技术及其发展前景[J].环境科学与管理,2007,32(3):150-153.
[3]李丽媛,江芳,万海勤,等.TiO2纳米薄片的合成及其光催化降解苯酚性能[J].无机化学学报,2011,27(6):1041-1046.
[4]周广阔,冯贵颖.活性炭负载纳米TiO2光催化降解苯酚的研究 [D]. 西安:西北农林科技大学, 2006.
[5]朱敏.多金属氧酸盐光催化降解活性艳橙研究 [D]. 大连:大连交通大学, 2004.
[6]任露泉.试验优化设计与分析 [M]. 北京: 高等教育出版社, 2003.
[7]史福有. Sn2+取代钛钨酸盐光催化降解模拟染料废水 [D]. 大连: 大连交通大学, 2013.
[8]SHENG FENG, ZHU XIUHUA, WANG WEI, et al. Synthesis of novel polyoxometalate K6ZrW11O39Sn·12H2O and photocatalytic degradation of azo dye aqueous solution with solar irradiation [J]. J Mol Catal A Chem. ,2014, 393: 232-239.
[9]ZHU XIUHUA, LIU JIAHUAN, ZHAO LILI, et al. Preparation of visible light response K6SiW11O39Sn for photocatalytic degradation of Acid Brilliant Scarlet [J]. Adv Mater Res, 2012, 476-478: 2005-2008.
[10]奚旦立,孙裕生,刘秀英. 环境监测 [M]. 北京:高等教育出版社, 2004.
[11]程为.负载型杂多酸(盐)催化剂光催化降解水中苯酚的研究 [D]. 大连: 大连交通大学, 2004.
[12]朱秀华,史福有,黄成琛,等.二氧化钛光催化降解活性红24模拟染料废水 [J].大连交通大学学报,2013, 34(2): 87-92.
[13]MYLONAS A, PAPACONSTANTINOU E. On the mechanism of Photocatalytic degradation of chlorinated phenols to CO2and HCl by polyoxometalates [J] . J. Photochem. Photobiol. A: Chem., 1996, 94: 77-82.
[14]OZER R R, FERRY J L. Kinetic Probes of the Mecanism of Polyoxometalate-Mediated Photocatalytic Oxidation of Chorinated Organics [J]. J. Phys. Chem. B., 2000, 104(40):9444-9448.
[15]高镰, 郑珊, 张青红. 纳米氧化钦光催化材料及应用[M]. 武汉: 化学工业出版社, 2002.
[16]邓南圣,吴峰.环境光化学[M]. 武汉: 化学工业出版社, 2003.
Photocatalytic Degradation of Phenol Wastewater with New Types of Polyoxometallates Under Sunlight Irradiation
ZHENG Xu,ZHU Xiuhua,WANG Wei, SHENG Feng
(School of Environmental and Chemical Engineering, Dalian Jiaotong University, Dalian 116028, China)
Aqueous phenol solution was selected as the goal dagradation compound, and a series new types of 1∶11Kegginpolyoxometallates,K6TiW11O39SnⅡ(TiW11Sn),K6ZrW11O39SnⅡ(ZrW11Sn),K8SiW11O39SnⅡ(SiW11Sn),andcommercial1∶12 Keggin polyoxometallate, H3PW12O40and H4SiW12O40, were chosen as photocatalysts. The photocatalytic degradation of the homogenous aqueous phenol solution under the sunlight irradiation was studied. Experiment results indicate that the aqueous phenol solution can be degradated with the above five photocatalysts under the sunlight irradiation. The degradation effects of the aqueous phenol solutions are quite different with different experiment conditions. The orthogonal test results show that the photocatalytic degradation efficiency of the aqueous phenol solution is affected by the initial concentration and the initial pH values of the phenol solution, the photolysis time, the kinds of catalysts and the dosage of the catalyst. The order of the importance of the above influence factors are the kinds of catalysts > the illumination time > the initial pH of the phenol solution > the dosage of catalyst > the initial concentration of the phenol solution. TiW11Sn is the best photocatalyst for the phenol degradation. When the initial concentration of the phenol solution is 3.05 mg/L with the initial pH values of 5 and the amount of TiW11Sn catalyst of 0.25 g/L, the decolorization rate of the aqueous phenol solution was 51.72% for sunlight irradiation 5 h. The reactions of the phenol photocatalytic degradation follow the Langmuir-Hinshelwood pseudo-first-order kinetics.
aqueous phenol solution; sunlight; photocatalysis; orthogonal test
1673- 9590(2016)02- 0114- 06
2015-06-29
辽宁省高等学校优秀人才支持计划资助项目(LR2013019);辽宁省高等学校环境科学与技术重点实验室基金资助项目(LS2010031)
郑旭(1989-)女,硕士研究生;朱秀华(1965-),女,教授,博士,主要从事环境化学的研究E- mail:zhuxiuhua1@hotmail.com.
A
