多子小瓜虫的形态发生及其寄生导致翘嘴鲌鳃组织病理变化
2016-11-12刘春雷顾泽茂翟艳花
王 哲 刘春雷 顾泽茂 翟艳花
(1. 华中农业大学水产学院,武汉 430070; 2. 淡水水产健康养殖湖北省协同创新中心,武汉 430070; 3. 湖北鱼禾园生态农业开发有限公司,荆州 434020)
多子小瓜虫的形态发生及其寄生导致翘嘴鲌鳃组织病理变化
王哲1,2刘春雷3顾泽茂1,2翟艳花1,2
(1. 华中农业大学水产学院,武汉 430070; 2. 淡水水产健康养殖湖北省协同创新中心,武汉 430070; 3. 湖北鱼禾园生态农业开发有限公司,荆州 434020)
为阐明小瓜虫的形态发生及其对鳃组织的危害过程,本文开展了多子小瓜虫的光镜观察和翘嘴鲌鳃组织病理切片方面的研究。光镜形态研究发现小瓜虫运动时呈球形,直径500—800 μm; 前端具有耳廓状胞口和内陷的袋状胞咽; 环境温度为18℃时,滋养体经1h左右发育成包囊,体表形成一层透明胶膜,并以虫体中央的分裂沟为界进行二分裂; 子代虫体从8细胞期进入16细胞期时,包囊内部形成内胞膜将子代虫体等分为两个集团。组织切片结果显示虫体呈卵圆形,挤压了周围的包裹细胞,导致组织变形; 鳃小片黏连,鳃丝上皮细胞受到破坏,严重区域鳃丝结构被完全破坏。本研究解析了小瓜虫的形态发生与发育过程以及对宿主危害的组织病理结构与机制,为揭示小瓜虫的侵染、发育和成熟规律奠定了理论基础,并为小瓜虫病害的有效防控提供理论资料。
多子小瓜虫;滋养体;形态发生;翘嘴鲌;组织病理
多子小瓜虫(Ichthyophthirius multifilii)俗称小瓜虫,属纤毛门(Ciliophora Doffein,1901)、膜口目(Hymenostomatida Delage & Hérouard,1896)、凹口科(Ophryoglenina Canella,1964),是一种世界分布的纤毛类原生动物寄生虫,多寄生于鱼体体表和鳃组织,形成肉眼可见的白色小点,可引起鱼类大量死亡并造成严重的经济损失[1—4]。1876年,法国科学家Fouquet[1]通过显微镜观察引起鱼类白点病的病原体,首次将其命名为多子小瓜虫(Ichthyophthirius multifilii),随后,Maclennan等[3]对小瓜虫的形态特征和生活史进行了补充描述,但由于年代久远,上述研究已无法考究。20世纪70年代起,Ewing等[5—8]利用电子显微镜系统观察了小瓜虫幼虫侵染宿主、形成滋养体、发育以及成熟脱落的过程,并描述了小瓜虫包囊期的形态和包囊壁特征。然而,其研究结果多为亚显微结构的观察,缺少小瓜虫活体形态学数据、照片以及形态发生过程的描述。相比于国外,我国关于小瓜虫的研究起步较晚,直到1960年,倪达书和李连祥[3]首次报道了我国小瓜虫的研究成果,描述了小瓜虫各阶段的形态特征以及其生活史,绘制了相关图片,提出了小瓜虫成虫耳廓状胞口以及幼虫体纤毛系并未特化的观点,与国外研究观点存在一定分歧。但受当时科研条件和技术的限制,上述研究缺乏直观而清晰的光学照片,不利于后期研究者的观察比较和养殖生产者的精准诊断,尚需进一步的研究来进行补充和完善。
目前,国内外关于小瓜虫的研究多集中于药物和疫苗方面。事实上,作为鱼类重要病原,小瓜虫的生活史、形态发生、侵染过程及致病机理等方面尚未完全清楚,这直接影响了小瓜虫药物和疫苗的研制。在生产实践中,除已被禁止使用的孔雀石绿和硝酸亚汞外,大多数药物如化学试剂[9]、中药提取物[10,11]、真菌提取物[12]等均缺乏较好的治疗效果,很难起到病害防控的作用; 另外,受表面抗原差异性的影响,关于小瓜虫疫苗的研究仍处于初级阶段,无法应用到实际生产上[13,14]。因此,为了有效防控小瓜虫病害,本文以寄生翘嘴鲌鳃部的小瓜虫为研究对象,通过形态学观察和组织病理学方法,研究小瓜虫的形态发生过程,以期揭示其侵染、发育和成熟规律,解析小瓜虫对宿主危害的组织病理结构及机制,丰富小瓜虫的基础研究。
1 材料与方法
1.1材料来源
病原体小瓜虫采自湖北鱼禾园生态农业开发有限公司(荆州)养殖的两龄患病翘嘴鲌(Culter alburnus)。病鱼体长30—40 cm,体重约1000 g左右,肉眼可见患病鱼鳃上有大量的白色小点。
1.2取样步骤
取患病翘嘴鲌4尾,分别取体表黏液、鳃、鳍条进行压片观察,确定病原体主要寄生在鳃丝上,进一步通过高倍镜检发现病原体符合小瓜虫的形态学特征。取患病鱼鳃丝,分别用波恩液、10%甲醛、饱和升汞、70%乙醇固定。
用吸管吸取适量灭菌水,轻轻冲洗鳃丝,除去多余的黏液和血液,多次冲洗后,将新鲜患病鱼的鳃丝剪成小块,放入无菌培养皿中,加灭菌水没过鳃组织,静置一段时间(约5—10min)后,肉眼可见大量白色的小瓜虫活跃在灭菌水中。在室温18℃的条件下,于解剖镜下用微吸管吸取少量小瓜虫置于凹玻片中,轻轻盖上盖玻片于显微镜下观察,并分时段记录虫体活动与分裂情况。
1.3甘油酒精法观察
取用10%甲醛或升汞固定的小瓜虫,用蒸馏水洗净后放入10%的甘油酒精(10 mL甘油+90 mL无水乙醇)中。观察时吸出若干虫体于载玻片上,小心盖上盖玻片,室温放置24h以上,待酒精挥发、甘油浓缩后于显微镜下进行观察和拍照。
1.4病理切片制备
取波恩氏液固定的鳃丝,剪成适宜大小,常规酒精梯度脱水,二甲苯透明处理,石蜡包埋,连续纵向切片,切片厚度为4 μm,水摊片、脱蜡后HE染色,干燥后中性树胶封片,显微镜下观察、拍照。
2 结果
2.1小瓜虫滋养体的形态特征
小瓜虫在翘嘴鲌鳃上形成大量肉眼可见白色的小点,经过灭菌水的冲洗、浸泡后,可见小瓜虫的滋养体从鳃丝上游离下来,并在水体中作无序的快速游动。脱离鱼鳃的滋养体呈卵圆形,直径500—800 μm,虫体柔软可变形。细胞核为透明的马蹄形或香肠形,容易被观察到,并随着细胞质流动而发生相应的变化; 细胞质内含有大量灰黑色的圆形颗粒,在虫体内作有序的流动; 腹缝线往往位于虫体的一侧,透明、无纤毛分布(图版Ⅰ-A、B)。滋养体周身被有短小密集的纤毛,游动时快速摆动;纤毛列从虫体的前极发出,围绕虫体呈弧形连续排列,最终汇集于虫体的后极。胞口部分相对于虫体其他部位较厚实,位于前级下方,正面观为椭圆形,围口纤毛列呈一侧较密集、一侧较疏松的"6"字形绕进胞口内部(图版Ⅲ-C-F)。胞口向内延伸至细胞内形成短小的袋状胞咽,胞咽内壁上附有大量密集的纤毛,在胞咽底部外侧,可见有一些粗壮的纤毛支撑着胞咽结构(图版Ⅱ-F)。
2.2小瓜虫包囊期形态特征
在水温18℃条件下,经过1h左右,大部分滋养体逐渐停止游动,沉淀在凹玻片底部,并在原地旋转。约0.5h后,小瓜虫从滋养体发育至包囊期,虫体外侧形成一层透明的包囊壁将虫体包裹起来。包囊一般呈椭圆形,与包裹的子代虫体数量成正比;包囊壁分内外两层,其内侧靠近虫体的包囊壁光滑,而外侧的包囊壁粗糙,并黏附有其他物质(图版Ⅱ-A、B)。包囊形成后,虫体在包囊内部快速旋转,以中央的分裂沟为界限向两侧拉长,同时,沿分裂沟方向由边缘向内部不断凹陷(图版Ⅱ-C)。当虫体进行第一次二分裂时,原始的胞口和前极依然存在,并未消失(图版Ⅱ-D,图版Ⅲ-A、B)。新生成的两个子代虫体快速反方向旋转,间隔10min左右,两个子代虫体继续进行二分裂,依次形成4、8、16、32等子代(图版Ⅰ-D-F)。当虫体由8细胞期进入16细胞期时,包囊内形成一层內胞膜(Endocystical membrane)将子代虫体等分成2个集团(图版Ⅰ-E、F),每个集团进行独立的二分裂。24h后,几乎所有虫体都形成包囊进行分裂,但有少数虫体并未形成包囊,在水体中停止游动,细胞膨大、破裂,细胞质流出、死亡。部分形成包囊的虫体也会停止分裂,包囊破裂,虫体流出,细胞裂解死亡。
2.3组织病理分析
从组织切片可以看出,健康翘嘴鲌的鳃丝和鳃小片有规律的沿一个方向紧密排列,鳃组织结构完整,鳃丝间隙清晰,鳃小片上皮细胞呈扁平状,排列整齐紧密(图版Ⅳ-A); 在被感染鱼的鳃上,小瓜虫大部分寄生于鳃丝的基部、顶端或鳃丝血管的附近;在虫体寄生的区域,鳃小片上皮细胞肿胀、坏死,末端黏连增生,将小瓜虫包裹在里面(图版Ⅳ-B)。当小瓜虫严重感染宿主鳃时,鳃小片上皮细胞严重受损,鳃小片扭曲、断裂; 鳃丝间充斥大量血液、黏液和弥散的细胞; 虫体挤压周围包裹的宿主细胞,鳃组织结构难以辨别,只可观察到虫体、弥散的组织细胞和鳃丝血管(图版Ⅳ-C-F)。随着小瓜虫在寄生部位发育、生长,虫体周围包裹的细胞层数也逐渐增多,使得寄生部位组织增生,因此形成肉眼可见的“白点”。
组织中的小瓜虫随包裹的细胞呈现圆柱形或椭球形。小瓜虫的口区纵切面为袋状,较短,内侧布满密集的纤毛; 虫体的细胞质中含有大量圆形颗粒(图版Ⅴ-A)。部分小瓜虫的细胞核和细胞膜之间,有一个封闭的囊膜结构; 这种结构是由一层与细胞膜厚度和结构相似的膜构成,膜内有空腔,表面结构不光滑并有密集的点状颗粒,并与细胞膜相连(图版Ⅴ-B-E); 连续的组织切片显示这种囊膜是一种连续的、立体的结构,在虫体中占据较大的空间,并在细胞内部延伸(图版Ⅴ-C-E)。此外,本研究发现成熟小瓜虫个体的细胞膜会凹陷进入细胞质中,形成有间隙的内折结构(图版Ⅴ-F)。
3 讨论
3.1小瓜虫的形态及形态发生
在早期研究中,陈启鎏[2]认为小瓜虫的胞口结构是圆形或椭圆形,而倪达书和李连祥[3]认为其幼虫和成虫的胞口结构皆是耳廓状。本研究通过仔细观察成虫的形态和鳃组织切片,发现小瓜虫胞口一侧稍稍低于另一侧,表明小瓜虫胞口的一侧向下凹陷,是立体结构的耳廓状,而并非是平面的椭圆形构造,因此,针对胞口的形态结构,我们更倾向于支持倪达书先生的观点。同时,小瓜虫在第一次分裂时其原始胞口一直存在,并没有消失,但仅能在分裂产生的两幼虫中的其一发现,另一幼虫观察不到胞口的存在; 同样,雷曼红[15]采用电子显微镜也观察到小瓜虫在进行二分裂时存在胞口结构,由此,我们推测小瓜虫在进行分裂时其中一个幼虫继承了原有的胞口,另一幼虫的胞口是新形成的,而不是原有胞口重新分化形成两个胞口,但其具体形成机制尚不清楚,需进一步研究。
小瓜虫的成虫虫体细胞质中充满了灰黑色或者灰白色的圆形颗粒,使虫体在光镜观察下呈灰黑色,经过HE染色后,这些颗粒有些被染成深红色。Nickell和Ewing[16]认为小瓜虫虫体内的圆形颗粒使虫体具有天然的保护色,从而使得小瓜虫得以规避敌害生物而完成整个生活史,并且这种颗粒的存在还将影响其后续生活史的进行[6]。在18℃条件下,当滋养体从寄生部位游离下来时,有些虫体在脱离鱼体1h后即进入包囊期,而有些经过24h才进入包囊期; 现阶段研究表明小瓜虫在15—20℃时,100%的小瓜虫4—12min内即可形成包囊[15],也可在18—21℃、25—32s内可形成包囊[17]; 这说明水温、水体环境、宿主、虫体的寄生部位或寄生状态都是影响小瓜虫形成包囊的因素。本研究中小瓜虫进入包囊期时间具有明显差异,可能是因为采用物理的方法强制将小瓜虫从鱼鳃上剥离下来,使得部分虫体尚未彻底成熟,未成熟的虫体进入包囊期时间过长或者在包囊阶段裂解死亡,无法顺利完成后续的生活史阶段。本研究在分离包囊期的虫体时,发现其很难被吸管吹打起来,且在光镜下可发现包囊外表面通常不光滑并黏附有颗粒物质,这说明外包囊壁具有一定的黏附作用,有利于包囊黏附在水中基质或水生生物上,从而增加了小瓜虫子代的成活率和感染寄主机率,同时这与Nickell和Ewing[16]的观察结果一致:小瓜虫包囊壁分为两层,外层不光滑,起附着作用; 内层光滑,起保护作用。
小瓜虫的虫体在游动时细胞呈卵圆形,经HE染色后,可以发现虫体在寄生部位形态通常不规则,细胞膜可以向凹陷形成内折结构,说明小瓜虫的细胞膜柔软,可塑性较高。我们推测这种柔软的细胞体结构增加了虫体与宿主细胞接触的表面面积,有利于小瓜虫摄食宿主的细胞和排泄代谢废物,尤其是当多种寄生虫寄生于同一宿主时,这种细胞结构更有利于小瓜虫在竞争中存活下来[18]。本研究在观察鳃组织切片时,发现部分小瓜虫内部存在一个立体的结构,与内质网的囊膜状结构类似[18],但大小与内质网不同,目前记载的内质网结构大多数依靠投射电子显微镜才得以观察[15,19,20],因此,小瓜虫的这种内部结构尚不清楚,究竟是由细胞膜内折形成还是虫体细胞的内部结构还有待于后续的研究。
3.2组织病理分析
病理切片结果显示,小瓜虫的寄生方式不同于斜管虫和车轮虫等常见的体外致病性纤毛虫,主要表现为小瓜虫多寄生于鳃部血管附近,虫体周围有数层细胞包裹,这种“内寄生”的方式使小瓜虫得以规避外界环境的刺激[21]。小瓜虫幼虫抵达寄生部位时,幼虫损伤上皮细胞,宿主为了修复虫体造成的损伤,修补上皮细胞的同时将小瓜虫包裹在组织里面[11]。因此当小瓜虫在宿主体表形成肉眼可见的"白点"时,表明鱼体已经被小瓜虫严重感染了。此时,虫体外有多层上皮细胞包裹,而上皮细胞具有保护、吸收和分泌等功能,这些细胞的存在阻碍了外界药物的快速渗透,导致多数药物对寄生阶段的小瓜虫无效[9—11,17],从而使寄生在上皮细胞内的小瓜虫规避外界不良环境的刺激。在研究过程中,我们观察到有时上皮细胞会包裹虫体从鳃丝上脱落下来,这可能是因为虫体可在组织内部穿梭,破坏了组织结构,造成鳃小片受损、断裂,直至脱落下来; Antychowicz等[22]则认为这种现象是机体为了抵御小瓜虫造成的进一步的组织损伤和继发感染而采取的自我保护机制。小瓜虫的寄生导致鳃组织受到严重破坏,鳃小片断裂,鳃丝间充斥着大量的血液、黏液和组织,严重阻碍上皮细胞与外界的气体交换; 其次,由于鳃结构遭到严重破坏,引起鱼类体液、营养物质流失,造成鱼类代谢紊乱; 上皮细胞的不完整又加剧了鱼类继发性细菌感染的风险,在这些因素的联合作用下,导致感染了小瓜虫的鱼类极易死亡[3]。
[1]Fouquet D. Note sur une espece d'infusoires parasites des poissons d'eau douce [J]. Archives de Zoologie Expérimentale et Générale,1876,5:159—165
[2]Chen Q L. The protozoan parasites from four species of Chinese pond fishes:Cteopharyngodon idelilus,Mylopharyngodon aethiops,Aristichthys nobilis and Hypophthalmichthys molitrixⅠ. The protozoan parasites of Cteopharyngodon idelilus [J]. Acta Hydrobiologica Sinica,1955,123—164 [陈啓鎏. 青、鲩、鳙、鲢等家鱼寄生原生动物的研究Ⅰ.寄生鲩鱼的原生动物. 水生生物学报,1955,123—164]
[3]Ni D S,Li L X. Studies on the morphology and life cycle of Ichthyophthirius multifiliis and its control,with a description of a new species [J]. Acta Hydrobiologica Sinica,1960,2:197—225 [倪达书,李连祥. 多子小瓜虫的形态、生活史及其防治方法和一新种的描述. 水生生物学报,1960,2:197—225]
[4]Abowei J F N,Briyai O F,Bassey S E. A review of some basic parasite diseases in culture fisheries flagellids,dinoflagellides and ichthyophthriasis,ichtyobodiasis,coccidiosis trichodiniasis,heminthiasis,hirudinea infestation,crustaceanparsite and ciliates [J]. British Journal of Pharmacology and Toxicology,2011,2(5):213—226
[5]Ewing M S,Kocan K M,Ewing S A. Ichthyophthirius multifiliis(Ciliophora) Invasion of Gill Epithelium [J]. The Journal of Protozoology,1985,32(2):305—310
[6]Ewing M S,Kocan K M. Ichthyophthirius multifiliis(Ciliophora) Development in Gill Epithelium [J]. The Journal of Protozoology,1986,33(3):369—374
[7]Ewing M S,Kocan K M. Ichthyophthirius multifiliis(Ciliophora) exit from gill epithelium [J]. The Journal of Protozoology,1987,34(3):309—312
[8]Ewing M S,Kocan K M,Ewing S A. Ichthyophthirius multifiliis:morphology of the cyst wall [J]. Transactions of the American Microscopical Society,1983,102(2):122—128
[9]Sudová E,Straus D L,Wienke A,et al. Evaluation of continuous 4-day exposure to peracetic acid as a treatment for Ichthyophthirius multifiliis [J]. Parasitology Research,2010,106(2):539—542
[10]Liang J H,Fu Y W,Zhang Q Z,et al. Identification and effect of two flavonoids from root bark of Morus alba against Ichthyophthirius multifiliis in grass carp [J]. Journal of Agricultural and Food Chemistry,2015,63(5):1452—1459
[11]Huang B,Chang H J. The effect of different chemicals on Ichthyophthirius disease in goldfish [J]. Fisheries Science,2003,22(2):18—20 [黄斌,常红军. 不同药物对金鱼小瓜虫病的防治效果. 水产科学,2003,22(2):18—20]
[12]Yao J Y,Xu Y,Yin W L,et al. Evaluation of nystatin isolated from Streptomyces griseus SDX-4 against the ciliate,Ichthyophthirius multifiliis [J]. Parasitology Research,2015,114(4):1425—1431
[13]Lin T L,Clark T G,Dickerson H. Passive immunization of channel catfish(Ictalurus punctatus) against the ciliated protozoan parasite Ichthyophthirius multifiliis by use of murine monoclonal antibodies [J]. Infection and Immunity,1996,64(10):4085—4090
[14]Wang X,Dickerson H W. Surface immobilization antigen of the parasitic ciliate Ichthyophthirius multifiliis elicits protective immunity in channel catfish(Ictalurus punctatus) [J]. Clinical and Diagnostic Laboratory Immunology,2002,9(1):176—181
[15]Lei M H. Studies on the Development of morphologu of Ichthyophthirius multifiliis and histopathology of the trophozoites experimental infections in Goldfish [D]. Sichuan Agricultural University,2005 [雷曼红. 多子小瓜虫形态发育及其感染金鱼的动态组织病理研究. 四川农业大学,2005]
[16]Nickell T A,Ewing M S. Dispersal of Ichthyophthirius multifiliis(Ciliophora) [C]. Proceedings of the Oklahoma Academy of Science,1989,69:23—25
[17]Chen D L. The studies on pathogeny,pathology,medication and immunoprophylaxis of Ichthyophthirius multifiliis of freshwater fishes [D]. Southwest China Normal University,2004 [陈达丽. 淡水鱼小瓜虫病的病原,病理及药物和免疫预防研究. 重庆西南师范大学. 2004]
[18]Matthews R A. Ichthyophthirius multifiliis fouquet and Ichthyophthiriosis in freshwater teleosts [J]. Advances in Parasitology,2005,59:159—241
[19]Porter K R,Claude A,Fullam E F. A study of tissue culture cells by electron microscopy methods and preliminary observations [J]. The Journal of Experimental Medicine,1945,81(3):233—246
[20]Lobo-da-cunha A,Azevedo C. Enzyme cytochemistry of the alveolar sacs and Golgian-Like cisternae in the ciliate Ichthyophthirius multifiliis [J]. The Journal of Protozoology,1990,37(3):206—211
[21]Nigrelli R F,Pokorny K S,Ruggieri G D. Notes on Ichthyophthirius multifiliis,a ciliate parasitic on fresh-water fishes,with some remarks on possible physiological races and species [J]. Transactions of the American Microscopical Society,1976,607—613
[22]Antychowicz J,Rogulska A,Zelazny J,et al. Scanning electron microscope studies on Ichthyophthirius multifiliis infection in the skin of carp Cyprinus carpio [J]. Bulletin of the Veterinary Institute in Puławy,1992,35:1—6
MORPHOLOGY AND MORPHOGENESIS OF ICHTHYOPHTHIRIUS MULTIFILIIS AND PATHOLOGICAL STUDY OF GILLS OF CULTER ALBURNUS
WANG Zhe1,2,LIU Chun-Lei3,GU Ze-Mao1,2and ZHAI Yan-Huan1,2
(1. College of Fisheries,Huazhong Agricultural University,Wuhan 430070,China; 2. Key Lab of Freshwater Animal Breeding,Ministry of Agriculture,Wuhan 430070,China; 3. Hubei Yuheyuan Eco Agricultural Development Co.,Ltd,Jingzhou 434020,China)
Ichthyophthirius multifiliis,a widely distributed protozoan ciliate,can infect various aquatic animals and results in Ichthyophthiriasis to cause serious economic losses. In order to clarify the morphology and morphogenesis of I. multifiliis and the pathological injuries of gill caused by this parasite. In present study,we carried on a survey on morphology and morphogenesis of I. multifiliis trophont and gill histopathology caused by this parasite isolated from Culter alburnus. Under light microscopy,trophonts that removed from host tissue assumed a spherical shape with a diameter range from 500 to 800 μm; ear-shaped cytostome and bag-shaped cytopharynx located in the anterior field; trophont encysted itself and transformed to tomont at 18 in 1h,and then underwent a rapid sequence of binary fission; a new endocystical membrane formed to separate the daughter cells into two equal groups during 8-cell stage to 16-cell stage. Pathological analysis indicates that I. multifiliis assumed oval in parasitic positions,stimulated and stressed the surrounded epithelial cells,caused deformation of tissue,adhesion of secondary gill and injuries of epithelial cells and even completely damaged the structure of gills. The present study provides detail description of morphology and morphogenesis of I. multifiliis and the mechanism of pathological injuries caused by this parasite,in order to lay the theoretical foundation for clarifying I. multifiliis invasion and development in the host and provide theory for treatment of Ichthyophthiriasis.
Ichthyophthirius multifiliis; Trophont; Morphogenesis; Culter alburnus; Histopathology
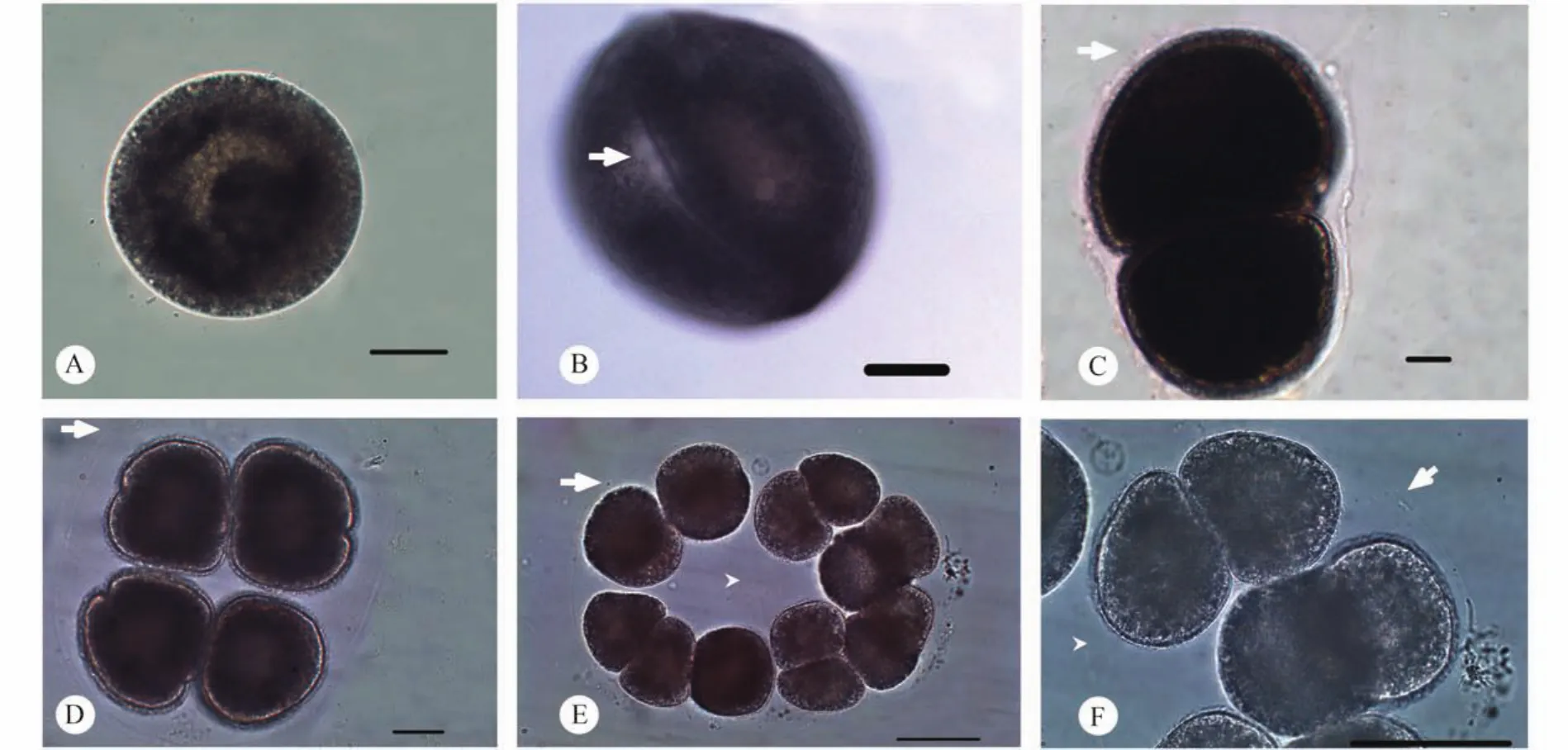
图版Ⅰ 多子小瓜虫活体分裂Plate Ⅰ The cellular cleavage of the Ichthyophthirius multifiliis
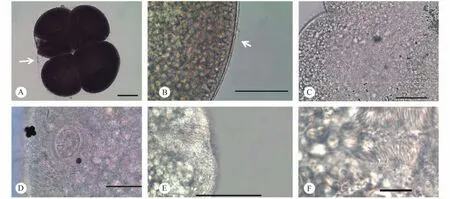
图版Ⅱ 多子小瓜虫形态Plate Ⅱ The morphology of Ichthyophthirius multifiliis
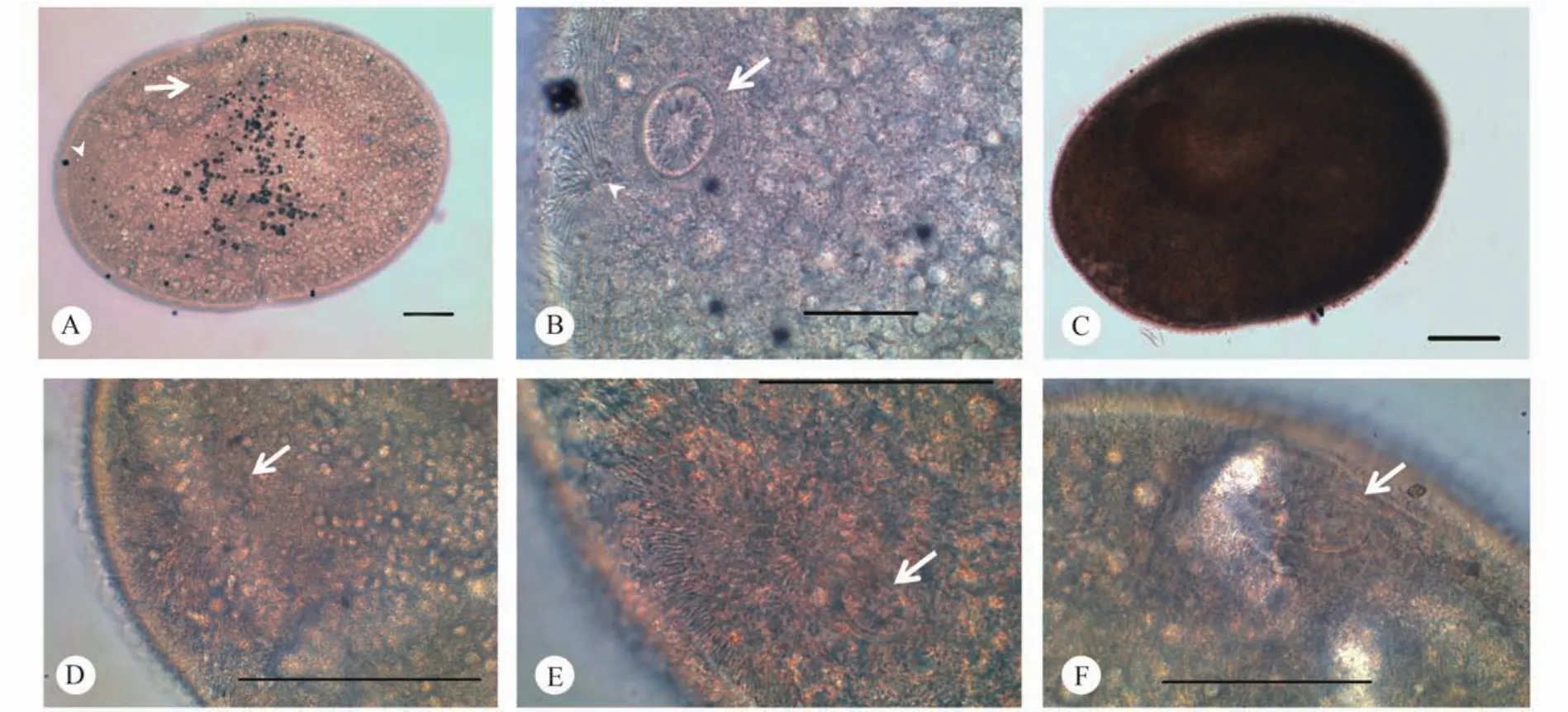
图版Ⅲ 甘油酒精透明的虫体Plate Ⅲ The Ichthyophthirius multifiliis treated by glycerin and ethanol

图版Ⅳ 鳃部组织切片Plate Ⅳ Histological sections(H & E) of gills
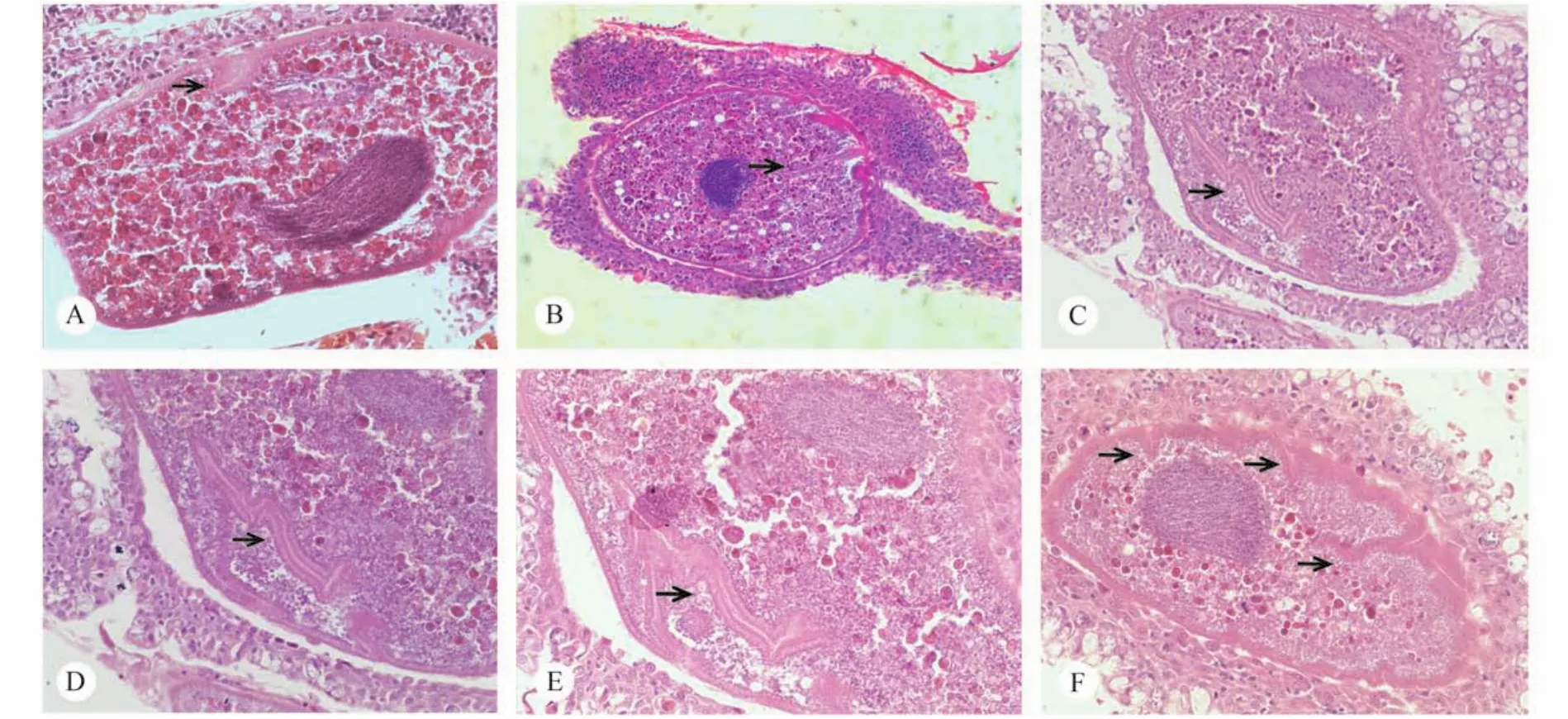
图版Ⅴ 组织切片中小瓜虫的结构Plate Ⅴ The histological sections(H & E) of Ichthyophthirius multifiliis
Q959.116
A
1000-3207(2016)05-0935-07
10.7541/2016.121
2015-10-22;
2016-03-04
湖北省重大科技创新计划(2013ABA009); 中央高校基本科研业务费专项资金(项目批准号2013PY023,2662015PY089)资助[Supported by the Major National Science and Technology Innovation Project of Hubei Province(2013ABA009); Fundamental Research Funds for the Central Universities(2013PY023,2662015PY089)]
王哲(1991—),男,山东济宁人; 博士研究生; 研究方向为寄生虫学。E-mail:wangz77@126.com
翟艳花(1983—),女,河南焦作人; 博士后; 研究方向为水产动物病害学。E-mail:348178741@qq.com
