斧文蛤金属硫蛋白基因的克隆与表达分析
2016-11-12蒋国萍程雪艳滕爽爽柴雪良林兴管刘广绪肖国强
蒋国萍 程雪艳 滕爽爽 柴雪良, 林兴管 刘广绪 肖国强
(1. 浙江省海洋水产养殖研究所,温州 325005; 2. 浙江省近岸水域生物资源开发与保护重点实验室,温州 325005;3. 上海海洋大学水产与生命学院,上海 201306; 4. 温州医科大学检验医学院,生命科学学院,温州 325005;5. 浙江大学动物科学学院,杭州 310058)
斧文蛤金属硫蛋白基因的克隆与表达分析
蒋国萍1,2,3程雪艳1,2,4滕爽爽1,2柴雪良1,2,3,4林兴管1,2刘广绪5肖国强1,2
(1. 浙江省海洋水产养殖研究所,温州 325005; 2. 浙江省近岸水域生物资源开发与保护重点实验室,温州 325005;3. 上海海洋大学水产与生命学院,上海 201306; 4. 温州医科大学检验医学院,生命科学学院,温州 325005;5. 浙江大学动物科学学院,杭州 310058)
金属硫蛋白(Metallothionein,MT)是一类富含半胱氨酸的小分子蛋白质,参与机体重金属解毒、维持金属元素代谢平衡以及清除自由基等生理功能。为了解斧文蛤金属硫蛋白(Ml-MT)的分子生物学特征及其在重金属Cd2+胁迫下的响应机制,本文采用RACE技术从斧文蛤(Meretrix lamarckii)总RNA反转录产物中获得了636 bp的Ml-MT cDNA基因序列。该序列包含65 bp的5′非编码区(UTR)和340 bp的3′非编码区(UTR)以及231 bp的开放阅读框(ORF),可编码76个氨基酸; 其中半胱氨酸占27%,不含芳香族氨基酸,含16个MT所特有的Cys-Xn-Cys结构,预测的分子量约为7.704 kD,理论等电点7.138。MT氨基酸序列比对分析表明:斧文蛤金属硫蛋白(Ml-MT)与丽文蛤(Meretrix lusoria)的相似性高达88%,与文蛤(Meretrix meretrix)的同源性为87%。实时荧光定量(qRT-PCR)检测MT在斧文蛤5种组织中均有表达,但存在组织特异性,其中内脏团表达量最高,其次依次为鳃丝、闭壳肌、外套膜、斧足。在Cd2+(0.13 mg/L)胁迫0、6h、12h、24h、48h、72h和96h下,斧文蛤内脏团MT呈现出不同程度的上调表达,具体表现为“高-低-高-低”的波浪式变化,除6h以外,其他时间点均与对照组存在极显著差异(P<0.01)。本研究表明:MT基因在维护机体正常生理功能及斧文蛤抵御重金属Cd2+胁迫过程中发挥着重要的分子调控作用。
斧文蛤;金属硫蛋白;基因克隆;表达分析;Cd2+
斧文蛤(Meretrix lamarckii)隶属于瓣鳃纲(Lamellibranchia)、帘蛤目(Veneroida)、帘蛤科(Veneridae)、文蛤属(Meretrix),是我国沿海重要的海水经济贝类种类之一[1]。斧文蛤营埋栖型生活、靠滤水进行呼吸及取食[2,3],因此可能极易受到环境重金属的污染胁迫。金属硫蛋白(Metallothionein,MT)是一类低分子量,富含半胱氨酸,有丰富的Cys-X(1-3)-Cys(X为除半胱氨酸以外的其他氨基酸)结构域的特异性结合蛋白[4]。MT广泛存在于生物体内、能被金属离子、氧化损伤以及免疫刺激等多种因素诱导,参与生物体内金属水平的稳态调节、自由基清除、重金属解毒等生物学功能[5]。研究表明:MT的表达水平能够间接反映生物体对环境的应激反应情况以及对重金属的解毒能力,因此常用于评价重金属的污染状况和生物体的适应能力[6]。目前,MT已被联合国环境规划署遴选为海洋环境监测的生物标志物之一[7](UNEP/RAMOGE)。
早在1979年,Ridlington等[8]在美洲牡蛎(Crassostrea virginica)中报道了软体动物的首个MT序列,此后陆续在紫贻贝(Mytilus edulis)[9]、海湾扇贝(Argopecten irradians)[10]、青蛤(Cyclina sinensis)[11]和菲律宾蛤仔(Ruditapes philippinarum)[12]等多种软体动物体中发现了MT的存在。然而,关于斧文蛤的MT基因及表达尚未见报道。本研究以斧文蛤为实验对象,利用RACE技术克隆Ml-MT基因全长cDNA序列,利用生物信息学手段分析了Ml-MT的分子特性,通过实时荧光定量技术(qRT-PCR)研究其在斧文蛤不同组织的表达差异,并探究Cd2+暴露对斧文蛤MT基因表达的影响,研究结果可为探讨斧文蛤MT解毒机理和功能提供一定的参考资料。
1 材料与方法
1.1实验材料
试验所用斧文蛤取自浙江省海洋水产养殖研究所清江实验基地[壳长(40.19±1.63) mm],实验室内暂养7d [盐度30±1,pH为8.20±0.05,温度(22±2) ℃],选择闭壳反应灵敏个体进行实验。暂养过程中保持连续充气,每24h换水1次,且每12h投喂约5×104cell/ mL的球等鞭金藻(Isochrysis galbana)。
1.2斧文蛤金属硫蛋白基因的克隆
斧文蛤总RNA提取及cDNA制备利用RN28试剂盒(北京艾德莱生物科技有限公司)提取总RNA,Nanodrop2000超微量核酸分析仪检测RNA的浓度和纯度,1.2%的琼脂糖凝胶电泳检测RNA的完整性,通过M-MuLV(美国Promega公司)反转录试剂盒获得cDNA,置于-80℃超低温冰箱中备用。
Ml-MT基因的同源克隆采用同源克隆的方法,利用NCBI数据库中文蛤(GU233466.1)、丽文蛤(AY525635.1)、河蚬(EF185126.1)、硬壳蛤(JQ691633.1)、菲律宾蛤仔(KF241789.1)和紫贻贝(AJ005452.1)MT基因的核苷酸序列进行多序列比对,并用Bioedit和Oligo 6.0软件在保守区域内设计简并引物MT-F1和MT-R1(表1)。PCR产物经1%琼脂糖凝胶电泳分离检测,并用GenClean琼脂糖凝胶DNA回收试剂盒(离心柱型)回收纯化后,送至上海生工生物工程技术有限公司测序,获得了226 bp大小的扩增产物,BLAST分析结果表明该序列为金属硫蛋白基因的部分序列。根据该部分序列,利用Oligo7软件设计RACE特异性引物:3-RACE-F1、3-RACE-R1,3-RACE-F2、3-RACE-R2和5-RACEF1、5-RACE-R1,5-RACE-F2、5-RACE-R2(表1),分别用于MT基因的3′端和5′端的RACE扩增。为了提高扩增PCR的特异性,3′端和5′端的RACE扩增均采用巢式PCR扩增技术。PCR扩增产物经过纯化、检测、割胶回收之后送至上海生工生物工程技术有限公司测序。
Ml-MT基因的克隆与鉴定为保证斧文蛤MT基因cDNA序列的正确性,根据拼接全长设计引物MT-F、MT-R(表1)用于全长克隆与鉴定,将PCR扩增产物纯化后连接到pMDTM19-T Vector(TaKaRa)载体上,转化到Trans1-T1 Phage Resistant感受态细胞(北京全式金生物技术有限公司)内,经LB平板(含Amp+)培养以及M13和特异性引物的菌液PCR筛选后,挑选阳性克隆菌送往上海生工生物工程技术有限公司测序。

表1 斧文蛤MT基因克隆与表达的引物序列Tab. 1 The gene cloning and primer sequence expression on the metallothionein of M. lamarckii
1.3斧文蛤金属硫蛋白基因的组织差异性表达
为检测Ml-MT mRNA在不同组织器官的表达水平,取5只健康的斧文蛤,解剖取其内脏团、鳃丝、外套膜、斧足和闭壳肌5个组织部位,分别提取各个组织的RNA,进行Real time-PCR。
1.4斧文蛤在Cd2+胁迫下金属硫蛋白基因的表达变化
根据前期Cd2+胁迫斧文蛤急性攻毒结果[13]以及参照其他相关研究[14]取合适的Cd2+浓度0.13 mg/ L,另设置不添加Cd2+为空白对照,胁迫处理96h,期间正常充气不投饵,分别于0、6h、12h、24h、48h、72h和96h取样。每次实验组和对照组各取5只斧文蛤,解剖取其内脏团,分别提取RNA,按照Promega反转录试剂盒进行cDNA第一链合成。根据已获得的Ml-MT基因cDNA全长序列,设计荧光定量引物RT-MT-F和RT-MT-R(表1); 以斧文蛤βactin(GenBank:KT448844)作为内参基因用于模板的校正,设计引物β-actin-F和β-actin-R(表1)。反应在Applied Biosystems StepOne PlusTM实时定量PCR仪上进行,反应程序为:95℃预变性30s;95℃变性 5s,60℃退火30s,40个循环; 95℃反应15s,60℃反应60s,95℃反应15s(制备熔解曲线)。
1.5生物信息学分析和数据处理
用ExPASy(http://web.expasy.org/translate/)在线翻译MT基因序列、推断其开放阅读框序列和编码的氨基酸序列; 用DNAStar软件中的EditSeq程序推断MT蛋白的分子量、等电点等; 用SignalP 4.1Server在线软件(http://www.cbs.dtu.dk/services/SignalP/)预测分析信号肽; 利用DNAStar中MegAlign程序对已获得的斧文蛤MT与其他双壳贝类MT的氨基酸序列进行多序列比对; 采用MEGA 6.0软件中的邻位相接法(NJ法)对不同物种的MT氨基酸序列构建系统进化树,设置Bootstrap的值为1000。
荧光定量数据处理采用2-ΔΔCt法计算[15]。实验数据采用SPSS19.0进行T检验,*P<0.05表示差异显著,**P<0.01表示差异极显著。
2 结果
2.1斧文蛤MT基因的克隆及序列分析
将简并引物扩增的部分序列、5′ 端RACE克隆序列和3′ 端RACE克隆序列用DNAStar软件中的Seqman程序拼接并全长克隆、测序、验证获得了斧文蛤MT基因的全长cDNA序列(GenBank登录号:KT448843)。斧文蛤MT基因的cDNA序列全长636 bp,其中开放阅读框231 bp(66—296 bp),5′ 端UTR为65 bp(1—65 bp),3′ 端UTR为340 bp(297—636 bp)具有多聚腺苷酸加尾信号AATAAA和polyA尾巴; 共编码76个氨基酸,其中半胱氨酸占27%,包含16个金属硫蛋白典型的Cys-X(1—3)-Cys结构。起始密码子为ATG,终止密码子为TGA。
通过DNAStar软件Editseq程序预测分析:斧文蛤MT蛋白序列包括9个强碱性氨基酸(K、R),10个强酸性氨基酸(D、E),6个疏水氨基酸(A、I、L、F、W、V),38个极性氨基酸(N、C、Q、S、T、Y),蛋白的分子量约为7.138 kD,理论的等电点PI= 7.0。经SignalP 4.1 Server在线软件预测分析显示:该蛋白没有明显的信号肽,也没有跨膜区域,为胞内蛋白。
经BLAST比对分析,Ml-MT编码的氨基酸与其他双壳贝类的MT蛋白具有较高的相似性。其中与丽文蛤(M. lusoria)、文蛤(M. meretrix)的MT蛋白相似性高达88%和87%,与河蚬(Corbicula fluminea)和硬壳蛤(M. mercenaria)MT蛋白的相似度也在70%以上,与其他双壳贝类也有较高的同源性。为了进一步研究斧文蛤与其他物种的MT系统进化关系,采用MEGA 6.0软件中邻位相连法(Neighbor-joining)构建斧文蛤与其他双壳贝类和人(Homo supiens. AAP97267.1)、小家鼠(Mus musculus. AAQ24163.1)、果蝇(Drosophila melanogaster. AGB95820.1)、原鸡(Gallus gallus. NP_990606.1)、非洲爪蟾(Xenopus laevis. NP_001081042.1)、日本沼虾(Macrobrachium nipponense. AJA05010.1)以及斑马鱼(Danio rerio. AAS00514.1)等16种MT氨基酸序列的系统进化树(图1)。从系统进化树可以看出整个进化树分为两大支,哺乳类、两栖类、鸟类、鱼类聚为脊椎动物一支,而果蝇类与其他双壳贝类聚为无脊椎这一支;其中斧文蛤与丽文蛤(M. lusoria. AAS928771)亲缘关系最近,文蛤(M. meretrix. ADM96223.1)次之,与哺乳类的亲缘关系较远,Ml-MT的分子进化地位与斧文蛤的生物学分类地位基本一致。
2.2斧文蛤 MT 基因组织表达差异
采用RT-qPCR法,检测斧文蛤成贝在自然状态下内脏团、鳃丝、外套膜、斧足、闭壳肌5种组织中MT在mRNA水平的表达状况见图2(各组织的MT基因表达量是相对于斧足MT基因的表达量)。结果显示,MT在斧文蛤各组织中均有表达,但存在组织特异性,表达量依次为内脏团>鳃丝>闭壳肌>外套膜>斧足。除外套膜外,斧足MT表达量与其他组织存在不同程度的差异(内脏团、鳃丝:P<0.01,极显著; 闭壳肌:P<0.05,显著)。
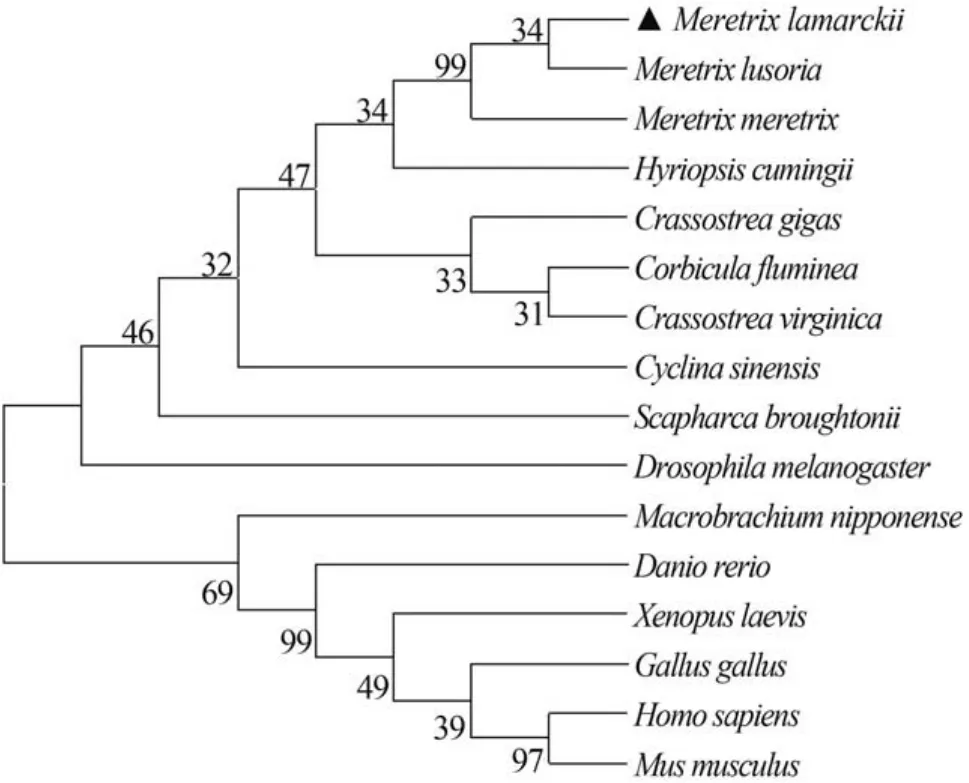
图1 根据金属硫蛋白氨基酸序列使用NJ构建的系统进化树Fig. 1 The NJ phylogenetic tree of vertebrate based on the amino acid sequences of M. lamarckii

图2 斧文蛤5种组织中MT mRNA的差异性表达Fig. 2 The different expressions of MT mRNA in five tissues of M. lamarckii
2.3斧文蛤MT基因在 Cd2+胁迫下的表达影响
如图3所示,与对照组(Cd2+:0.00 mg/L)实验期间MT表达量变化不大相比,实验组内脏团MT随Cd2+胁迫时间的延长呈现出不同程度的上调表达,具体表现为“高-低-高-低(0—48h、48—96h)”的波浪式变化。6h开始缓慢上升,24h和72h为两轮峰值,分别是对照组的7.1和7.4倍。之后缓慢下降; 整个试验期间Ml-MT的表达量均高于对照组,除6h以外其他时间点均与对照组存在极显著差异(P<0.01)。
3 讨论
3.1斧文蛤MT基因生物信息学分析
金属硫蛋白是一类广泛存在于生物体内多功能诱导性的小分子蛋白超家族,其主要功能是调节必需金属元素的稳定和非必需金属元素的解毒[16—18]。关于MT解毒机理推测认为:一方面,结构决定功能可能是由于金属进入生物体内以后,可迅速启动MT基因的特异性金属应答反应、提高mRNA 转录水平合成大量MT蛋白,通过保守Cys中巯基(-SH)螯合金属离子形成复合物减轻毒性,同时清除由此作用产生的自由基等最终达到解毒目的[19]; 另一方面,或者通过参与和介导一系列的酶促反应、信号传递和基因调节引起相关基因的表达变化,从而起到解毒作用维持生物体正常的生理活动[20]。本研究通过RACE技术,克隆获得了斧文蛤Ml-MT的全长cDNA序列,共编码76个氨基酸,其中半胱氨酸占27%。此外,Ml-MT编码的蛋白含有16个MT特有Cys-X(1-3)-Cys结构,并且具有软体动物MT蛋白的Barcoding(CKCXXXCXCX)。与软体动物MT 编码的氨基酸比对发现Cys残基分布高度保守。从进化树中可以发现,两栖、鱼类、鸟类以及哺乳类动物的MT最后聚为脊椎动物一支,而Ml-MT最后聚到无脊椎动物中的软体动物一支。预示着金属硫蛋白受体蛋白有着共同的祖先,只是随着时间推移,动物进化分化出了不同类型的受体蛋白。
3.2斧文蛤MT基因组织表达特异性分析
Ml-MT不同组织qRT-PCR特异性表达中发现:虽然其在所检测的组织中都有表达,但存在一定的组织差异性,其表达量依次为内脏团>鳃丝>闭壳肌>外套膜>斧足。该结果与其他研究结果相类似[21,22]。这可能由于内脏团是主要的消化和解毒器官,具有较强的抗氧化能力,对重金属有很强的蓄积和代谢能力; 鳃丝作为呼吸滤食器官直接暴露污染水体中,因此MT表达量也相对较高; 闭壳肌作为收缩防御器官,对外界刺激比较敏感,由于应激反应会快速收缩关闭双壳达到自我保护的目的; 外套膜和斧足可能是双壳关闭以后,腔内残留污染水体,外套膜接触面积大于斧足,故斧足表达量最低。但有研究显示:斧足表达量大于外套膜和闭壳肌[23],认为斧足是钻掘器官,长期接触污染泥沙,故MT表达量比较高,这可能是生物体长期生活的环境和习性不同所造成。
3.3斧文蛤MT基因在Cd2+胁迫下的表达分析
Cd2+是生物生命活动中的非营养元素,其原子结构使之极易进入生物组织和细胞并同酶蛋白活性中心的巯基(-SH)结合,引起酶空间构象改变,导致酶活性下降,代谢紊乱,成为致毒的根源[24]。而MT被认为是生物体在遭受重金属胁迫后最先参与重金属解毒和代谢的生物大分子[25]。已有研究发现,MT基因的表达量与生物体内重金属浓度和胁迫时间具有明显的正相关性。例如,随 Cd2+暴露浓度增大和时间的延长,长牡蛎(C. gigas)消化腺和鳃组织中MT转录本的表达量显著升高[26]。鉴于不同组织Ml-MT的差异性表达和已往研究经验[22],本文选取斧文蛤内脏团为对象,研究Cd2+胁迫斧文蛤不同时间下Ml-MT mRNA的相对表达变化。结果发现:Ml-MT mRNA随着时间的延长呈现出不同程度的上调表达,具体表现“高-低-高-低”的波浪式变化,该结果与其他研究结果相类似[22,27—29]。其原因推测可能是:重金属Cd2+进入生物体内脏团后,产生一个毒物胁迫刺激,诱导MT基因超常表达,致使MT的表达量迅速升高,合成大量的MT蛋白与Cd2+结合; 当MT的表量达到较高的浓度时,能够满足重金属解毒的需求,MT基因恢复到正常表达水平; 但随着合成的MT蛋白与内脏团中重金属的源源不断结合,MT表达量逐渐下降到较低水平,无法满足随之增加的重金属毒性胁迫,新一轮MT基因的超常表达又被激起,随之也产生更高的mRNA相对表达,从而导致了全程MT基因相对表达量呈现“高-低-高-低”的波浪变化。Paul-Pont等[29]在研究欧洲鸟尾蛤(Cerastoderma edule)时发现:Cd2+暴露水体中,鳃中Cemt1基因在攻毒后24h和168h时有较高的表达水平,而在72h的诱导则被显著抑制,称之为“脉冲式波动”。而本研究中却没有出现抑制现象,仅随胁迫时间的延长呈现出不同程度的上调表达,除6h以外,其他时间点均与对照组存在极显著差异(P<0.01),这可能与本实验所用的安全浓度SC(Cd2+:0.13 mg/L)有关,Cd2+产生的毒性胁迫在斧文蛤MT解毒承受范围之内,故没有出现抑制胁迫现象。研究表明:MT基因诱导水平往往受多种因素影响,存在温度效应关系、剂量效应关系和时间效应关系等[30,31],因此,在探讨MT mRNA作为环境重金属污染指标的研究中,要综合考虑多种影响因素。
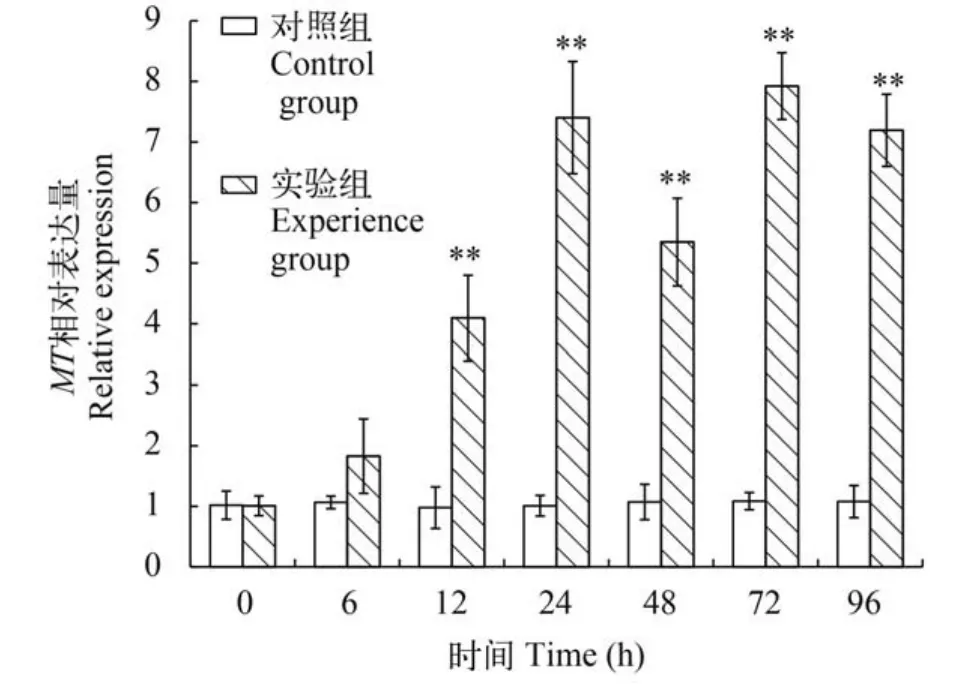
图3 斧文蛤内脏团MT基因在重金属镉胁迫下不同时间相对表达量的变化Fig. 3 The relative expression of MT in liver of M. lamarckii under Cd2+stress at different times
[1]Zhuang Q Q. Chinese Animal Fauna:Mollusca Bivalvia Veneridae [M]. Beijing:Science Press. 2001,229—236[庄启谦. 中国动物志-软体动物门双壳纲帘蛤科. 北京:科学出版社. 2001,229—236]
[2]Wang X Q,Cao M,Yan B L,et al. Biology and reproduction of clam Cyclinasinensis [J]. Fisheries Science,2006,25(6):312—316 [王兴强,曹梅,阎斌伦,等. 青蛤的生物学及其繁殖. 水产科学,2006,25(6):312—316]
[3]Pan B P,Song X,Luo K Y,et al. expression of lysozyme gene in Cyclinasinensis exposed to Vibrio anguillarum[J]. Oceanologia et Limnologia Sinica,2010,41(6):901—906 [潘宝平,宋欣,罗凯娅,等. 青蛤(Cyclinasinensis)溶菌酶基因在鳗弧菌(Vibrio anguillarum)刺激下的表达. 海洋与湖沼,2010,41(6):901—906]
[4]Dziegiel P,Jelena M,Muszczynska B,et al. Role of metallothionein expression in non-small cell Lung carcinomas [J]. RocznikiAkademiiMedycznej W Bialymstoka,2004,49(1):43—45
[5]Liu W Q,Niu D J,Song L S,et al. Cloning and expression of Metallothionein gene in Argopectenirradians [J]. Oceanologia et Limnologia Sinica,2006,37(5):444—449 [刘维青,倪多娇,宋林生,等. 海湾扇贝(Argopectenirradians)金属硫蛋白基因的隆与分析. 海洋与湖沼,2006,37(5):444—449]
[6]Zhang G C. Functions and applied prospects of metallothionein [J]. Yantai Normal University Journal(Natural Science Edition),2005,21(1):142—145 [张桂春. 金属硫蛋白的功能及应用前景. 烟台师范学院学报(自然科学版),2005,21(1):142—145]
[7]UNEP/RAMOGE. Manual on the biomarkers recommended for the MED POL biomonitoring programme [R]. UNEP,Athens. 1999,1—92
[8]Ridlington J W,Fowler B A. Isolation and partial characterization of a cadmium-binding protein from the American oyster(Crassostrea virginica) [J]. Chemico-Biological Interactions,1979,25(2/3):127—138
[9]Lemoine S,Laulier M. Potential use of the levels of the mRNA of a specific metallothionein isoform(MT220) in mussel(Mytilus edulis) as a biomarker of cadmium contamination [J]. Marine Pollution Bulletin,2003,46(11):1450—1455
[10]Wang L L,Song L S,Ni D J,et al. Alteration of metallothionein mRNA in bay scallop Argopectenirradians under cadmium exposure and bacteria challenge [J]. Comparative Biochemistry and Physiology,Part C,2009,149(1):50—57
[11]Lu D,Luo K Y,Pan B P,et al. Cloning and expression of metallothionein and thioredoxin gene in Cyclina sinensis exposed to cadmium [J]. Oceanologia et Limnologia Sinica,2012,43(1):47—51 [吕达,罗凯娅,潘宝平,等. 青蛤(Cyclina sinensis)金属硫蛋白及硫氧还蛋白基因的克隆与表达分析. 海洋与湖沼,2012,43(1):47—51]
[12]Lin X L,Wang Q,Yuan Z Y,et al. Cloning and expression of Metallothionein gene in Ruditapes philippinarum exposed to cadmium [J]. Oceanologia et Limnologia Sinica,2014,45(5):1006—1012 [林晓玲,王清,袁泽轶,等. 菲律宾蛤仔(Ruditapes philippinarum)金属硫蛋白基因克隆及Cd2+胁迫下的表达分析. 海洋与湖沼,2014,45(5):1006—1012]
[13]Jiang G P,Xiao G Q,Zhang J M,et al. Effect of ocean acidification on the acute toxicity of Cd2+and Hg2+to juvenile Meretrix lamarckii [J]. Acta Hydrobiologica Sinica,2016,40(2):1—7 [蒋国萍,肖国强,张炯明,等. 海洋酸化下Cd2+和Hg2+对斧文蛤幼贝急性毒性效应. 水生生物学报,2016,40(2):1—7]
[14]Wang L,Pan L Q,Xu C Q,et al. Combination effects of cadmium and benzo[α]pyrene on acute toxicity and metabolic enzymes activities of Ruditapes philippinarum [J]. Acta Hydrobiologica Sinica,2011,35(1):37—44 [王琳,潘鲁青,徐超群,等. Cd~(2+)-B[α]P复合污染对菲律宾蛤仔急性毒性和解毒代谢酶活力的影响. 水生生物学报,2011,35(1):37—44]
[15]Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod [J]. Methods,2001,25(4):402—408
[16]Vasak M,Hasler D W. Metallothionein:new functional and structural insights [J]. Current Opinion in Chemical Biology,2000,4(2):177—183
[17]Coyle P,Philcox J C. Metallothionein:The multipurpose protein [J]. Cellular and Molecular Life Sciences,2002,59(4):627—647
[18]Ruttkay-Nedecky B,Nejdl L,Gumulec J,et al. The role of metallothionein in oxidative stress [J]. International Journal of Molecular Sciences,2013,14(3):6044—6066
[19]Ren X Y,Zhou Y,Zhang J P,et al. Metallothionein gene expression under different time in testicular sertoli and spermato genic cells of rats treated with cadmium [J]. Reproductive Toxicology,2003,17(2):219—227
[20]Moulis J M. Cellular mechanisms of cadmium toxicity related to the homeostasis of essential metals [J]. Biometals,2010,23(5):877—896
[21]Choi Y K,Jo P G,Choi C Y. Cadmium affects the expression of heat shock protein 90 and metallothionein mRNA in the Pacific oyster,Crassostrea gigas [J]. Comparative Biochemistry and Physiology,Part C:Toxicology and Pharmacology,2008,147(3):286—292
[22]Zhao S S,Meng F P,Fu H F,et al. Metallothionein levels in gills and visceral mass of Ruditapes philippinarum exposed to sublethal doses of cadmium and copper [C]. International Conference on Challenges in Environmental Science and Computer Engineering,CESCE. 2010,2:181—186
[23]Wu C,Chen L X,Ni X Y,et al. Metallothionein in different tissues of meretrixmeretrix exposed to Zinc [J]. Sichuan Journal of Zoology,2012,31(1):54—58 [吴超,陈露茜,倪小英,等. 锌诱导金属硫蛋白在文蛤不同组织中的表达. 四川动物,2012,31(1):54—58]
[24]Cao J H,Ma G Z,Fang Z Q. Effects of cadmium on superoxide dismutase activities in the liver and gill tissue of grass carp [J]. Reservoir Fisheries,2004,24(1):9—11
[25]Amiard-Triquet C,Rainglet F,Larroux C,et al. Metallothioneins in Arctic bivalves [J]. Ecotoxicology and Environmental Safety,1998,41(1):96—102
[26]Choi Y K,Jo P G,Choi C Y. Cadmium affects the expression of heat shock protein 90 and metallothionein mRNA in the Pacific oyster,Crassostrea gigas [J]. Comparative and Physiology,Part C,2008,147(3):286—292
[27]Chang Y T,Jong K J,Liao B K,et al. Cloning and expression of metallothionein cDNA in the hard clam(Meretrix lusoria) upon cadmium exposure [J]. Aquaculture,2007,262(2—4):504—513
[28]Wang Q,Wang X,Wang X,et al. Analysis of metallotione in expression and antioxidant enzyme activities in Meretrix meretrix larvae under sublethal cadmium exposure [J]. Aquatic Toxicology,2010,100(4):321—328
[29]Paul-Pont I,Gonzalez P,Baudrimont M,et al. Short-term metallothionein inductions in the edible cockle Cerastoderma edule after cadmium or mercury exposure:Discrepancy between mRNA and protein responses [J]. Aquatic Toxicology,2010,97(3):260—267
[30]Huo L H,Chen C F,Lin Z H,et al. The metallothionein gene expression in Sinonovacula constricta exposing to cadmium [J]. Oceanologia et Limnologia Sinica,2012,43(4):723—728 [霍礼辉,陈彩芳,林志华,等. 镉诱导缢蛏(Sinonovacula constricta)体内金属硫蛋白基因变化规律研究. 海洋与湖沼,2012,43(4):723—728]
[31]Baer K N,Benson W H. Influence of chemical and environmental stressors on acute cadmium toxicity [J]. Journal of Toxicology Environmental Health,1987,22(1):35—44
In this study,by using RACE technology to gain 636 bp of metallothionein(Ml-MT) gene cDNA sequences from total RNA reverse transcription product. The sequence contains 65 bp of 5′ Untranslated Region(UTR) and 340 bp of 3′ UTR in addition to 213 bp of the open reading frame(ORF),which can encode 76 amino acids. Of this,accounting for 27% cysteine,no aromatic amino acids and there are 16 MT of the specific Cys-Xn-Cys structure,where the molecular weight and theoretical isolectric point were predicted to be 7.704 kD and 7.138 respectively. The MT amino acid sequence alignment comparative analysis indicated that the M. lamarckii and Meterix lusoria were similar at more than 88%,with M. meretrix homology of 87%. The quantification real-time PCR(qRT-PCR) detection showed that there were MT expressions in five kinds of tissue of M. meretrix. These expressions had tissue specificity where visceral mass had the highest levels,followed by the Gill filaments,adductor muscle,mantle and foot. In Cd2+0.13 mg/L exposures of 0,6h,12h,24h,48h,72h and 96h,the MT mRNA of M. meretrix visceral mass displayed different increasing degrees of contamination time. Specific performance is “high-low-high-low” wave trend changes. Except for 6h,the other time points compare with control group have significant difference(P<0.01). This study showed that MT gene in the maintenance of normal physiological function of the body play an important role of molecular regulation in Cd2+stress of M. meretrix.
CLONING AND EXPRESSION OF METALLOTHIONEIN GENE IN MERETRIX LAMARCKII
JIANG Guo-Ping1,2,3,CHENG Xue-Yan1,2,4,TENG Shuang-Shuang1,2,CHAI Xue-Liang1,2,3,4,LIN Xing-Guan1,2,LIU Guang-Xu5and XIAO Guo-Qiang1,2
(1. Zhejiang Mari-culture Research Institute,Wenzhou 325005,China; 2. Zhejiang key lab of Exploitation and presevation of coastal Bio-Resource,Wenzhou 325005,China; 3. College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China; 4. Laboratory Medicine and Life Science College of Wenzhou Medical University,Wenzhou 325005,China;5. College of Animal Sciences,Zhejiang University,Hangzhou 310058,China)
Metallothionein(MT) is a family of cysteine-rich,low molecular weight proteins. It involves heavy metal detoxification,maintain metabolic balance free radical scavenging metal elements and other physiological functions. A large number of studies show that the expression level of MT can indirectly reflect the stress response of organisms to the environment and the ability of detoxification of heavy metals. As a result,it is often used to evaluate the pollution status of heavy metals and the adaptability of organisms to these heavy metals. Therefore,MT presently has been selected as one of the biomarkers of marine environmental monitoring by the United Nations Environment Program.
Meretrix lamarckii; Metallothionein; Gene cloning; Expression; Cd2+
S917.4
A
1000-3207(2016)05-0914-07
10.7541/2016.05.118
2015-09-07;
2016-01-21
海洋公益性行业科研专项(201205021-5); 国家贝类产业技术体系(CARS-48); 国家自然科学基金面上项目(31372503); 水产种质资源平台运行服务(2015DKA30470)资助 [Supported by Scientific Research Projects of Marine Public Welfare Industry(201205021-5); National Shellfish Industry Technology System(CARS-48); Project of the National Natural Science Foundation of China(31372503); Aquatic Germplasm Resources Platform Operation Service(2015DKA30470)]
蒋国萍(1989—),女,安徽宿州市人; 研究生; 主要从事海洋酸化与滩涂贝类生态学研究。E-mail:jgp1126090790@163.com
肖国强(1978—),男,江苏镇江市人; 副研究员; 主要从事生态生理学研究。E-mail:xiaogq1978@163.com
