黄酒中9 种生物胺的高效液相色谱分析法
2016-11-11曹利瑞俞剑燊夏永军王光强艾连中上海理工大学医疗器械与食品学院上海0009江南大学食品科学与技术国家重点实验室江苏无锡上海金枫酒业股份有限公司上海黄酒工程技术研究中心上海050
曹利瑞,朱 松,俞剑燊,夏永军,王光强,胡 健,艾连中,(.上海理工大学医疗器械与食品学院,上海 0009;.江南大学 食品科学与技术国家重点实验室,江苏 无锡 4;.上海金枫酒业股份有限公司 上海黄酒工程技术 研究中心,上海 050)
黄酒中9 种生物胺的高效液相色谱分析法
曹利瑞1,朱 松2,俞剑燊3,夏永军1,王光强1,胡 健3,艾连中1,*
(1.上海理工大学医疗器械与食品学院,上海 200093;2.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;3.上海金枫酒业股份有限公司 上海黄酒工程技术 研究中心,上海 201501)
建立一种检测黄酒中生物胺的反相高效液相色谱法。用三氯乙酸提取黄酒中生物胺,丹磺酰氯作为衍生化试剂,1,7-二氨基庚烷作为内标定量。色谱条件为:Waters XBridge C18色谱柱(4.5 mm×250 mm,3.8 μm)作为分离柱,乙腈和水作为流动相进行梯度洗脱,流速1 mL/min,紫外检测波长254 nm。结果表明,9 种生物胺(盐酸吡哆胺、色胺、腐胺、尸胺、β-苯乙胺、组胺、酪胺、精胺和亚精胺)在40 min内能被很好分离。在1~50 mg/L质量浓度范围内,各种生物胺呈现良好的线性相关性(R2>0.999)。各生物胺加标回收率为79.54%~89.55%,相对标准偏差为3.14%~6.35%,该法各组分检出限(RSN=3)为0.002~0.009 mg/L。应用柱前衍生化高效液相色谱-紫外检测法,实现了黄酒中生物胺的准确检测。
生物胺;黄酒;高效液相色谱法;梯度洗脱
生物胺(biogenic amine,BA)是一类具有一定生物活性的有机化合物。可看作是氨分子中的氢原子被烷基或者芳基取代后而生成的化合物。生物胺具有一定的生理功能,微量生物胺是生物体(包括人体)内的正常活性成分,但是,人体摄入过多的生物胺并进入血液中,易产生头痛、呼吸紊乱、心悸、血压变化等不良症状[1]。常见的食品中的生物胺主要包括腐胺、尸胺、精胺、亚精胺等脂肪族生物胺,酪胺、苯乙胺等芳香族生物胺,及组胺、色胺等杂环族生物胺。
生物胺普遍存在于发酵产品中,比如酸奶、奶酪、发酵香肠、酱菜、泡菜、腐乳、酱油、葡萄酒、啤酒等。其中,酒类生物胺的研究较多,主要针对葡萄酒[2]、啤酒[3]、青棵酒[4]、桑果酒[5]以及黄酒[6]等。由于生物胺的种类很多,且各种生物胺之间可以相互转化,此外生物胺的毒性受很多因素影响,且具有个体差异性,因此制定酒中的生物胺标准十分困难,但部分国家已经尝试根据不同食品的特性给出生物胺的限量标准。澳大利亚和瑞士规定葡萄酒中的组胺不得高于10 mg/L,法国不得高于8 mg/L,荷兰不得高于3.5 mg/L,而德国更加严格,不得高于2 mg/L[7]。
目前已有多种方法应用于食品中生物胺的测定,如电化学生物传感器法[8]、薄层色谱法[9]、气相色谱法[10]、离子色谱法[11]、反相高效液相色谱(reversed phase highperformance liquid chromatography,RP-HPLC)法[12]、毛细管电泳法[13]、酶联免疫法[14]、胶束液相色谱[15]等。这些方法各有优缺点,电化学生物传感器法可以初步筛选食品中的生物胺,具有简便、高效、灵敏等优点,但由于酶源的选择及酶活的保持方面仍需改善,应用面较窄。薄层色谱法具有操作简单、成本低等优点,但只能进行生物胺的定性和半定量检测。气相色谱法测定时前处理简单,无需衍生化,但应用的生物胺种类较少。离子色谱法具有高效、灵敏度好、选择性高、所用样品量少等优点,但同时测定生物胺的种类有限。RP-HPLC法可以对食品中的生物胺进行定量分析,具有较高的灵敏度和准确性,缺点是前处理较复杂,需进行衍生化处理。毛细管电泳法具有快速简便、所需样品量少、成本低等优点,但其检出限较高,重复性较差。酶联免疫法分析快速,可以几个样品同时分析,但应用范围较窄,目前多应用在组胺的分析。胶束液相色谱应用于生物胺的研究报道较少,其具有成本低、选择性好、流动相毒性小等优点。
实际应用中,主要采用HPLC法对食品中生物胺进行检测分析。本研究参考GB/T 5009.208—2008《食品中生物胺含量的测定》中样品前处理方法根据实际样品进行调整并改进,简化了前处理步骤,并从流动相的选择、色谱柱的选择、衍生化试剂的选择及其量的确定、洗脱条件的优化等方面进行了研究,建立了同时检测黄酒中9种生物胺含量的RP-HPLC方法,并进行了评估。结果表明,该方法快速简便、灵敏度高、重复性和准确性好,可以满足黄酒中生物胺的检测要求。
1 材料与方法
1.1 材料与试剂
9 种单体生物胺标准品:盐酸吡哆胺(CAS号:524-36-7,98%)、组胺(CAS号:51-45-6,96%)、β-苯乙胺(CAS号:64-04-0,98%)、酪胺(CAS号:51-67-2,98%)、腐胺(CAS号:110-60-1,98%)、尸胺(CAS号:462-94-2,98%)、色胺(CAS号:61-54-1,98%)、亚精胺(CAS号:124-20-9,99%)、精胺(CAS号:71-44-3,98%)、1,7-二氨基庚烷(98%)、丹磺酰氯(98%) 阿拉丁试剂有限公司;甲醇、丙酮(均为色谱纯) 国药集团化学试剂有限公司。乙醚、正丁醇、正己烷、三氯甲烷、谷氨酸钠、碳酸氢钠、氯化钠、氢氧化钠、盐酸、三氯乙酸(均为分析纯)。
1.2 仪器与设备
1525高效液相色谱仪(配2998紫外检测器、2707自动进样器、Empower3化学工作站) 美国Waters公司;3K30冷冻离心机 德国Sigma公司;V3旋涡混合器 德国IKA公司;KQ-600B超声波清洗仪 上海续畅实业有限公司;WNB45L1数显恒温水浴锅 德国Memmert公司;MGS-2200氮吹仪 上海汇析精密仪器有限公司;ML204电子分析天平 瑞士Mettler Toledo公司;PB-10酸度计 德国Sartorius公司;Milli-Q超纯水器美国Millipore公司;0.22 μm滤膜针头滤器 上海安普科学仪器有限公司。
1.3 方法
1.3.1 标准溶液及内标使用液的配制
准确称取适量的各种生物胺标准品,0.1 mol/L盐酸溶液作为稀释液,配制标准储备溶液,使其终质量浓度为l 000 mg/L,储存于4 ℃冰箱。取上述各溶液,依然用0.1 mol/L盐酸稀释,充分混匀,其终质量浓度为100 mg/L,即生物胺标准混合使用液。分别取适量此混合使用液,以0.1 mol/L盐酸溶液作为稀释液,分别配制成终质量浓度为1.00、2.50、5.00、10.0、15.0、25.0、50.0 mg/L的梯度标准溶液。准确称取适量内标物质,0.1 mol/L盐酸溶液作为稀释液,配制成质量浓度为1 000 mg/L的内标标准储备溶液,储存于4 ℃冰箱。取所配制内标标准储备溶液,用0.1 mol/L盐酸稀释,配制成质量浓度为100 mg/L的内标使用液,储存于4 ℃冰箱。以上所配制标准溶液及内标使用液的保存期限为1周。
1.3.2 样品预处理及衍生化
量取10.00 mL酒样,加入0.2 mL内标使用液,再加入适量氯化钠至溶液饱和。准确移取5.00 mL的试样提取液,置于离心管中,使用氢氧化钠溶液调节pH值为11.5~12.0。再加入5.0 mL的正丁醇-三氯甲烷(1∶1,V/V)混合溶液,充分混合,4 000 r/min离心10 min,分层后,吸取有机相,重复操作两次,合并提取液,取3.0 mL提取液,再加入0.2 mL l mol/L盐酸,充分混合,在40 ℃条件下用氮气吹干,然后加入1.0 mL 0.1 mol/L盐酸,溶解残留物,待衍生。
取0.50 mL上述待衍生的试样溶液,加入饱和碳酸氢钠溶液1.5 mL、丹磺酰氯衍生溶液1.5 mL,充分混匀。在60 ℃水浴条件下反应30 min,最后,再加入谷氨酸钠溶液100 μL,充分混匀,60 ℃条件下保温15 min。取出,加入超纯水l mL,在40 ℃条件下用氮气除去丙酮。之后加入乙醚3 mL,充分混合,使其静置分层,吸取乙醚层,重复操作2 次,合并乙醚提取液,在40 ℃条件下氮气吹干。加入乙腈1.0 mL,溶解残留物,再用 0.22 μm滤膜针头滤器过滤,则滤液待测。
1.3.3 色谱条件
色谱柱为XBridge C18色谱柱(4.5 mm×250 mm,3.8 μm),流动相A为水,流动相B为乙腈,采用梯度洗脱,洗脱程序见表1。流速1 mL/min,紫外检测波长254 nm,进样量10 μL。
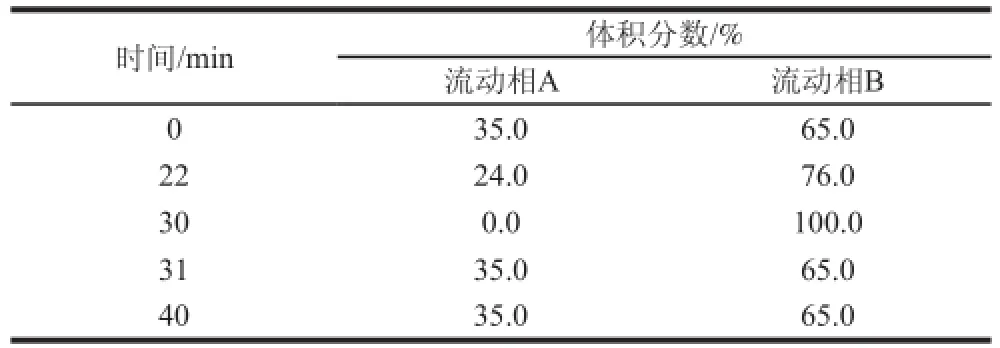
表1 梯度洗脱程序Table 1 Gradient elution program
2 结果与分析
2.1 流动相的选择
在生物胺的测定中,特别是RP-HPLC方法检测生物胺时,主要采用梯度洗脱,但也有的研究者使用等度洗脱或线性洗脱[16]。测定时流动相的选取对生物胺的完美分离至关重要。对于不同的样品,进行RP-HPLC检测时,对于流动相的要求也不尽相同。在进行黄酒中生物胺的检测时,要获得准确、可靠的检测方法,选择适合的流动相至关重要,这要结合黄酒基质-流动相配比进行反复摸索与实践。文献中用到的流动相主要有:甲醇-水[17]、乙腈-水[18]、氯仿-三乙胺[19]、乙腈-甲醇-水[20]、甲醇-醋酸铵[21]、乙腈-醋酸-醋酸钠[22]、乙酸-乙腈/甲醇-乙腈[23]等。参考已有文献中使用的这些流动相及其峰形特点,本实验选择了较常用且配制比较方便的3 种流动相:甲醇-水、乙腈-水、乙腈-水-三氟乙酸。
实验结果表明,甲醇-水的分离效果不如乙腈-水的好,经常有大面积干扰峰出现,而加入三氟乙酸以后的流动相与乙腈-水作流动相时相比,峰形并无明显差别,再者因为在流速为1.0 mL/min时,乙腈和水溶液混溶时压力变动不是很大,不会对柱子的使用寿命造成影响。而且,乙腈的紫外吸收截止波长在210 nm左右,对物质的分离不会造成干扰。故综合文献,选取了乙腈-水作为梯度洗脱的流动相。
2.2 色谱柱的选择
要选择色谱柱,首先要根据样品特性来选择分离模式。由于被测物质是低分子质量的有机碱,且衍生后产物溶于有机溶剂,故选择用键合相的反相模式,使用高纯度硅胶基质、充分封端的键合相色谱柱较合适,故选择本实验室的Waters XBridge C18色谱柱(4.5 mm×250 mm,3.8 μm),且通过实验验证XBridge色谱柱的稳定性和重现性较好。
2.3 衍生化试剂的选择及其量的确定
生物胺在进行液相测定时,由于其本身不具有荧光特性,也没有特异的紫外吸收基团,必须同衍生试剂反应生成具有荧光或紫外吸收的衍生物,才能实现生物胺定量测定[17]。文献[24]中提到的衍生化试剂有丹磺酰氯、邻苯二甲醛、苯甲酰氯、二硝甲酰氯、荧光胺等。其中丹磺酰氯和邻苯二甲醛是目前比较常用的生物胺衍生化试剂。然而,邻苯二甲醛的衍生化产物不稳定。丹磺酰氯的反应产物比较稳定,故本实验选取丹磺酰氯作为衍生化试剂,并对其最适反应的量进行了探索,结果见图1。
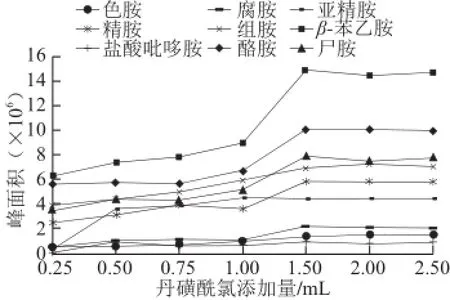
图1 丹磺酰氯添加量对衍生产物的影响Fig.1 Effect of dansyl chloride concentration on derivitization of biogenic amines
选取丹磺酰氯质量浓度为10、50 mg/L的混标作为底物,分别加入0.25、0.50、0.75、1.00、1.50、2.00、2.50 mL丹磺酰氯衍生溶液。由图1可知,衍生化试剂的量为1.5 mL时,β-苯乙胺、酪胺、尸胺、腐胺、盐酸吡哆胺的衍生化产物的量达到最大,且随着衍生化试剂量的增加,衍生化产物的量并未明显增加;当衍生化试剂的量为2 mL时,组胺、精胺、亚精胺、色胺的衍生化产物的量达到最大,但与1.5 mL时相比,并无明显差异。故为避免试剂的损失,选取衍生化试剂的最佳反应量为1.5 mL。
2.4 洗脱条件的优化
本实验选用乙睛-水的流动相体系,以进行梯度洗脱程序的探索,见表2。通过实验中不断调整,洗脱程序2为最佳洗脱程序。图2为生物胺标准混合溶液的色谱图。由图2可知,9 种生物胺在40 min内达到完全分离,且峰形对称。
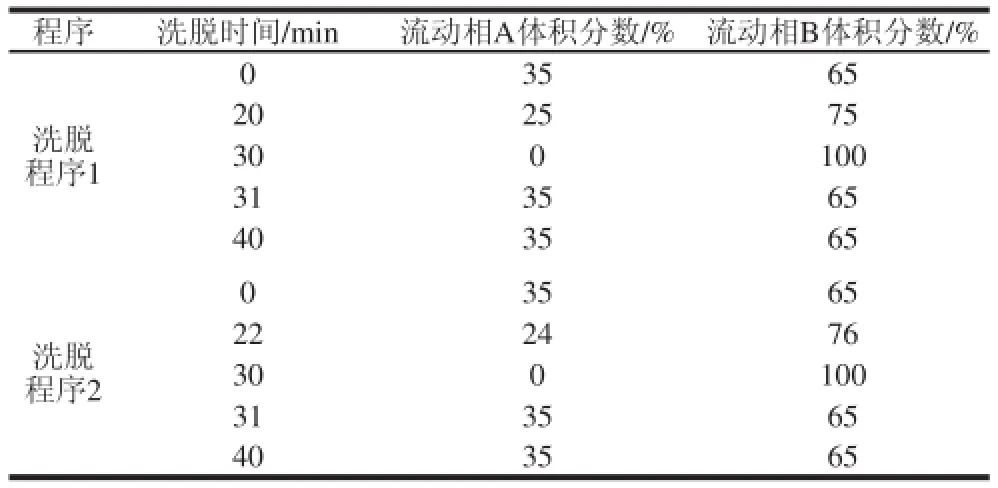
表2 梯度洗脱程序的优化Table 2 Gradient elution program optimization
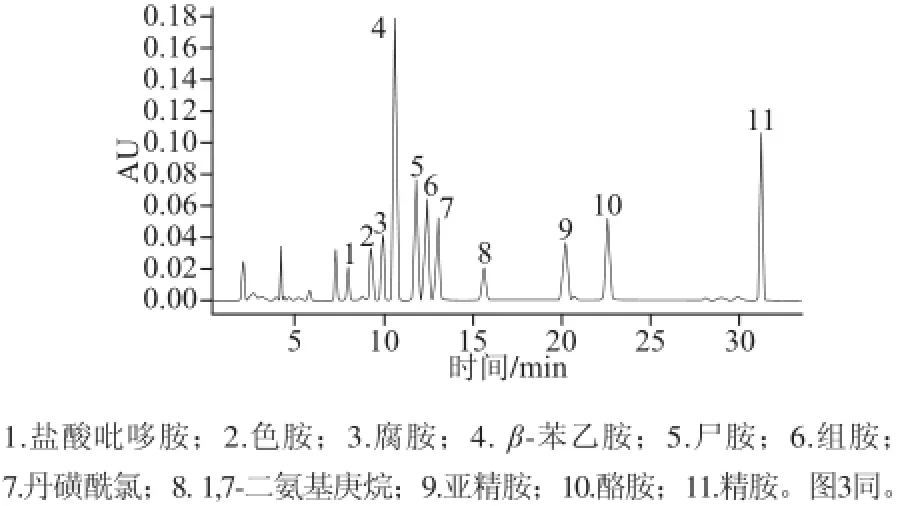
图2 生物胺标准品液相色谱图Fig.2 HPLC chromatogram of biogenic amine standards
2.5 方法学评价
2.5.1 标准曲线、检出限、定量限
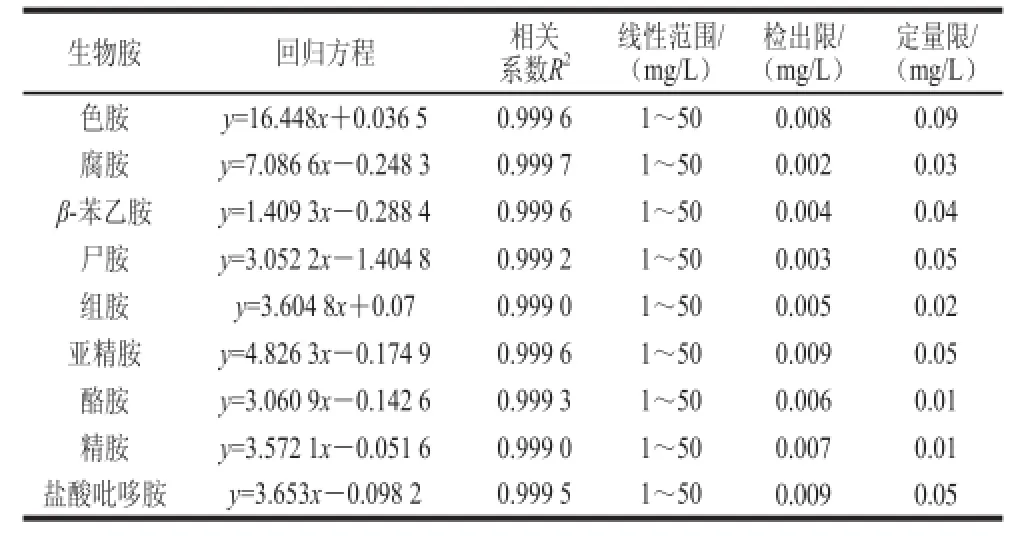
表3 HPLC法检测生物胺的回归方程、相关系数及检测线Table 3 Regression equations with correlation coefficients and limits of detection for DNS-CL-amine derivatives
按照上述方法配制标准系列混合标准溶液进行线性实验,标准系列质量浓度为1.00、2.50、5.00、10.0、15.0、25.0、50.0 mg/L。根据信噪比法,以3倍信噪比作为检出限的确定标准,以10倍信噪比作为定量限的确定标准。结果见表3。
由表3可知,9 种生物胺在1~50 mg/L范围内呈现良好的线性关系,相关系数均大于0.999。各组分生物胺的检出限为0.002~0.009 mg/L。满足生物胺检测的要求。
2.5.2 样品加标回收率
选取一黄酒样品,在线性范围内选取1.0、2.5、10 mg/L三个质量浓度做加标回收实验。应用以上所建方法进行前处理并测定,未加标样品与各加标水平样品平行测定3 份,结果如表4所示。
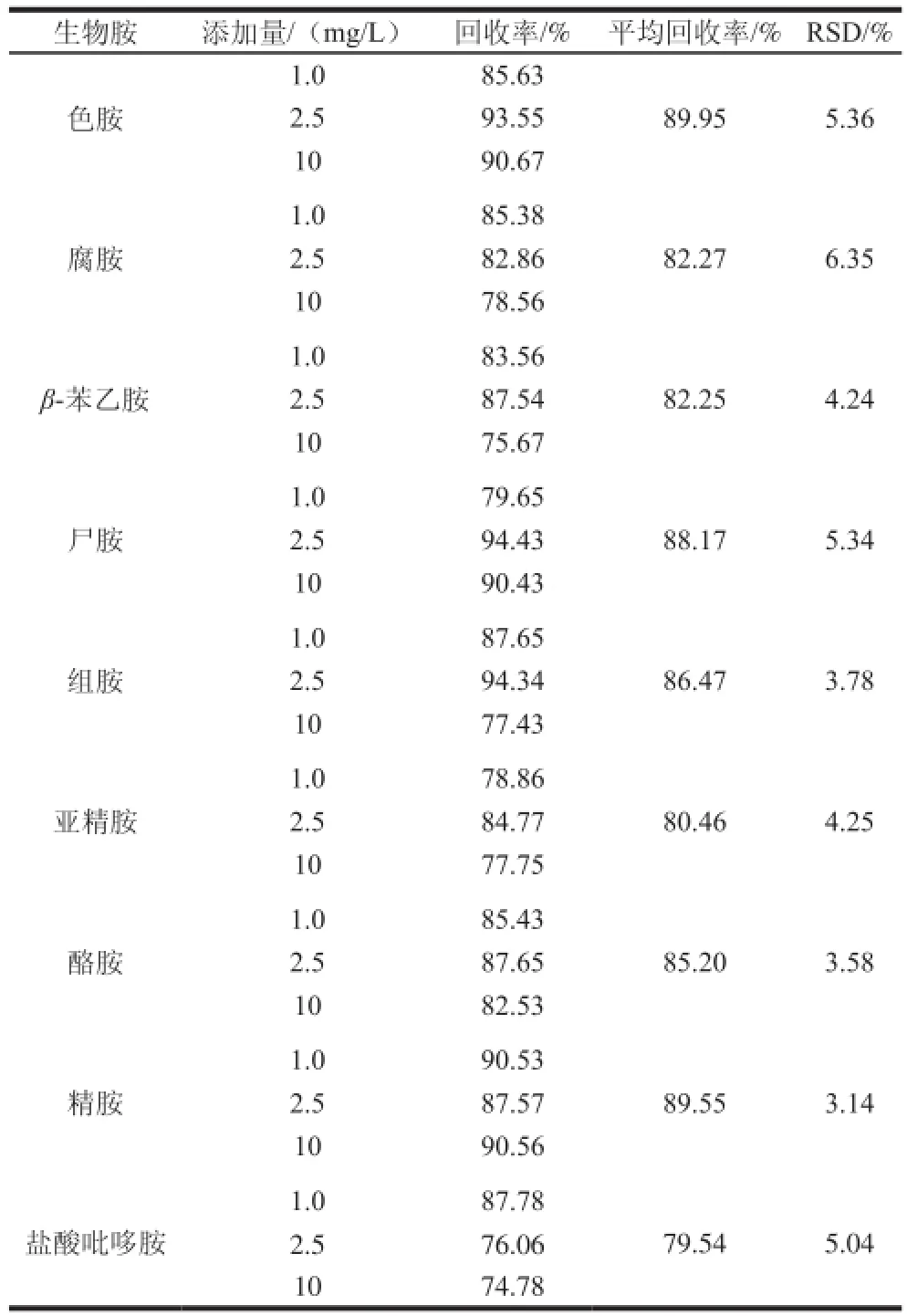
表4 生物胺加标回收率的测定Table 4 Recoveries for biogenic amines from spiked sample
由表4可知,9 种生物胺在3 种不同的加标水平下,平均回收率在79.54%~89.55%之间。其相对标准偏差(relative standard deviation,RSD)在3.14%~6.35%之间,均符合检测要求。
2.5.3 精密度分析
选取一黄酒样品,做6 次平行,应用以上所建方法进行前处理并测定,计算测定结果的平均值和RSD。表5结果显示,除酪胺、盐酸吡哆胺之外,RSD均小于5%,表明精密度符合检测要求。
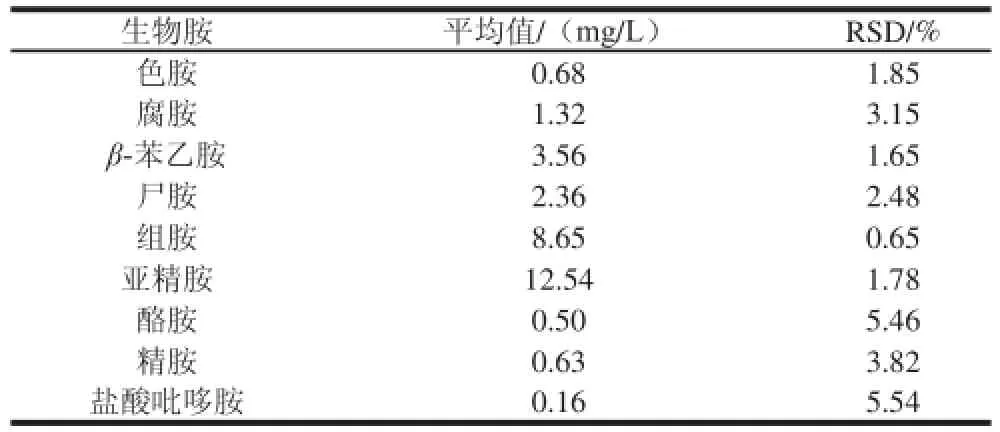
表5 精密度分析结果Table 5 Precision of the method for the determination of biogenic amines
2.6 黄酒样品分析
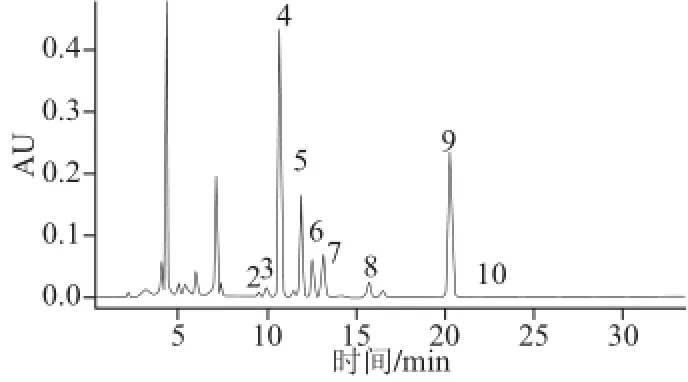
图3 黄酒样品的高效液相色谱图Fig.3 HPLC chromatogram of Chinese yellow wine sample
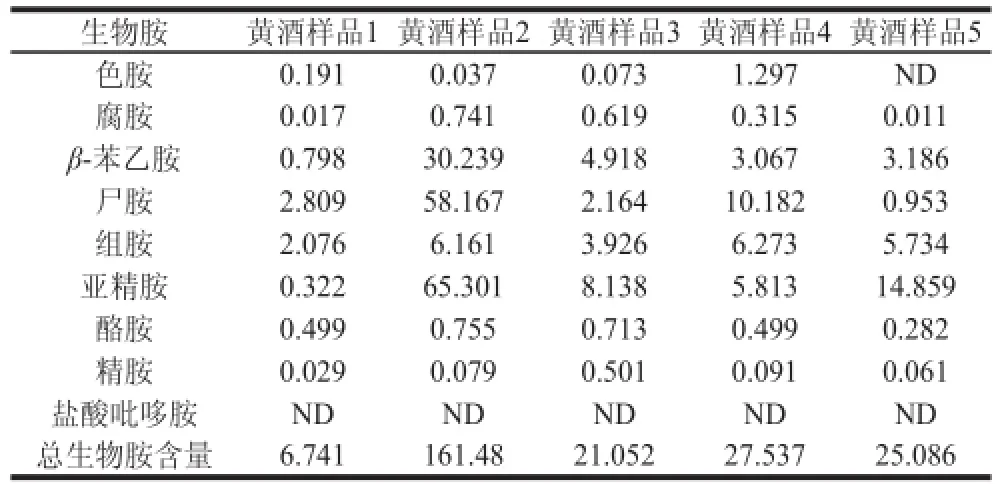
表6 样品中生物胺含量的测定Table 6 Biogenic amine contents in tested samples mg/L
由图3可知,黄酒中的各种生物胺得到完全分离,且峰形对称,可以准确定量。部分测定结果见表6,由表6可知,在不同种类的黄酒样品中,生物胺的含量差别明显,5 种样品中,总生物胺含量的范围在6.741~161.48 mg/L之间。不同样品间生物胺含量的差异,可能与黄酒的生产过程及其贮藏环境有关,还需要进一步的研究。
3 结 论
采用RP-HPLC-紫外检测法,丹磺酰氯柱前衍生梯度洗脱测定黄酒中的生物胺,能使9 种生物胺在40 min内达到完全分离,该法具有较好的重现性,较高的灵敏度,较好的准确性,适合黄酒中生物胺的检测。
[1] SILLA S M. Biogenic amines: their importance in foods[J]. International Journal of Food Microbiology, 1996, 29(2/3): 213-231. DOI:10.1016/0168-1605(95)00032-1.
[2] 沈念原, 王秀芹. 高效液相色谱法测定葡萄酒中生物胺的含量[J].食品工业科技, 2011, 32(4): 394-396.
[3] HALASE A, BARATH A, HOLZAPFEL W H. The biogenic amines content of beer: the effect of barley, malting and brewing on amine concentration[J]. Z Lebensm Unters Forsch A, 1999, 208(2): 418-423. DOI:10.1007/s002170050440.
[4] 杜木英, 陈宗道, 阚建全, 等. 青稞酒发酵过程中生物胺动态变化[J].食品科学, 2012, 33(3): 163-167.
[5] 黄进. 桑堪果酒中生物胺和杂醇油调控技术研究[D]. 南昌: 江西农业大学, 2011.
[6] 陆永梅, 董明盛, 吕欣, 等. 高效液相色谱法测定黄酒中生物胺的含量[J]. 食品科学, 2006, 27(1): 196-199. DOI:10.3321/ j.issn:1002-6630.2006.01.046.
[7] LEHTONEN P. Determination of amines and amino acids in wine: a review[J]. American Journal of Enology and Viticulture, 1996, 47(2): 127-133.
[8] LANGE J, WITTMANN C. Enzyme sensor arrays for the determination of biogenic amines in food samples[J]. Analytical and Bioanalytical Chemistry, 2002, 372(2): 276-283. DOI:10.1007/s00216-001-1130-9.
[9] SHAKILA R J, VASUNDHARA T S, KUMUDAVALY K V. A comparison of the TLC-densitometry and HPLC method for the determination of biogenic a mines in fish and fishery products[J]. Food Chemistry, 2001, 75(2): 255-259. DOI:10.1016/S0308-8146(01)00173-X.
[10] AWAN M A, FLEET I, THOMAS C L P. Determination of biogenic diamines with a vaporization derivatisation approach using solidphase microextraction gas chromatography-mass spectrometry[J]. Food Chemistry, 2008, 111(2): 462-468. DOI:10.1016/ j.foodchem.2008.03.068.
[11] BORAB B M, ROHRER J S. Determination of biogenic amines in alcoholic beverages by ion chromatography with suppressed conductivity detection and integrated pulsed amperometric detection[J]. Journal of Chromatography A, 2007, 1155(1): 22-30.
[12] SIMAT V, DALGAARD P. Use of small diameter column particles to enhance HPLC determination of histamine and other biogenic amines in seafood[J]. LWT-Food Science and Technology, 2011, 44(2): 399-406. DOI:10.1016/j.lwt.2010.08.011.
[13] 乔成栋, 宋平顺, 严祥, 等. 5 种生物胺的毛细管胶束电动色谱分离[J].分析化学研究, 2007, 35(1): 95-98.
[14] 麻丽丹, 巴中华. 酶联免疫吸附试验法检测盐渍鳀鱼中的组胺[J].中国酿造, 2008, 27(14): 85-86.
[15] MALINOWSKA I, STĘPNIK K E. Analysis of somc biogenic amines by micellar liquid chromatography[J]. Chromatography Re-search International, 2012, 2012: 1155-1163.
[16] ZOTOU A, LOUKOU Z, SOUFLEROS E, et al. Determination of biogenic amines in wines and beers by high performance liquid chromatography with pre-column dansylation and ultraviolet detection[J]. Chromatographia, 2003, 57(7/8): 429-439. DOI:10.1007/BF02492537.
[17] 李志军. 食品中生物胺及其产生菌株检测方法研究[D]. 青岛: 中国海洋大学, 2007.
[18] PROESTOS C, LOUKATOS P, KOMAITIS M. Determination ofbiogenic amines in wines by HPLC with precolumn dansylation and fl uorimetric detection[J]. Food Chemistry, 2008, 106: 1218-1224. DOI:10.1016/j.foodchem.2007.06.048.
[19] COSTANTINI A, DORIA F, VAUDANO E, et al. Chemical and molecular methods for the control of biogenic amine production by microorganisms[J]. Annals of Microbiology, 2011, 61: 173-178. DOI:10.1007/s13213-010-0073-9.
[20] 谢铭. 黄酒中生物胺的分析研究[J]. 广州化工, 2010, 38(4): 139-141. DOI:10.3969/j.issn.1001-9677.2010.04.050.
[21] SLOMKOWSKA A, AMBROZIAK W. Biogenic amine profi le of the most popular Polish beers[J]. European Food Research and Technology 2002, 215: 380-383. DOI:10.1007/s00217-002-0571-5.
[22] KIM J Y, KIM D, PARK P, et al. Effects of storage temperature and time on the biogenic amine content and microflora in Korean turbid rice wine Makgeolli[J]. Food Chemistry, 2011, 128: 87-92. DOI:10.1016/j.foodchem.2011.02.081.
[23] LU Y M, LU X, CHEN X H, et al. A survey of biogenic amines in Chinese rice wines[J]. Food Chemistry, 2007, 100: 1424-1428. DOI:10.1016/j.foodchem.2005.11.035.
[24] 栾同青. 黄酒酿造过程生物胺变化规律及其产生菌株研究[D]. 济南: 齐鲁工业大学, 2013.
Development of an Analytical Method for Nine Biogenic Amines in Chinese Yellow Wine by HPLC
CAO Lirui1, ZHU Song2, YU Jianshen3, XIA Yongjun1, WANG Guangqiang1, HU Jian3, AI Lianzhong1,*
(1. School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China; 2. State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, China; 3. Shanghai Engineering Research Center of Chinese Rice Wine, Shanghai Jinfeng Wine Co. Ltd., Shanghai 201501, China)
An analytical method for biogenic amines in Chinese rice wine by reversed phase high-performance liquid chromatography (RP-HPLC-HPLC) was developed. The biogenic amines in Chinese yellow wine were extracted with trichloroacetic acid (TCA), and then pre-column derivatized with dansyl chloride for quantification using 1,7-diamino heptane as the quantitative internal standard. A C18chromatographic column (4.5 mm × 250 mm, 3.8 μm) was used for separation. The mobile phase was composed of a mixture of acetonitrile and water at a flow rate of 1 mL/min, and the ultraviolet (UV) detection wavelength was 254 nm. The results showed that nine biogenic amines (pyridoxamine dihydrochloride, tryptamine, putrescine, cadaverine, beta phenethylamine, histamine, tyramine, spermine and spermine) were separated completely within 40 minutes. In the concentration range of 1–50 mg/L, each biogenic amine presented good linear correlation (R2> 0.999). After the addition of a mixed standard solution of biogenic amines to Chinese yellow wine, the recovery rates were 79.54%–89.55%, with relative standard deviations (RSDs) ranging from 3.14% to 6.35%, and the limit of detection for each component was 0.002–0.009 mg/L. Therefore, The HPLC method with pre-column derivatization and UV detection could be used for the determination of biogenic amines in Chinese yellow wine.
biogenic amine; Chinese yellow wine; high performance liquid chromatography (HPLC); gradient elution
10.7506/spkx1002-6630-201604019
TS201.6
A
1002-6630(2016)04-0103-05
曹利瑞, 朱松, 俞剑燊, 等. 黄酒中9 种生物胺的高效液相色谱分析法[J]. 食品科学, 2016, 37(4): 103-107. DOI:10.7506/ spkx1002-6630-201604019. http://www.spkx.net.cn
CAO Lirui, ZHU Song, YU Jianshen, et al. Development of an analytical method for nine biogenic amines in Chinese yellow wine by HPLC[J]. Food Science, 2016, 37(4): 103-107. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201604019. http://www.spkx.net.cn
2015-06-25
上海市农业科技成果转化资金项目(133919N1000);上海市研究生创新基金项目(JWCXSL1402);沪江基金研究基地专项(D15012)
曹利瑞(1991—),女,硕士研究生,研究方向为食品生物技术。E-mail:caoliruizhe@163.com
*通信作者:艾连中(1976—),男,教授,博士,研究方向为食品生物技术。E-mail:ailianzhong@163.com
