亚热带地区水稻(Oryza sativa L.)气孔臭氧通量和产量的响应关系
2016-11-11张继双唐昊冶刘钢朱建国
张继双,唐昊冶,刘钢,朱建国*
(1.中国科学院南京土壤研究所土壤与农业可持续发展国家重点实验室,南京210008;2.中国科学院大学,北京100049)
亚热带地区水稻(Oryza sativa L.)气孔臭氧通量和产量的响应关系
张继双1,2,唐昊冶1,刘钢1,朱建国1*
(1.中国科学院南京土壤研究所土壤与农业可持续发展国家重点实验室,南京210008;2.中国科学院大学,北京100049)
基于开放式臭氧浓度升高O3-FACE(Free-Air Concentration Elevation of O3)实验平台,利用前期水稻O3-FACE试验的基础数据,通过建立水稻产量与不同评价指标(累积气孔O3吸收通量PODY和O3浓度指标AOTX)的响应关系,比较了水稻产量损失与各评价指标的相关性差异,通过对暴露剂量、吸收通量相关参数取值与产量损失的观察和分析结果的比较,找出更为合理的农作物臭氧风险评估阈值。结果表明:随着通量阈值Y[0~11 nmol O3·m-2PLA·s-1(PLA:projected leaf area,投影叶面积)]和暴露浓度阈值X(0~50 nL·L-1)的增加,回归分析R2值逐渐增加,当Y为11 nmol O3m-2PLA·s-1和X为50 nL·L-1时,气孔臭氧吸收通量POD11和累积暴露剂量AOT50与水稻相对产量的相关性最大,当通量阈值Y为8~13 nmol O3·m-2PLA·s-1和暴露阈值X为46~58 nL·L-1时,可获得较高的R2值取值范围,分别为0.70~0.75和0.70~0.745。参考文献发现,目前地表臭氧污染可能引起的水稻产量损失范围为5%~8%,对照圈中POD9~10和AOT40~45产量损失的预测值亦在这区间,但前者R2值(0.73~0.74)明显高于后者R2值(0.64~0.69),表明基于气孔臭氧通量的评价指标能更好地反映水稻产量的变化。通过进一步分析发现,当通量阈值Y为9 nmol O3·m-2PLA·s-1时,能更准确地评估水稻产量损失,且其R2值(0.73)高于通量指标POD6(0.57)。以上研究结果表明,通量指标POD9更适合评估亚热带地区O3污染对水稻作物的影响。
气孔导度;水稻(Oryza sativa L.);臭氧;通量响应关系
臭氧(O3)具有强氧化性,是对流层主要的二次空气污染物之一,对植物的生长发育产生不利影响[1-2]。近年来,伴随着我国经济的快速发展,氮氧化物(NOx)、一氧化碳(CO)和挥发性有机物(VOCs)等O3前体物排放量剧增,导致地表O3浓度以每年0.5%~2%的速率增加[3]。对流层O3浓度的日益升高,已经严重威胁到我国粮食生产安全[4]。因此,制定科学合理并适合我国农业特点的O3风险评估方法具有重要意义。
为了定量评价植物对O3的响应关系,科研人员开展了大量研究工作。20世纪80年代,美国农业部和环境保护局创建了全国农作物损失评价网,利用田间原位开顶式气候箱(OTCs)来研究农作物(主要有豆类、块茎类和禾本科作物等)对不同浓度O3水平的响应机制,并通过建立O3浓度(M7)与作物产量浓度响应模型,对作物产量损失进行评估[5]。随着研究的持续深入,发现O3对作物造成的负面影响主要是由O3的累积效应引起,由此提出了O3剂量的概念,并利用AOT40、SUM06和W126等不同暴露指标来反应O3剂量对作物伤害的阈值[6]。AOT40(大于40 nL·L-1的小时平均O3浓度与40 nL·L-1差值的累计值)将40 nL· L-1作为O3对作物产生伤害的临界值,超过临界值的O3将对作物产生负面效应[7-8],因其与作物的反应有良好的拟合关系,较好地反映了O3对作物的潜在威胁,所以曾被广泛用于O3风险评价当中[9]。然而,基于AOT40等暴露指标建立的作物产量损失的剂量响应模型,仅仅考虑了植物冠层水平的O3浓度变化,忽略了生物和气候因素对气孔O3吸收的调节作用[10],用于作物产量损失的评估时,存在一定局限性和不确定性。大量研究表明,O3对植物的伤害主要取决于植物的气孔O3吸收量[11],而气孔是O3进入植物体的主要通道,气孔开度大小对植物叶片O3吸收数量起着调节和限制作用[12]。为了准确评估O3对作物生长和产量的影响,基于气孔O3吸收通量的方法被提出并广泛应用于作物产量损失的评估中[13]。该方法以Jarvis气孔导度模型[14]为基础,既考虑了环境因素与植物自身因素,又考虑了植物对环境改变的生理响应,更接近实际水平,可避免过高估计O3污染对作物造成的伤害[15]。目前,我国O3污染研究多数是在OTCs实验条件下以暴露指标为主,缺乏自然环境条件下O3浓度升高对作物O3通量影响的研究[16]。大量研究表明,OTCs可以改变植物冠层的微气候条件,如温度、降雨、湿度和风速等自然环境条件,影响植物叶片气体交换、污染物吸收以及土壤养分供给等,改变植物对O3的敏感性,从这种模拟环境中取得的研究结果预测O3浓度升高对作物生长的影响,具有较多的不确定性。鉴于此,在开放系统下升高臭氧浓度,以尽可能接近自然环境的条件下,利用模型预测我国作物的气孔O3吸收通量和产量损失将有利于臭氧风险评价方法的进一步完善。
水稻是世界上重要的粮食作物,而中国是世界上最大的水稻生产国(水稻产量占全球30%)和消费国(年消费1.465亿吨)[17]。近年来许多研究表明水稻是对O3污染比较敏感的农作物品种[2]。由于人口的增长和农田减少,社会对水稻产量和质量的需求持续上升。本文根据中日合作建立的亚洲首个稻/麦轮作O3-FACE(Free-air concentration elevation of O3)平台,利用Jarvis气孔导度模型和通量模型,计算水稻叶片气孔O3吸收通量,建立气孔O3吸收通量与水稻产量的通量关系模型,综合分析了不同O3通量和水稻产量的拟合关系;同时根据计算的不同O3暴露剂量,比较分析了不同O3风险评价指标在水稻产量损失评估中的优劣,为政府制定相应的法律、法规、政策提供理论依据。
1 材料和方法
1.1 试验区概况
试验于2007—2009年在中国O3-FACE研究基地进行。该基地位于江苏省江都市小纪镇马凌村良种场(32°35′5″N,119°42′0″E),海拔高度5 m,典型的亚
热带海洋气候区,年均降雨量980 mm左右,年均蒸发量大于1100 mm,年均温度14.9℃,年日照时间大于2100 h,年无霜期220 d,耕作方式为水稻-冬小麦轮作,典型的轮作农田生态系统。
1.2 试验平台
O3-FACE系统设置大气O3浓度升高圈(FACE,E)和对照处理圈(Ambient,A),每个处理各有三个重复,FACE圈之间以及FACE圈与对照圈之间的间隔大于70 m,以减少O3释放的圈际影响。FACE圈为直径14 m的正八边形,作物冠层上方50~60 cm处放置8根放气管道,管道上分布有锯齿状小孔,由计算机自动控制FACE圈气体的喷放。晴天每天09:00—18:00释放O3,使FACE圈内O3浓度始终比对照圈O3浓度高50%,雨天、雾天(避免水蒸发时水滴所在处O3被浓缩)、自然环境中O3浓度低于20 nL·L-1(低于可观察效应阈值40 nL·L-1)或高于250 nL·L-1(避免水稻叶片局部过度损伤)时暂停通气。在90%的放气时间内,平台控制区域O3浓度的误差在控制目标值的20%以内,3个对照圈无放气管道,环境条件与自然状态完全一致。
1.3 供试水稻
2007年供试品种为武运粳15(WYJ15,粳稻)、扬稻6号(YD6,粳稻)、汕优63(SY63,杂交稻)和两优培九(LYPJ,杂交稻);2008、2009年供试品种相同,为武运粳21(WYJ21,粳稻)、扬稻6号、汕优63和两优培九。成熟期,每个小区取样2 m2,测定实产。
1.4 气孔导度模型
本文采用Jarvis气孔导度模型[14]对水稻剑叶气孔导度进行模拟,模型公式如下:
gsto=gmax×min(fphen,fO3)×flight×max[fmin,(fVPD×ftemp)]
式中:gsto表示单位投影叶面积(PLA)[18]实际气孔导度(mmol O3·m-2PLA·s-1);gmax表示最大气孔导度(mmol O3·m-2PLA·s-1);fmin表示最小相对气孔导度值,为固定常数,由最小气孔导度和最大气孔导度的比值确定(本文取值0.01);fphen、fO3、flight、ftemp和fVPD分别是水稻物候期(phen)、O3吸收通量、光照(PPFD)、大气温度(T)和水汽压差(VPD)对气孔导度的限制函数,并以相对值的形式表示,取值范围为0≤f≤1,其中:O3吸收通量以小时O3浓度大于0 nmol O3·m-2PLA·s-1累积O3浓度值(POD0)表示,累积时间采用有效积温形式计算,从开花前-350℃·d至开花后1000℃·d,并以0℃·d为基温,开花前为负值,开花后为正值。
气孔导度模型公式及相关参数在表1中列出。
1.5 臭氧通量模型
参考LATAP[18]的方法来计算水稻剑叶气孔O3通量,公式如下:

式中:Fst表示气孔O3吸收速率(nmol O3·m-2PLA·s-1);[O3]表示冠层臭氧浓度;rb表示叶的边界层阻力;rc表示叶的气孔阻力;gext表示叶的非气孔导度。
叶边界层阻力rb和叶气孔阻力rc计算公式如下:

式中:gb表示叶边界层导度,通过冠层高度处风速(u,m·s-1)和叶片宽度(w,0.02 m)计算得到。计算公式如下[19]:

累积气孔臭氧通量计算公式如下:
PODY=Σmax(Fst-Y,0)
式中:PODY表示气孔臭氧吸收速率大于临界值Y时的累积气孔臭氧吸收通量(mmol·m-2);Y表示气孔臭氧吸收速率的临界值(nmol O3·m-2PLA·s-1)。
1.6 数据处理
根据Feng等[19]提供的方法,利用最小二乘法对水稻产量与O3通量/剂量指标进行线性回归分析,将回归线截矩作为理论产量,每个处理的实际产量与回归线截矩的比值作为相对产量(RY),以O3通量/剂量指标为横坐标,相对产量(RY)为纵坐标,进行通量/剂量效应分析,根据分析结果比较不同评价指标在水稻产量损失评估中的优劣。其中相对产量作为O3通量/剂量为零时的假设产量,使得每个处理间的产量具有可比性。
通量效应分析中,本文对水稻气孔O3吸收速率临界值Y从0~18进行连续取值,间隔为1,建立PODY与水稻产量间的通量响应关系模型,分析不同Y值条件下气孔O3通量PODY与相对产量之间的关系,以确定最合理的气孔O3吸收阈值。
同时计算了臭氧浓度指标AOTX,X从0~70进行连续取值,间隔为5,建立AOTX与水稻产量间的剂量响应关系模型,分析不同X值下AOTX与水稻相对产量之间的关系,其臭氧累积计算期间与通量指标PODY相同,而不是3个月的累积期。

式中:AOTX为有效光照条件下(太阳总辐射≥50 W· m-2)大于X(nL·L-1)的小时平均O3浓度与X(nL·L-1)差值的累计值(nL·L-1·h)。
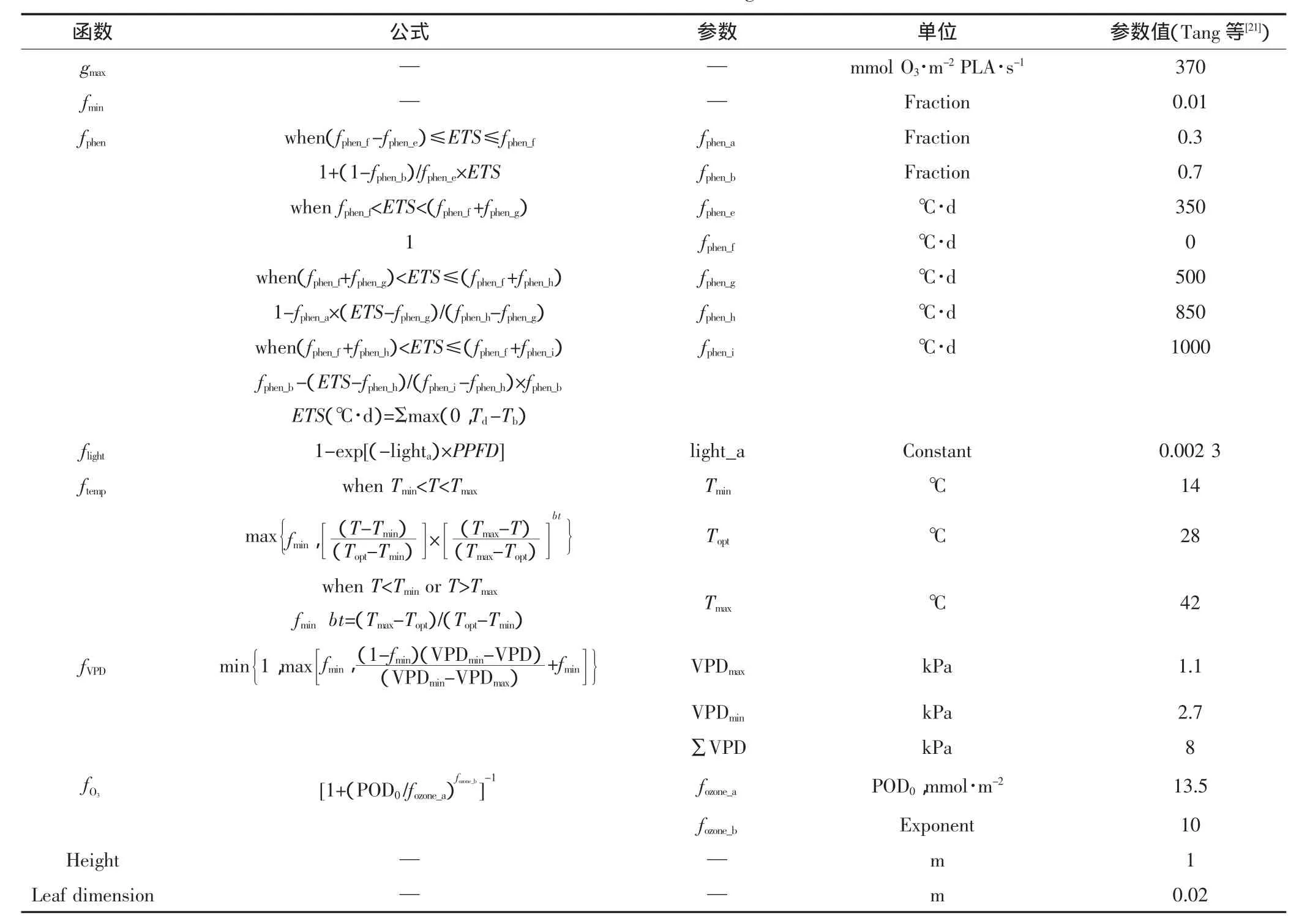
表1 水稻剑叶气孔导度计算参数Table 1 Parameterization used to calculate rice flag leaves stomatal conductance
2 结果与分析
2.1模型数据输入
气象数据是模型运行的驱动因子,本研究所用的气象数据由FACE平台设置的气象监测站(Campbell Sci.North Logan,Utah,USA)监测得到(图1),2007、2008、2009年三个水稻种植季节:日均最大和最小温度分别为27.3、20.7℃,27.4、21.0℃,27.2、20.4℃;日均最大光量子通量密度(PPFD)分别为1137、1147、1001 μmol·m-2·s-1;累积降雨量分别为421、392、511 mm。其中,2009年水稻季降雨量比2007和2008水稻季多,从而对2009年水稻季太阳辐射产生影响,使该季大气温度(T)和光量子通量密度(PPFD)小于前两季;水稻生长季节相对湿度(RH)保持在80%~100%之间,并与降雨量正相关。
冠层高度臭氧浓度由O3分析仪(Thermo Electron 49i,Thermo Scientific Co.,USA)监测得到,每隔20 s记录一次。在水稻生长季节内,FACE圈的累积O3剂量指标AOT40稳定增长,FACE圈和对照圈AOT40差异明显,且差异随时间的增加而增加,2007、2008、2009年FACE圈分别比对照圈高93.8%、107%、136%,日7 h平均O3浓度FACE圈分别比对照圈高23.6%、23.1%、21.2%(图2)。
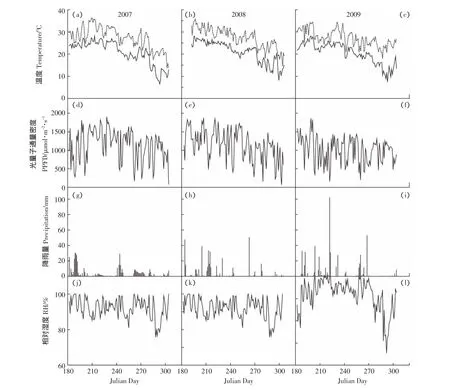
图1 水稻生长季内气象数据(2007—2009年)Figure 1 Meteorological data collected at the experiment site during the 2007,2008,and 2009 growth seasons
图3表示在整个累积计算期间内各环境因子(PPFD、VPD、T)对气孔导度的限制作用(以YD6为例,不同品种间曲线略有不同)。当出现光照时,气孔张开,随着光照增强,其对气孔导度限制作用减弱;日出之前,温度最低,温度对气孔导度的限制作用最强,随着温度升高,其对气孔导度的影响逐渐趋于稳定,然后随着温度的下降,其对气孔导度的限制作用增强。2009年温度的影响强于其他年份,主要是因为当年水稻季降雨量多而导致环境温度下降造成的(图1)。由于农田自然环境条件相对稳定,水汽压差(VPD)对气孔导度的影响变化不大。
计算水稻气孔O3通量时,所有数据集(气象数据和O3浓度数据)均转换为小时均值的形式。
2.2 产量分析
参考Zhu等[20]的分析方法,分别对FACE圈和对照圈水稻品种产量求均值,发现O3处理显著减少了14.3%的水稻产量(图4),其中WYJ15、WYJ21、YD6、LYPJ和SY63分别减少9.9%、10.5%、9.1%、20.5%和16.5%。不同水稻品种产量有显著差异,其中LYPJ产量最高,WYJ21产量最低,品种间产量差异随季节而
变化。不同品种对臭氧浓度升高表现出不同的响应,与粳稻相比,杂交稻对臭氧浓度升高更敏感,表现出更高的产量差异(图4)。方差分析结果表明(表2):O3×Cultivar展现出弱显著交互作用(P=0.068),而O3× Cultivar×Year交互作用不显著(P=0.131)。通过分析发现,这种现象由于FACE圈中SY63产量的不稳定性而引起,与对照圈相比,FACE圈中SY63各季产量分别下降了17.5%、27.5%和16.3%。当忽略SY63时,方差分析结果表明:O3×Cultivar的交互作用不显著(P=0.318),然而O3×Cultivar×Year或O3×Year的交互作用仍保持不显著(P值分别为0.878和0.612)。因此,考虑到SY63对O3表现出较大的年际变化,通量/剂量效应分析中该品种2008年产量被忽略。
2.3 通量效应分析
图5展示了通量分析和剂量分析中R2值的变化,以及FACE圈和对照圈的相对产量的估计值(相对产量分别表示为A-RY和E-RY)。R2值随阈值Y增加而增加,当阈值Y等于11 nmol O3·m-2PLA·s-1时,O3吸收通量(POD11)与水稻相对产量的相关性最大(图5 a)。当通量阈值Y=8~13 nmol O3·m-2PLA·s-1时,获得高R2值取值范围(0.70~0.75),不同通量指标间R2值相差较小。同样,从图5 b可以看出,当X取值为46~58 nL·L-1时,可以得到较高的R2值范围(0.70~0.745)。
通过分析发现,随着臭氧阈值的增加,水稻的相对产量呈现明显的下降趋势(图6)。从图6可以看出,通量POD6与相对产量剂量效应分析得到的R2值(0.57)明显小于POD9和POD11的R2值(0.73、0.75),且AOT40指标的剂量效应分析R2值介于POD6和POD9两指标通量效应分析R2值之间。随着通量阈值Y继续增加,点的聚集效应随之出现(图6 c)。通过对相对产量和通量(图6a、图6b)做残差分析(图7a、图7b)发现,POD9的残差分布比POD6更均匀。关于合理阈值的选择将在讨论部分给出。

图2 2007年、2008年和2009年生长季内AOT40(a、b、c)(大于40 nL·L-1的小时O3浓度与40 nL·L-1差值的累计值)以及7 h均值M7(d、e、f)的季节变化Figure 2 AOT40(accumulated daytime[O3]above a threshold of 40 nL·L-1)in 2007(a),2008(b),2009(c)seasons and seasonal change in daily 7-h(9:00—16:00,Chinese Standard Time)mean[O3]in 2007(d),2008(e),2009(f)seasons
3 讨论
目前,关于水稻气孔导度模型的研究仍然很少。本研究利用了Tang等[21]基于FACE实验数据修正的气孔导度模型来评估水稻剑叶的臭氧通量。与开顶式气室(OTC)不同,本研究是在开放式臭氧浓度增高环境(FACE)条件下进行,可以更好地代表未来环境臭氧浓度升高的情况,避免OTC试验中对冠层微气候
的影响[22]。
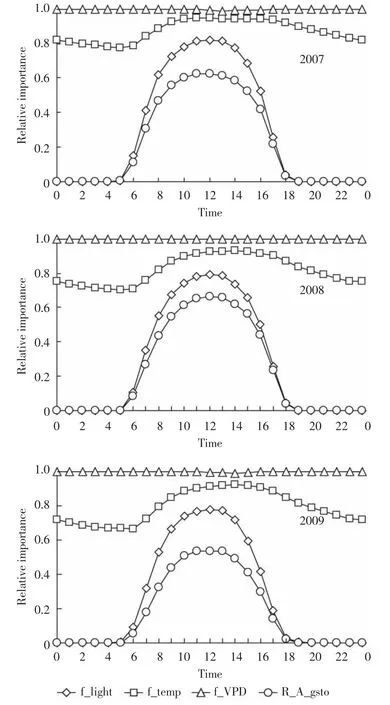
图3 水稻累积期间内环境变量(PPFD,VPD,T)对相对气孔导度(0~1,1表示最大气孔导度)影响的日变化曲线Figure 3 The relative importance of environmental variables(PPFD,VPD,T)for relative stomata conductance(gsto)(0~1,where 1 represents gmax)expressed as average diurnal curves for the accumulated period of rice

图4 对照圈和FACE圈水稻产量(n=3)Figure 4 Yield of rice(Oryza sativa L.)under A-O3and E-O3(n=3)
与暴露剂量指标(AOT40)相比,通量指标最重要的提高在于对累积期间的界定[9]。大量研究表明,早期灌浆期间剑叶没有明显的衰老过程,但是在灌浆后期其叶绿素含量快速下降[23]。本研究中暴露剂量指标AOTX累积计算期间与通量指标计算期间相同(从开花前-350℃·d-1至开花后1000℃·d-1)。如在Pleijel等[24]实验中,作物生育周期少于三个月,导致其对臭氧风险的评估结果具较高的不确定性。另外,气孔导度模型综合考虑了生物和气候因素对气孔导度的影响,揭示了气孔导度与各环境限制因子的关系,基于气孔导度模型的气孔O3通量指标在水稻产量损失的评估方面比O3暴露指标更具优势。
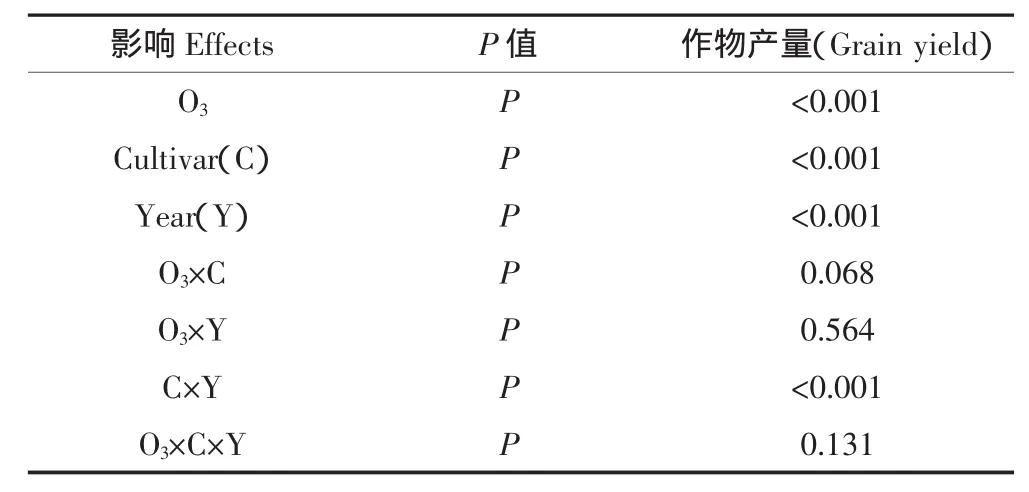
表2 响应臭氧浓度升高的粮食产量方差分析Table 2 Analysis of variance for grain yield in response to elevated[O3]
对于AOTX和PODY来说,选择合适的阈值(X和Y)对于臭氧风险评估的结果至关重要,所以本文不仅比较R2值大小,而且通过分析比较水稻的产量损失来选择合适的O3风险评估阈值。在欧洲,当通量阈值Y为6 nmol O3·m-2PLA·s-1时(对小麦、马铃薯等评估),相对产量和O3通量具有显著的相关性[13]。本研究中,当Y=6 nmol O3·m-2PLA·s-1时,相对产量和POD6的相关性较低(R2=0.57,图7A),不能很好反应水稻产量的变化,预测产量损失时可能存在较高的不确定性。根据EDU试验以及整合分析[2,25]的结果,目前地表臭氧污染可能引起的水稻产量损失范围为5%~8%。从图5可以看出,对照圈中POD9~10和AOT40~45产量损失的预测值在该区间,但前者R2(0.73~0.74)值要高于后者R2(0.64~0.69),表明基于气孔臭氧通量的评价指标能更好地反映水稻产量的变化。并且,随着通量阈值Y的升高,对照圈中具有低气孔臭氧吸收通量(POD10)的部分数据点出现集聚效应。同时考虑对照圈中可能的产量损失和R2值,通量阈值取为9 nmol O3·m-2PLA·s-1时,能更好地评估亚热带地区的水稻产量损失。这与Yamaguchi等[26]研究结果相似(Y=10 nmol O3·m-2PLA·s-1)。尽管该通量阈值要小于Feng等[19]对小麦通量阈值的研究结果(Y= 12 nmol O3·m-2PLA·s-1),但不能简单地认为亚热带地区水稻品种比小麦品种对O3更敏感,因为两者使用了不同的模型参数值。
通量和剂量效应关系中较高的R2值范围分别出现在POD8~13(R2=0.70~0.75)和AOT46~58(R2=0.70~0.74)。但是,当考虑到合理的阈值Y=9~10 nmol O3· m-2PLA·s-1和X=40~45 nL·L-1时,通量指标POD9~10的R2值(0.73~0.74)明显高于剂量指标AOT40~45的R2值(0.64~0.69)。可见与暴露剂量指标相比,通量指标与产量损失有更好的相互关系,对产量损失的评估更为准确。因此,基于累积气孔O3通量的方法适合于定量评估O3污染对水稻作物的影响,尤其是缺乏O3风险评估方法的亚热带地区。

图5 相对产量和气孔O3通量PODY或累积暴露剂量AOTX回归分析R2值与O3通量阈值Y(a)或O3暴露剂量阈值X(b)的关系,以及线性外推得到的对照圈和FACE圈相对产量的预测值Figure 5 R2-values of the regressions between relative yield and PODY over a threshold of Y nmol O3·m-2PLA·s-1(x-axis)(A)or relative yield(RY;y-axis)and AOTX over an hourly threshold concentration of Xppb(x-axis)(B).Also the values of RY at ambient(A-RY)and elevated O3(E-RY)were shown by linear extropolation
本研究选用了两种杂交稻和三种常规粳稻作为实验材料,通过分析发现杂交稻对O3污染更敏感。通过计算三个生长季节敏感性品种产量,其产量损失达到18%(图4)。因此,可以判定一个地区水稻对O3的敏感特性变异,不仅和年际间气候变异有关而且与水稻品种有关,当评估O3污染对作物的影响时,应该充分考虑这些因素。最后,值得注意的是,O3风险评估的计算中忽略了一个或多个气孔导度的限制因素,都
会导致过高估计其潜在风险,产生不确定性。因此,需要更多的O3观、监测站点和不同O3处理水平试验(低于对照处理的O3水平试验),以提高和改善O3风险评估方法。
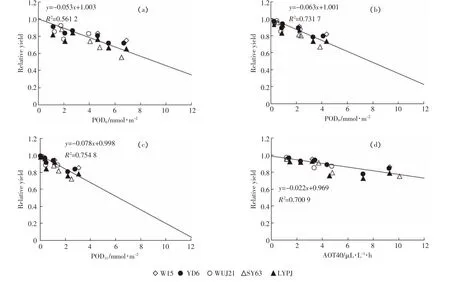
图6 相对产量与POD6(a)、POD9(b)、POD11(c)和AOT40(d)的关系Figure 6 Relationship between relative yield and POD6(a),POD9(b),POD11(c)and AOT40(d)

图7 相对产量和POD6(a)、POD9(b)回归分析残差图Figure 7 Residual plots for the regressions between relative yield and POD6(a)and POD9(b)
4 结论
研究表明,基于累积气孔O3通量的方法不仅考虑了环境O3浓度的变化对气孔导度的影响,而且考虑了环境和生物因子对气孔运动的调节作用,更接近于实际水平,是目前评估O3对植物伤害的更为可靠的方法。与剂量指标AOTX相比,通量指标PODY能更好地反映水稻产量的变化。根据试验观察的产量损失率区间,选用POD9评估对亚热带地区O3污染造成的水稻产量损失风险更为合适。
[1]Ashmore M R.Assessing the future global impacts of ozone on vegetation[J].Plant Cell and Environment,2005,28:949-964.
[2]Feng Z Z,Kobayashi K.Assessing the impacts of current and future concentrations of surface ozone on crop yield with meta-analysis[J].Atmospheric Environment,2009,43:1510-1519.
[3]Vingarzan R.A review of surface ozone background levels and trends[J]. Atmospheric Environment,2004,38:3431-3442.
[4]Tang H Y,Takigawa M,Liu G,et al.A projection of ozone-induced wheat production loss in China and India for the years 2000 and 2020 with exposure-based and flux-based approaches[J].Global Change Biology,2013,19:2739-2752.
[5]Heck W C,Adams R M.Reassessment of crop loss from ozone[J].Environment Science and Technology,1983,17:572-581.
[6]Further J,Skarby L,Ashmore M R.Critical levels for ozone effect on vegetation in Europe[J].Environmental Pollution,1997,97:91-106.
[7]Pleijel H,Berglen E A,Danielsson H,et al.Differential ozone sensitivity in an old and a modern Swedish wheat cultivar grain yield and quality,leaf chlorophyll and stomata conductance[J].Environmental and Experimental Botany,2006,56(1):63-71.
[8]Mills G,Buse A,Gimeno B,et al.A synthesis of AOT40-based response functions and critical levels of ozone for agricultural and horticultural crops[J].Atmospheric Environment,2007,41:2630-2643.
[9]Pleijel H,Wallin G,Karlsson P E,et al.Ozone deposition to an oat crop(Avena sativa L.)grown in open-top chambers and in the ambient air[J]. Atmospheric Environment,1994,28:1971-1979.
[10]佟磊,王效科,苏德·毕力格,等.水稻气孔臭氧通量拟合及通量与产量关系的比较分析[J].农业环境科学学报,2011,30(10):1930-1938.
TONG Lei,WANG Xiao-ke,Sudebilige,et al.Stomatal ozone uptake modeling and comparative analysis of flux-response relationships of rice[J].Journal of Agro-Environment Science,2011,30(10):1930-1938.
[11]NouchiI.Responses of whole plants to air pollutants//Omasa K,Saji H,YoussefianS,etal.Eds.Airpollutionandplantbiotechnology-prospects for phytomonitoring and phytoremediation[M].Springer-Verlag Tokyo,Tokyo,Japan,2002:3-39.
[12]Heath R L,Lefohn A S,Musselman R C.Temporal processes that contribute to nonlinearity in vegetation responses to ozone exposure and dose[J].Atmospheric Environment,2009,43:2919-2928.
[13]Pleijel H,Danielsson H,Emberson L D,et al.Ozone risk assessment for agricultural crops in Europe:Further development of stomata flux and flux-response relationships for European wheat and potato[J]. Atmospheric Environment,2007,41:3022-3040.
[14]Jarvis P G.The interpretation of the variations in leaf water potential
and stomatal conductance found in canopies in the field[J].Philosophical Transactions of the Royal Society,London B,1976,273:593-610
[15]Mills G,Pleijel H,Braun S,et al.New stomata flux-based critical levels for ozone effects on vegetation[J].Atmospheric Environment,2011,45:5064-5068.
[16]吴荣军,郑有飞,赵泽,等.基于气孔导度和臭氧吸收模型的冬小麦干物质累积损失评估[J].生态学报,2010,30(11):2799-2808.
WU Rong-jun,ZHENG You-fei,ZHAO Ze,et al.Assessment of loss of accumulated dry matter in winter wheat based on stomata conductance and ozone uptake model[J].Acta Ecologica Sinica,2010,30(11):2799-2808.
[17]国家统计局.中国统计年鉴[M].北京:中国统计出版社,2013.
National Bureau of Statistics.China statistical yearbook[M].Beijing:China Statistics Press,2013.
[18]LRTAP Convention.Manual on methodologies and criteria for modeling and mapping critical loads&levels and air pollution effects,risk and trends//Chapter 3.Mapping Critical Levels for Vegetation(2010 Revision).Available at:http://icpvegetation.ceh.ac.uk.
[19]Feng Z Z,Tang H Y,Uddling J,et al.A stomata ozone flux-response relationship to assess ozone-induced yield of winter wheat in subtropical China[J].Environment Pollution,2012,164:16-23.
[20]Zhu X K,Feng Z Z,Sun T F,et al.Effects of elevated ozone concentration on yield of four Chinese cultivars of winter wheat under fully open-airfield conditions[J].Global Change Biology,2011,17:2697-2706.
[21]Tang H Y,Pang J,Zhang G X,et al.Mapping ozone risks for rice in China for years 2000 and 2020 with flux-based and exposure-based doses[J].Atmospheric Environment,2014,86:74-83.
[22]Tang H Y,Liu G,Han Y,et al.A system for free-air ozone concentration elevation with rice and wheat:Control performance and ozone exposure regime[J].Atmospheric Environment,2011,45:6276-6282.
[23]Pang J,Kobayashi K,Zhu J G,et al.Yield and photosynthetic characteristics of flag leaves in Chinese rice(Oryza sativa L.)varieties subjected to free-air release of ozone[J].Agriculture,Ecosystems and Environment,2009,132:203-211.
[24]Pleijel H.Statistical aspects of critical levels for ozone//Kärenlampi L,Skärby L.Eds.Critical levels for ozone in Europe:Testing and Finalising the Concepts[R].UNECE Workshop Report.University of Kuopio,Department of Ecology and Environmental Science,University of Kuopio,1996:130-150.
[25]Wang X P,Denise L Mauzerall.Characterizing distributions of surface ozone and its impact on grain production in China,Japan and South Korea:1990 and 2020[J].Atmospheric Environment,2004,38:4383-4402.
[26]Yamaguchi M,Hoshino D,Inada H,et al.Evaluation of the effects of ozone on yield of Japanese rice(Oryza sativa L.)based on stomatal ozone uptake[J].Environmental Pollution,2014,184:472-480.
Stomatal ozone flux-resPonse relationshiPs of rice(Oryza sativa L.)in subtroPical area
ZHANG Ji-shuang1,2,TANG Hao-ye1,LIU Gang1,ZHU Jian-guo1*
(1.State Key Laboratory of Soil and Sustainable Agriculture,Institute of Soil Science,Chinese Academy of Sciences,Nanjing 210008,China;2.University of Chinese Academy of Sciences,Beijing 100049,China)
Based on previous investigations on a fully open-air ozone(O3)fumigation experiment(O3-FACE),we established dose-response relationships using O3dose index AOT40(accumulated[O3]above 40 nL·L-1)and PODY(phytotoxic O3dose,accumulated stomatal flux of O3above a threshold of Y nmol·m-2·s-1),and compared their performance on O3-induced rice yield loss evaluation.The aim of this study is to find the optimum threshold for exposure-based and flux-based dose-response relationships used for ozone risk assessment on rice.Our result showed that the R2-value of regression analysis increased with flux threshold Y[0~11 nmol O3·m-2PLA·s-1(PLA:projected leaf area)]and exposure threshold X(0~50 nL·L-1)increase,respectively.When flux threshold Y was 11 nmol O3·m-2PLA·s-1and exposure threshold X was 50 nL·L-1,the O3dose index POD11and AOT50 had the strongest correlation with RY(relative yield)of rice,respectively.High R2-value was derived i.e.0.70~0.75 and 0.70~0.745 when flux threshold Y was within the range of 8~13 nmol O3·m-2PLA·s-1and exposure threshold X was 46~58 nL·L-1,respectively.Previous studies have indicated that the rice yield loss caused by near-surface ozone pollution may range from 5%to 8%.These results were similar with our estimation on ambient[O3]treatment using POD9~10and AOT40~45.The higher R2-value 0.73~0.74 with POD9~10compared to that of 0.64~0.69 with AOT40~45 indicated that flux-based assessment may have a superior performance on O3-induced rice yield loss estimation.Further analysis found that when flux threshold Y=9 nmol O3·m-2PLA·s-1,assessment of rice yield loss was more accurate,and the R2-value(0.73)was higher than that of POD6(0.57).Our results suggested that POD9is suitable for evaluating rice yield loss due to O3increase in subtropical area.
stomatal conductance;rice(Oryza sativa L.);ozone;flux-response relationship
S511
A
1672-2043(2016)10-1857-10
10.11654/jaes.2016-0594
张继双,唐昊冶,刘钢,等.亚热带地区水稻(Oryza sativa L.)气孔臭氧通量和产量的响应关系[J].农业环境科学学报,2016,35(10):1857-1866.
ZHANG Ji-shuang,TANG Hao-ye,LIU Gang,et al.Stomatal ozone flux-response relationships of rice(Oryza sativa L.)in subtropical area[J].Journal of Agro-Environment Science,2016,35(10):1857-1866.
2016-04-28
科技部国际科技合作与交流项目(2010DFA22770)
张继双(1990—),男,硕士研究生,主要从事全球变化下农田生态系统对臭氧响应的研究。E-mail:jszhang@issas.ac.cn
*通信作者:朱建国E-mail:jgzhu@issas.ac.cn
