Agrobacteriumtumefaciens OAH-01产脲酶发酵培养基优化
2016-11-11侯恩玲刘良禹林金雪娇毛相朝
侯恩玲, 刘良禹, 林金雪娇, 毛相朝
中国海洋大学食品科学与工程学院,山东 青岛 266003
AgrobacteriumtumefaciensOAH-01产脲酶发酵培养基优化
侯恩玲, 刘良禹, 林金雪娇, 毛相朝*
中国海洋大学食品科学与工程学院,山东 青岛 266003
氨基甲酸乙酯(EC)是大多数发酵制品中的潜在致癌物,而尿素是EC的最主要前体物质之一,因此需要采取相关措施控制发酵制品中尿素的含量。向酒体中添加脲酶具有安全、高效和处理条件温和等优点,是FDA推荐的降低EC 含量的优先方法。微生物是脲酶的主要来源,可利用其实现脲酶的大规模生产。本文以产脲酶根癌农杆菌AgrobacteriumtumefaciensOAH-01为研究对象,考察了该菌株的生长曲线和产酶曲线,证明该菌株产脲酶属生长关联型,且能在较短时间内达到最大产酶量,此外还研究了发酵培养基组成对该菌发酵产酶的影响,通过单因素及正交试验优化确定了最佳发酵培养基组成(g/L):蛋白胨20,酵母粉5,葡萄糖5,FeCl30.54,Na2HPO40.5,KH2PO40.5,NiSO40.1,起始pH 7.0。在最适条件下发酵16 h,菌悬液中脲酶酶活可达1.077 U/mL,为优化前的2.4倍。超声破碎后细胞上清中的脲酶活性为0.419 U/mL,为优化前的4.4倍。
氨基甲酸乙酯; 根癌农杆菌; 脲酶; 发酵优化
氨基甲酸乙酯(Ethyl Carbamate,EC)是一种致癌物质,广泛存在于发酵食品如酱油、面包、奶酪及酒精饮料中,是发酵过程中的天然副产物[1,2]。2007年,国际癌症研究机构将其由第2B组“或可能令人类患癌的物质”改为第2A组“可能令人类患癌的物质”[3]。目前许多国家都制定了EC的限量标准,加拿大是第一个制定酒精饮料中EC限量标准的国家,此后,美国、日本、韩国等国家也相继制定了部分饮料中EC的限量标准,同时该物质在2002年成为联合国粮农组织重点监控物质,并制定出国际标准,食品添加剂联合专家委员会(JECFA)在第64次会议上建议,应尽可能减少发酵食品和饮料中的EC含量,同时世界卫生组织也提议应该制定酒类饮料中EC含量限量标准[4]。在酒精制品的发酵和存储过程中,尿素被认为是EC的主要前体物质,它可以同乙醇反应而转化成EC[5, 6]。因此,控制酒精饮料中的尿素含量是减少EC含量的关键。
根据相关报道及实际应用情况,可从3个方面控制尿素的含量:(1)对原料进行处理。尿素常用于作为肥料,粮食原料中会有尿素残留,而通过精制加工,可以有效减少尿素和精氨酸(尿素的前体物质)含量[7];(2)降低发酵过程中尿素的生成。通过控制发酵过程中尿素的合成代谢途径从而达到降低尿素含量的目的。例如,Kitamoto等构建了一株工程清酒酵母,该酵母在发酵过程中不产生尿素和EC[8],Suizu等则发现当敲除酵母Saceharomycescerevisiae的CAR1基因后,将不再有尿素的积累[9]。(3)通过添加脲酶来分解尿素。据报道,通过添加酸性脲酶可以有效降低尿素含量[10]。Liu等报道一株Enterobactersp.,其产生的酸性脲酶可以去除黄酒中66.5%的尿素[11]。Zhou等也报道市售的酸性脲酶可以去除黄酒中80%的尿素[12]。微生物是脲酶的主要来源。虽然关于细菌、真菌和放线菌产脲酶的报道较多,但不同菌种所产脲酶的性质及其产酶能力存在很大差异,从中寻找能适用于发酵食品生产的脲酶,具有现实意义。目前将微生物来源脲酶应用于降解发酵食品中的尿素,从而降低EC含量的相关研究仍较少见。本实验室自主筛选得到一株产脲酶的根癌农杆菌AgrobacteriumtumefaciensOAH-01,以该菌株为研究对象,通过单因素及正交试验对其发酵培养基组成进行优化,确定了该菌株的最佳产酶条件,提高了菌株的产酶量。
1 材料与方法
1.1 材料
1.1.1 菌株
根癌农杆菌AgrobacteriumtumefaciensOAH-01由本实验室筛选并保藏于中国普通微生物菌种保藏管理中心(CGMCC),保藏编号为CGMCC NO.10914。
1.1.2 主要试剂
蔗糖、D-果糖、麦芽糖、α-乳糖、硫酸铵、FeCl3、KH2PO4、Na2HPO4、MnSO4·4H2O、NiSO4·6H2O、MgSO4·7H2O等购自国药集团化学试剂有限公司,蛋白胨、酵母粉购自Oxoid公司,琼脂、尿素购自Sigma公司。
1.1.3 培养基及主要试剂
LB培养基(g/L):蛋白胨10,酵母粉5,NaCl 10,pH 7.0。
脲酶选择培养基(g/L):蛋白胨1,NaCl 5,葡萄糖0.1,KH2PO42,尿素2,酚红0.012,琼脂15,pH 6.80。121 ℃灭菌20 min。
复筛培养基(g/L):不添加琼脂,其余同脲酶选择培养基。
发酵培养基(g/L):蛋白胨5,葡萄糖5,KH2PO40.5,Na2HPO40.5,MnSO4·4H2O 0.055,NiSO4·6H2O 0.1,MgSO4·7H2O 0.1,pH 7.0。121 ℃灭菌20 min。
显色剂Ⅰ:称取15.0 g苯酚加 0.625 g 亚硝基铁氢化钠,加水溶解,定容至 250 mL。
显色剂Ⅱ:称取13.125 g 氢氧化钠,加适量水溶解,再向其中加入7.5 mL 次氯酸钠,定容至 250 mL。
1.2 实验方法
1.2.1 酶活测定方法
底物为3%尿素,反应缓冲液为0.05 mol/L 柠檬酸缓冲液(pH 4.5),将50 μL适当稀释的发酵液加入1 mL反应体系中,在37 ℃下反应15 min后,加1 mL 10%三氯乙酸终止反应,再加1 mL显色剂I和1 mL显色剂II。37 ℃反应15 min后定容至25 mL,测OD625。酶活单位定义(U):在上述条件下反应,每分钟释放1 μmol氨定义为一个酶活单位。
1.2.2 菌株生长和产酶特性测定
为研究菌株A.tumefaciensOAH-01的生长和产酶特性。将保藏的菌种接种至LB培养基中37 ℃、180 r/min震荡培养24 h,然后将活化后的菌液按照2.5%的接种量接入上述发酵培养基(40 mL/250 mL三角瓶)中37 ℃、180 r/min震荡培养。24 h内每隔4 h取样测定摇瓶发酵液中的菌体浓度和酶活性,每次测三个平行样。
1.2.3 碳源对菌株发酵产酶的影响
(1)不同碳源对菌株发酵产酶的影响:配制不同碳源(葡萄糖、蔗糖、D-果糖、麦芽糖、α-乳糖,浓度均为5 g/L)的发酵培养基,按照2.5%的接种量将活化后的菌液接种于含不同碳源的发酵培养基(40 mL/250 mL三角瓶)中37 ℃、180 r/min震荡培养16 h后,测定菌悬液中的脲酶活力,比较不同碳源对菌株发酵产酶的影响。
(2)碳源浓度对菌株发酵产酶的影响:选择发酵产酶水平最高的碳源为最优碳源,将其在发酵培养基中的浓度分别调整为0.5 g/L、1 g/L、5 g/L、10 g/L、15 g/L和20 g/L,按照2.5%的接种量将活化后的菌液接种于含不同浓度碳源的发酵培养基(40 mL/250 mL三角瓶)中37 ℃、180 r/min震荡培养16 h后,测定菌悬液中脲酶活力以确定最佳碳源浓度。
1.2.4 氮源对菌株发酵产酶的影响
(1)不同氮源对菌株发酵产酶的影响:配制不同氮源(蛋白胨,氯化铵、硝酸钠、硫酸铵、硝酸钾浓度均为5 g/L)的发酵培养基,按照2.5%的接种量将活化后的菌液接种于含不同氮源的发酵培养基(40 mL/250 mL三角瓶)中37 ℃、180 r/min震荡培养16 h后,测定菌悬液中的脲酶活力,比较不同氮源对菌株发酵产酶的影响。
(2)氮源浓度对菌株发酵产酶的影响:选择最优氮源,将其在发酵培养基中浓度分别调至5 g/L、10 g/L、20 g/L、30 g/L、40 g/L、50 g/L、60 g/L、70 g/L和80 g/L,按照2.5%的接种量将活化后的菌液接种于含不同浓度氮源的发酵培养基(40 mL/250 mL三角瓶)中37 ℃、180 r/min震荡培养16 h后,测定菌悬液中的脲酶活力,确定最佳氮源浓度。
1.2.5 酵母粉对菌株发酵产酶的影响
原始发酵培养基中不含酵母粉,通过向初始发酵培养基中添加0 g/L、0.5 g/L、1 g/L、5 g/L、10 g/L、15 g/L、20 g/L和25 g/L的酵母粉配制发酵培养基,按照2.5%的接种量将活化后的菌液接种于含不同浓度酵母粉的发酵培养基(40 mL/250 mL三角瓶)中37 ℃、180 r/min震荡培养16 h后,测定菌悬液的酶活力,考察酵母粉对菌株发酵产酶的影响。
1.2.6 发酵初始pH对菌株产酶的影响
分别配制不同初始pH(4.0、5.0、6.0、7.0、8.0、9.0和10.0)的发酵培养基,按照2.5%的接种量将活化后的菌液接种于不同pH的发酵培养基(40 mL/250 mL三角瓶)中37 ℃、180 r/min震荡培养16 h后,测定脲酶活力,比较不同初始pH对菌株发酵产酶的影响。
1.2.7 常见金属离子对菌株发酵产酶的影响
向除去金属离子的发酵培养基中添加不同浓度的Ni2+、Mn2+、Mg2+、Fe3+、Na2HPO4和KH2PO4离子,按照2.5%的接种量将活化后的菌液接种于含不同浓度金属离子的发酵培养基(40 mL/250 mL三角瓶)中37 ℃、180 r/min震荡培养16 h后,测定菌悬液中的脲酶活力,考察不同金属离子及金属离子的不同浓度对菌株发酵产酶的影响。
1.2.8 正交试验
根据单因素试验结果,选取蛋白胨、酵母粉、葡萄糖、FeCl3四因素,以发酵后菌悬液中的脲酶活力为指标,做四因素三水平正交试验,优化发酵培养基配方。试验设计如下表1。
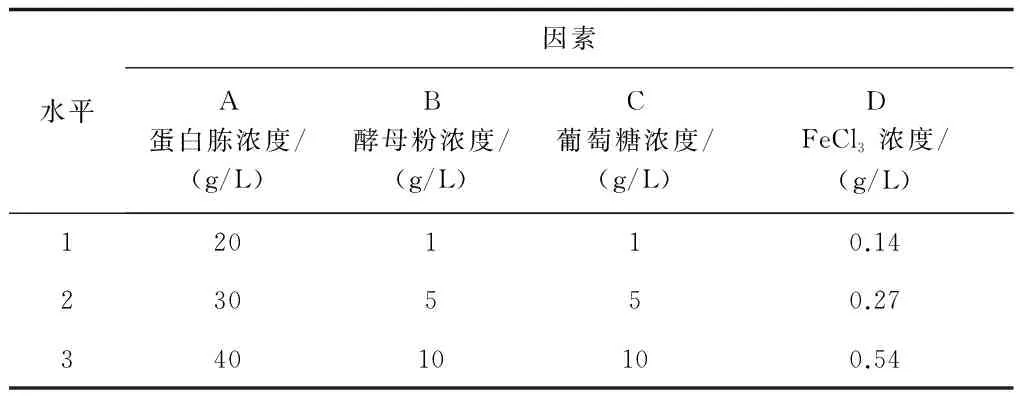
表1 正交试验L27(35)
2 结果与讨论
2.1 菌株A.tumefaciensOAH-01的生长及产酶特性
菌株A.tumefaciensOAH-01生长曲线和产酶曲线如图1所示。4 h内菌体处于延滞期,生长缓慢,产酶量较小。4 h后菌体进入指数生长期,产酶水平也随着菌体密度增加而迅速提升,说明产酶属于生长关联型。16 h时,菌体密度达到最大,之后进入稳定期和衰退期。而16 h脲酶活力也达到最大,表明酶活力和菌体量显著相关,这与Liu等报道的Enterobactersp.菌株类似[11]。根据前人的文献报道,Lactobacillusfermentum需30 h~72 h酶活力水平才能达到最高[13],而Proteusmirabilis则至少需72 h[14]。与之相比,A.tumefaciensOAH-01产酶峰值到来的时间显著缩短。

图1 菌株A. tumefaciens OAH-01的
2.2 碳源对菌株发酵产酶的影响
2.2.1 不同碳源对菌株发酵产酶的影响
碳源是组成细胞骨架及菌体生长代谢不可缺少的营养成分,不同菌体中所含有的酶系不同,因此对不同碳源的利用率也不同,菌种利用不同种类的碳源得到的菌体量和产酶量也有很大差异。不同种类的碳源对菌株A.tumefaciensOAH-01发酵产酶的影响如图2A所示,从图中可以看出,当葡萄糖为碳源时所得脲酶酶活水平最高,使用其他4种碳源,所得脲酶酶活力相差不大,但均低于葡萄糖,因此选择葡萄糖作为发酵培养基中的碳源。
2.2.2 碳源浓度对菌株发酵产酶的影响
考察不同葡萄糖浓度对菌株发酵产酶的影响。如图2B所示,葡萄糖浓度对菌株发酵产酶影响较大。当葡萄糖浓度为0.5 g/L和1.0 g/L时,发酵产酶活力较低,说明碳源浓度低会使菌体营养不足,产酶量少。当葡萄糖浓度增加到5.0 g/L时,酶活显著增加并达到最大值,进一步增加葡萄糖浓度,酶活开始呈现下降趋势,说明碳源浓度过高反而会抑制菌体产酶。因此,葡萄糖的最佳浓度为5.0 g/L。
2.3 氮源对菌株发酵产酶的影响
2.3.1 不同氮源对菌株产酶的影响
氮源是菌体细胞和各种含氮物质的构成成分,也是菌体生长合成代谢产物必不可少的营养成分。不同种类氮源对发酵产酶影响如图2C所示。从图中可看出,当以蛋白胨作为氮源时,菌株生长状况良好,而使用其他种类氮源进行发酵,16 h后,发酵液仍保持澄清状态,菌体没有明显生长迹象。这说明菌株A.tumefaciensOAH-01无法有效利用氯化铵、硝酸钠、硫酸铵、硝酸钾等无机氮源进行菌体生长。因此选择蛋白胨作为发酵培养基氮源。
2.3.2 氮源浓度对菌株产酶的影响
向发酵培养基中添加不同浓度的蛋白胨,考察氮源浓度对菌株发酵产酶的影响。如图2D所示,当蛋白胨浓度在5 g/L~30 g/L内时,随蛋白胨浓度升高,脲酶活性逐渐增加,30 g/L时脲酶活性达到最大,继续增大蛋白胨浓度,脲酶活性开始下降。因此发酵培养基中蛋白胨的最适浓度选择30 g/L左右。
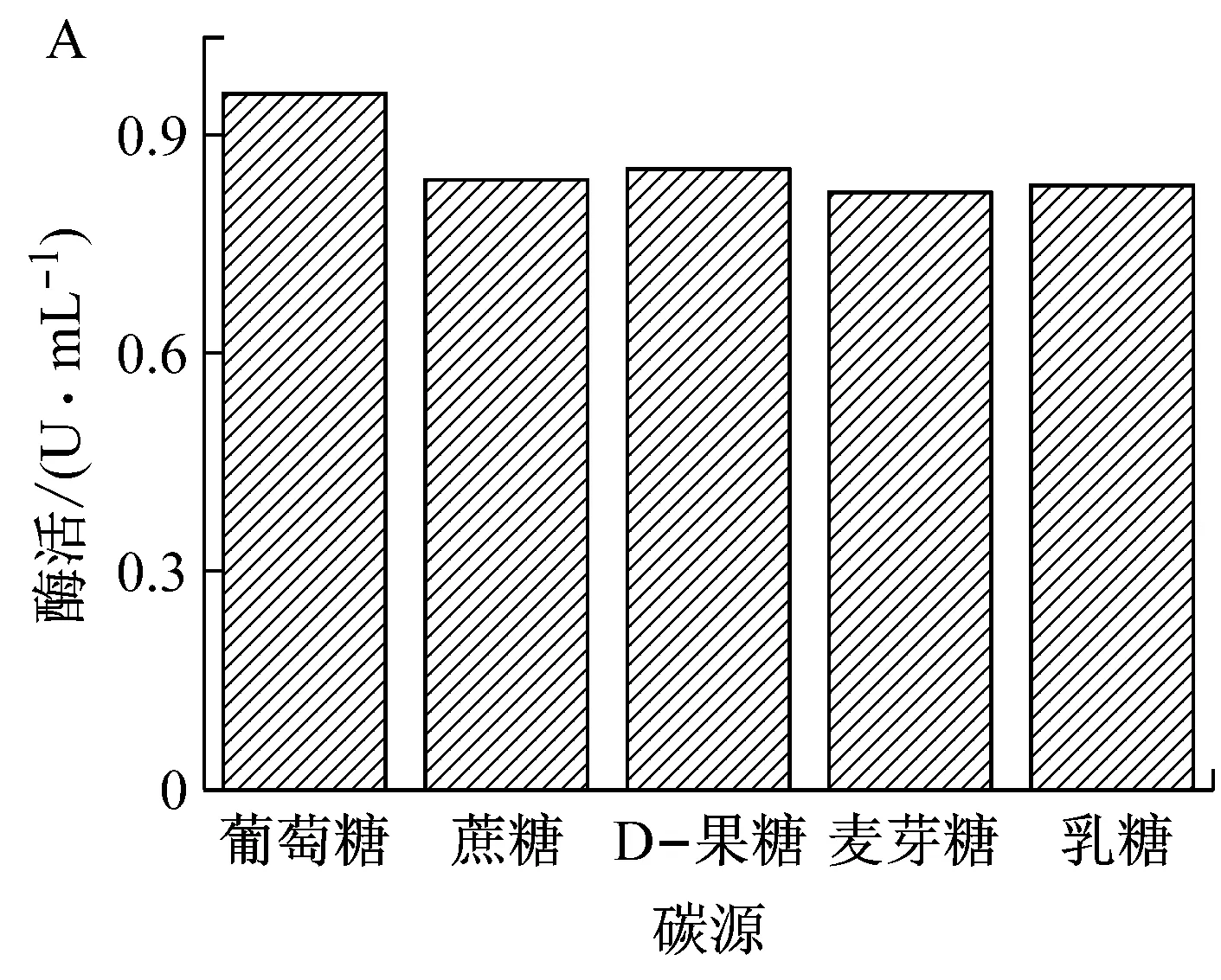



图2 碳源、氮源对菌株发酵产酶的影响
2.4 酵母粉对菌株产酶的影响
酵母粉作为菌体生长的营养物质,既可算作碳源,也可作为氮源。考察在初始发酵培养基中添加不同浓度酵母粉对菌株发酵产酶的影响,结果如图3所示。当酵母粉添加浓度在20 g/L以下时,对产酶有促进作用,但随着添加浓度提高,发酵液中酶活力减弱。当添加量超过20 g/L时,则反而会抑制产酶。因此,酵母粉的适宜添加浓度定为5.0 g/L。
2.5 发酵初始pH对菌株产酶的影响
发酵培养基的初始pH会直接影响菌体的生长代谢。由图4可知,发酵培养基初始pH对发酵产酶的影响。当初始pH为6.0~9.0时,发酵后获得的脲酶酶活较高,且当pH为7.0时脲酶酶活力最高。当pH小于6.0或大于9.0时发酵后酶活力较低,说明过酸或过碱都会影响菌体的生长和脲酶的产量。因此,本试验认为pH 7.0为菌株OAH-01发酵产酶的最适宜pH。

图3 酵母粉浓度对菌株发酵产酶的影响

图4 发酵初始pH对菌株产酶的影响
2.6 常见金属离子对菌株发酵产酶的影响
某些金属离子是核酸、蛋白质、辅酶和细胞膜的构成元素,同时还有维持细胞渗透压和调节酸碱度的作用。
2.6.1 Ni2+对菌株产酶的影响
脲酶是一种含镍的寡聚酶[15]。培养基中的Ni2+对菌株产酶可能会产生促进作用。为考察Ni2+对菌株发酵产酶的影响,分别向发酵培养基中添加终浓度为0 mmol/L、0.008 mmol/L、0.04 mmol/L、0.2 mmol/L和1 mmol/L的Ni2+。不同浓度的Ni2+对菌株产酶的影响如图5A所示。从图中可看出,低浓度的Ni2+对菌体产酶有促进作用,但随着Ni2+浓度升高,逐渐变为抑制。因此,在发酵培养基中添加少量Ni2+可有助于提高脲酶的产量。
2.6.2 Mn2+对菌株产酶的影响
为考察Mn2+对菌株产酶的影响,向发酵培养基中添加了不同浓度的Mn2+,浓度分别为0 mmol/L、0.008 mmol/L、0.04 mmol/L、0.2 mmol/L、1 mmol/L、5 mmol/L、10 mmol/L和50 mmol/L,图5B显示,随Mn2+添加量的提高,菌株产酶总体上表现为受抑制。因此以不添加Mn2+为宜。

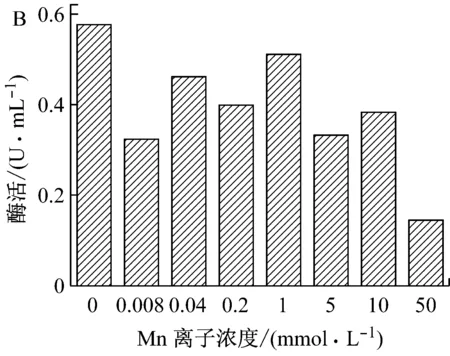


图5 金属离子对菌株产酶的影响
2.6.3 Mg2+对菌株产酶的影响
图5C显示了不同Mg2+浓度对菌株产酶的影响。从图中可看出,在0~50 mmol/L的范围内,Mg2+浓度高低与脲酶活力无显著相关性。因此可从发酵培养基配方中去除添加Mg2+。
2.6.4 Fe3+对菌株产酶的影响
向发酵培养基中添加浓度分别为0 mmol/L、0.04 mmol/L、0.2 mmol/L、1 mmol/L、5 mmol/L、10 mmol/L和50 mmol/L的Fe3+,结果如图5D所示。Fe3+浓度对菌株产酶影响较大,当浓度为1 mmol/L时对产酶促进效果最显著。
2.6.5 初始培养基中Na2HPO4和KH2PO4对菌株OAH-01发酵产酶的影响
为考察Na2HPO4和KH2PO4对菌株产酶的影响,向培养基中分别添加0 g/L、0.1 g/L、0.5 g/L、1 g/L、1.5 g/L和2 g/L的Na2HPO4和KH2PO4。如图6所示,随Na2HPO4浓度提高,脲酶酶活先升高后保持稳定,当Na2HPO4浓度为0.5 g/L,脲酶酶活达到最大,再提高浓度,酶活基本保持不变。因此将Na2HPO4浓度定为0.5 g/L。随KH2PO4浓度的升高,脲酶酶活则逐渐下降。但当浓度为0.1 g/L和0.5 g/L时,发酵后得到的脲酶酶活要高于初始发酵培养基。浓度越小脲酶酶活越高,故选择KH2PO4的添加浓度为0.1 g/L。

图6 Na2HPO4和KH2PO4对菌株产酶的影响
2.7 正交试验优化结果
通过单因素试验确定了培养基中各组分对菌株产酶的影响及各组分的最适浓度范围。为进一步确定最佳培养基配方,根据试验结果,选取对菌株产酶影响较大的四个因素:蛋白胨(A)、酵母粉(B)、葡萄糖(C)、FeCl3(D),以发酵后菌悬液中脲酶活力为指标,设计四因素三水平正交试验,结果如表2所示。

表2 正交试验结果
极差R值分析可知,蛋白胨、酵母粉、葡萄糖、FeCl3浓度对菌悬液中酶活力影响的主次效应为FeCl3>酵母粉>葡萄糖>蛋白胨。根据图7可知,这四种组分浓度的最优组合是A1B2C2D3,即蛋白胨20 g/L,酵母粉5 g/L,葡萄糖5 g/L,FeCl30.54 g/L,此时发酵后菌悬液中酶活水平最高。

图7 酶活均值主效应图
2.8 验证试验
采用最佳培养基进行发酵,菌悬液中的脲酶活力水平为1.077 U/mL,是使用初始发酵培养基所得酶活(0.45 U/mL)的2.4倍。将发酵后收获的菌体进行超声破碎,离心取上清测脲酶活力,结果显示,采用最佳培养基配方,上清液中脲酶酶活可达0.419 U/mL,而使用初始培养基,上清中酶活力仅为0.095 U/mL,前者比后者提升了4.4倍。
3 结论
以产脲酶根癌农杆菌A.tumefaciensOAH-01为对象,研究了该菌株的生长曲线和产酶曲线。利用单因素试验及正交优化确定了最佳发酵培养基组成(g/L):蛋白胨20,酵母粉5,葡萄糖5,FeCl30.54,Na2HPO40.5,KH2PO40.5,NiSO40.1,起始pH 7.0。在优化后的培养条件下,菌悬液中脲酶活力水平提高2.4倍,而超声破碎后,细胞上清液中脲酶活性水平提高了4.4倍。
[1] Masqu MC, Soler M, Zaplana B,etal. Ethyl carbamate content in wines with malolactic fermentation induced at different points in the vinification process. Annals of Microbiology, 2011, 61(1): 199-206.
[2] Sarah H, Colin C, Nicholas P,etal. Survey of ethyl carbamate in fermented foods sold in the United Kingdom in 2004. Journal of Agricultural & Food Chemistry, 2007, 55(7): 2755-2759.
[3] 巫景铭, 洪瑞泽. SPE结合GC/MS测定黄酒中氨基甲酸乙酯. 酿酒, 2010, 37(6): 67-70.
[4] 刘俊. 中国黄酒中氨基甲酸乙酯控制策略及机制的研究[D]. 无锡:江南大学, 2012.
[5] Delledonne D, Rivetti F, Romano U. Developments in the production and application of dimethylcarbonate. Appl Catala-Gen, 2001, 221(1): 241-251.
[6] Wang D, Yang B, Zhai X,etal. Synthesis of diethyl carbonate by catalytic alcoholysis of urea. Fuel Process Technol, 2007, 88(8): 807-812.
[7] 沈棚. 客家黄酒中氨基甲酸乙酯的研究[D]. 广东:仲恺农业工程学院, 2014.
[8] Kitamoto K, Miyazaki K, Yamaoka H,etal. Sake Brewing Tests using Sake Yeasts Producing No Urea in Sake Factories. J Ceram Soc Jpn, 1992, 87: 602-607.
[9] Suizu T, Iimura Y, Gomi K,etal. Construction of Urea Non-producing YeastSaccharomycescerevisiaeby Disruption of the CAR1 Gene. Agric Biol Chem, 1990, 54(2): 537-539.
[10] 赵光鳌, 刘吉泉. 酒中致癌物氨基甲酸乙酯的研究. 食品与发酵工业, 1988, 5: 70-72.
[11] Liu J, Xu Y, Nie Y,etal. Optimization production of acid urease byEnterobactersp. in an approach to reduce urea in Chinese rice wine. Bioproc Biosyst Eng, 2012, 35(4): 651-657.
[12] Zhou JD, Ding GH, Zheng ZQ. Study on enzymatic characteristics of acid urease to hydrolyze urea in Chinese rice wine. China Brew, 2006, 11(11): 45-46.
[13] Mhadhbi H, Ben-Rejeb S, Cleroux C,etal. Purification and characterization of acid urease fromLactobacillusfermentum. Talanta, 1990, 37(2): 167-173.
[14] Mohammed SO, Elshahaby OA, Hafez EE,etal. Characterization and purification of urease enzyme from newproteusmirabilisstrain. Journal of Advanced Scientific Research, 2014, 5(4): 12-20.
[15] 赵圣国, 王加启, 刘开朗等. 脲酶在生物工程中的应用. 生物技术通报, 2009, 3: 37-41.
Optimization of fermentation culture by urease-producing strainAgrobacteriumtumefaciensOAH-01
HOU En-ling, LIU Liang-yu, LIN JIN Xue-jiao, MAO Xiang-zhao
Food science and engineering, Ocean university of China, Shandong, Qingdao, 276000
Urea as the main precursor of ethyl carbamate (EC) is a potential carcinogenic component in most of the fermented foods. The methods for elimination of urea must be taken to control the amount of urea. The preferred method for reducing EC content recommended by FDA is adding urease to the wine, because of its advantages such as efficiency, high safety and mild treatment conditions. Microbes are the main source of urease which can be carried out mass production. In this paper, an urease-producing strainAgrobacteriumtumefaciensOAH-01 was investigated. Its growth curve and urease-producing curve indicated that the production of enzyme was growth associated model and it could reach the maximum yield in a relatively short time. The effects of fermentation medium composition on urease production by OAH-01 were also investigated. The fermentation medium composition was optimized based on single factor experiment and orthogonal experiment. The optimal medium and conditions were as follows (g/L): peptone 20, yeast extract 5, glucose 5, FeCl30.54, Na2HPO40.5, KH2PO40.5, NiSO40.1, pH 7.0 and cultivation 16 h. Under the optimized conditions, the urease activity of cell suspension was 1.08 U/mL, it was 2.4 times than that before optimization. The activity of supernatant after ultrasonic decomposition was 0.419 U/mL, it was 4.4 times than that before optimization.
ethyl carbamate;Agrobacteriumtumefaciens; urease; fermentation optimization
山东省科技重大专项(编号:2015ZDZX05003)。
侯恩玲(1990~),女,硕士研究生。E-mail:15763908360@163.com。
*通讯作者:毛相朝,男,教授。Tel:0532-82031360,E-mail:xzhmao@ouc.edu.cn。
