Cd污染下香樟和油樟幼苗N>、P、K的积累与分配特征
2016-11-11陈良华杨万勤胡相伟
陈良华,徐 睿,杨万勤,张 健,胡相伟,高 顺
(四川农业大学 生态林业研究所 林业生态工程重点实验室,四川 成都611130)
Cd污染下香樟和油樟幼苗N>、P、K的积累与分配特征
陈良华,徐睿,杨万勤,张健,胡相伟,高顺
(四川农业大学 生态林业研究所 林业生态工程重点实验室,四川 成都611130)
【目的】 研究2个樟科树种养分积累及利用效率对镉(Cd)污染的响应特征,探讨2个树种在重金属Cd胁迫条件下维持养分平衡能力的差异及对镉污染土壤的适应能力。【方法】 以长江流域的典型樟科树种香樟和油樟为试验材料,研究不同Cd污染处理(0.12,2.5和5 mg/kg,对应处理编号分别为对照、T1和T2)对2个树种各器官中N、P、K含量和积累量、分配模式、化学计量比以及养分利用效率的影响。【结果】 与对照相比,Cd污染条件下香樟N、P、K含量与积累量等指标大多没有显著变化,而油樟的这些指标常常在胁迫条件下显著下降。Cd污染并未影响N、P、K在香樟各器官中的分配比例,但T2条件下油樟N、P、K向叶片的分配比例均显著增加。各种Cd处理条件下2个树种的N/P均小于14,Cd污染引起2个树种茎中的N/P和粗根中P/K变化显著。与对照相比,T1和T2处理下香樟的N、P、K利用效率未发生显著变化,而油樟的N、P、K利用效率提高。【结论】 在Cd污染条件下,与香樟相比,油樟在维持N、P、K吸收与分配及维系养分平衡等方面对重金属Cd胁迫更为敏感,受到的负面影响较大;在Cd污染区域,更适合栽培香樟用以修复土壤环境。
镉污染;养分分配;樟科;养分利用效率
Cd污染是目前我国最为普遍、最为严重的重金属污染之一,具有很强的生物毒性。Cd进入食物链后会严重影响人类健康,长期积累具有致癌、致畸和致突变的潜在风险,近年来的“Cd米”事件引起了社会对这一污染的高度关注。未污染的土壤Cd主要来源于成土母质(0.1~0.2 mg/kg),人为污染主要来源于矿产冶炼、工业废水、汽车尾气排放、农用物资的施用以及大气沉降等,这些过程导致大量的Cd迁移进入土壤、水体和大气环流[1-3]。据统计,我国Cd污染农田面积已达20 万hm2,约占耕地面积的1/6[4],因此,有效地控制和治理Cd污染刻不容缓。Cd是植物的非必需元素,长期被Cd污染的土壤会影响植物的生长发育,引起生物多样性、种群结构和分布特征的改变[5-7],植物则通过一系列分子和生理适应机制适应土壤污染的加剧,目前的研究主要关注以下方面:1)重金属的吸收、转运规律与调控过程,即关注Cd在植物与土壤系统间的迁移、转化和富集过程;2)重金属离子与脱毒因子结合以实现区隔化等脱毒过程;3)抗氧化系统激活和细胞渗透调节过程[8-11]。但是,目前缺乏重金属胁迫条件下养分吸收和分配、养分积累特征和利用效率变化等方面的相关研究,开展此类研究将为Cd污染区域的植物栽培管理和生态环境建设提供科学依据。
植物修复技术是最为经济、实用和环保的技术,这一技术首先要求植物能够耐受较高浓度的重金属污染并能在污染土壤中正常生存与繁衍。樟科(Lauraceae)的香樟与油樟是我国重要的乡土树种,同时也是樟科中生长较为迅速的代表,生物量大的特征使其具有修复重金属污染土壤的潜质。这类树种广泛分布于长江以南及西南地区,在城市绿化和生态建设中起着重要作用。这一区域的冲积土中Cd含量普遍偏高[12],迄今为止并没有相关研究关注这类树种在Cd污染条件下的养分获取、积累与分配模式变化和利用效率特性,因而限制了其在污染区域的推广应用和栽培管理。因此,本研究以香樟和油樟为对象,研究Cd污染土壤对这2种植物大量养分元素(N、P、K)的吸收和转运、积累与分配的影响,分析养分化学计量特征以及利用效率的变化,评估树种间维持营养平衡的能力、养分循环特征和胁迫耐受性等方面的差异,旨在为重金属污染地区的树种筛选、资源开发和栽培管理提供参考。
1 材料与方法
1.1盆栽处理
2013年5月初选择健康的香樟和油樟幼苗,剪去主根,将剩余根系于ABT生根粉溶液(50 mg/kg)中浸泡6 h。将浸泡后的苗木预栽培在含有混合培养基质(V(冲积土)∶V(细沙)=3∶1)的苗床。待苗木新芽长出约5 cm时,移栽长势一致的幼苗用于试验。试验共设置3个处理,使土壤中Cd含量分别为0.12(对照,CK),2.5(T1)和5 mg/kg(T2),其中对照中的Cd含量为土壤本底值。以上处理均是将Cd(NO3)2溶液(10 μmol/L)施入土壤充分混匀并平衡1个月后用于盆栽试验。每盆移栽1株幼苗,所用花盆为圆台型(口径30 cm、深25 cm),每盆装10 kg冲积土(含水量23%,最大田间持水量52%),供试土壤采自四川农业大学成都校区附近,为农田中0~20 cm的表层土。同时收获5株处理初期的幼苗,测算此时的生物量、养分含量及初始N、P、K积累量。试验于2013年6月初开始,每处理9次重复,试验在半受控(只遮蔽雨水)的大棚中进行,每次浇水均避免水分渗漏,以防止Cd流失。为避免施肥对重金属胁迫的干扰效应[10],本研究在3个月的试验处理过程中不施肥。处理期间苗木生长良好,未受到缺素的影响。
1.2取样和试验分析
2013年9月初,每种苗木每处理随机选择5株,将苗木分为叶、茎、细根和粗根4部分,叶片和茎用自来水冲洗干净后用去离子水润洗,而细根和粗根冲洗后用20 mmol/L Na-EDTA浸泡20 min,将清洁后的植物器官放入烘箱,于105 ℃杀青30 min后再于70 ℃烘至恒质量,称量各器官的干物质量,取各器官样品用不锈钢粉碎机研磨后过筛(孔径 0.246 mm),以备N、P、K含量的测定。
植物样品经H2SO4-H2O2消煮后测定其中的N、P、K含量,N含量采用半微量凯氏定氮法[13]测定,P含量用钼锑抗比色法[13]测定,K含量用原子吸收分光光度计(岛津AA-7000火焰原子吸收光谱仪)法[14]测定,每次测定重复5次,结果取均值。
1.3数据处理与统计分析
根据试验初期和结束时香樟、油樟幼苗各器官N、P、K积累量的差异,计算2个物种N、P、K的积累和分配特征。养分(N、P、K)利用效率指单位养分所产生的生物量,根据生物量增加量和N、P、K积累量计算,其公式如下:
养分(N、P、K)利用效率=生物量总量增加量/养分(N、P、K)的总积累量。
数据用“平均值±标准差”表示。采用SPSS 16.0统计软件对2个树种3个Cd处理的数据进行单因素方差分析(One-way ANOVA),并用Tukey法进行处理间差异显著性检验(α=0.05)。利用二元方差分析(Two-way univariate analysis)检验器官、Cd及其交互作用对N、P、K含量,N/P和P/K的显著性效应;分析树种、Cd及其交互作用对N、P、K在各器官中的积累量及积累总量,总N/P,总P/K,养分(N、P、K)利用效率的显著性效应。
2 结果与分析
2.1Cd污染对香樟和油樟各器官中N、P、K含量的影响
Cd污染条件下,香樟和油樟幼苗各器官中N、P、K含量及二元方差分析结果见图1和表1。
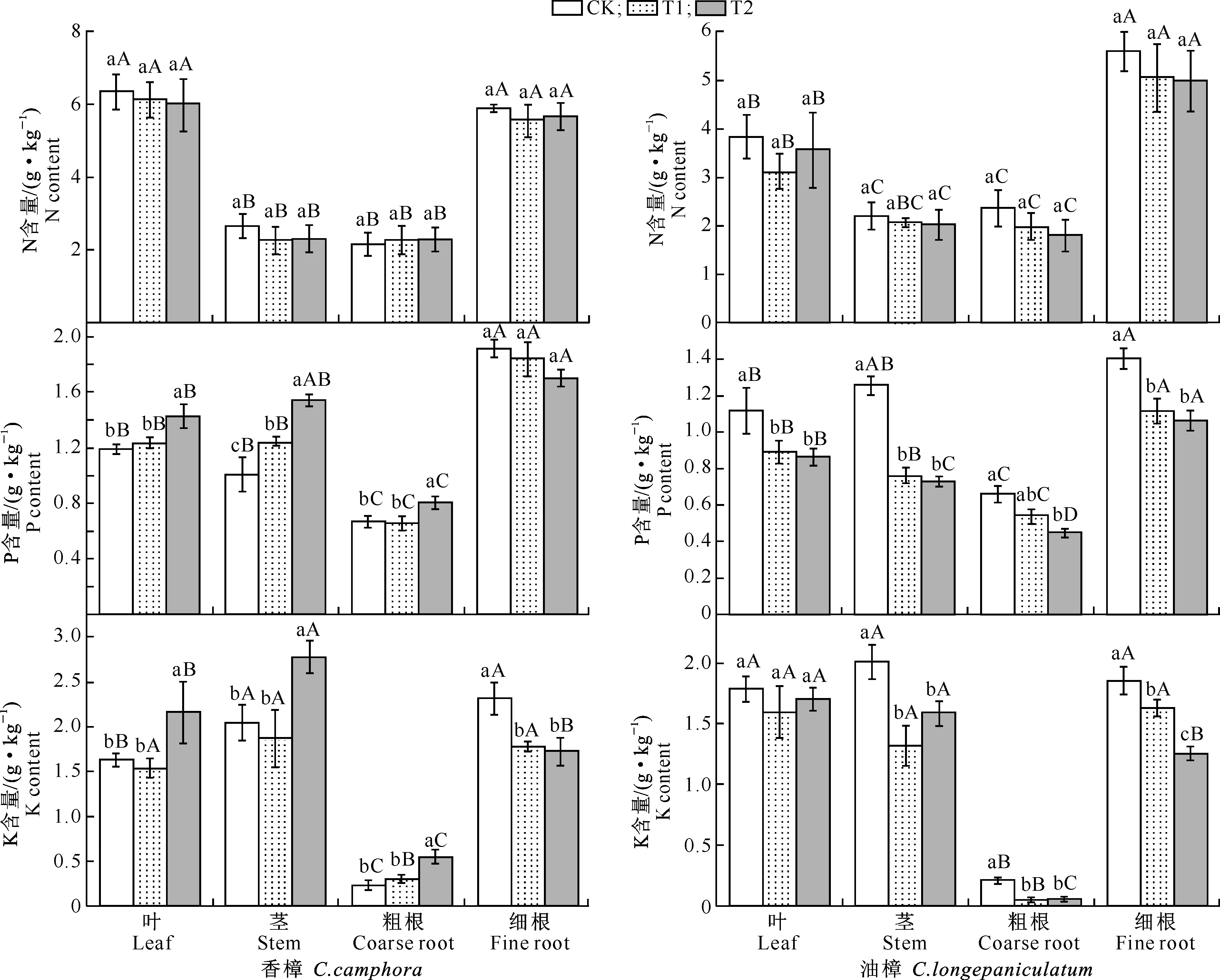
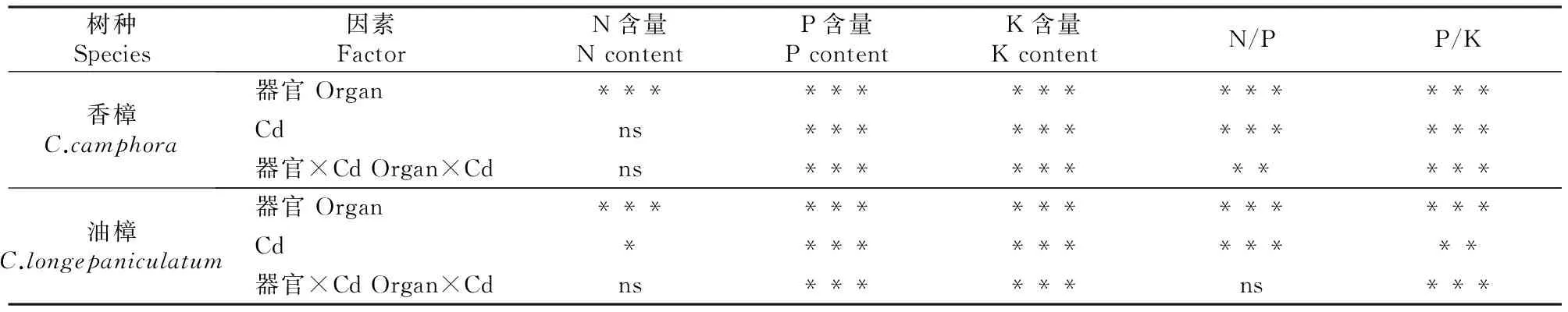
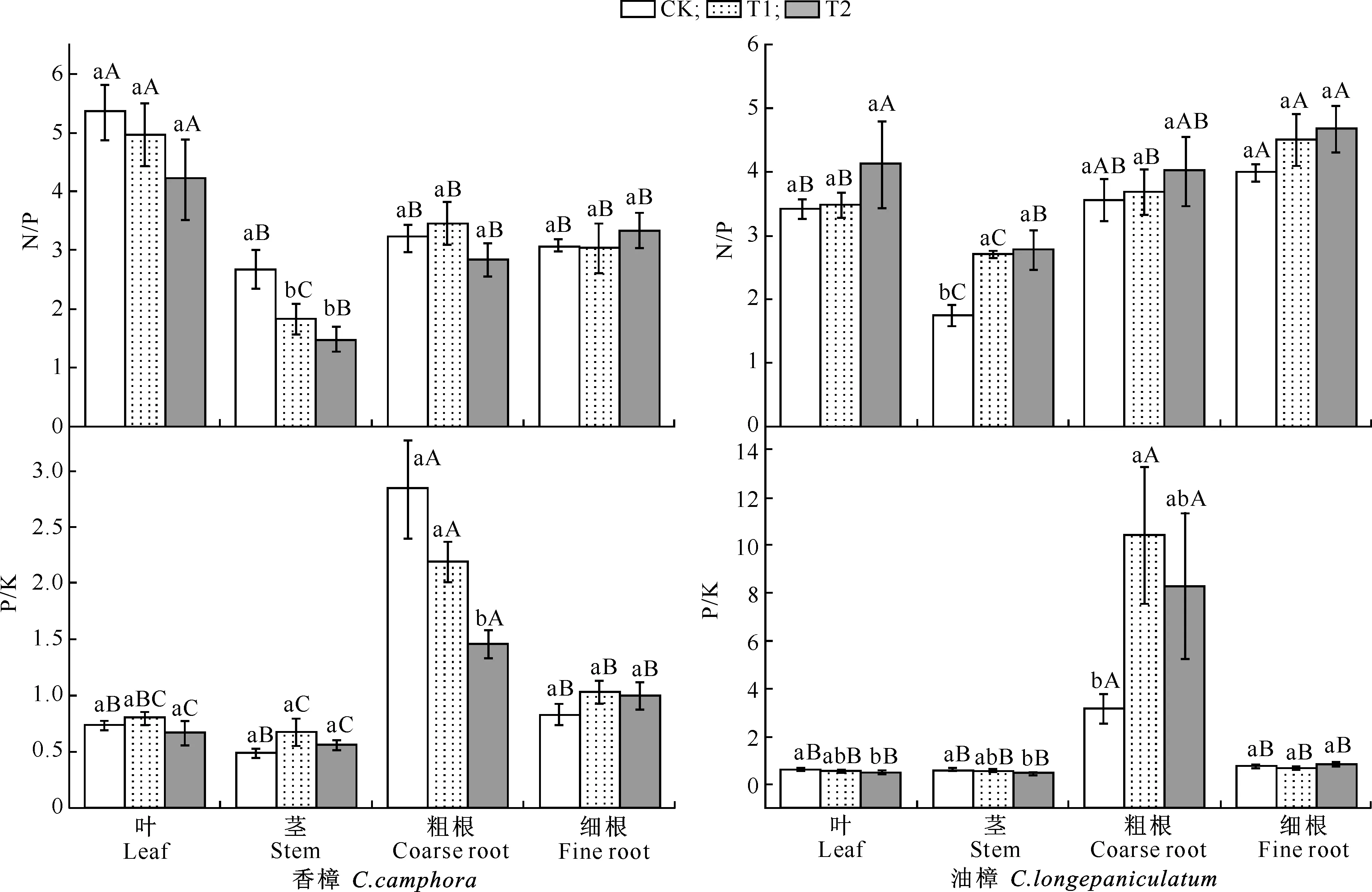
图 1 Cd污染条件下香樟和油樟幼苗各器官的N、P、K含量(n=5)图柱上标不同小写字母指同一器官不同处理间差异显著(P<0.05),标不同大写字母指同一处理不同器官间差异显著(P<0.05)。下图同Fig.1 N,P and K contents in different organs of C.camphora and C.longepaniculatum seedlings under Cd pollution (n=5) Different small letters indicate significant difference in each organ among different treatments (P<0.05),and different capital letters indicate significant difference in each treatment among different organs (P<0.05).The same below表 1 器官、Cd及其交互作用对香樟和油樟N、P、K含量及其比值影响的二元方差分析Table 1 Effect of organ,Cd and the interaction on N,P,K and their ratios of C.camphora and C.longepaniculatum
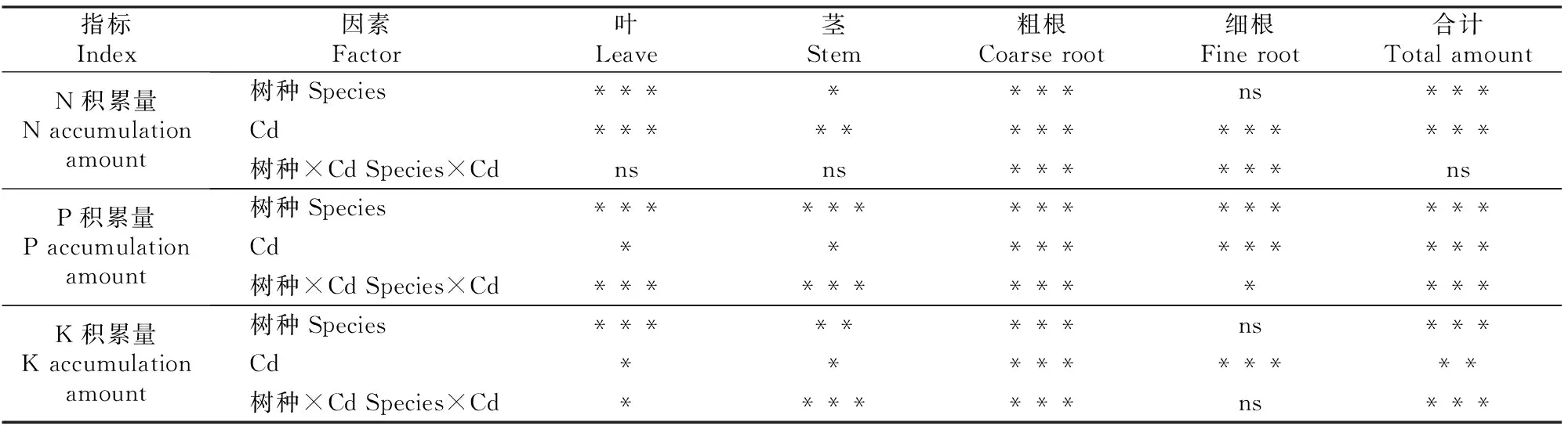
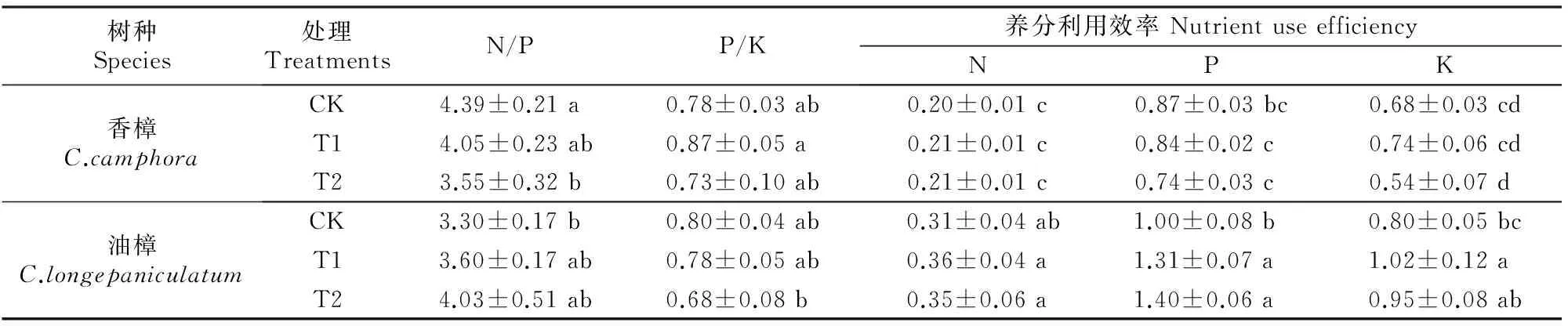
注:ns、*、**、***分别表示P>0.05,0.01 Note:ns,*,**,*** represent difference atP>0.05,0.01 由图1和表1可见,在所有处理条件下,香樟和油樟叶片及细根N含量均显著高于其他器官,2个树种的N含量均受到了器官(作为独立因子)的极显著影响;与对照相比,T1和T2均没有显著影响2个树种各器官的N含量,但二元方差分析表明Cd显著影响了油樟的N含量。与其他器官相比,各处理香樟和油樟细根的P含量最高,T2处理显著增加了香樟叶、茎和粗根中的P含量,但T1、T2处理总体显著降低了油樟各器官的P含量,并且随着Cd污染程度的增加P含量进一步下降;二元方差分析表明,器官、Cd及其交互作用均极显著影响了2个树种的P含量。T2处理显著增加了香樟叶片、茎和粗根中的K含量,但T1和T2处理均显著降低了其细根中K含量;对于油樟而言,T1和T2处理明显降低了茎、粗根和细根中的K含量,其中细根的K含量随着Cd污染程度的增加进一步下降,但T1和T2处理对其叶片的K含量影响不显著;二元方差分析表明,器官、Cd及其交互作用均极显著影响了2个树种的K含量。 2.2Cd污染对香樟和油樟N、P、K积累与分配的影响 表2显示,与对照相比,T1、T2处理均未显著影响香樟幼苗各器官中的N积累量,也未显著影响香樟幼苗的总N和总K积累量,但T2处理显著增加了香樟幼苗的总P积累量。对油樟而言,T1和T2处理显著降低了除叶片外其余器官的N、K积累量及其总积累量,T1和T2处理均显著降低了油樟幼苗各器官的P积累量及总P积累量,并随着Cd污染程度的增加而下降。表3表明,Cd显著影响了2个树种各器官中N、P、K的积累量及其总积累量。 表 2 Cd污染条件下单株香樟和油樟幼苗各器官的N、P、K积累量(n=5)Table 2 N,P and K accumulation in different organs of C.camphora andC.longepaniculatum seedlings under Cd pollution (n=5) mg/株 注:同列数据后标不同小写字母表示同一指标不同处理间差异显著(P<0.05),表4同。 Note:Different small letters indicate significant difference in each indexes among different treatments (P<0.05),Table 4 is same. 表 3 树种、Cd及其交互作用对香樟和油樟幼苗各器官N、P、K积累量影响的二元方差分析Table 3 Effect of species,Cd and the interaction on N,P,and K accumulation in different organs of C.camphora and C.longepaniculatum 如图2显示,与对照相比,T1和T2处理未显著改变N、P在香樟各器官中的分配比例,但T2处理显著增加了K向香樟粗根分配的比例,K在其他器官的分配比例未受显著影响。对油樟而言,与对照相比,T1处理并未显著改变各器官N、P、K的分配比例,但是T2处理显著降低了N在粗根和细根中的分配比例,显著增加了N在叶片的分配比例;T2处理显著降低了P在茎中和K在粗根中的分配比例,却显著增加了P和K在叶片中的分配比例。 图 2Cd污染条件下香樟和油樟幼苗各器官中N、P、K的分配特征(n=5) Fig.2Allocation characteristics of N,P and K in different organs ofC.camphoraandC.longepaniculatumseedlings under Cd pollution (n=5) 2.3Cd污染对香樟和油樟化学计量比及养分利用效率的影响 如图3所示,与对照相比,T1和T2处理香樟与油樟叶片、粗根和细根N/P并未显著变化,但T1和T2处理显著降低了香樟茎N/P,显著增加了油樟茎N/P。与对照相比,T1和T2处理香樟叶片、茎和细根P/K并未受到显著影响,但T2处理显著降低了粗根P/K;对于油樟而言,随着Cd污染程度的增加,叶片和茎P/K逐渐下降,T2处理与对照差异达显著水平,但T1和T2处理油樟粗根P/K却明显上升。二元方差分析结果(表1)表明,除器官与Cd的交互作用对油樟N/P影响不显著外,其余的器官、Cd及其交互作用极显著影响了2个树种的N/P和P/K。 图 3Cd污染条件下香樟和油樟幼苗各器官的N/P与P/K(n=5) Fig.3N/P and P/K in different organs ofC.camphoraandC.longepaniculatumseedlings under Cd pollution (n=5) 表4显示,与对照相比,T2处理显著降低了香樟的总N/P,但并未显著影响总P/K;T1和T2处理虽然一定程度上增加了油樟的总N/P、降低了总P/K,但与对照差异均并未达到显著水平。T1和T2处理并未显著影响香樟N、P、K利用效率,但T1和T2处理显著增加了油樟P利用效率,对N、K利用效率的增加作用不明显。二元方差分析结果(表5)表明,Cd独立因子显著影响了2个树种幼苗的总P/K及P、K利用效率。 表 4 Cd污染条件下香樟和油樟幼苗总N/P、总P/K及N、P、K利用效率(n=5)Table 4 Total N/P,total P/K,N use efficiency (NUE-N),P use efficiency (NUE-P) and K use efficiency (NUE-K) of C.camphora and C.longepaniculatum seedlings under Cd pollution (n=5) 表 5 树种、Cd及其交互作用对香樟幼苗总N/P、总P/K及养分利用效率影响的二元方差分析Table 5 Effect of species,Cd and the interaction on total N/P,total P/K and nutrient use efficiency of C.camphora and C.longepaniculatum 土壤中过量的Cd会影响土壤生物数量及活性,进而影响矿质元素的矿化[15],也影响土壤养分的有效性;同时,重金属离子可能与土壤中的其他矿质元素相互作用,从而影响植物根系对养分元素的吸收。朱翠娟[16]发现,重金属离子与阳离子养分多为拮抗作用,与阴离子因土壤理化性质的不同有时表现为拮抗作用,有时表现为协同作用。许多研究表明,重金属离子在根系中的过量积累还会引起膜透性增大[17],从而造成养分同化代谢的紊乱,比如重金属胁迫条件下,植物同化氮素的关键酶——硝酸还原酶(NR)活性下降[18];Cu胁迫会降低酸性磷酸酶的分泌及其在根系组织中的活性,从而影响植物正常的磷生理代谢[19],这些都会影响植物的营养特征和养分平衡。本研究表明,Cd胁迫下,2个近缘树种之间在维持营养元素的吸收与同化等方面存在显著差异,油樟在Cd胁迫条件下各个器官P和K含量均表现出了一定程度下降,其中根系中的P、K含量下降程度较大,说明Cd污染条件下油樟根系对P、K的吸收、同化和转运均被显著抑制,最终可能会导致根系中的离子失衡。对于香樟而言,Cd污染条件下除细根P、K含量有一定程度下降之外,其他器官P和K含量大多有一定程度上升,因此认为Cd污染主要影响了香樟对P和K的转移与分配。T2条件下香樟的总P积累量显著增加,可能是因为一定程度的Cd胁迫作为环境信号,激活了相关抗性防御机制,提高了相关酶活性[20],其他学者也观察到类似现象[21],据此推测P素富集可能有利于Cd解毒,但具体机制需要深入研究。本研究结果表明,与对照相比,T2条件下香樟地上部分(叶和茎)K含量明显增加,而高浓度的K离子则有利于调节细胞的渗透势,在稳定叶片细胞膨压、维持稳定的光合速率等方面具有积极的作用[22]。由此可见,Cd污染条件下香樟比油樟具有更强的维持养分吸收和营养平衡的能力。 植物N、P、K作为植物主要的营养元素,在植物的器官之间存在生物内循环机制以适应不同的环境条件[23],营养元素的积累总量和分配格局也是衡量植物生长潜力的重要指标,可以反映植物对环境变化的综合响应[12]。本研究中,与对照相比,T1和T2处理降低了油樟各器官N、P、K积累量及其总积累量,这可能会给油樟幼苗的生长造成负面影响。然而,在Cd污染条件下香樟N、P、K营养特征仍能保持稳定,说明在营养富集方面香樟对Cd并不敏感,受到的负面影响较小。此外,人们通常认为植物器官之间对养分相互竞争,存在养分分配的权衡机制[24-25],器官间有效的权衡能使得生存、防御、生长和繁殖等方面的效益达到最大,从而使植物能更好地适应环境变化[26-27]。本研究中,香樟在Cd污染条件下N、P、K元素的分配特征变化较小,但在油樟中发生了显著变化,N、P、K向叶片的分配比例明显增加,而在其他器官中则发生了一定程度的下降,说明Cd污染条件下油樟将有限的养分优先分配给了叶片,以保持稳定的C固定率,减轻Cd对叶片的伤害及对树种生长的负面影响。 植物的N/P和P/K是确定植物受限元素的重要指标,是环境和植物共同作用的结果,决定了植物的生长策略和适应特征[28]。植物叶片保持稳定的N/P是正常生长发育的基础。Klausmeier等[29]认为,植物叶片的最适N/P应为14~16,大于16植物主要缺P,小于14则主要缺N。本研究中2个树种的N/P均低于14,说明2个树种的生长均不同程度受到N的限制。值得注意的是,Cd污染条件下,2个树种叶片、粗根和细根的N/P比较稳定,只有茎的N/P发生了显著变化,可见是因为茎的P含量发生了显著变化,说明Cd胁迫条件下茎中P储存库的源汇格局发生了变化,其中香樟茎的生长转向缺N,而油樟茎的生长主要缺P;T2处理下香樟总N/P显著下降也说明Cd污染使得香樟生长较为缺N,可以通过施加外源N来补充一定的N素,使香樟更好地适应Cd胁迫条件[10]。2个树种P/K的变化主要发生在粗根中,说明粗根除了作为植物的物理支撑和重要的碳库之外[30],也是重要的养分库,Cd胁迫条件下粗根P或K的再分配也显得十分活跃。此外有大量研究表明,胁迫环境会引起植物的资源受限,植物需要提高资源利用效率以适应逆境。本研究Cd胁迫条件下,香樟的N、P、K利用效率均未发生显著变化,但油樟的这些参数均有一定上升,尤其是P利用效率,可以推断在Cd污染条件下油樟受到了P素的限制,促使其采取提高P利用效率的保守策略来适应重金属Cd胁迫逆境。 Cd污染条件下,香樟和油樟在N、P、K养分的吸收与同化、积累与分配以及养分利用效率等方面表现出了不同的敏感性和适应性。与香樟相比,油樟N、P、K积累量及其在器官之间的分配更容易受到Cd污染的影响,尤其是P和K;Cd污染条件下,油樟将更多N、P、K养分向叶片分配以维持其光合速率与生长,并通过提高N、P、K利用效率的策略来适应逆境;香樟的N、P、K积累与分配受Cd影响较小,在各器官的分配比例并没有受到Cd污染的显著影响。2个树种的养分响应和适应特征说明,Cd污染对油樟的营养平衡造成了负面影响,物种之间的这些差异主要是遗传和生态适应性差异造成的。由此可见,在Cd污染区域,更适合栽培香樟用以修复受Cd污染的土壤环境。 [1]黄益宗,朱永官.森林生态系统镉污染研究进展 [J].生态学报,2004,24(1):101-108. Huang Y Z,Zhu Y G.A review on cadmium contamination in forest ecosystem [J].Acta Ecologica Sinica,2004,24(1):101-108. [2]王新,周启星,贾永锋.Cd 和 Cu 在草甸棕壤-植物系统中行为特性的研究 [J].生态环境,2005,14(6):838-842. Wang X,Zhou Q X,Jia Y F.Behavioral characteristics of Cd and Cu in meadow brown soil-plant system [J].Ecology and Envionment,2005,14(6):838-842. [3]黄艺,倪师军,桑世华,等.四元交互体系 Cd2+,Na+//Cl-,SO2-4-H2O 298 K 时的相平衡 [J].物理化学学报,2008,24(2):333-337. Huang Y,Ni S J,Sang S H,et al.Phase equilibrium of Quaternary reciprocal system Cd2+,Na+//Cl-,SO2-4-H2O at 298 K [J].Acta Physico-Chimica Sinica,2008,24(2):333-337. [4]周建斌,邓丛静,陈金林,等.棉秆炭对镉污染土壤的修复效果 [J].生态环境,2008,17(5):1857-1860. Zhou J B,Deng C J,Chen J L,et al.Remediation effects of cotton stalk carbon on cadmium (Cd) contaminated soil [J].Ecology and Envionment,2008,17(5):1857-1860. [5]段昌群,王焕校,姜汉侨.污染条件下生物多样性丧失的生态遗传学机制 [J].生态科学进展,2004(1):267-290. Duan C Q,Wang H X,Jiang H Q.Biodiversity loss under globalized environmental pollution:a perspective on ecological genetics [J].The Progress of Ecological Science,2004(1):267-290. [6]王贵军.浙江富阳环山乡二次金属回收冶金污染区植物多样性及土壤重金属对植被影响的研究 [D].安徽芜湖:安徽师范大学,2007. Wang G J.Research on diversities of plants and effects of soil heavy metals on the vegetation in the vicinity of secondary metal smelters in Huanshan town of Fuyang city,Zhejiang Province [D].Wuhu,Anhui:Anhui Normal University,2007. [7]李有志,罗佳,张灿明.湘潭锰矿区植物资源调查及超富集植物筛选 [J].生态学杂志,2012,31(1):16-22. Li Y Z,Luo J,Zhang C M.Plant resources investigation and hyperaccumulator screening in Xiangtan manganese mine area of Hunan Province,central-south China [J].Chinese Journal of Ecology,2012,31(1):16-22. [8]Sanita di Toppi L,Gabbrielli R.Response to cadmium in higher plants [J].Environ Exp Bot,1999,41(2):105-130. [9]Hall J.Cellular mechanisms for heavy metal detoxification and tolerance [J].J Exp Bot,2002,53(366):1-11. [10]Chen L,Han Y,Jiang H,et al.Nitrogen nutrient status induces sexual differences in responses to cadmium inPopulusyunnanensis[J].J Exp Bot,2011,62(14):5037-5050. [11]薛永,王苑螈,姚泉洪,等.植物对土壤重金属镉抗性的研究进展 [J].生态环境学报,2014,23(3):528-534. Xue Y,Wang Y Y,Yao Q H,et al.Research progress of plants resistance to heavy metal Cd in soil [J].Ecology and Environmental Sciences,2014,23(3):528-534. [12]吴福忠,杨万勤,张健,等.镉胁迫对桂花生长和养分积累,分配与利用的影响 [J].植物生态学报,2010,34(10):1220-1226. Wu F Z,Yang W Q,Zhang J,et al.Effects of cadmium stress on growth and nutrient accumulation,distribution and utilization inOsmanthusfragransvar.thumbergii[J].Chinese Journal of Plant Ecology,2010,34(10):1220-1226. [13]鲁如坤.土壤农业化学分析方法 [M].北京:中国农业科技出版社,2000. Lu R K.Soil and agro-chemical analytical methods [M].Beijing:China Agricultural Science and Technology Press,2000. [14]Chen L,Hu X,Yang W,et al.The effects of arbuscular mycorrhizal fungi on sex-specific responses to Pb pollution inPopuluscathayana[J].Ecotox and Environ Safe,2015,113:460-468. [15]Nieminen T,Helmisaari H S.Nutrient retranslocation in the foliage ofPinussylvestrisL.growing along a heavy metal pollution gradient [J].Tree Physiol,1996,16(10):825-831. [16]朱翠娟.山西省太原,大同及忻州盆地农田系统重金属生态效应地球化学评价 [D].北京:中国地质大学,2007. Zhu C J.Crops ecological geochemical assessment of heavy metals in Taiyuan,Datong and Xinzhou basins of Shanxi Province [D].Beijing:China University of Geosciences,2007. [17]张小艾,李名扬,汪志辉,等.重金属及盐碱对二月兰幼苗生长和生理生化的影响 [J].草业学报,2013,22(2):187-194. Zhang X A,Li M Y,Wang Z H,et al.Effects of heavy metals and saline-alkali on seedlings growth,physiological-biochemical ofOryehophragmusviolaeeus[J].Acta Prataculturae Sinica,2013,22(2):187-194. [18]Chen L,Zhang L,Tu L,et al.Sex-related differences in physiological and ultrastructural responses ofPopuluscathayanato Ni toxicity [J].Acta Physiol Plant,2014,36(7):1-10. [19]柯文山,熊治廷,金则新,等.海州香薷(ElsholtziahaichouensisSun) 不同生态型 Cu 吸收和酸性磷酸酶活性差异 [J].生态学报,2007,27(8):3172-3181. Ke W S,Xiong Z T,Jin Z X,et al.Differences of Cu uptake and acid phosphatase activity of twoElsholtziahaichouensisSun populations [J].Acta Ecologica Sinica,2007,27(8):3172-3181. [20]康丽娜,吴福忠,杨万勤,等.铅胁迫对欧美杂交杨幼苗碳,氮和磷积累与分配的影响 [J].植物生态学报,2012,36(6):578-586. Kang L N,Wu F Z,Yang W Q,et al.Effects of Pb stress on C,N and P accumulation and allocation inPopulusdeltoids×P.nigraseedlings [J].Chinese Journal of Plant Ecology,2012,36(6):578-586. [21]Cao X,Ma L Q,Tu C.Antioxidative responses to arsenic in the arsenic-hyperaccumulator Chinese brake fernPterisvittataL. [J].Environ Pollut,2004,128(3):317-325. [22]Li S,Yu J,Zhu M,et al.Cadmium impairs ion homeostasis by altering K+and Ca2+channel activities in rice root hair cells [J].Plant Cell Environ,2012,35(11):1998-2013. [23]唐罗忠,刘志龙,虞木奎,等.两种立地条件下麻栎人工林地上部分养分的积累和分配 [J].植物生态学报,2010,34(6):661-670. Tang L Z,Liu Z L,Yu M K,et al.Nutrient accumulation and allocation of aboveground parts inQuercusacutissimaplantations under two sites conditions in Anhui,China [J].Chinese Journal of Plant Ecology,2010,34(6):661-670. [24]冯丽,张景光,张志山,等.腾格里沙漠人工固沙植被中油蒿的生长及生物量分配动态 [J].植物生态学报,2009,33(6):1132-1139. Feng L,Zhang J G,Zhang Z S,et al.Growth and biomass allocation dynamics ofArtemislaordosicain sand-fixing vegetation of the tengger desert of China [J].Chinese Journal of Plant Ecology,2009,33(6):1132-1139. [25]Lind E M,Borer E,Seabloom E,et al.Life-history constraints in grassland plant species:a growth-defence trade-off is the norm [J].Ecol Lett,2013,16(4):513-521. [26]任海彦,郑淑霞,白永飞.放牧对内蒙古锡林河流域草地群落植物茎叶生物量资源分配的影响 [J].植物生态学报,2009,33(6):1065-1074. Ren H Y,Zheng S X,Bai Y F.Effects of grazing on foliage biomass allocation of grassland communities in Xilin river basin,Inner Mongolia [J].Chinese Journal of Plant Ecology,2009,33(6):1065-1074. [27]肖遥,陶冶,张元明.古尔班通古特沙漠 4 种荒漠草本植物不同生长期的生物量分配与叶片化学计量特征 [J].植物生态学报,2014,38(9):929-940. Xiao Y,Tao Y,Zhang Y M.Biomass allocation and leaf stoichiometric characteristics in four desert herbaceous plants during different growth periods in the Gurbantünggüt desert,China [J].Chinese Journal of Plant Ecology,2014,38(9):929-940. [28]Zhang L,Bai Y,Han X.Application of N∶P stoichiometry to ecology studies [J].Acta Bot Sin,2003,45(9):1009-1018. [29]Klausmeier C A,Litchman E,Daufresne T,et al.Optimal nitrogen-to-phosphorus stoichiometry of phytoplankton [J].Nature,2004,429(6988):171-174. [30]李宁,徐武兵,赖江山,等.亚热带常绿阔叶林 8 个常见树种粗根生物量 [J].科学通报,2013,58(4):329-335. Li N,Xu W B,Lai J S,et al.The coarse root biomass of eight common tree species in subtropical evergreen forest [J].Chinese Science Bulletin,2013,58(4):329-335. N,P and K accumulation and allocation pattern ofCinnamomumcamphoraandC.longepaniculatumseedlings under Cd pollution CHEN Lianghua,XU Rui,YANG Wanqin,ZHANG Jian,HU Xiangwei,GAO Shun (KeyLaboratoryofEcologicalForestryEngineering,InstituteofEcology&Forestry,SichuanAgriculturalUniversity,Chengdu,Sichuan611130,China) 【Objective】 The nutrient accumulation and nutrient use efficiency in two Lauraceae species was detected to discuss the differences in maintaining nutrient balance between them and to estimate their adaptation capacity in soils polluted by heavy metals.【Method】 Two typical species in Yangtze River basin, i.e.,CinnamomumcamphoraandC.longepaniculatum,were used to detect effects of different cadmium (Cd) pollution levels (0.12 mg/kg,CK;2.5 mg/kg,T1;and 5 mg/kg,T2) on content,accumulation,allocation pattern,stoichiometric ratio,and nutrient use efficiency of N,P,and K.【Result】 Compared to control,there was no significant change in most parameters in contents and accumulations of N,P,and K inC.camphorawhen exposed to Cd pollution.In contrast,most of these parameters significantly decreased inC.longepaniculatum.Cd pollution did not significantly affect the nutrient allocation pattern of N,P and K inC.camphora,whereas the allocated N,P and K to leaves increased inC.longepaniculatumunder T2.In all conditions,the ratios of N to P in all organs of both species were lower than 14.N/P changed greatly in stems,while P/K varied greatly in coarse roots in both species.Compared to control,there was no significant change in use efficiencies of N,P or K inC.camphora,whereasC.longepaniculatumexhibited higher N,P and K use efficiencies.【Conclusion】C.longepaniculatumwas more sensitive to heavy metal stress,and had more negative effects thanC.camphorain terms of nutrient uptake,allocation,and maintenance of nutrient balance under Cd pollution.Therefore,C.camphorais more suitable for remediation of Cd polluted soils thanC.longepaniculatum. Cd pollution;nutrient allocation;Lauraceae;nutrient use efficiency 时间:2016-09-0709:02DOI:10.13207/j.cnki.jnwafu.2016.10.013 2015-03-19 四川省科技厅应用基础项目(2013JY0083);国家自然科学基金项目(31300513);“十二五”国家科技支撑计划项目(2011BAC09B05);四川省教育厅基础研究项目(13ZB0280) 陈良华(1982-),男,四川泸州人,博士,主要从事植物生理研究。E-mail:chenlh@sicau.edu.cn 高顺 (1977-),男,河南西平人,副研究员,主要从事植物抗逆性和环境修复研究。E-mail:shun1220@yahoo.com S792.230.1;Q945.79 A 1671-9387(2016)10-0091-09 网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160907.0902.026.html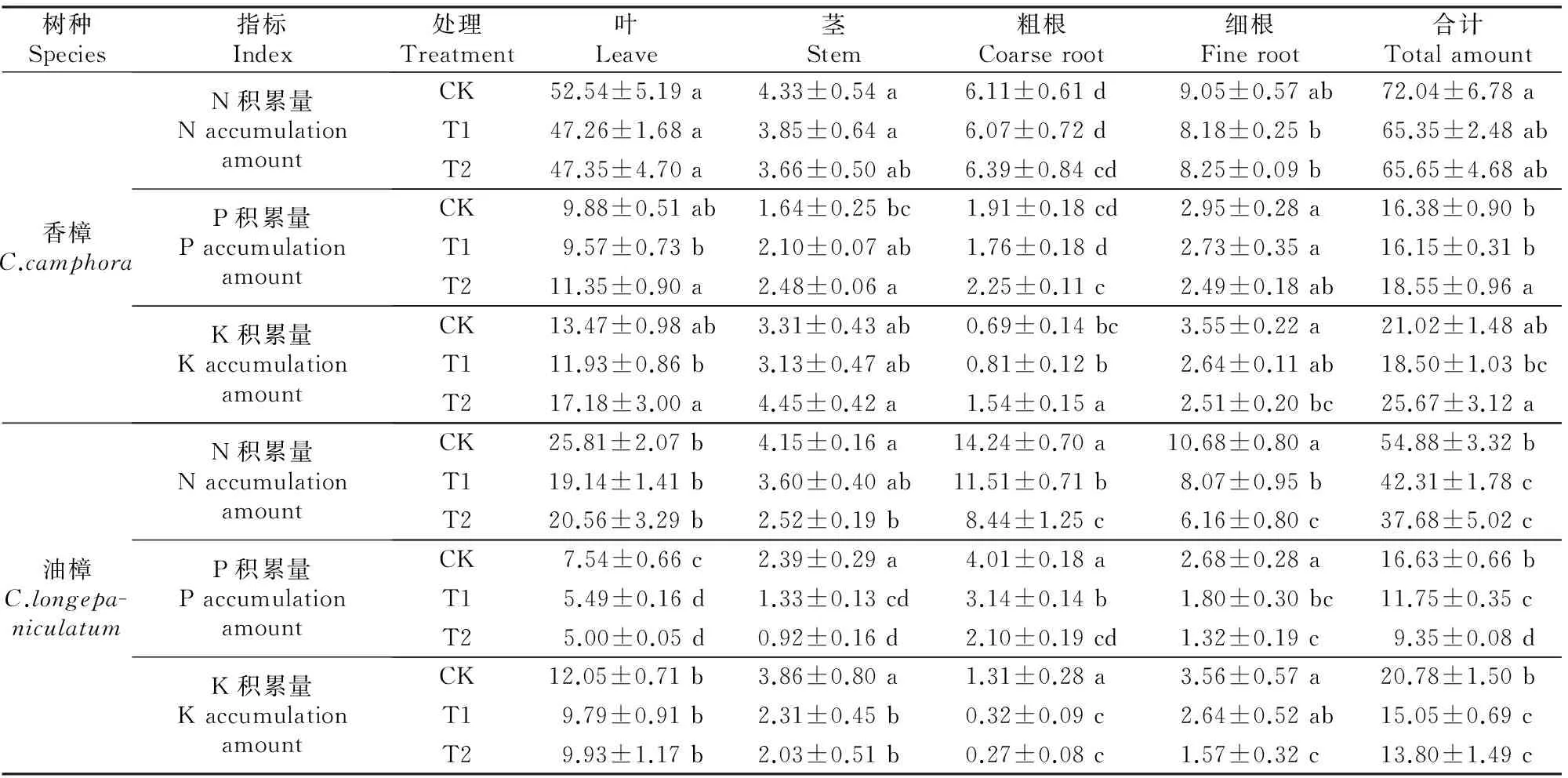

3 讨 论
4 结 论
