饲料脂肪水平对中间球海胆幼胆生长、消化酶和热胁迫后抗氧化酶活力的影响
2016-11-10侯受权左然涛常亚青李广宋坚张伟杰赵冲
侯受权,左然涛,常亚青,李广,宋坚,张伟杰,赵冲
(大连海洋大学农业部北方海水增养殖重点实验室,大连116023)
饲料脂肪水平对中间球海胆幼胆生长、消化酶和热胁迫后抗氧化酶活力的影响
侯受权,左然涛,常亚青,李广,宋坚,张伟杰,赵冲
(大连海洋大学农业部北方海水增养殖重点实验室,大连116023)
为了确定中间球海胆Strongylocentrotus intermedius幼胆饲料中适宜的脂肪水平,采用摄食生长试验探讨了饲料中脂肪水平(3%、6%、9%、12%和15%)对海胆幼胆存活、生长、消化酶和热胁迫后抗氧化酶活力的影响,试验共进行96 d。结果表明:试验结束时,6%饲料脂肪水平组海胆增重率最高,显著高于15%脂肪组(P<0.05);随着饲料脂肪水平的升高,中间球海胆消化道中脂肪酶活力显著升高(P<0.05),淀粉酶活力显著下降(P<0.05),胃蛋白酶活力有下降趋势(P>0.05);饲料脂肪水平显著影响热胁迫后海胆体腔液中抗氧化酶活力,其中热胁迫2 h后,12%脂肪组超氧化物歧化酶(SOD)活力最高,显著高于15%脂肪组(P<0.05);热胁迫6 h后,海胆体腔液过氧化氢酶(CAT)活力最高值出现在6%脂肪组,且高于12%和15%脂肪组。研究表明,6%饲料脂肪水平时中间球海胆幼胆的生长速率最快,6%~12%饲料脂肪水平能够显著提高热胁迫后海胆的抗氧化能力。
中间球海胆;饲料脂肪水平;消化酶;抗氧化酶
中间球海胆Strongylocentrotus intermedius原产于日本北海道和俄罗斯远东沿海,由于其性腺色泽好、味甜,在国际市场广受欢迎。1989年,大连海洋大学将其引入中国,现已成为中国北方重要的海水养殖品种[1]。海带、裙带菜、石莼是海胆养殖的主要饵料来源。但是,鲜活生物饵料供应极不稳定,尤其是每年夏季高温季节,只能以干品替代,且高温期极易腐烂变质,严重降低了海胆的成活率、摄食量和生长速率[2]。配合饲料因其原料来源广泛、营养搭配均衡、饲料利用率高成为海胆养殖产业获得突破性发展的关键。目前,配合饲料用于北方球海胆Strongylocentrotus droebachiensis[3-5]、加州红海胆S.franciscanus[6]、Evechinus chloroticus[7]和中间球海胆S.intermedius[8-9]亲胆养殖的研究已有报道,结果表明,配合饲料在降低饵料系数,提高海胆性腺指数和营养品质方面具有生物饵料无可比拟的优势。但有关海胆幼胆营养生理的研究却少有报道。适宜的脂肪水平不仅能够提高动物的生长性能,而且有助于促进动物机体免疫和抗应激能力的发挥[10]。棘皮动物对脂肪的需求量相对较低,廖明玲[10]研究发现,刺参的最适脂肪需求为0.19%~1.36%。Gibbs等[11]研究发现,饲料中磷脂添加量超过7%时,海胆的生长性能受到显著抑制,低于1.0%~6.4%磷脂水平处理组。
有关高温胁迫下饲料脂肪水平影响海胆幼胆抗氧化能力的研究至今尚未见报道。因此,本研究中探讨了饲料中不同脂肪水平对中间球海胆幼胆生长、消化酶和热胁迫后体腔液中抗氧化酶活力的影响,以期为高温季节海胆幼胆配合饲料中适宜脂肪水平的添加提供理论依据。
1 材料与方法
1.1 材料
试验用中间球海胆幼胆为农业部北方海水增养殖重点实验室同一批卵孵化培育的幼海胆。
1.2 方法
1.2.1 饲料的配制以海藻粉和豆粕为主要蛋白源,通过梯度添加用鱼油配制的5种等氮(粗蛋白质为20%)试验饲料,使饲料脂肪水平分别为3%、6%、9%、12%、15%,并依次命名为L-3、L-6、L-9、L-12和L-15组(表1)。将所有粉状原料粉碎过100目,并按照配比将饲料干粉进行充分混合,然后将鱼油和卵磷脂的混合物均匀搓至上述干粉饲料中。随后,向加过鱼油的原料中添加30%的自来水并利用搅拌机充分混合均匀。用双螺杆制片机(济南鼎润机械有限公司)制成海胆片状饲料(100 mm×50 mm×1.2 mm)。制作好的饲料于烘箱(40℃)中烘干,冷却后用双层塑料袋包装,储存于阴凉干燥处备用。试验饲料的原料组成及营养成分实测值见表1。
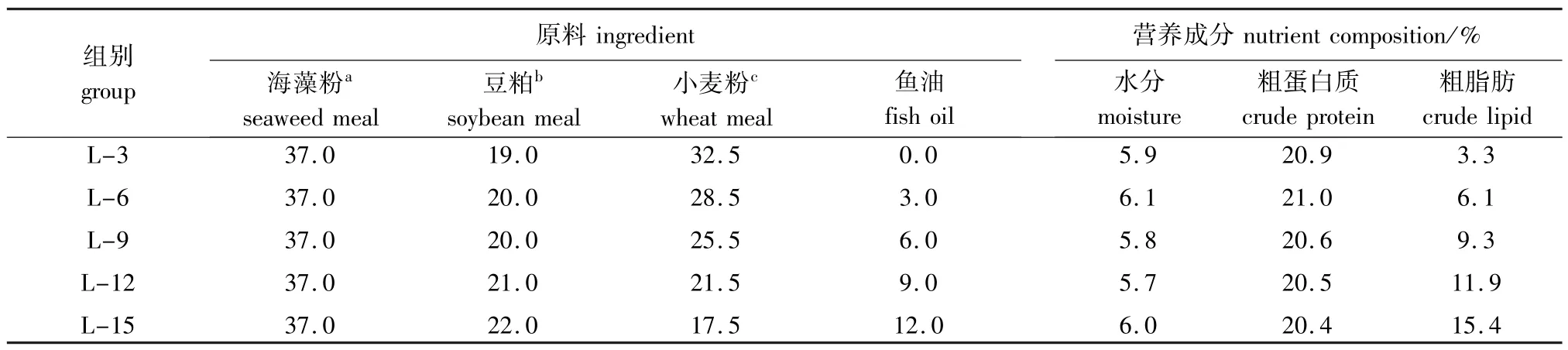
表1 试验饲料的原料组成和营养成分(饲料干物质)Tab.1 Ingredients and approximate compositions of the experimental diets(dry matter)w/%
1.2.2 试验设计 试验开始前将试验海胆置于1000 L水槽中暂养,每天换水和投喂配合饲料各一次(17:00),换水比例为总体积的50%。经过2周驯化,将大小均匀、健康无病的海胆(初始体质量3.83 g±0.40 g)分养至15个网笼(直径15 cm,高20 cm)中,再将试验网笼挂放在1000 L蓝色玻璃钢水槽中,每个网笼投放15只海胆。
试验在农业部北方海水增养殖重点实验室进行,试验周期为96 d。试验期间,每天换水一次,换水比例为玻璃钢水槽容积的50%。换水时吸底,以清除水槽底部的残饵和粪便,每次换水后投喂一次配合饲料(17:00)。试验期间,溶氧>5 mg/L,水温保持在(15±2)℃,盐度为28~30。摄食生长试验结束后,对每个网笼中的海胆进行计数并称重,计算成活率和体增重。从每个网笼中随机选取3只海胆,分离消化道并收集于1.5 mL离心管中,用1 mL注射器吸取体腔液,在4℃下,以3000 r/min离心5 min,将上清液移至新的1.5 mL离心管中,消化道和体腔液上清用液氮速冻后保存于冰箱(-80℃)中备用。
1.2.3 热应激试验 在摄食生长试验结束后,将各组海胆置于26℃恒温水槽中,并于热应激后15 min、2 h、6 h,从每个网笼各取3只海胆,解剖海胆并收集体腔液,液氮速冻后保存于冰箱(-80℃)中备用。
1.2.4 消化酶活力的测定 将-80℃下保存的肠道样品在冰上解冻,按质量(g)∶体积(mL)= 1∶9的比例加入生理盐水,在冰水浴条件下机械匀浆,冷冻离心(4℃,2500 r/min)10 min后留取上清液。胃蛋白酶、淀粉酶、脂肪酶、总蛋白含量的测定均采用南京建成生物工程研究所生产的试剂盒,按照试剂盒说明书进行操作。利用Epoch酶标仪(美国Biotek公司)对显色溶液吸光度进行测定。各消化酶活力定义为:每毫克组织蛋白在37℃下每分钟分解蛋白生产1μg氨基酸相当于一个胃蛋白酶活力单位(U);每毫克蛋白在37℃下与底物作用30 min,水解10 mg淀粉定义为一个淀粉酶活力单位(U);在37℃条件下,每克组织蛋白与底物反应1 min,每消耗1μmol底物为一个脂肪酶活力单位(U)。
1.2.5 抗氧化酶活力测定 采用南京建成试剂盒测定海胆体腔液抗氧化酶活力。各抗氧化酶活力定义为:每毫升反应液中SOD抑制率达50%时对应的SOD量为一个SOD活力单位(U);每毫升血清或血浆每秒钟分解1μmol的H2O2的量为一个过氧化氢酶(CAT)活力单位(U);在37℃条件下,每分钟每毫升血清(浆)使反应体系的吸光度(OD)值增加0.01时,为一个总抗氧化能力(AOC)单位(U)。
1.3 数据处理
试验数据均以平均值±标准误(mean±S.E)表示。采用SPSS 16.0软件进行单因素方差分析,用Turkey's法进行多重比较,显著性水平设为0.05。
2 结果与分析
2.1 饲料脂肪水平对中间球海胆存活和生长的影响
从表2可见:中间球海胆的存活率均大于89%,且各处理组之间无显著性差异(P>0.05);随着饲料脂肪水平的升高,海胆增重率总体呈现降低的趋势;在32 d和64 d时,海胆最大增重率出现在L-3组,显著高于L-15组(P<0.05);在96 d时,L-6组中间球海胆的增重率最大,与L-3、L-9和L-12组无显著性差异(P>0.05),但显著高于L-15组(P<0.05)。
2.2 饲料脂肪水平对中间球海胆消化酶活力的影响
从表3可见:中间球海胆胃蛋白酶活力随着饲料脂肪水平的升高呈降低的趋势,但各组间无显著性差异(P>0.05);脂肪酶活力随饲料脂肪水平的升高而升高,其中L-15组脂肪酶活力最高(15.76 U/mg),显著高于L-3组(P<0.05);海胆消化道淀粉酶活力随着饲料脂肪水平的升高呈逐渐降低的趋势,其中L-3组海胆淀粉酶活力最高(2.14 U/mg),显著高于L-9和L-15组(P<0.05)。
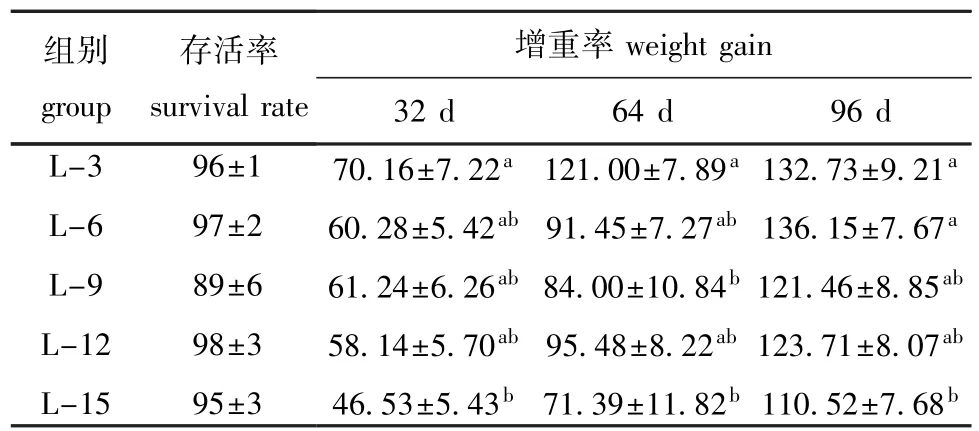
表2 饲料脂肪水平对中间球海胆存活和生长的影响Tab.2 Effects of dietary lipid level on survival and grow th of sea urchin Strongylocentrotus intermedius%
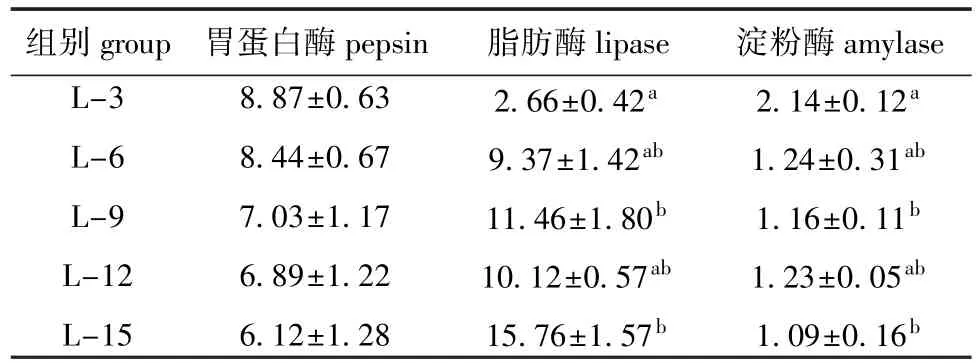
表3 饲料脂肪水平对中间球海胆消化酶活力的影响Tab.3 Effects of dietary lipid level on activities of digestive enzymes in sea urchin U/mg
2.3 饲料脂肪水平对中间球海胆抗氧化酶活力的影响
从表4可见:热应激之前,当饲料脂肪水平由3%升高至12%时,海胆体腔液SOD活力由32.06 U/mL显著升高至36.62 U/mL(P<0.05),随着饲料脂肪水平的进一步升高,SOD活力下降至33.81 U/mL(P>0.05);热应激2 h时,海胆体腔液SOD变化趋势与热应激前一致,其中L-12组海胆体腔液中SOD酶活力最高(40.21 U/mL),显著高于L-15组(P<0.05),但与其他各组无显著性差异(P>0.05);热应激6 h时,当饲料脂肪水平由3%升高至6%时,海胆体腔液SOD活力由34.27 U/mL显著升高至37.92 U/mL(P<0.05),之后随着饲料脂肪水平的进一步升高,SOD活力显著降至30.02 U/mL(P<0.05)。
从表5可见:热应激前,饲料脂肪水平未对海胆体腔液AOC活力产生显著影响(P>0.05);热应激15 min时,AOC活力随脂肪水平的升高呈先升高后降低的趋势,L-6组AOC活力最高(0.41 U/mL),显著高于L-12和L-15组(P<0.05);热应激6 h时,AOC活力随脂肪水平的升高而降低,L-3组海胆体腔液AOC活力最高(0.31 U/mL),与L-6组相当(0.26 U/mL),均显著高于其余各组(P<0.05)。
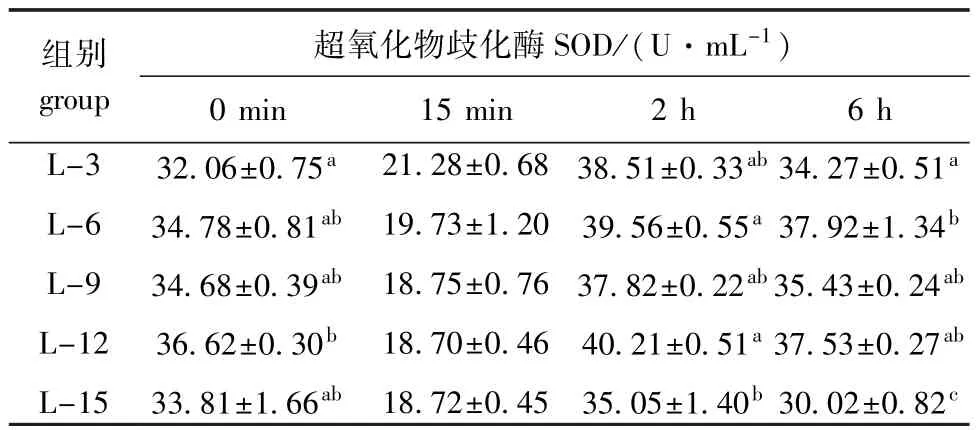
表4 饲料脂肪水平对中间球海胆SOD活力的影响Tab.4 Effects of dietary lipid level on the SOD activity in sea urchin
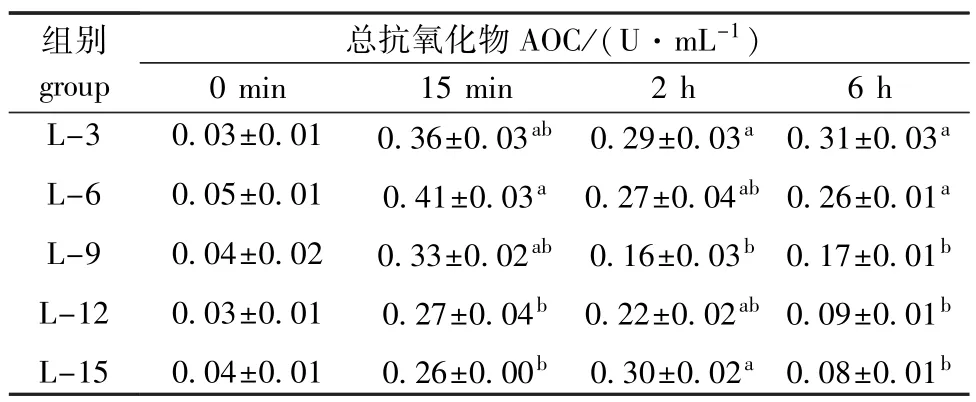
表5 饲料脂肪水平对中间球海胆总抗氧化力的影响Tab.5 Effects of dietary lipid level on the totalanti-oxidative capacity in sea urchin
从表6可见:海胆体腔液CAT活力在热应激前后均无显著性变化(P>0.05),但随着饲料脂肪水平的升高均呈先升高后降低的趋势,且热应急6 h后饲料脂肪水平为6%时,CAT活力最高。
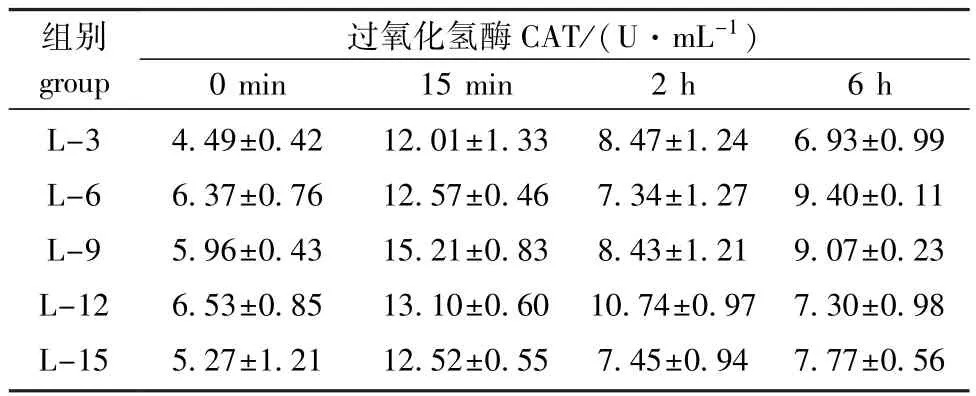
表6 饲料脂肪水平对中间球海胆CAT活力的影响Tab.6 Effects of dietary lipid level on the activity of catalase in sea urchin
3 讨论
3.1 适宜的饲料脂肪水平能够提高中间球海胆消化酶活力和生长速率
脂肪不仅是水产动物重要的能量来源,而且所含的脂肪酸尤其是必需脂肪酸在动物正常生长、免疫、性腺发育和繁殖性能过程中发挥着重要作用[12]。适宜的脂肪水平不仅能够满足水产动物对必需脂肪酸的需求,而且可以节约部分蛋白质,从而降低因蛋白质氧化分解产生的氨氮和亚硝酸盐的含量。本研究表明,随着中间球海胆幼胆饲料中脂肪水平的升高,中间球海胆幼胆存活率及增重率总体呈下降趋势。以增重率作为评价指标,中间球海胆幼胆的脂肪需求量为3%。Gibbs等[11]研究表明,随着饲料中磷脂水平的升高,绿海胆幼胆的生长速率显著降低,其对磷脂的最适需求量为1.0%。对刺参的研究表明,0.19%~1.36%的饲料脂肪水平即可满足其营养需求[10]。与其他水产动物相比,棘皮动物对脂肪的需求量较低,这可能与大型藻类中脂肪含量较低有关。海胆主要食用部分为性腺,其中脂肪含量约为4.8%,刺参主要食用部分为体壁,脂肪含量约为0.2%[13],而鱼类肌肉中脂肪含量约为10%,机体脂肪沉积量的不同可能是不同动物脂肪营养需求差异的原因。海胆为底栖动物,且运动能力迟缓,因此,对能量的需求低于游动能力较强的鱼类。此外,有研究表明,海胆似乎具有利用亚油酸(C18:2n-6,LA)和亚麻酸(C18:3n-3,LNA)合成花生四烯酸(C20:4n-6,ARA)、二十碳五烯酸(C20:5n-3,EPA)和二十二碳六烯酸(C22:6n-3,DHA)的能力[14]。本研究中摄食3%脂肪水平的饲料(未添加鱼油)的海胆具有较高生长速率,具体机理需要进行更深入地研究。
动物消化酶活力的高低决定了其消化道对不同营养物质消化能力的强弱,消化酶活力的变化不仅受到饲料营养组成的影响,而且受到环境、生长阶段和健康状况等因素的影响[15]。本研究中发现,海胆脂肪酶活力随饲料脂肪水平的升高而增强,说明动物能够通过提高自身脂肪酶活力来应对不断提高的脂肪水平,从而提高其对脂肪的消化和吸收能力。廖明玲[10]发现,刺参肠道脂肪酶活力随着饲料中脂肪水平的增加而升高。也有研究表明,随着饲料脂肪水平升高,大鳞副泥鳅Paramisgurnus dabryanus[16]和大西洋鲱Clupea harengus[17]幼鱼脂肪酶活力呈现先升高后降低的趋势。韩光明等[18]发现,高脂饲料可显著降低吉富罗非鱼Oreochromis niloticus前、中肠脂肪酶活力。本研究中并未观察到高脂肪水平组海胆脂肪酶活力受到抑制的现象,这可能与本试验中最高脂肪水平(15%)不足够高有关。随着饲料脂肪水平的升高,中间球海胆消化道蛋白酶和淀粉酶活力均具有降低的趋势。研究发现,白甲鱼Onychostoma sima、胭脂鱼Myxocyprinus asiaticus肠道蛋白酶活力随着饲料脂肪水平的升高而降低[19]。向枭等[20]研究认为,当饲料脂肪水平低于最适需求(7.14%~9.26%)时,翘嘴红鲌Erythroculter ilishaeformis幼鱼淀粉酶和蛋白酶活力随着脂肪水平的升高而升高;超过最适需求时,淀粉酶和蛋白酶活力会随饲料脂肪水平的升高而降低。有关饲料脂肪水平调控蛋白酶和淀粉酶活力的机制尚不明确,还需进一步探讨。
3.2 适宜的脂肪水平能够提高中间球海胆抗热胁迫能力
超氧化物歧化酶(SOD)与过氧化氢酶(CAT)共同组成了生物体内活性氧防御系统,在清除超氧自由基、过氧化氢和过氧化物,阻止或减少羟基自由基形成等方面发挥着重要作用[21]。随着饲料脂肪水平的升高,热应激前后海胆体腔液中SOD活力呈现先升高后下降的趋势,且在脂肪水平为12%时具有最大值。这与对大鳞副泥鳅[16]、梭鱼Chelon haematocheilus[22]、红鳍东方鲀Takifugu rubripes[23]的研究结果相似。本试验中饲料脂肪水平是通过梯度添加鱼油来实现的,即随着饲料脂肪水平的升高n-3长链多不饱和脂肪酶(LC-PUFA)随之升高。在最适脂肪范围内,随着饲料中n-3 LC-PUFA水平的提高,奥尼罗非鱼Oreochromis niloticus[24]和褐昌鲉Sebastiscusmarmoratus[25]鱼体的抗氧化性也随之升高。过高水平的n-3 LC-PUFA在体内会发生脂质过氧化反应,致使机体产生较高含量的超氧阴离子,超氧阴离子会攻击机体组织[26-27],体内SOD具有消除超氧阴离子的作用[28],因此,脂肪水平最高的组海胆机体的SOD活力最低,可能与高含量的n-3 LC-PUFA有关。本研究中同时发现,热应激(26℃)15 min时,海胆SOD活力较应激前有较大幅度的降低,这可能是因为动物体在感受热应激时,机体动用大量的SOD来应对外源性的氧化应激,而在应激2 h之后,各处理组SOD活力虽有差异,但总体上活力恢复至热应激之前的水平,这说明海胆为了适应外界温度变化而合成了大量SOD以补充前期消耗。相比于SOD,热应激之前各饲料处理组海胆体腔液中AOC活力均处于较低水平,且各处理组间差异不显著。在热应激之后,AOC活力有较大幅度提高,在15 min时,6%脂肪水平组AOC活力最高,2 h时15%脂肪水平组活力最高,说明在热应激初期,n-3 LC-PUFA会逐渐发挥其抗氧化功能。但随着氧化应激程度的加剧,在应激后6 h,AOC活力随着饲料脂肪水平的升高而显著降低,说明n-3 LC-PUFA可能是通过自身氧化来保护机体抗氧化酶活力,而一旦全部被氧化,脂肪酸的氧化产物超氧阴离子会严重危害机体抗氧化酶系统,致使高脂肪组海胆抗氧化酶活力降至最低。
综上所述,随着饲料脂肪水平的升高,中间球海胆生长速率、淀粉酶和蛋白酶活力降低,且在饲料脂肪水平6%时具有最大生长速率,而较高脂肪水平(6%~12%)能显著提高中间球海胆体腔液中抗氧化酶活力。
[1] 经晨晨,张伟杰,宋坚,等.中间球海胆与紫海胆种间杂交的受精、孵化和幼体发育研究[J].大连海洋大学学报,2015,30(6):620-626.
[2] 苏延明,蔡学新,孙俭,等.用几种饲料原料饲喂中间球海胆稚胆的效果[J].大连海洋大学学报,2008,23(3):242-246.
[3] Liyana-Pathirana C,Shahidi F,Whittick A.The effect of an artificial diet on the biochemical composition of the gonads of the sea urchin(Strongylocentrotus droebachiensis)[J].Food Chemistry,2002,79(4):461-472.
[4] Pearce C M,Daggett T L,Robinson SM C.Effect of urchin size and diet on gonad yield and quality in the green sea urchin(Strongylocentrotus droebachiensis)[J].Aquaculture,2004,233(1):337-367.
[5] Daggett T L,Pearce C M,Tingley M,et al.Effect of prepared and macroalgal diets and seed stock source on somatic growth of juvenile green sea urchins(Strongylocentrotus droebachiensis)[J].Aquaculture,2005,244(1-4):263-281.
[6] Mcbride S C,Price R J,Tomb P D,et al.Comparison of gonad quality factors:color,hardness and resilience of Strongylocentrotus franciscanus between sea urchins fed prepared feed or algal diets and sea urchins harvested from the Northern California fishery[J].Aquaculture,2004,233(1-4):405-422.
[7] Phillips K,Hamid N,Silcock P,et al.Effect ofmanufactured diets on the yield,biochemical composition and sensory quality of Evechinus chloroticus sea urchin gonads[J].Aquaculture,2010,308(s1-s2):49-59.
[8] Lawrence JM,Chang Y Q,Cao X B,et al.Potential for production of uni by Strongylocentrotus intermedius using dry formulated feeds[J].Journal of theWorld Aquaculture Society,2011,42(2):253-260.
[9] Chang Y Q,Lawrence JM,Cao X B,et al.Food consumption,absorption,assimilation and growth of the sea urchin Strongylocentrotus intermedius fed a prepared feed and thealga Laminaria japonica[J].Journal of theWorld Aquaculture Society,2005,36(1):68-75.
[10] 廖明玲.刺参幼参脂肪及n-3系列高度不饱和脂肪酸需求的研究[D].大连:大连海洋大学,2014.
[11] Gibbs V K,Watts SA,Lawrence JM,et al.Dietary phospholipids affect growth and production of juvenile sea urchin Lytechinus variegates[J].Aquaculture,2009,292(1-2):95-103.
[12] Zuo R T,AiQH,MaiK S,etal.Effects of dietary n-3 highly unsaturated fatty acids on growth,nonspecific immunity,expression of some immune related genes and disease resistance of largeyellow croaker(Larimichthys crocea)following natural infestation of parasites(Cryptocaryon irritans)[J].Fish and Shellfish Immunology,2012,32(2):249-258.
[13] 常亚青,丁君,宋坚,等.海参、海胆生物学研究与养殖[M].北京:海洋出版社,2004.
[14] Cook E J,Hughes A D,Orr H,et al.Influence of dietary protein on essential fatty acid in the gonadal tissue of sea urchins Psammechinus miliaris and Paracentrotus lividus(Echinodermata)[J].Aquaculture,2007,273(4):586-594.
[15] 任晓伟.环境因子和营养水平对半滑舌鳎消化酶活性的影响[D].青岛:中国海洋大学,2008.
[16] 曾本和,廖增艳,吴双,等.饲料脂肪水平对大鳞副泥鳅幼鱼生长性能、消化酶活性及抗氧化能力的影响[J].动物营养学报,2016,28(4):1105-1113.
[17] Pedersen B H,Nilssen EM,Hjelmeland K.Variations in the content of trypsin and trysinogen in larval herring(Clupea harengus)digesting copepod nauplii[J].Marine Biology,1987,94(2):171-181.
[18] 韩光明,王爱民,徐跑,等.饲料中脂肪水平对吉富罗非鱼幼鱼成活率、肌肉成分及消化酶活性的影响[J].上海海洋大学学报,2010,19(4):469-474.
[19] 向枭,周兴华,陈建,等.饲料脂肪水平对白甲鱼幼鱼生长性能、体组成和血清生化指标的影响[J].动物营养学报,2013,25(8):1805-1816.
[20] 向枭,周兴华,陈建,等.饲料中脂肪含量对翘嘴红鲌幼鱼消化酶活性的影响[J].北京水产,2008(5):35-38.
[21] 刘志鸿,牟海津,王清印.软体动物免疫相关酶研究进展[J].渔业科学进展,2003,24(3):86-90.
[22] 张春暖,王爱民,刘文斌,等.饲料脂肪水平对梭鱼脂肪沉积、脂肪代谢酶及抗氧化酶活性的影响[J].中国水产科学,2013,20(1):108-115.
[23] 孙阳,姜志强,李艳秋,等.饲料脂肪水平对红鳍东方鲀幼鱼肝脏抗氧化酶活力及组织结构的影响[J].广东海洋大学学报,2013,33(3):27-32.
[24] 甘晖,李坚明,冯广朋,等.饲料脂肪水平对奥尼罗非鱼幼鱼生长和血浆生化指标的影响[J].上海海洋大学学报,2009,18(1):35-41.
[25] 岳彦峰,彭士明,施兆鸿,等.饲料n-3 HUFA水平对褐菖鲉血清生化指标、主要脂代谢酶活力及抗氧化能力的影响[J].海洋渔业,2013,35(4):460-467.
[26] Mourente G,Tocher D R,Diaz E,et al.Relationships between antioxidants,antioxidant enzyme activities and lipid peroxidation products during early development in Dentex dentex eggs and larvae[J].Aquaculture,1999,179(1):309-324.
[27] Gill R,Tsung A T.Linking oxidative stress to inflammation:Tolllike receptors[J].Free Radical Biology&Medicine,2010,48(9):1121-1132.
[28] Dalla V.Salinity response in brickish water populations of the freshwater shrimp Palaemonetes antennarius:I.oxygen consumption[J].Comparative Biochemistry and Physiology,1987,87(2):471-478.
Effects of dietary lipid level on grow th performance,digestive enzyme activity and anti-oxidative capacity after heat stress in juvenile sea urchin Strongylocentrotus intermedius
HOU Shou-quan,ZUO Ran-tao,CHANG Ya-qing,LIGuang,SONG Jian,ZHANGWei-jie,ZHAO Chong
(Key Laboratory of Mariculture&Stock Enhancement in North China's Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023,China)
Juvenile sea urchin Strongylocentrotus intermedius were fed diets containing 3%,6%,9%,12%and 15%of lipid for 96 days to investigate the effects of dietary lipid levels on growth performance,digestive enzyme activity and anti-oxidative capacity.Results showed that there was significantly higher or themaximal weight gain rate(WGR)in the sea urchin fed the diet containing 3%lipid than that in the sea urchin fed the diet containing 15%lipid(P<0.05).The amylase activity was shown to be significantly lower(P<0.05)and lower in pepsin in the sea urchin juveniles fed the elevated lipid diets.Lipase activity was increased significantly with the increase in dietary lipid(P<0.05).Relatively high dietary lipid(6%-12%)led to improve activity of superoxide dismutase(SOD)and anti-oxidant capacity(AOC)in the thermal stress sea urchin,with the maximal SOD activity in the sea urchin exposed to 2 and 6 hour thermal stress in the 12%dietary lipid group,and significantly higher than that in the 15%dietary lipid group(P<0.05).Themaximal catalase(CAT)activity in coelomic fluid was observed in the sea urchin exposed to 15 min and 6 hour thermal stress in the 6%dietary lipid group,significantly higher than that in the 12%and 15%dietary lipid groups,and higher than that in the 15%dietary lipid group(P<0.05),indicating that6%-12%lipid was of the optimal for improvement of anti-oxidative capacity in response to thermal stress,though 6%lipid was suggested to be optimal for the growth of sea urchin.
Strongylocentrotus intermedius;dietary lipid level;digestive enzyme;anti-oxidative enzyme
S917.4
A
10.16535/j.cnki.dlhyxb.2016.05.012
2095-1388(2016)05-0538-06
2016-07-19
辽宁省农业攻关及成果产业化项目(2015203003);中国科协“青年人才托举工程”资助;国家自然科学基金资助项目(41606180)
侯受权(1990—),男,硕士。E-mail:ythsq2014@163.com
左然涛(1985—),男,博士,讲师。E-mail:rtzuo@dlou.edu.cn
