新疆多浪羊IL-1β基因原核表达载体的构建与表达
2016-11-10曾国航徐宏伟李莲瑞
曾国航,徐宏伟,李莲瑞
(1 塔里木大学 a 生命科学学院,b 动物科学学院,新疆 阿拉尔 843300;2 新疆兵团塔里木畜牧科技重点实验室,新疆 阿拉尔 843300)
新疆多浪羊IL-1β基因原核表达载体的构建与表达
曾国航1a,徐宏伟1a,李莲瑞1b,2
(1 塔里木大学 a 生命科学学院,b 动物科学学院,新疆 阿拉尔 843300;2 新疆兵团塔里木畜牧科技重点实验室,新疆 阿拉尔 843300)
【目的】 构建新疆多浪羊IL-1β基因编码区的原核表达载体,在大肠杆菌中进行诱导表达,为进一步研究IL-1β蛋白的结构功能奠定基础。【方法】 从含质粒pMD-18T-IL-1β的大肠杆菌DH5α中获取IL-1β基因,与pET-28b质粒DNA连接,构建原核表达载体pET-28b-IL-1β。先将其转化到克隆载体E.coliDH5α感受态细胞中大量拷贝,经菌液PCR和EcoRⅠ、XhoⅠ双酶切鉴定后,提取pET-28b-IL-1β质粒转化到表达载体E.coliBL21(DE3)中,再次进行菌液PCR和EcoRⅠ、XhoⅠ双酶切鉴定。将阳性单克隆接种于LB液体培养基,以终浓度为1 mmol/L IPTG进行诱导,用SDS-PAGE电泳检测IL-1β蛋白的表达及存在形式,通过Western blotting验证表达产物是否为目的蛋白。【结果】 成功构建了新疆多浪羊IL-1β基因的原核表达载体pET-28b-IL-1β,该载体经诱导后表达出融合蛋白,分子质量为32.4 ku,主要以包涵体的形式表达;经Western blotting检测,带有6×His标签的融合蛋白有很好的反应原性。【结论】 成功构建了新疆多浪羊IL-1β基因的原核表达载体pET-28b-IL-1β,其在大肠杆菌BL21(DE3)中经诱导后表达出分子质量约为32.4 ku的IL-1β融合蛋白。
多浪羊;IL-1β基因;原核表达
新疆多浪羊是新疆南疆特色肉羊品种,其个体大、增重快,适合农区饲养,羔羊可当年育肥并屠宰,并具有耐干旱、耐热、耐低营养水平及抗逆、抗病、适应性强等优良性状,对荒漠化、半荒漠化等恶劣生态环境有较高的适应性。
白细胞介素(Interleukin,IL)是重要的细胞因子之一,IL-1有2种形式,分别为白细胞介素-1α(interleukin-1α,IL-1α)和白细胞介素-1β(interleukin-1β,IL-1β),二者有一定程度的局部同源性和相同的结构域[1],其都能与IL-1的功能受体结合,从而发挥生理作用[2-5]。IL-1β在机体的免疫反应中,能激活与调节免疫细胞,介导T、B淋巴细胞的活化、增殖与分化,还在炎症反应中起重要作用[6-7]。IL-1β是最早被研究的细胞因子之一,其在免疫活动中处于细胞因子网络的中心地位,几乎所有的有核细胞都能产生IL-1β[8-10]。IL-1β是一种多效的促炎细胞因子,能够引发一系列的炎症调节,也可影响机体的生理代谢、造血和免疫功能等[11]生命活动。目前,IL-1β因子虽然在医学领域未被广泛应用,但其在免疫方面的特殊作用使它在临床方面具有诱人的应用前景。
本试验构建了新疆多浪羊IL-1β基因的原核表达载体,并进行了诱导表达,获得了带有组氨酸标签的融合蛋白,旨在为进一步获取新疆多浪羊IL-1β目的蛋白并用其制作单克隆抗体奠定基础。
1 材料与方法
1.1材料
1.1.1菌株含质粒pMD-18T-IL-1β的大肠杆菌DH5α、含质粒pET-28b的大肠杆菌BL21(DE3)菌液,均由塔里木大学畜牧科技兵团重点实验室于-70 ℃保存。
1.1.2主要试剂DL2000 DNA Marker、低分子蛋白Marker、T4DNA连接酶、限制性内切酶EcoRⅠ和XhoⅠ,均购自大连宝生物工程有限公司;IPTG,购自Biotopped公司;一抗(带组氨酸6×(His)标签的鼠源单克隆抗体)、二抗(辣根过氧化物酶标记的羊抗鼠多克隆标记)、辣根过氧化物酶标记(HRP Conjugate)、质粒提取试剂盒、琼脂糖回收试剂盒,均购自全式金公司。
1.1.3引物设计与合成根据GenBank上的IL-1β基因序列(GenBank号:NM_001009465.2),用primer premier 5.0软件设计特异性引物,由上海生工生物工程技术服务有限公司合成。上游引物为(PF):5′-GGCGAATTCCTTCATTGCCCAGGT-TTC-3′,下游引物为(PR):5′-GGCCTCGAGCTGCGTATGGCTTCTTTA-3′。其中GGC为保护性碱基,PF中GAATTC为EcoRⅠ酶切位点,PR中CTCGAG为XhoⅠ酶切位点。
1.2方法
1.2.1目的片段的获得取-70 ℃保存的含质粒pMD-18T-IL-1β的大肠杆菌DH5α和含质粒pET-28b的大肠杆菌BL21(DE3)菌液各1 μL,分别加入5 mL LB液体培养基(含氨苄青霉素50 μg/mL)中,振荡培养过夜。根据全式金质粒提取试剂盒说明,分别提取pMD-18T-IL-1β和pET-28b质粒,进行EcoRⅠ和XhoⅠ双酶切,获得目的片段IL-1β和具有粘性末端的线性质粒pET-28b,酶切体系为:pMD-18T-IL-1β 或pET-28b质粒 16 μL,EcoRⅠ 1 μL,XhoⅠ 1 μL,10× Buffer 2 μL。酶切产物于65 ℃水浴15 min灭活酶活性,经0.8%琼脂糖凝胶电泳后,用全式金琼脂糖回收试剂盒分别回收IL-1β和pET-28b酶切目的片段,并用核酸蛋白仪测定IL-1β和pET-28b片段浓度,调节IL-1β与pET-28b片段浓度比为3∶1,备用。
1.2.2pET-28b-IL-1β原核表达载体的构建与鉴定将IL-1β和pET-28b在T4DNA 连接酶作用下连接,构建原核表达载体pET-28b-IL-1β。连接反应体系如下:IL-1βDNA 6 μL, pET-28b 载体 2 μL,T4DNA 连接酶1 μL;连接条件为16 ℃下反应16 h。将连接产物加入到100 μL 大肠杆菌DH5α感受态细胞中,先在冰上放置30 min,再42 ℃作用90 s,然后于冰上放1 min,最后加入890 μL SOC培养基,170 r/min振荡1 h后,7 500 r/min离心10 min,沉淀用100 μL SOC培养基悬浮,涂布于含50 μg/mL卡那霉素的LB固体培养基上,培养过夜。
挑取重组单克隆菌接种至5 mL LB培养基中,37 ℃下170 r/min振荡培养过夜,进行菌液PCR鉴定,PCR反应体系:10× PCR buffer 2 μL,dNTP 1.6 μL,TaqDNA聚合酶 0.4 μL,PF 0.5 μL,PR 0.5 μL,模板DNA 0.5 μL,ddH2O 14.5 μL。用全式金质粒提取试剂盒提取pET-28b-IL-1β载体质粒,进行EcoRⅠ和XhoⅠ双酶切鉴定,挑选阳性克隆菌保存备用。
1.2.3融合蛋白的诱导表达用全式金质粒提取试剂盒提取pET-28b-IL-1β质粒,转化到BL21(DE3)中,步骤同1.2.2。将菌液PCR和双酶切鉴定正确的pET-28b-IL-1β阳性克隆菌接种于含50 μg/mL卡那霉素的LB培养基中,37 ℃下180 r/min振荡培养至OD600为0.6~0.8时,加入IPTG至其终浓度为1 mmol/L,37 ℃下200 r/min振荡培养,进行诱导,于诱导后1,2,3,4 h各取样1次,每次2 mL。试验同时设pET-28b转化的BL21(DE3)对照,分别在诱导0和4 h取样2 mL。样品经12 000 r/min离心2 min,收集菌体,分别加100 μL 2×SDS上样缓冲液、10 μL DTT,充分混匀,沸水浴5 min后,12 000 r/min离心2 min,利用SDS-PAGE电泳检测pET-28b-IL-1β是否表达。
1.2.4融合蛋白表达形式的检测将重组质粒pET-28b-IL-1β表达菌接种于含有50 μg/mL卡那霉素的LB培养基中,培养至OD600为0.6~0.8时,加入IPTG至其终浓度为1 mmol/L,37 ℃下180 r/min振荡培养,诱导4 h。试验同时设pET-28b转化的BL21(DE3)对照,分别在诱导0和4 h取样2 mL。诱导培养菌液于4 ℃下7 000 r/min离心10 min,收集菌体,用1×TE buffer充分悬浮菌体,涡旋后反复冻融3~5次,冰浴超声破碎菌体30次(超声3 s,间隔3 s,温度37 ℃,功率200 W)。超声后,分装到1.5 mL离心管中,12 000 r/min离心2 min,将上清和沉淀分开,分别加2 mol/L尿素1 mL,4 ℃重悬5 min,12 000 r/min离心2 min,重复上述步骤,每管再加8 mol/L尿素200 μL,12 000 r/min离心5 min,将上清和沉淀分开备用,用SDS-PAGE电泳检测融合蛋白的存在形式。
1.2.5重组蛋白的Western blotting分析转移:将IPTG诱导4 h的含pET-28b-IL-1β和含pET-28b质粒(空白对照)的BL21(DE3)分别进行点样,SDS-PAGE电泳结束后,将上述电泳所得胶放入转移缓冲液中平衡30 min。用铅笔标记Hybond转移膜的边角,放入转移缓冲液中平衡10~15 min。最后将SDS-PAGE凝胶与湿润的Hybond膜正确放入转移盒[12],接通电源,将整个电泳槽放置4 ℃冰箱中,30 mA转移8 h。封闭:用蒸馏水洗净转移好的膜表面的电泳液,随后放在封闭液中,室温封闭2 h。一抗孵育:将一抗用封闭液做1∶5 000倍的稀释,将转移膜放置于一抗稀释液中4 ℃过夜孵育。洗膜:用TBS-T洗膜3次,每次10 min。二抗孵育:用辣根过氧化酶标记的羊抗鼠IgG与封闭液做1∶5 000倍的稀释,室温振荡孵育2 h。洗膜:用TBS-T洗膜3次,每次10 min。显色:将膜放入显色液中,3~5 min后显色。
2 结果与分析
2.1目的片段IL-1β与载体pET-28b的获得
对提取的pMD-18T-IL-1β、pET-28b质粒分别进行EcoRⅠ和XhoⅠ双酶切,结果如图1所示。由图1可知,EcoRⅠ和XhoⅠ双酶切的pET-28b质粒与未酶切的pET-28b质粒差异比较明显,未酶切的质粒为超螺旋结构,其迁移率要比双酶切后的线性结构质粒快;pMD-18T-IL-1β质粒经双酶切后,获得了862 bp的目的基因片段IL-1β和2 692 bp的载体片段。

图 1 pMD-18T-IL-1β、pET-28b的EcoRⅠ和XhoⅠ双酶切结果
2.2重组质粒pET-28b-IL-1β的鉴定
以单克隆菌液为模板,进行菌液PCR,结果(图2)显示,获得了862 bp的IL-1β片段。pET-28b-IL-1β质粒经EcoRⅠ和XhoⅠ双酶切后,获得了 5 368 bp的线性质粒pET-28b和862 bp的IL-1β片段(图3)。

图 2 pET-28b-IL-1β的PCR鉴定

图 3 pET-28b-IL-1β的EcoRⅠ和XhoⅠ双酶切鉴定
2.3融合蛋白pET-28b-IL-1β基因在大肠杆菌BL21(DE3)中的诱导表达
将原核表达质粒pET-28b-IL-1β转化到宿主菌BL21(DE3)中,并用IPTG进行诱导,结果见图4。由图4可知,诱导后原核表达质粒pET-28b-IL-1β产生了分子质量约为32.4 ku的特异性蛋白,而对照组pET-28b不表达该蛋白,与预期结果一致。由图4还可知,随着诱导时间增加,该蛋白的表达量增加,4 h达到最大。
2.4融合蛋白pET-28b-IL-1β表达形式的确定
表达菌经反复冻融超声后,分别吸取上清和沉淀,用SDS-PAGE电泳检测融合蛋白pET-28b-IL-1β的表达形式,结果如图5所示。由图5可知,融合蛋白主要以包涵体的形式表达,上清中也有表达,但表达量远低于包涵体。
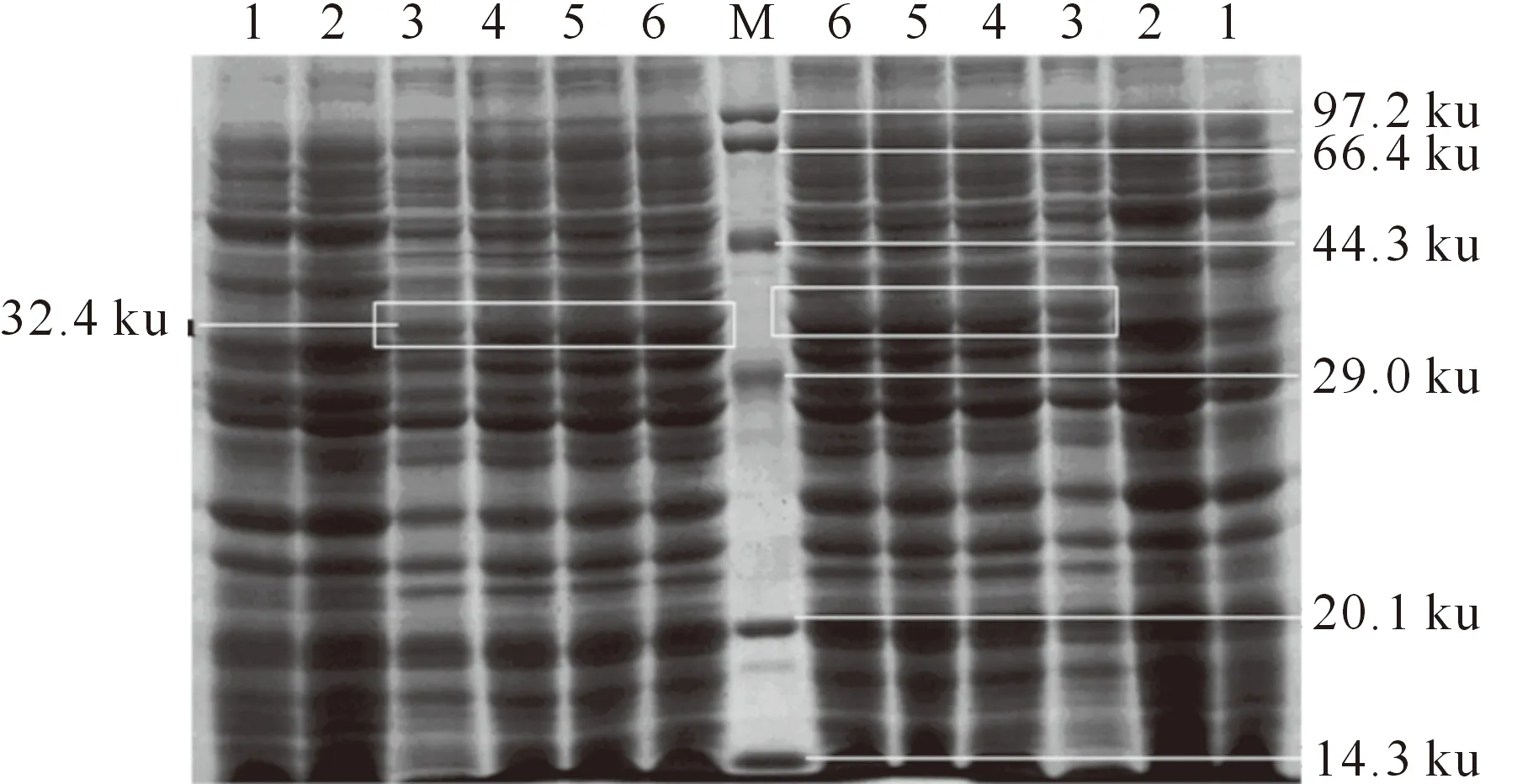
图 4 融合蛋白pET-28b-IL-1β的SDS-PAGE分析
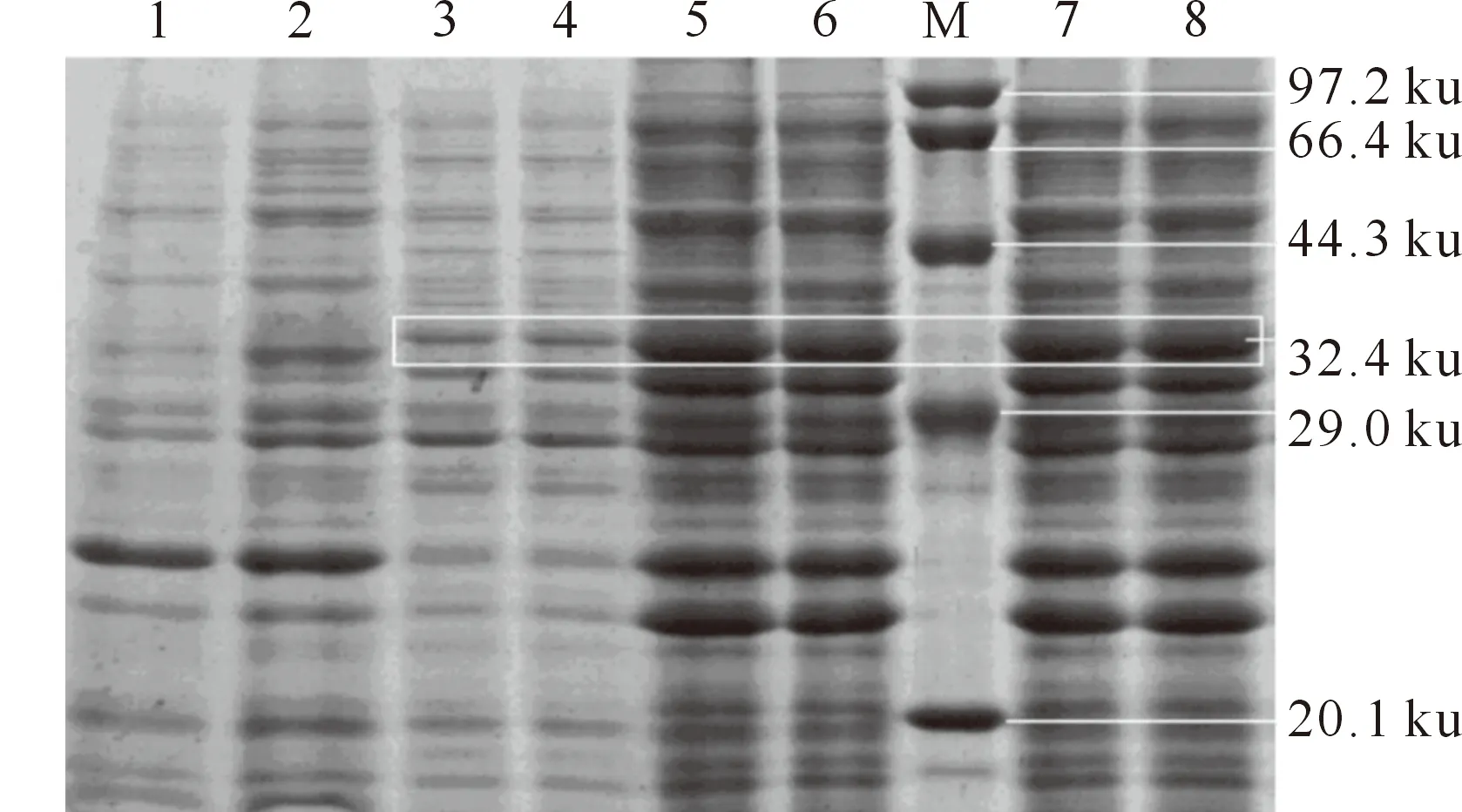
图 5 融合蛋白pET-28b-IL-1β的表达形式
2.5目的蛋白的Western blotting检测
Western blotting结果(图6)表明,诱导表达融合蛋白IL-1β能够从凝胶中转移到Hybond膜上,且在膜上IL-1β融合蛋白的相应位置处有显色条带,在空白对照处不出现条带。
3 讨 论
常用的外源蛋白表达系统分为原核表达系统和真核表达系统[13],在原核表达系统中,大肠杆菌表达系统最为常用,其具有遗传背景稳定、表达量高、表达产物容易纯化、价格低廉等优点[14]。在大肠杆菌表达系统中,表达外源基因水平远远高于其他基因的表达水平。pET系统是在大肠杆菌中克隆和表达重组蛋白的最强大的系统,可以从自身基因中产生大量蛋白,优化靶蛋白的表达[15]。本研究将新疆多浪羊IL-1β基因通过酶切连接在pET-28b载体上,构建pET-28b-IL-1β原核表达质粒,再转化到大肠杆菌BL21(DE3)中进行诱导表达,通过SDS-PAGE电泳在32.4 ku处可见表达出的目的蛋白。

图 6 IL-1β融合蛋白的Western blotting鉴定
试验目的蛋白的表达为融合表达方式,这种方式能增强目的蛋白的可溶性,不但能使其正确折叠,而且目的蛋白的活性也较高[16]。经可溶性分析发现,本试验中的IL-1β融合蛋白主要以包涵体形式存在,虽然上清中也有表达,但是其表达量较低。新合成的肽链在折叠过程中部分折叠而形成的中间体称为包涵体,其中包括了大量的目的蛋白,它的优势在于能包裹目的蛋白,不被水降解,可以通过离心等方式获得目的蛋白[17]。本试验表达的带有His-标签的融合蛋白IL-1β,可以在天然或变性条件下用NTA His-Bind树脂或IDA His-Bind树脂进行纯化[18-19],为后续融合蛋白的纯化奠定了一定的基础。
[1]Sousa E L,Martinho F C,Leite F R,et al.Macrophage cell activation with acute apical abscess contents determined by Interleukin-1 Beta and tumor necrosis factor Alpha production [J].Journal of Endodontics,2014,9(14):576-577.
[2]Guo L,Wei G,Zhu J,et al.IL-1 family members and STAT activators induce cytokine production by Th2,Thl7,and Thl cells [J].Proc Nat Acad Sci USA,2009,10(6):3463-3468.
[3]Sakuma S,Tokuhara D,Otsubo H,et al.Dynamic change in cells expressing IL-1β in rat hippocampus after status epilepticus [J].Journal of Neuroinflammation,2014,8(5):25-32.
[4]Kobayashi M,Squire G R,Mousa A,et al.Role of interleukin-1 and tumor necrosis factor alpha in matrix degradation of human osteoarthritic cartilage [J].Arthritis Rheum,2005,52(1):128-135.
[5]Largo R,Alvarez-Soria M A,Diez-Ortego I,et al.Glucosamine inhibits IL-1 beta-induced NFkappaB activation in human osteoarthritic chondrocytes [J].Osteoarthritis Cartilage,2003,11(4):290-298.
[6]Homandberg G A,Umadi V,Kang H,et al.High molecular we-ight hyaluronan promotes repair of IL-1beta-damaged cartilage explants form both young and old bovines [J].Osteoarthritis Cartilage,2003,11(3):177-186.
[7]Auron P E,Webb A C.Interleukin-1:a gene expression system regulated at multiple levels [J].Eur Cytokine Netw,1994,4(5):573-592.
[8]Zhang X,Mao Z,Yu C.Suppression of early experimental osteoarthritis by gene transfer of interleukin-1 receptor antagonist and in interleukin-10 [J].J Orthop Res,2004,22(4):742-750.
[9]Fan Z,Yang H,Bau B,et al.Role of mitogen-activated protein kinases and NF-kappaB on IL-1beta-induced effects on collagen type Ⅱ,MMP-1 and 13 mRNA expression in normal articular human chondrocytes [J].Rheumatol Int,2006,26(10):900-903.
[10]Chuang Y T,Lin Y C,Lin K H,et al.Tumor suppressor death-associated protein kinase is required for full IL-1beta production [J].Blood,2011,117(3):960-970.
[11]Sims J E,Gayle M A,Slack J L,et al.Interleukin 1 signaling occurs exclusively via the type Ⅰ receptor [J].Proc Natl Acad Sci,1993,9(4):6155-6159.
[12]高玲美,牛钟相,丁淑燕.动物细胞因子研究进展 [J].动物医学进展,2003,24(4):46-48.
Gao L M,Niu Z X,Ding S Y.The advancement in the research of animal cytokines [J].Progress in Veterinary Medicine,2003,24(4):46-48.
[13]贺艳艳.新疆卡拉库尔羊TNF-α基因的克隆、原核表达及抗原性分析 [D].新疆阿拉尔:塔里木大学,2012.
He Y Y.Cloning and prokaryotic expression of Xinjiang karakul sheep TNF-α gene and the analysis of its antigenicity [D].Alaer,Xinjiang:Tarim University,2012.
[14]Nuc P,Nuc K.Recombinant protein production inEscherichiacoli[J].Postepy Biochem,2006,52(4):448-456.
[15]解庭波.大肠杆菌表达系统的研究进展 [J].长江大学学报(自然科学版)医学卷,2008,5(3):77-82.
Xie T B.Research progressonE.coliexpression system [J].Journal of Yangtze University (Nat Sci Ed) Medicine Ⅴ,2008,5(3):77-82.
[16]潘辉.新疆卡拉库尔羊Fas基因的克隆、原核表达及抗原性分析 [D].新疆阿拉尔:塔里木大学,2012.
Pan H.Cloning and prokaryotic expression of Xinjiang karakul sheep Fas gene and the analysis of its antigenicity [D].Alaer,Xinjiang:Tarim University,2012.
[17]夏启玉,肖苏生,邓柳红,等.包涵体蛋白的复性研究进展 [J].安徽农业科学,2008,36(14):5801-5803.
Xia Q Y,Xiao S S,Deng L H,et al.Research progress in renaturation of inclusion body protein [J].Journal of Anhui Agri Sci,2008,36(14):5801-5803.[18]宋翠翠,曹国宪,张莉,等.大肠杆菌表达GST-Aβ 42融合蛋白的纯化条件及鉴定 [J].现代生物医学进展,2008,8(12):2453-2456.
Song C C,Cao G X,Zhang L,et al.Optimal purification condition and identification of GST-Aβ 42 expression inEscherichiacoli[J].Progress in Modern Biomedicine,2008,8(12):2453-2456.
[19]车婧,韩金祥,王世立.促进包涵体蛋白复性的几种有效添加剂 [J].医学分子生物学杂志,2004,1(2):122-125.
Che J,Han J X,Wang S L.Several additives that effectively improve protein refolding [J].J Med Mol Biol,2004,1(2):122-125.
Construction and expression of prokaryotic expression vector ofIL-1βfrom Duolang sheep in Xinjiang
ZENG Guohang1a,XU Hongwei1a,LI Lianrui1b,2
(1 aCollegeofLifeScience,bCollegeofAnimalScience,TarimUniversity,Alaer,Xinjiang843300,China;2KeyLaboratoryofTarimHusbandryScienceandTechnology,XinjiangProduction&ConstructionGroup,Alaer,Xinjiang843300,China)
【Objective】 The prokaryotic expression vector ofIL-1βgene encoding area of Xinjiang Duolang sheep was constructed and induced to express inE.colito lay foundation for further study on its structure and function.【Method】 The prokaryotic expression vector pET-28b-IL-1β was constructed by connectingIL-1βgene from plasmid pMD-18T-IL-1β ofE.coliDH5α and pET-28b ofE.coliBL21(DE3).Large copies of competent cells were obtained by transforming it into cloning vectorE.coliDH5α.After identification using bacteria PCR and double enzyme digestion withEcoRⅠ andXhoⅠ,pET-28b-IL-1β plasmid was extracted and transformed intoE.coliBL21(DE3) expression vector.Then,it was identified again using PCR and double enzyme digestion.The positive monoclonal antibody was inoculated into LB culture medium.With a final concentration of 1 mmol/L IPTG induction,the IL-1β protein expression and its form was detected by electrophoresis SDS-PAGE and checked by Western blotting test.【Result】 The recombinant prokaryotic expression vector pET-28b-IL-1β of Xinjiang Duolang sheep was constructed successfully.After induction,fusion protein was expressed with molecular weight of 32.4 ku.It mainly expressed in the form of inclusion body.Western blotting detection found that the fusion protein with 6×His tag had good immunogenicity.【Conclusion】 The prokaryotic expression vector pET-28b-IL-1β ofIL-1βgene from Xinjiang Duolang sheep was successfully constructed and the obtained fusion protein inEscherichiacoliBL21(DE3) had molecular weight of 32.4 ku.
Duolang sheep;IL-1βgene;prokaryotic expression
时间:2016-08-0909:40DOI:10.13207/j.cnki.jnwafu.2016.09.003
2015-01-28
国家自然科学基金项目“棉酚对新疆多浪羊白细胞介素表达的影响研究”(30960277);创新群体项目“南疆地区羊标准化养殖的群发病防控及预警响应机制研究”(TDZKCX201401)
曾国航(1989-),男,新疆乌鲁木齐人,在读硕士,主要从事动物基因工程研究。E-mail:540745294@qq.com
李莲瑞(1968-),女,新疆库尔勒人,教授,博士,硕士生导师,主要从事分子免疫学研究。E-mail:lilianrui51@163.com
S826
A
1671-9387(2016)09-0017-05
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160809.0940.006.html
