斑秃皮损凋亡因子Annexin V表达及与T细胞浸润的相关性
2016-11-10张小婷蔡泽明叶艳婷章星琪
赵 莹 张小婷 蔡泽明 叶艳婷 张 斌 章星琪
·论著·
斑秃皮损凋亡因子Annexin V表达及与T细胞浸润的相关性
赵莹1张小婷2蔡泽明3叶艳婷4张斌4章星琪4
目的:检测斑秃皮损凋亡因子Annexin V的表达并确定其与T细胞浸润的相关性。方法:对22例斑秃患者皮损(11例早期斑秃和11例中晚期斑秃)和10例正常头皮进行CD3/CD4/CD8和Annexin V的免疫组化双染。结果:早期斑秃Annexin V在浅层血管和毛囊周围的阳性细胞数显著高于中晚期斑秃,而在深层毛囊周围显著低于中晚期斑秃(P<0.05)。早期斑秃深层毛囊周围T细胞浸润与Annexin V阳性细胞数量呈显著正相关,而浅层毛囊周围两者无明显相关性。结论:早期斑秃浅层永久性毛囊细胞凋亡与T细胞浸润无相关性,而深层周期性毛囊周围T细胞浸润是毛囊细胞凋亡的主要原因。
斑秃;凋亡因子;T细胞
斑秃发病机制不清,研究多倾向于认为其是精神压力及遗传因素等原因导致毛囊的免疫豁免丧失,局部T细胞在毛囊周围"蜂拥状"浸润,而后通过多种机制诱导毛囊上皮细胞凋亡,使生长期毛囊提前进入退行期及休止期,从而引起毛发脱落[1-3]。
研究发现,早期斑秃患者皮损生长期毛囊促凋亡因子表达增高,抑制凋亡因子表达下降[4],且头皮浅层存在明显炎症细胞浸润[5],而对炎症浸润与毛囊凋亡的相关性及斑秃早期毛囊凋亡部位尚不清。凋亡因子Annexin V是检测细胞早期凋亡的灵敏指标[6]。本研究通过免疫组化双染的方法对早期及中晚期斑秃皮损浅层和深层毛囊Annexin V的表达和淋巴细胞亚群的浸润情况进行检测,并对两者进行相关性分析,以了解早期斑秃淋巴细胞浸润部位及浸润程度,并探讨早期斑秃凋亡的始发部位及毛囊凋亡与炎症浸润的相关性。
1 研究对象及方法
1.1研究对象本研究纳入斑秃患者22例(早期斑秃11例,中晚期11例)。入选标准:经临床确诊的斑秃患者诊断标准参照赵辨《中国临床皮肤病学》;脱发部位无外伤;入选前2个月内未接受系统性糖皮质激素、免疫抑制剂及调节剂等治疗。排除标准:假性斑秃及其他瘢痕性脱发,真菌感染,梅毒性脱发、拔毛癖及其他因素引起的脱发患者。根据患者病程分为早期斑秃组(病程≤3个月,且轻拉发试验阳性)和中晚期斑秃组(病程>3个月,且轻拉发试验阴性)。正常对照10例,均来自本院外科及皮肤科头皮手术如皮肤色素痣或良性肿物切除术所取皮疹边缘正常组织。正常对照组无脱发表现,与斑秃患者的性别、年龄相匹配。
1.2实验方法取斑秃患者皮损活动性边缘组织及正常对照头皮,分别为横切部和纵切部,再将横切部置于解剖显微镜下,沿皮脂腺下缘层面离断为浅层及深层两部分,石蜡包埋后行免疫组织化学双染,分别为Annexin V与 CD3、CD4、CD8双染。
1.2.1免疫组化双染方法玻片经脱蜡,水化,抗原修复,消除内源性过氧化物酶活性,蛋白阻断后,加Annexin V一抗兔单克隆抗体(EPITMICS, No.3225-1,克隆号EPR3979,胞膜染色)100 μL,湿盒孵育TBS冲洗后,加生物素连接二抗100 μL(Alkaline phosphatase rabbit IgG VECTASTAIN ABC KIT(No. AK-5005)),湿盒孵育TBS冲洗后加Vecastain regent 100 μL ,湿盒孵育TBS冲洗后显色剂(VECTOR Nova RED Substrate Kit)显色5 min,显微镜下控制显色程度,显色合适时终止反应。再次蛋白阻断后,滴加一抗[鼠抗人CD3单抗(DAKO,No.M7254,克隆号F7.2.38)或鼠抗人CD4单抗(DAKO, No. M7310,克隆号4B12),或鼠抗人CD8单抗(DAKO, No. M7103,克隆号C8/144B]100 μL,湿盒孵育TBS冲洗后加生物素连接二抗100 μL(ELITE MOUSE IgG VECTASTAIN ABC KIT(No.PK-6102)),湿盒孵育TBS冲洗后加Alkaline phosphatase rabbit IgG VECTASTAIN ABC KIT(No. AK-5005)100 μL,湿盒孵育TBS冲洗后加显色剂(VECTOR Alkaline phosphatase Substrate Kit III)显色5 min,显微镜下控制显色程度,以水溶性封片剂封片。
1.2.2免疫组化计数方法细胞计数分别由两位实验者独立完成,计数每位患者病理片5个高倍镜视野(*400)并取其平均值。CD3,CD4,CD8 阳性细胞的判定为胞膜天蓝色染色;Annexin V阳性细胞判定为胞膜呈红色。
1.2.3统计学方法采用SPSS 13.0软件包进行统计分析。计量资料先用Kolmogorov-Smirnov法检验正态性,两个或多样本均数的比较采用单因素方差分析(One-way ANOVA)。计数资料的比较采用χ2检验(根据频数情况决定是否采用校正的χ2检验,Fisher精确概率法)。计量资料的相关性分析选用Pearson和Spearman检验。所有统计结果均采用双侧检验,P<0.05为有统计学意义。
2 研究结果
2.1早期和中晚期斑秃皮损CD3/CD4/CD8阳性T细胞的分布早期斑秃患者CD3+、CD4+、CD8+T细胞在浅层毛囊、深层毛囊及浅层血管周围皆有中到大量浸润(图1a、b、c、d),而中晚期斑秃T细胞的浸润主要集中在毛囊深层。
与正常对照组相比,早期斑秃患者在浅层血管、浅层毛囊和深层毛囊周围T细胞的浸润明显增多(P<0.05),而中晚期斑秃患者深层毛囊周围T细胞浸润显著增多,但浅层血管和毛囊周围T细胞浸润与正常对照组无显著差异(图2a、b、c)。早期斑秃患者浅层血管和毛囊周围T细胞浸润较中晚期显著增高(P<0.05),而在深层毛囊周围早、中及晚期斑秃患者T细胞的浸润差异无统计学意义。
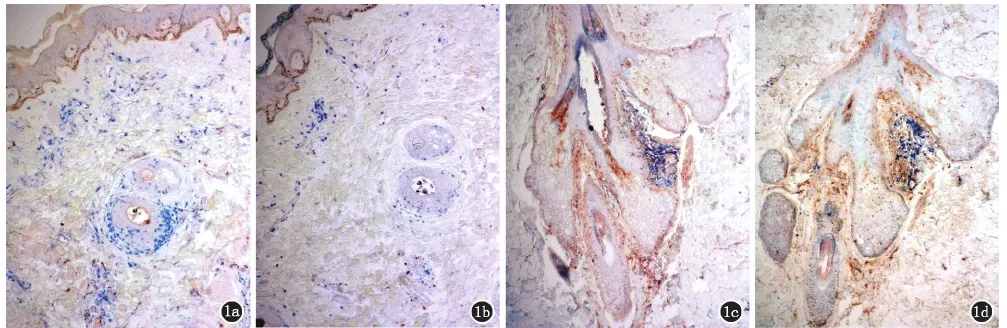
1a.横切面早期活动期斑秃浅层毛囊周围及内部,浅层血管CD4+T细胞;1b. CD8+T细胞浸润;1c.纵切面早期活动期斑秃浅层皮脂腺层面毛囊周围CD4+T细胞;1d.CD8+T细胞浸润
图1早期斑秃患者浅层永久毛囊周围T细胞浸润(蓝色为CD4,CD8阳性细胞,AP染色,×100;棕红色为Annexin V阳性细胞,HRP染色,×100)
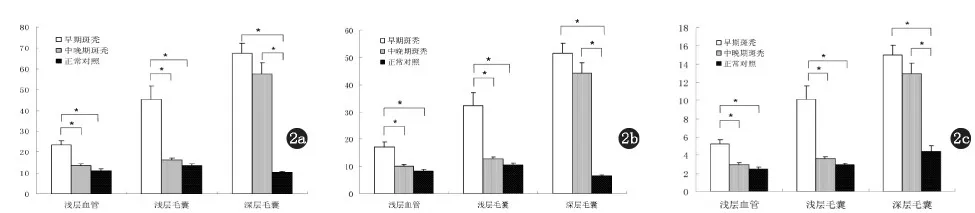
2a:CD3+T细胞;2b:CD4+T细胞;2c:CD8+T细胞
2.2早期和中晚期斑秃皮损Annexin V阳性细胞的分布在早期斑秃浅层毛囊可见上皮部分细胞表达Annexin V阳性,但毛囊内部鲜见阳性细胞(图3a)。中晚期斑秃浅层毛囊鲜见Annexin V阳性细胞(图3b)。早期斑秃生长期毛囊深层可见毛囊周围结缔组织散在少量Annexin V阳性细胞。而早期退行期毛囊深层可见毛乳头周围的毛基质细胞Annexin V表达阳性,随着毛囊的退行,Annexin V阳性细胞逐渐增多,内毛根鞘和外毛根鞘先后可见Annexin V表达,且阳性细胞逐渐向上蔓延至毛囊远端的峡部和膨大部,至退行期中晚期的毛囊索条Annexin V阳性细胞较为密集。
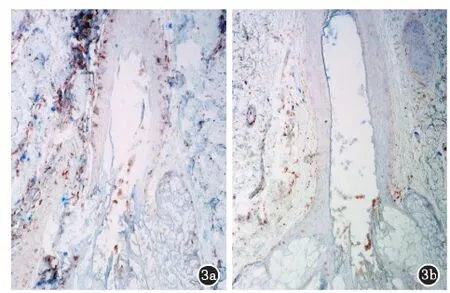
3a:早期斑秃浅层毛囊上皮Annexin V表达较为密集;3b:中晚期斑秃浅层毛囊上皮鲜见Annexin V阳性细胞
图3斑秃浅层毛囊Annexin V表达(棕红色为阳性细胞,HRP,×100)
早期斑秃Annexin V阳性细胞在浅层血管和毛囊周围显著高于中晚期斑秃,而在深层毛囊周围显著低于中晚期斑秃(P<0.05)。早期和中晚期斑秃Annexin V阳性细胞数量在浅层血管、浅层毛囊和深层毛囊周围皆显著高于正常对照组(P<0.05),差异有统计学意义(图4)。
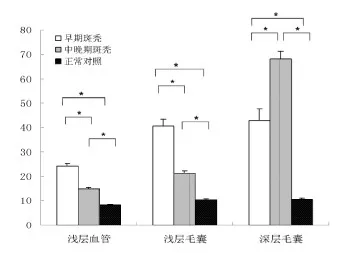
图4 早期、中晚期斑秃和正常对照
2.3早期和中晚期斑秃毛囊周围T细胞和Annexin V阳性细胞的分布相关关系早期斑秃深层毛囊周围CD4、CD8阳性T细胞浸润与Annexin V阳性细胞数量呈显著正相关性,而浅层毛囊周围两者无明显相关性。中晚期斑秃而浅层毛囊与深层毛囊周围CD4、CD8阳性T细胞浸润程度和Annexin V阳性细胞数量无明显正相关(表1)。

表1 T细胞浸润和Annexin V阳性细胞在浅、深层毛囊的相关性
注:*P<0.05
3 讨论
斑秃毛发脱落主要分为两个阶段:免疫细胞浸润和毛囊异常的快速退行性变[7]。早期斑秃,即在斑秃的急性期,组织病理主要表现为炎症细胞浸润[8];而在中晚期斑秃,皮损炎症浸润可不明显,病理改变主要集中在毛囊周期的改变,退行期及休止期毛囊明显增多,以及毛囊微小化[5,9]。
本研究以皮脂腺为水平,将头皮分为两层,浅层包括表皮及真皮浅层的永久毛囊,深层包括真皮深层及脂肪层的周期性毛囊[10]。Whiting[11]指出斑秃患者皮损处受累毛囊深部毛球周围的纤维化不显著,而其在浅部毛囊区域的纤维化比较明显。该种纤维化可能与局部的炎症细胞活性关系密切,但既往病理研究对浅层毛囊和血管炎症在斑秃发病中的作用尚未深入探索。本研究发现,早期斑秃患者浅层血管和毛囊周围可见中量到大量T细胞浸润,显著高于正常对照;浅层毛囊部分上皮细胞表达Annexin V,但毛囊内部鲜见阳性细胞,推测在早期斑秃发病过程中浅层永久毛囊虽受炎症破坏,但并不严重。随着病程的发展,中晚期斑秃患者皮损处浅层血管和毛囊周围淋巴细胞浸润减少,与正常对照持平,毛囊Annexin V阳性细胞较少,表明在斑秃中晚期,炎症细胞浸润较少,浅层永久毛囊极少遭受破坏。
在早期斑秃深层毛囊周围T细胞浸润显著高于正常对照,但低于中晚期斑秃,且与Annexin V阳性细胞数量呈显著正相关性,而在浅层毛囊无明显相关。说明早期斑秃在浅层毛囊虽明显炎症浸润,但其凋亡和T细胞浸润关系不大,而深层毛囊周围炎症细胞浸润是导致其凋亡的主要原因。中晚期斑秃毛囊深层T细胞浸润与Annexin V阳性细胞数量无明显相关性,推测是由于中晚期毛囊已经凋亡,而T细胞逐渐消散或凋亡所致。
上述发现表明,浅层血管和毛囊周围T细胞浸润同深层毛球部浸润同样参与早期斑秃病理进程和毛囊凋亡过程。早期斑秃的免疫进程包括毛囊免疫豁免的丧失以及对抗原的异常提呈[1],尽管两者机制有所不同,但正常人群的浅层和深层毛囊均被认为是毛囊免疫豁免部位[12]。之前我们研究曾发现,早期斑秃浅层Th1型细胞因子升高,生长期毛囊促凋亡基因caspase3、p53、Fas mRNA表达水平增高[4],因此推测浅层毛囊和血管周围T细胞浸润,细胞因子的分泌可能对毛囊周期造成影响,免疫豁免丧失,引发生长期毛囊快速退行性变,周期性毛囊凋亡。
综上所述,本研究推测早期斑秃疾病刚发生发展时浅层毛囊有轻度破坏凋亡,但并不严重,且其凋亡和T细胞浸润关系不大。与之相比,早期斑秃深层毛囊周围T细胞浸润是导致其凋亡的主要原因。在斑秃中晚期,炎症细胞浸润较少,浅层永久毛囊极少遭受破坏。
[1] Gilhar A. Collapse of immune privilege in alopecia areata: coincidental or substantial?[J]. J Invest Dermatol,2010,130(11):2535-2537.
[2] Zhang X, Zhao Y, Ye Y, et al. Lesional infiltration of mast cells, Langerhans cells, T cells and local cytokine profiles in alopecia areata[J]. Arch Dermatol Res,2015,307(4):319-331.
[3] Estefan J, Ribeiro M, Abad E, et al. Alopecia areata-Part II: diagnosis and pathology[J]. Skinmed,2015,13(2):121-126.
[4] 蔡泽明,赵莹,张斌,等.早期斑秃皮损处炎症细胞因子及凋亡因子的异常表达[J].中华皮肤科杂志,2015,48(2):128-131.
[5] 张小婷,赵莹,张斌,等.斑秃皮损的炎症浸润和毛囊周期改变特征[J].广东医学,2013,34(6):867-871.
[6] Aubry JP, Blaecke A, Lecoanet-Henchoz S, et al. Annexin V used for measuring apoptosis in the early events of cellular cytotoxicity[J]. Cytometry,1999,37(3):197-204.
[7] Guo H, Cheng Y, Shapiro J, et al. The role of lymphocytes in the development and treatment of alopecia areata[J]. Expert Rev Clin Immunol,2015,11(12):1335-1351.
[8] Dy LC, Whiting DA. Histopathology of alopecia areata, acute and chronic: Why is it important to the clinician?[J]. Dermatol Ther,2011,24(3):369-374.
[9] 赵莹,巩毓刚,张斌,等.斑秃患者的临床特征-附524例临床、皮肤镜及病理特点[J].中国麻风皮肤病杂志,2011,27(1):751-754.
[10] Shimomura Y, Christiano AM. Biology and genetics of hair[J]. Annu Rev Genomics Hum Genet,2010,11(1):109-132.
[11] Whiting DA. Histopathologic features of alopecia areata: a new look[J]. Arch Dermatol,2003,139(12):1555-1559.
[12] Paus R, Bertolini M. The role of hair follicle immune privilege collapse in alopecia areata: status and perspectives[J]. J Investig Dermatol Symp Proc,2013,16(1):S25-27.
(收稿:2016-01-30修回:2016-03-29)
·论著·
基金项目:自治区卫生厅青年科技人才专项科研项目(编号:2014Y07)
作者单位:新疆维吾尔自治区人民医院,乌鲁木齐,830001
通信作者:吴秀娟,E-mail: wxj7795@163.com
反射式共聚焦扫描显微镜在日光性角化病诊断中的应用
吴秀娟向芳赵宗峰邹云敏普雄明
[摘要]目的:明确反射式共聚焦扫描显微镜(RCM)下日光性角化病的形态学特征及在诊断日光性角化病中的应用价值。方法:对136例日光性角化病患者进行RCM技术扫描并与常规组织病理进行比较分析。结果:136例患者RCM成像特征为棘细胞层排列紊乱及角质形成细胞异型性,与日光性角化病组织病理改变一致,符合率100%。结论:日光性角化病在RCM下具有典型特征,可作为无创诊断日光性角化病的重要依据。
[关键词]共聚焦扫描显微镜;日光性角化病
[Abstract]Objective: To determine the image features of actinic keratosis (AK) under reflectance confocal microscopy (RCM) and the application value in the diagnosis of AK. Methods: The lesions of 136 patients who were clinically suspected AK were examined with RCM and the results were compared with biopsy. Results: The characteristics of AK under RCM were disorganization of stratum spinosum and atypical keratinocytes, which were accordance with the feature of histopathology of AK. The agreement rate was 100%. Conclusion: The characteristics of AK under RCM is typical and can be used as a tool in the diagnosis of AK.
[Key words]reflectance confocal microscopy; actinic keratosis
日光性角化病是最常见的皮肤肿瘤,长期暴晒、I-III型皮肤、PUVA治疗、砷暴露和慢性皮肤炎症均为重要的易感因素。临床表现为红斑、角化性丘疹或斑块,好发于日光暴露部位,如面部、前额、手、下肢等。几十年来,日光性角化病一直被认为是一种癌前病变,与浸润性鳞状细胞癌有着相似的细胞、组织病理及分子机制,因此,目前把日光性角化病定位为皮肤原位癌[1,2]。日光性角化病,病变局限在表皮,一般不会发生转移,但在10年内仍有10%~20%的日光性角化病皮损进展为鳞状细胞癌[3]。然而,在日光性角化病皮损周围看似100%正常皮肤部位经组织病理学证实也具有日光性角化病的病理改变[4],因此提出区域癌化这一概念,表明在整个非典型角质细胞区域均有肿瘤形成,而不仅是在皮损区域有瘤细胞形成[5]。通常日光性角化病的诊断需要依靠临床和组织病理学,需要进行有创性的皮损活组织检查,因此,对于日光性角化病的诊断和管理皮肤病理检查不是一个可行性方法,而对于区域癌化这部分病变,皮损活组织检查更加不现实,所以可行重复性无创诊断方法。
反射式共聚焦扫描显微镜(Reflectance confocal microscopy, RCM)已被用来评估非黑素瘤等皮肤肿瘤的组织病理学特征,日光性角化病是最有希望进行实时诊断的疾病[6]。RCM是近年来一种新兴的飞速发展的非侵入性三维计算机断层成像技术,具有原位、实时、动态等特点,可以保证在细胞生理状态下进行无创诊断。RCM一直被用来实时诊断非黑素瘤皮肤癌,尤其是基底细胞癌的非侵入性诊断[7,8]。但是,日光性角化病的RCM评估还只是在初步研究阶段[9]。本研究利用RCM技术对136例日光性角化病患者的图像特征进行归纳总结并与常规组织病理进行比较分析,探讨RCM在诊断日光性角化病中的应用价值。
1 资料与方法
1.1临床资料136例患者均为2012年1月至2015年1月在新疆维吾尔自治区人民医院皮肤性病科门诊就诊的患者,136例患者中男38例,女98例(男∶女=1∶2.58),平均年龄(62.21±13.44)岁,病程4~35个月,平均(20.13±4.80)个月,皮损发生在面颊部75例,鼻背23例,额部8例,颞部25例,上肢2例,头皮2例,眼睑1例。所有患者单发者有83例,多发者有53例。表现为淡褐色或红色圆形、不规则形角化性丘疹或斑片,直径0.5~2 cm,境界比较清楚,表面附着黏着性鳞屑,伴有角化过度或呈疣状增生,周围有红晕(图1)。
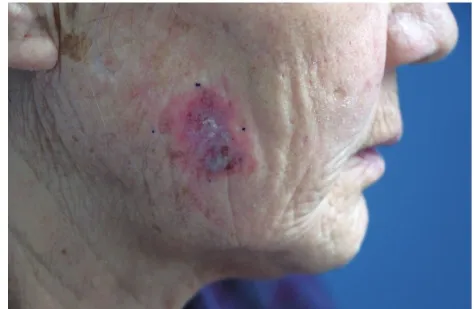
图1 右面颊淡红色斑疹,表面少许结痂
1.2方法
1.2.1仪器反射式共聚焦激光扫描显微镜(Vivascope1500美国Lucid公司),上海康奥中国有限公司。
1.2.2研究方法对所有接受检查的患者告知检查方法及目的,选取患处皮损,用蒸馏水浸润皮损处,以医用超声耦合剂为介质,行RCM扫描。然后,该皮损行皮肤活检进行常规组织病理检查。
2 结果
2.1组织病理结果136例患者均经组织病理学检查明确诊断日光性角化病,日光性角化病组织病理特征:角化过度和角化不全交替,表皮呈芽蕾向下增生,棘细胞排列紊乱,表皮下部有不典型角质形成细胞,细胞核大、多形性、深染,真皮浅层有明显的日光弹性纤维变性,并可见程度不同的淋巴细胞浸润(图2)。
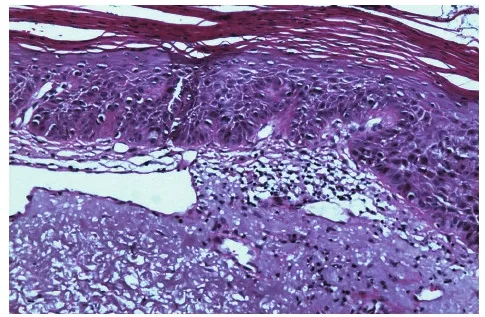
图2 角化过度、角化不全,表皮细胞排列紊乱,表皮中下部细胞明显异型性(HE,×100 )
2.2RCM图像特点日光性角化病RCM图像分析结果显示:120例患者伴有角化过度,126例患者伴有灶状角化不全,所有患者皮损部位均可见表皮角质形成细胞排列紊乱,失去正常的蜂窝状结构,角质形成细胞大小和形态呈非典型性,为异型的角质形成细胞,异型的角质形成细胞表现为边缘较高折光的靶形细胞,呈非典型蜂窝状模式(图3a),102例患者在真皮网状层上部可见日光弹力组织变性,表现为明亮的束状无定型物质,128例在皮损区真皮浅层有单一核细胞及少许噬黑素细胞浸润(图3b),103例在皮损区可观察到血管明显扭曲扩张(图3c)。
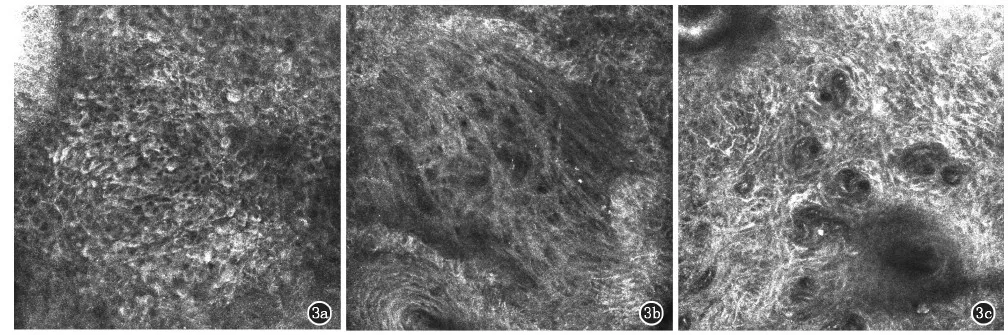
3a:表皮细胞排列紊乱及异型角质形成细胞,异型角质形成细胞表现为边缘较高折光的靶形细胞(0.5 mm×0.5 mm);3b:皮损区可见以单一核细胞为主的炎症细胞浸润(0.5 mm×0.5 mm);3c:皮损区可见血管明显扭曲扩张(0.5 mm×0.5 mm)
图3日光性角化病RCM图像
2.3RCM诊断符合率依据Aghassi等[9]的诊断标准,本研究136例患者经RCM检查诊断日光性角化病136例,经组织病理学证实均为日光性角化病,可见RCM诊断日光性角化病的符合率为100%。
3 讨论
日光性角化病(Actinic Keratosis, AK)又称为光线性角化病,是临床上最常见的原位皮肤癌[10],临床表现为多发性红色或黄棕色干燥、鳞屑性损害,发生于老年人,特别发生于易晒伤而不易晒黑者,面部、颈部、手背及前臂最常受累,有0.1%~10%的日光性角化病发展成侵袭性鳞状细胞癌。白种人中,澳大利亚地区发病率最高,男约55%,女约37%,发病年龄30~70岁。美国发病率次之,约为11%~26%。欧洲最少,发病率约6%~15%[11-13]。诊断日光性角化病除外依靠典型的临床表现之外,常规组织病理学评估仍是金标准。但对于每个皮损均采用活组织检查费用昂贵、耗时,而且还有手术疤痕形成。
越来越高的非黑素瘤皮肤癌发病率促进了光学技术的革新,促进了这些皮损的非侵袭形态学特征。RCM已经在体内非侵袭的描述非黑素瘤皮肤癌。Aghassi等[9-14]于2000年已经发表了日光性角化病的RCM评估标准,即71%的皮损有角化过度,100%表皮下部核增大和核异型性,57%的皮损表皮结构紊乱。但是RCM的穿透深度在一定程度上限制了日光性角化病的诊断,尤其对于肥厚型和角化过度型皮损。对于活组织检查来说,RCM逐渐变为可选择的方式,由于将来光学穿透深度的技术发展或者简单的去除角质层,其限制性也会被克服。
本研究的目的是评估RCM在日光性角化病诊断中的应用以及优化RCM评判日光性角化病参数。共有136例患者均经组织病理学检查明确诊断日光性角化病,每个患者的皮损均行RCM检查,总结上述患者RCM特点有:①角化过度或角化不全;②表皮角质形成细胞排列紊乱,异型的角质形成细胞表现为边缘较高折光的靶形细胞,呈非典型蜂窝状模式;③真皮网状层上部可见明亮的束状无定型物质,为日光弹力组织变性;④真皮浅层有单一核细胞及少许噬黑素细胞浸润,局部见血管明显扭曲扩张。其中,棘细胞层排列紊乱及细胞异型性是RCM诊断日光性角化病最特异性指征,这与Ulrich等[15]的结论一致,并且炎症细胞浸润和外渗不是诊断日光性角化病的敏感参数,因为这些特征不能总是在RCM检查时观察到。另外,日光性角化病和早期鳞状细胞癌、鲍温病如何通过RCM图像进行鉴别,尚需进一步研究。除了RCM能无创诊断日光性角化病外,还可以用来监测外用5%氟尿嘧啶治疗日光性角化病的效果[16]。
总之,本研究利用RCM技术对日光性角化病皮损进行扫描,观察认为棘细胞层排列紊乱及细胞异型性是RCM诊断日光性角化病具有高度的敏感性和特异性,为日光性角化病的RCM诊断提供了经验。
参考文献
[1] Heaphy MR, Ackerman AB. The nature of actinic keratosis: a critical review in a historical perspective[J]. J Am Acad Dermatol,2000,43:138-150.
[2] Ackerman AB. Solar keratosis squamous cell carcinoma in situ[J]. J Am Acad Dermatol,2003,139:1216-1217.
[3] Dodson JM, DeSpain J, Hewett JE, et al. Malignant transformation of actinic keratoses and the controversy over treatment: a patient-oriented perspective[J]. Arch Dermatol,1991,127:1029-1031.
[4] Guenther ST, Hurwitz RM, Buckel LJ, et al. Cutaneous squamous cell carcinomas consistently show histologic evidence of in situ changes: a clinicopathologic correlation[J]. J Am Acad Dermatol,1999,41:443-448.
[5] Braakhuis BJ, Tabor MP, Kummer JA, et al. A genetic explanation of Slaughter's concept of field cancerization: evidence and clinical implications[J]. Cancer Res,2003,63:1727-1730.
[6] Wurm EM, Curchin CE, Lambie D, et al. Confocal features of equivocal facial lesions on severely sun-damaged skin: four case studies with dermatoscopic, confocal, and histopathologic correlation[J]. J Am Acad Dermatol,2012,66(3):463-473.
[7] Nori S, Rius-Diaz F, Cuevas J, et al. Sensitivity and specificity of reflectance mode confocal microscopy for in-vivo diagnosis of basal cell carcinoma: a multicenter study[J]. J Am Acad Dermatol,2004,51:923-930.
[8] Torres A, Niemeyer A, Berkes B, et al. 5% imiquimod cream and reflectance-mode confocal microscopy as adjunct modalities to Mohs' micrographic surgery for treatment of basal cell carcinoma[J]. Dermatol Surg,2004,30:1462-1469.
[9] Aghassi D, Anderson RR, Gonzalez S. Confocal laser microscopic imaging of actinic keratoses in vivo: a preliminary report[J]. J Am Acad Dermatol,2000,43:42-48.
[10] Stockfleth E, Kerl H. Guidelines for the management of actinic keratoses[J]. Eur J Dermatol,2006,16:599-606.
[11] Memon AA, Tomenson JA, Bothwell J, et al. Prevalence of solar damage and actinic keratosis in a Merseyside population[J]. Br J Dermatol,2000,142:1154-1159.
[12] Salasche SJ. Epidemiology of actinic keratoses and squamous cell carcinoma[J]. J Am Acad Dermatol,2000,42:S4-S7.
[13] Frost C, Williams G, Green A. High incidence and regression rates of solar keratoses in a Queensland Community[J]. J Invest Dermatol,2000,115:273-277.
[14] Rishpon A, Kim N, Scope A, et al. Reflectance confocal microscopy criteria for squamous cell carcinomas and actinic keratoses[J]. Arch Dermatol,2009,145(7):766-772.
[15] Ulrich M, Alarcon I, Malvehy J. In vivo reflectance confocal microscopy characterization of field-directed 5-fluorouracil 0.5%/salicylic acid 10% in actinic keratosis[J]. Dermatology,2015,230:193-198.
[16]Ishioka P, Maia M, Rodrigues SB. Evaluation of the therapeutic results of actinic keratosis treated with topical 5% fluorouracil by re fl ectance confocal laser microscopy: preliminary study[J]. An Bras Dermatol,2015,90(3):426-429.
(收稿:2015-10-13修回:2015-12-08)
Correlation between the apoptotic factor Annexin V and T lymphocytes infiltration in alopecia areata
ZHAOYing1,ZHANGXiaoting2,CAIZeming3,YEYanting4,ZHANGBin4,ZHANGXingqi4.
1.DepartmentofDermatology,HezeMunicipalHospital,Heze270000,China; 2.DepartmentofDermatology,theSecondAffiliatedHospitalofWenzhouMedicalUniversity,Wenzhou325000,China; 3.DepartmentofDermatology,theThirdAffiliatedHospitalofNanchangUniversity,Nanchang330008,China; 4.DepartmentofDermatology,theFirstAffiliatedHospitalofSunYat-senUniversity,Guangzhou510000,China
Correspondingauthor:ZHANGXingqi,E-mail:xingqi.zhang@aliyun.com
Objective: To detect the expression of apoptotic factors Annexin V and to determine the relationship between the expression of apoptotic factors Annexin V and the T lymphocyte infiltration in alopecia areata (AA). Methods: Immunohistochemical double-staining of CD3/CD4/CD8 and Annexin V was used to detect the expression of apoptotic factors Annexin V in the lesions of 22 patients with AA (11 patients at early stage and 11 at advanced stage) and normal scalp of 10 controls. Results: The number of Annexin V-positive cells around vessels and follicular in the superficial layer of the lesions in early stage was significantly higher than that in advanced stage. However, the number in deep layer around follicular of the lesions was significantly lower than that in advanced stage (P<0.05). There was a positive correlation between the number of T lymphocyte and Annexin V positive cells in deep layer and there was no significant correlation in superficial layer. Conclusion: The apoptosis of permanent hair follicle cells in superficial layer was uncorrelated with T lymphocyte infiltration and the T cell infiltration was the main cause of the apoptosis of cyclical hair follicle cells in deep layer.
alopecia areata; apoptotic factors; T lymphocyte
Application of the reflectance confocal microscopy in the diagnose of actinic keratosis
WUXiujuan,XIANGFang,ZHAOZongfeng,ZOUYunmin,PUXiongming.
People'sHospitalofXinjiangUygurAutonomousRegion,Urumqi830001,China
Correspondingauthor:WUXiujuan,E-mail:wxj7795@163.com
山东省医药卫生科技发展计划项目(编号:2013WS0100)
1菏泽市立医院皮肤科,山东菏泽,270000
2温州医科大学附属第二医院皮肤科,浙江温州,325000
章星琪,E-mail: xingqi.zhang@aliyun.com
3南昌大学第三附属医院皮肤科,江西南昌,330008
4中山大学附属第一医院 皮肤科,广州,510000
