LuxS/AI-2型群体感应系统调控细菌生物被膜形成研究进展
2016-11-09武瑞赟李平兰
刘 蕾,桂 萌,武瑞赟,3,李平兰,*
(1.中国农业大学食品科学与营养工程学院,北京食品营养与人类健康高精尖创新中心,北京 100083;2.北京市水产科学研究所,北京 100068;3.内蒙古大学生命科学学院,内蒙古 呼和浩特 010021)
LuxS/AI-2型群体感应系统调控细菌生物被膜形成研究进展
刘蕾1,桂萌2,武瑞赟1,3,李平兰1,*
(1.中国农业大学食品科学与营养工程学院,北京食品营养与人类健康高精尖创新中心,北京 100083;2.北京市水产科学研究所,北京 100068;3.内蒙古大学生命科学学院,内蒙古 呼和浩特 010021)
生物被膜是大多数细菌在自然状态下的一种生长方式,使菌体具有浮游态时不具有的优势。它的形成和发展受到群体感应系统的调控,该系统是细菌依赖于群体密度而调控其生理行为的一种机制。其中LuxS/2型自诱导物(autoinducer 2,AI-2)群体感应系统又称种间群体感应系统,广泛存在于G+及G-菌中。其信号分子AI-2被认为是种间通用的信号分子,参与调控多种细菌的生物被膜。此外,目前已发现多种LuxS/AI-2型群体感应系统抑制剂,它们可以影响许多细菌生物被膜的形成。目前研究人员已开始致力于揭示LuxS/AI-2型群体感应系统调控生物被膜形成的分子机制,这对于进一步理解LuxS/AI-2型群体感应系统与生物被膜的关系具有重要意义。
生物被膜;LuxS/AI-2型群体感应系统;2型自诱导物;群体感应抑制剂;调控机制
LIU Lei, GUI Meng, WU Ruiyun, et al. Progress in research on biofilm formation regulated by LuxS/AI-2 quorum sensing[J]. Food Science, 2016, 37(19): 254-262. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201619043. http://www.spkx.net.cn
生物被膜是大多数细菌在自然状态下的一种生长方式。除海洋细菌外,绝大多数细菌都生存在非纯流体悬浮环境中,它们都会附着在生物或非生物表面,形成生物被膜。研究发现,生物被膜不是细菌个体的简单堆积,而是由细菌菌体及胞外分泌物如多糖、纤维蛋白、脂蛋白等相互作用而形成的具有复杂结构的膜样物质。多数细菌在自然环境中之所以选择以生物被膜状态生存,主要是由于无论单菌种生物被膜,还是多菌种复杂生物被膜均具有浮游状态时不可比拟的优势,且被膜态的细菌可启动一系列基因的表达来协调其群体性行为[1]。
1 生物被膜研究现状
1.1生物被膜的形成过程
目前的研究已经证实,细菌生物被膜的形成需经历5个阶段:1)细菌细胞对表面基质的初始附着;2)附着的细菌分泌胞外多聚物从而促进细菌对表面基质进行不可逆附着;3)生物被膜结构形态的初步形成和发展;4)生物被膜结构形态的成熟;5)生物被膜中个体细胞的脱落。而脱落的个体细胞可以再次附着,并形成一个新的生物被膜。通过这5个阶段,细菌生物被膜完成了附着、形成、成熟、老化脱落、再重新附着的循环过程[2]。
在最初的阶段,附着在表面基质的细菌个体细胞被其分泌的胞外多聚物包裹,开启了生物被膜的形成,其中许多细菌还可以通过菌毛的运动来自由地移动。这些初始附着的细菌还没有开始进行生物被膜形成过程中的分化阶段,因此很多细菌还可以离开基质表面重新回到之前的浮游状态。之后细菌开始启动一系列基因的表达,分泌胞外多糖等物质,使得细菌不可逆地黏附到基质表面。
1.2生物被膜发挥生理功能的群体行为
自然状态下的多数细菌以生物被膜状态生存,主要是由于被膜态细菌具有浮游态时不具有的优势,且被膜态的细菌可启动一系列基因的表达来协调其群体性行为[1]。
首先,形成生物被膜的细菌在生理功能上像一个整体发挥作用。Cheng等[3]研究发现,在牛的瘤胃中,各种环境和细菌形成了一个独特的小生态系统,多种细菌共生并附着在纤维素等表面,形成一个复杂的多菌种生物被膜,共同协作对营养物质进行分解代谢。Kim等[4]研究证明,生物被膜中的细菌是通过信号分子的交流来实现其功能的。
其次,生物被膜中的细菌在行为表现上像一个整体共同协调作用。Sun Hong等[5]研究发现,在营养物质充足的条件下,细菌常常滑动至营养物质浓度高的地区;而在干燥或营养物质匮乏的条件下,个体细胞则分化成包囊,使整个生物被膜形成更为复杂的结构。当然,生物被膜高度的结构化也为其中的细菌个体提供了有利的生存环境。位于生物被膜不同位置的细菌个体接触不同的微环境时,其生长状态不同,但高度的结构化能够让不同位置的细菌都接触到营养物质,进而采取与所处微环境相适宜的方式生存,最终从整体上保障整个细菌群体的生存[2]。
1.3乳酸菌生物被膜研究现状
关于益生乳酸菌生物被膜的研究还相对匮乏。Lebeer等[6]对L. rhamnosus的生物被膜形成能力与影响因素做了相关研究,发现被膜的形成受到培养基及胃肠道环境等多种因素的影响。Brink等[7]研究报道,影响益生菌生物被膜形成的因素众多,除去自身基因调控的因素外,外界环境的很多因素都会明显干扰益生菌生物被膜的形成与发展,如培养基中营养物质的缺乏及限制性碳源的供给均会促进其生物被膜的形成,生物被膜态比悬液培养时对低pH值更为敏感等。有研究人员对比了不同流速下L. rhamnosus生物被膜的形成能力,发现在低流速下生物被膜更易形成,而高流速时几乎无法形成,并推断这是由于在低流速的环境下胞外多聚物的含量更高导致的。同时研究发现,将被膜态的L. rhamnosus制成微制剂,不仅能更好地控制其释放,还可增强其耐热耐酸等性能,如将形成高密度生物被膜的益生菌包裹在壳聚糖包被的藻酸盐制备的微胶囊中,可显著提高其抗冷冻干燥的能力和耐热性。Cheow等[8]的研究显示,生物被膜态的益生菌与浮游态下相比具有更显著的免疫调节作用。由此可见,生物被膜的形成是乳酸菌在环境胁迫中发挥生理功能的重要基础。被膜态乳酸菌通过其生理和行为上的共同调节,表现出了其浮游态不具备的优势。
1.4调控生物被膜的四大机制
1.4.1双组分系统(two components system,TCS)
TCS包括两种蛋白:组氨酸激酶蛋白(histidine protein kinase,HPK),即“受体”,和其偶联蛋白即“调控子”(response regulator,RR)。一旦识别外界刺激,HPK被激活,同时保守的组氨酸残基发生自磷酸化。随后该磷酸基团转移到其耦合RR保守的天冬氨酸残基上。磷酸化导致RR被激活,它是最常见的调控因子。例如,P. aeruginosa中控制生物被膜形成的最主要的信号转导机制之一就是GacS(HPK)/GacA(RR)双组份系统。一旦被信号激活,GacS(HPK)/GacA(RR)双组份系统便激活rsm基因的转录。rsm基因编码两个非编码的小RNA(sRNA),即RsmY和RsmZ,它们的表达水平与控制浮游状态和生物被膜状态间的转换密切相关。高表达量的rsmY和rsmZ促进生物被膜的形成,低表达量时与生物被膜损伤有关。Gac调控通路与另外两个HPK也有关联,即RetS和LadS。尽管RetS被证明与GacS相互拮抗,抑制生物被膜所需基因的表达,但是LadS可以加固GacS依赖型生物被膜所需基因的激活作用。与此同时,Gac系统激活对糖肽类和氯霉素抗生素耐药性。在许多细菌中TCS系统都参与调控生物被膜的形成[9]。
1.4.2胞外质膜功能信号通路
细菌中常用的也是可能被低估的信号转导机制是胞外质膜功能信号通路,包括可转化的Sigma因子,一个Anti-sigma因子,其优先存在于细胞质膜,隔绝和抑制其同源的Sigma因子和其他可激活该信号通路的胞周质及胞外蛋白。周质和胞外蛋白识别胞外信号,Anti-sigma因子降解导致释放Sigma因子,从而促进一系列靶基因的转录。在P. aeruginosa中,AlgU ECF Sigma因子控制胞外多聚物藻酸盐的产生,藻酸盐可以影响生物被膜的结构。AlgU Sigma因子与Anti-sigma因子MucA共同发挥功能,对未知信号产生应答,其C端区域被AlgW蛋白酶切割[10]。
1.4.3胞内信使环二鸟苷酸(cyclic diguanylate,c-di-GMP)
信号转导分子是胞内二级信使c-di-GMP。该信使的量被严格控制,当二鸟苷酸环化酶(diguanylate cyclase,DGC)结合GGDEF区域时分泌量增多,当磷酸二酯酶(phosphodiesterases,PDEs)结合EAL区域时分泌量减少。在细菌中,高c-di-GMP水平一般与生物被膜形成有关,这主要是通过产生表面黏附胞器,启动胞外多聚物(extracellular polymeric substances,EPS)合成以及降低运动性[11-13]。
1.4.4群体感应系统
细菌通过群体感应(quorum sensing,QS)系统来调控与生物被膜形成相关基因的表达。监测信号分子的阈值可能是通过组氨酸蛋白激酶,或者是信号分子主动或被动地进入细胞,结合到调控蛋白,从而激活了特定基因的表达。在S. aureus中,浮游态与被膜状态的转变主要是受QS系统的调控[14]。S. aureus的QS系统由agr操纵子调控,agrD负责编码信号分子。信号分子一经产生、输出并达到阈值,agrD编码的信号分子便通过双组分转导系统AgrCA控制非编码的小RNA—RNAIII的表达,而RNAIII下调负责编码黏附素基因的表达。因此它促进了菌体的分散及胞外蛋白酶的活性,负调控菌体数量、生物被膜的形成以及对糖肽类抗生素的耐受性[15]。尽管agr操纵子的功能与糖肽类抗生素耐药性之间的关系还存在争议,但是大多数糖肽类耐受型的金黄色葡萄球菌都是agr缺陷型的。本文将重点介绍LuxS/AI-2 QS系统调控细菌生物被膜形成的研究现状。
2 LuxS/AI-2 QS系统调控的生物被膜的研究现状
近几年来的研究发现,在生物被膜的逐渐形成和发展过程中,QS系统和双组份调控系统发挥了重要的调控作用[16-17]。其中AI-2信号分子介导的LuxS/AI-2 QS系统因其广泛存在于G+和G-菌中而受到越来越多的关注。
2.1QS系统介绍
QS系统是细菌依赖于群体密度而调控其生理行为的一种机制。随着细菌的分裂生长,细菌的密度增加,同时在其生长的过程中,细菌会分泌化学信号分子,伴随群体密度的增加,胞外信号分子的浓度也增加,细菌通过感知胞外信号分子的浓度而得知其群体的密度,当胞外信号分子浓度达到某一阈值时,细菌启动一系列基因的表达,从而调节其诸多行为,包括生物被膜形成、芽孢形成、生物发光、丛聚及毒力因子的表达等[18-22]。细菌利用这种信号反馈机制,使其行为呈现群体水平的一致性和协调性,像多细胞生物般共同协调作用。
QS系统常被分为革兰氏阴性菌QS系统、革兰氏阳性菌QS系统和种间QS系统。QS系统首先在海洋发光菌V. fischeri中发现,其被认为是大多数革兰氏阴性菌QS系统的代表。革兰氏阴性菌QS系统的特异性信号分子是N-酰基高丝氨酸内酯(N-acyl homoserine lactones,AHLs),在多种G-菌共生的环境下,每种细菌都能够识别自身所产生的信号分子,并将信号进行传递。G+菌利用修饰的寡肽(autoinducingpeptide,AIP)作为种内信号分子,绑定在细胞膜上的双组分组氨酸激酶为受体来进行信息的交流,通过磷酸化级联反应来进行信号的传递。乳酸菌首先在核糖体中合成AIP的前体肽,其在向外运输的过程中,经过一系列转录后修饰和加工,成为具有活性的AIP。AIP不能自由穿过细胞壁,通过要ATP结合盒式蛋白(ATP-binding cassette transporter,ABC)转运系统或其他膜通道蛋白作用运送至胞外,从而发挥作用。有文献报道称益生菌的这一QS系统参与细菌素的合成与释放[23]。
LuxS/AI-2QS又称种间QS系统,广泛存在于G+及G-菌中,甚至存在于真菌中。其信号分子AI-2被认为是种间通用的信号分子,在诸如肠道菌群等多菌种生态环境中发挥着重要的信号传递与交流作用,因此受到研究者的关注。一些欧洲国家如西班牙、挪威等已全面开展了这方面的研究工作,其中与生物被膜形成相关的QS系统成为研究的热点[24-26]。
2.2LuxS/AI-2 QS系统信号分子AI-2的合成途径及结构
AI-2是介导LuxS/AI-2 QS系统的通用信号分子,可参与微生物多种行为的信号传递与交流,其代谢生成途径见图1。
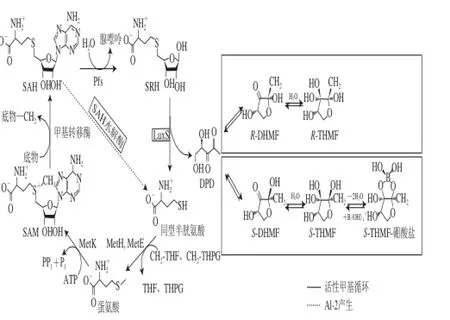
图1 LuxS/AI-2型QS系统信号分子AI-2生成代谢通路图[27]Fig.1 Production of signal molecule AI-2 of LuxS/AI-2 quorum sensing[27]
AI-2的前体物质是DPD,DPD是SAM代谢的副产物。SAM广泛存在于各种细菌、真菌及多细胞生物中,是主要的细胞甲基化供体,不同的物种具有不同的SAM代谢途径。SAM可将甲基基团转移给多种不同的底物,生成具有毒性的产物SAH,然后通过甲硫腺苷核苷酶(5’-methylthioadenosine nucleosidase,MTAN(Pfs))和LuxS两个蛋白依次将其转化为SRH和同型半胱氨酸(homocysteine,Hcy),同时生成AI-2的前体物质DPD[28]。DPD是一种高活性分子,它经过重排及一系列的附加反应生成不同的DPD衍生物,进而可作为信号分子即AI-2被不同的细菌识别[29]。本课题组曾体外克隆表达了禽致病性大肠杆菌的Pfs和LuxS蛋白,通过催化底物SAH体外合成了具有活性的AI-2信号分子,表明了体外生物合成AI-2的可能性[30]。此外,本课题组在早期研究中发现,禽致病性大肠杆菌的AI-2产生水平与luxS基因的转录水平具有高度相关性,而与pfs基因的转录水平没有显著相关性[31]。
AI-2作为通用信号分子,其结构引起了研究人员的关注。有研究报道称通过捕获活性分子及其特异受体的复合物,再对其进行晶体分析和结构解析,鉴别了两种不同的DPD衍生物,即来源于V. harveyi的S-THMF borate和R-THMF[32]。其中,V. harveyi的AI-2含有硼,硼的生物学功能尚不明确,其以高浓度存在于海洋环境中,可能因此硼在V. harveyi的AI-2中存在。在前体物质DPD中添加硼可以使V. harveyi的AI-2生成量大大超过S. typhimurium的AI-2,反过来,去除了硼的前体物DPD促进了S. typhimurium的AI-2信号分子的合成,同时导致了V. harveyi的AI-2信号分子的损失[32]。这些研究表明细菌利用一个保守的生化合成途径去合成化学性信号分子的中间物,而这些中间物的最终结构组分由特定环境的化学组成决定。此外,一些细菌可能拥有两种或更多的AI-2受体以识别不同的DPD衍生物,并根据不同的信号分子传递不同的信息来调节特定的行为。AI-2由SRH的核糖基团衍生而来,因此AI-2最有可能是结构与核糖类似的呋喃酮。呋喃酮具有作为理想信号分子的几个主要特点。首先,呋喃酮是广泛存在的分子,可以由SAM经LuxS催化生成,也可以来源于糖和氨基酸。其次,呋喃酮环上取代基团不同,可以是水溶性、脂溶性或挥发性的。最后,每种呋喃酮具有多种立体异构体,这对于信号分子的特异性识别至关重要[28]。
2.3AI-2信号分子的呈递与内化
AI-2信号分子随着细菌密度的增高而增多,但当其浓度达到一定阈值时,AI-2会发生内化作用。目前研究较为清楚的是弧菌、大肠杆菌和沙门氏菌的AI-2信号分子递呈及内化途径。
哈维氏弧菌和霍乱弧菌的AI-2信号分子被LuxP/LuxQ检测,引起磷酸化级联反应,从而调控众多基因的转录。LuxP是周质结合蛋白家族的成员之一,其结构与核糖体结合蛋白RbsB类似,它通过两个结构域夹紧其配体与其结合,图2为不结合/结合AI-2信号分子的LuxP三维结构模式图[33]。然而,LuxP的同系物仅在弧菌中发现。LuxP与膜内蛋白LuxQ形成一个混合的双组份感应激酶系统,由一个膜周质感应区域、细胞质组氨酸激酶和应答调节区域构成,发挥检测AI-2的功能。在低细胞密度时,LuxQ作为一种激酶,在组氨酸激酶域中交互磷酸化组氨酸残基。一系列磷酸转运反应最终引起LuxO的磷酸化。磷酸化的LuxO间接抑制激活剂LuxR的转录。在高细胞密度时,AI-2与LuxP绑定相互作用使得LuxQ从激酶转化为磷酸酶。LuxQ的去磷酸化引发了磷酸基团逆向传递级联反应,去阻遏LuxR。LuxR激活了编码荧光素酶lux操纵子的转录,引起发光[34]。
LuxS调控大肠杆菌和沙门氏菌ABC转运系统的表达,该ABC转运系统由lsr(LuxS regulated)操纵子编码,参与AI-2分子的呈递和内化。大肠杆菌和沙门氏菌AI-2的受体是LsrB受体,AI-2与LsrB结合并转运至细胞内,之后被LsrK磷酸化并LsrR相互作用,LsrR是一个SorC样的转录因子,抑制lsr操纵子的表达[26]。AI-2的内化可能发挥一下生理作用。首先,AI-2的内化可能用于终止QS级联反应;其次,AI-2内化是为了将AI-2传递至内部检测系统;最后,AI-2内化可以干扰其他竞争性菌种的AI-2 QS系统,如大肠杆菌内化沙门氏菌产生的AI-2被认为可能是一种抗AI-2的交流机制[35]。

图2 不结合(a)与结合(b)AI-2的LuxP三维晶体结构图[33]Fig.2 Three-dimensional crystal structures of apo-LuxP, without bound AI-2 (a) and holo-LuxP, with bound AI-2 (b)[33]
AI-2的产生与识别和内化没有直接的关系。本课题组曾研究发现,鸭疫里默氏杆菌缺乏luxS基因,自身不能合成AI-2信号分子,但可以识别呈递外源AI-2,且外源AI-2能够调控其生物被膜的形成[36]。
2.4luxS基因及AI-2信号分子对细菌生物被膜形成的作用
迄今为止,已发现包括大肠杆菌、沙门氏菌、金黄色葡萄球菌及链球菌等在内的许多细菌具有LuxS/AI-2 QS系统关键基因luxS。许多研究报道,luxS基因及其合成的信号分子AI-2在多种细菌的生物被膜形成过程扮演重要角色[37-39]。
Sun Zhongke等[40]研究发现,过表达B. longum NCC2705的luxS,其生物被膜形成能力上调约50%,显示luxS基因与其生物被膜形成相关。Lebeer等[41]也报道,luxS在L. reuteri100-23和L. rhamnosus GG中发挥着重要的生理代谢作用并影响生物被膜形成能力。此外,研究发现,外源添加信号分子AI-2可促进P. aeruginosa PAO1[42]、H. pylori[43]、S. epidermidis RP62A[44]等的生物被膜形成;低浓度AI-2可促进Streptococcus suis生物被膜的形成,而高浓度AI-2则抑制Streptococcus suis生物被膜的形成[45];外源添加AI-2可减弱S. aureus生物被膜的形成[46];也有研究发现Streptococcus sanguis的生物被膜形成与AI-2没有关系[47]。本课题组早期研究发现,适宜浓度的AI-2(0.185 mmol/L)可显著增强禽致病性大肠杆菌的生物被膜形成能力,且可以减弱其毒力基因(pfs、vat、luxS、tsh、fuyA和iucD)的转录水平和对鸡胚成纤维细胞DF-1的黏附和入侵能力[48]。对于自身缺乏AI-2合成能力的鸭疫里默氏杆菌,我们发现外源AI-2参与调控其对非洲绿猴肾细胞(Vero细胞)的黏附和入侵能力[49]。
2.5LuxS/AI-2 QS系统抑制剂对生物被膜形成的影响
QS系统对细菌群体性生理行为进行全局调控,这种调控通常发生在不同细菌群体的交界面或细菌-宿主相互作用的边缘处。在自然环境中,细菌竞争有限的资源,具有干扰群体感应能力的细菌要比依赖于群体感应的其他细菌具有优势[50]。因此,通过抑制群体感应从而开发新型抗菌疗法引起研究者的广泛关注。其中,研发群体感应抑制剂从而阻断群体感应是一个重要的研究方向。
AI-2合成包括两步主要的反应。首先是腺嘌呤从SAH经MTAN(pfs编码)作用产生SRH。接下来SRH经LuxS裂解形成DPD和Hcy。此外,MTAN也与AHL QS系统有关,LuxS和MTAN仅在细菌中发现,这使得它们可以作为很好的作用靶点。目前已经报道了一些LuxS和MTAN的抑制剂。S-脱氢核糖-L-同型半胱氨酸和S-同型核糖-L-半胱氨酸分别阻断LuxS合成的第一步和最后一步。在这些分子的基础上,Shen Gang等[51]合成一些更有效的LuxS抑制剂。可以抑制LuxS的肽类物质也在不断研发[52-53]。从Immucillin和DADMe-immucillin开始,一些在10-12和10-14级别的其他MTAN抑制剂(如BuTDADMeimmucillin-A和p-Cl-PhT-DADMe-immucillin-A)也被研发出来[54]。
DPD衍生物包括Ac2-DPD、烷基-DPD、碳酸-DPD、三氟-S-THMF-borate以及一些与DPD结构类似的物质,如Laurencione和4-羟基-5-甲基-3-(2H)-呋喃酮(4-hydroxy-5-methyl-3-(2H)-furanone,MHF)可以激活AI-2 QS系统,然而一些含有二醇的物质(包括焦榈酚),硼酸和砜可以作为AI-2-LuxP结合的潜在拮抗剂[55]。熊果酸、异丁基-DPD和苯基-DPD可以抑制E. coli和P. aeruginosa生物被膜的形成[56-57]。此外,4-羧酸甲酯-苯基硼酸和LMC-21会影响V. anguillarum和V. vulnificus生物被膜形成量而不影响菌体总数量[58]。
QS系统能够在信号转导级联反应这一水平被阻断。这类物质中研究最广泛的是天然呋喃酮复合物,(5Z)-4-溴-5-溴亚甲基-3-丁酰基-2(5H)-呋喃酮和肉桂醛。天然的呋喃酮或Fimbrolide首先分离自红藻D. pulchra,而肉桂醛来源于肉桂树的树皮。迄今为止不同的天然Fimbrolide类似物和一些合成的呋喃酮已被发现或合成。这些与酰基侧链和卤素取代物非常不同。此外,一些肉桂醛类似物也被报道过[59-60]。具有QS抑制效果的肉桂醛类似物的关键结构包含了α、β不饱和酰基基团,作为与疏水基团和部分负电荷连接的Michael接受者参与反应[61]。
呋喃酮和肉桂醛可以影响不同类型的QS系统。这些物质可以通过降低应答调节子LuxR的DNA结合能力从而抑制V. harveyi的AI-2 QS,LuxR位于信号转导级联反应的基础位置[59]。这些物质也可以阻断不同的AHL QS系统,可能是通过将AHL与其受体分开。此外,共价修饰的天然呋喃酮,失活的LuxS及加速LuxR的翻转可以分别阻断AI-2和AHL QS。
卤代呋喃酮可以影响P. aeruginosa、E. coli、B. subtilis、S. epidermidis、P. gingivalis、S. enterica serovar Typhimurium、Streptococcus spp.和Vibrio spp.生物被膜的形成[61-67]。肉桂醛可以影响B. cenocepacia、B. multivorans、P. aeruginosa、E. coli和Vibrio spp.生物被膜的形成[60,68-69]。虽然一些研究表明呋喃酮对生物被膜的QS具有抑制效果,但是这些物质的毒性限制了它们的使用。相反,肉桂醛作为风味添加剂被广泛地应用在食品和饮料上。
2.6LuxS/AI-2 QS系统参与调控细菌生物被膜形成的机制
关于LuxS/AI-2 QS系统如何调控生物被膜形成方面,目前的研究初步表明,LuxS/AI-2 QS系统主要参与调控了生物被膜形成的关键基因。
目前研究较为清楚的是V. cholerae中QS系统调控生物被膜的途径(图3)。V. cholerae通过Ⅰ型种特异性自诱导物(genus-specific autoinducer-1,CAI-1)和AI-2两类信号分子AIs来控制QS的目标基因。CAI-1属种内信号分子,是由CqsA产生的一个结构不明确的复合物,可通过其同源传感器激酶蛋白CqsS来检测。LuxS合成的种间信号分子AI-2,则可通过LuxPQ受体复合物进行检测。当菌体密度低AIs缺乏时,CqsS和LuxQ表现为激酶,通过磷酸转移蛋白LuxU将磷酸基团转移至相应的调节蛋白LuxO。LuxO~P复合物激活了编码4 种小RNA(small RNAs,sRNAs)的基因转录,这4 种sRNAs被命名为群体调控RNAs1-4(quorum regulatory RNAs1-4,Qrr1-4)。Qrr sRNAs与其sRNA伴侣蛋白Hfq和mRNA编码基因hapR碱基配对并使该mRNA不稳定,从而导致没有HapR蛋白产生。在这种条件下,受HapR抑制的基因启动表达,而受HapR激活的基因无法表达。当菌体密度高时,AIs与其同源性传感器结合,将传感器从激酶转换为磷酸酶,从而逆转了磷酸化级联反应。去磷酸化的LuxO是没有活性的,因此qrr基因的转录终止,HapR产生,HapR抑制型基因调控模式发生反转。QS系统控制的基因包括负责毒力因子表达基因和生物被膜形成的基因。重要的是迄今为止发现的每一个V. cholerae 的QS目标基因都需要HapR参与调控[70]。Xue Ting等[44]采用外源添加AI-2信号分子,证明AI-2可增强ica操纵子及编码生物被膜相关蛋白的基因bhp的转录,进而显著提高了S. epidermidis生物被膜的形成能力。而Henke等[71]研究发现,信号分子AI-2通过抑制V. harveyi Ⅲ型分泌系统基因的表达而影响其生物被膜的形成。S. pneumoniae的LuxS/AI-2 QS系统通过调控lytA基因的转录改变自溶素的表达从而影响细胞壁的降解和生物被膜的产生[72]。在A. pleuropneumoniae中还发现,LuxS/AI-2 QS系统与编码生物被膜PGA合成蛋白的基因pgaABC有关[73]。

图3 V. cholerae的QS系统调控途径[74]Fig.3 Regulation pathway of quorum sensing in V. cholera[74]
2.7细菌QS系统的保守与进化
QS系统对于细菌群体有利,细菌通过该系统协调群体生理行为。由此延伸的与进化有关的问题非常新颖且亟待解决:细菌细胞-细胞间的信号交流如何进化?细菌实现交流付出的代价?QS系统的可靠性如何保证?“偷听”是否发生及怎样发生?
类似于群居的昆虫,微生物中也存在着牺牲个体利益成全群体利益的行为。例如,土壤中的M. xanthus在营养物质缺乏的环境中产生耐受性芽孢,它可以非生长状态存活很久并散播到新的环境中[75-76]。芽孢的发展需要细胞群体中很大比例的成员进行致死性分化,从而形成可以促进芽孢生成并传播的结构。QS系统通过调控菌体的化学性交流控制了M. xanthus的致死性分化过程[77]。
QS系统存在着“间谍”行为或“偷听”机制。P. aeruginosa没有luxS基因,不能合成AI-2。但是,在囊性纤维变性的唾液样品中P. aeruginosa可以监测其他非致病菌产生的AI-2。在囊性纤维变性的肺中存在各种致病菌和非致病菌。P. aeruginosa通过监测外部环境中的S. enterica具有类似V. fi scheri LuxR的蛋白SdiA,它可以截取其他革兰氏阴性菌LuxI产生的AHLs。S. enterica对这些信号分子产生应答,表达rck操纵子和其他保护菌体免受宿主肠道免疫防御作用的基因[78]。S. gordonii可以通过分泌AI-2调节C. albicans的生物被膜形成[79]。S. gordonii的luxS基因突变会影响与P. gingivalis luxS缺失株混合生物被膜形成的能力[80]。此外,有些细菌自身不产生AI-2,但是可以利用其他细菌的AI-2来调节自身的行为,同时干扰其他细菌的行为,如S. melilot自身不产生AI-2,但是可以利用E. carotovora分泌的AI-2来调控自身生理行为[81]。
关于细菌中菌体-菌体之间交流的研究对于理解生物进化具有重要意义。群体感应可以促发细菌种内交流并使细菌监测群体数量从而协调基因的表达。此外,虽然一些作为信号分子自体诱导物具有很高的种特异性,但是一些自体诱导物可以促发种间信号交流。因此,原核生物同真核生物类似,也存在着化学信号交流的机制。细菌群体感应信号检测和传递系统是非常复杂的,由多个网络组成,而每个网络又由不同的结构布局形成。由于细菌存在于变化的环境中,其中具有多种化学物质,一些是信号分子,一些是不能传递信息的物质。细菌如何识别特定的信号分子启动相应的QS系统网络需要更多深入的研究。
3 展 望
LuxS/AI-2 QS系统作为种间信号交流系统,帮助细菌实现自然环境下多菌种跨种间的信息交流,不仅调控细菌自身菌群的生理行为,而且对维持微生物多样性起重要作用。对于病原性细菌,其生物被膜的形成与耐药性及毒力密切相关,而传统抗生素疗法的失效导致迫切需要研发新型疗法。此外,在食品生产加工过程中,生产设备中形成的微生物生物被膜难以根除,不仅影响了食品的风味和品质,对食品行业造成了重大的经济损失,而且对消费者的身体健康带来了负面影响。因此通过抑制它们的AI-2合成能力、竞争AI-2作用靶点或阻断AI-2呈递内化,干扰其QS系统及其下游级联反应,从而削弱或清除其生物被膜仍是主要研究方向。对于有益微生物,其生物被膜及LuxS/AI-2 QS的相关研究尚处于起步阶段。如何通过调节LuxS/AI-2 QS而影响其生物被膜形成能力,从而提高其对胃肠道及益生菌产品生产过程中不良环境的耐受性逐渐引起了研究人员的关注。同时,肠道中的有益微生物是如何调控自身及周围细菌的群感系统,从而调节肠道菌群平衡和拮抗病原微生物是另一大研究热点。
[1] BLACKLEDGE M S, WORTHINGTON R J, MELANDER C. Biologically inspired strategies for combating bacterial biofilms[J]. Current Opinion in Pharmacology, 2013, 13(5): 699-706. DOI:10.1016/ j.coph.2013.07.004.
[2] GU H, HOU S, YONGYAT C, et al. Patterned biofi lm formation reveals a mechanism for structural heterogeneity in bacterial biofi lms[J]. Langmuir,2013, 29(35): 11145-11153. DOI:10.1021/la402608z.
[3] CHENG K J, FAY J P, HOWARTH R E, et al. Sequence of events in the digestion of fresh legume leaves by rumen bacteria[J]. Applied and Environmental Microbiology, 1980, 40(3): 613-625.
[4] KIM S M, PARK J H, LEE H S, et al. LuxR homologue SmcR is essential for Vibrio vulnificus pathogenesis and biofilm detachment,and its expression is induced by host cells[J]. Infection and Immunity,2013, 81(10): 3721-3730. DOI:10.1128/IAI.00561-13.
[5] SUN H, ZUSMAN D R, SHI W. Type IV pilus of Myxococcus xanthus is a motility apparatus controlled by the frz chemosensory system[J]. Current Biology, 2000, 10(18): 1143-1146.
[6] LEBEER S, VERHOEVEN T L, PEREA V M, et al. Impact of environmental and genetic factors on biofilm formation by the probiotic strain Lactobacillus rhamnosus GG[J]. Applied and Environmental Microbiology, 2007, 73(21): 6768-6775.
[7] BRINK H G, NICOL W. The infl uence of shear on the metabolite yield of Lactobacillus rhamnosus biofilms[J]. New Biotechnology, 2014,31(5): 460-467. DOI:10.1016/j.nbt.2014.06.003.
[8] CHEOW W S, KIEW T Y, HADINOTO K. Controlled release of Lactobacillus rhamnosus biofi lm probiotics from alginate-locust bean gum microcapsules[J]. Carbohydrate Polymers, 2014, 103: 587-595. DOI:10.1016/j.carbpol.2014.01.036.
[9] CHOI K S, VEERARAGOUDA Y, CHO K M, et al. Effect of gacS and gacA mutations on colony architecture, surface motility, biofi lm formation and chemical toxicity in Pseudomonas sp. KL28[J]. Journal of Microbiology, 2007, 45(6): 492-498.
[10] BAZIRE A, SHIOYA K, SOUM-SOUTERA E, et al. The sigma factor AlgU plays a key role in formation of robust biofi lms by nonmucoid Pseudomonas aeruginosa[J]. Journal of Bacteriology, 2010, 192(12): 3001-3010. DOI:10.1128/JB.01633-09.
[11] FAGERLUND A, SMITH V, ROHR A K, et al. Cyclic-di-GMP regulation of Bacillus cereus group biofilm formation[J]. Molecular Microbiology, 2016, 101(3): 471-494. DOI:10.1111/mmi.13405.
[12] MATSUYAMA B Y, KRASTEVA P V, BARAQUET C, et al. Mechanistic insights into c-di-GMP-dependent control of the biofi lm regulator FleQ from Pseudomonas aeruginosa[J]. Proceedings of National Academy of Sciences of the United States of America, 2016,113(2): E209-E218. DOI:10.1073/pnas.1523148113.
[13] ZHU H, MAO X J, GUO X P, et al. The hmsT 3’ untranslated region mediates c-di-GMP metabolism and biofilm formation in Yersinia pestis[J]. Molecular Microbiology, 2016, 99(6): 1167-1178. DOI:10.1111/mmi.13301.
[14] IKONOMIDIS A, VASDEKI A, KRISTO I, et al. Association of biofilm formation and methicillin-resistance with accessory gene regulator (agr) loci in Greek Staphylococcus aureus clones[J]. Microbial Pathogenesis, 2009, 47(6): 341-344. DOI:10.1016/ j.micpath.2009.09.011.
[15] COELHO L R, SOUZA R R, FERREIRA F A, et al. agr RNAIII divergently regulates glucose-induced biofilm formation in clinical isolates of Staphylococcus aureus[J]. Microbiology, 2008, 154(Pt 11): 3480-3490. DOI:10.1099/mic.0.2007/016014-0.
[16] CHRISTIAEN S E, MATTHIJS N, ZHANG X H, et al. Bacteria that inhibit quorum sensing decrease biofilm formation and virulence in Pseudomonas aeruginosa PAO1[J]. Pathogens and Disease, 2014,70(3): 271-279. DOI:10.1111/2049-632X.12124.
[17] O’LOUGHLIN C T, MILLER L C, SIRYAPORN A, et al. A quorumsensing inhibitor blocks Pseudomonas aeruginosa virulence and biofilm formation[J]. Proceedings of National Academy of Sciences of the United States of America, 2013, 110(44): 17981-17986. DOI:10.1073/pnas.1316981110.
[18] DAVIES D G, PARSEK M R, PEARSON J P, et al. The involvement of cell-to-cell signals in the development of a bacterial biofilm[J]. Science, 1998, 280(5361): 295-298. DOI:10.1126/ science.280.5361.295.
[19] DERZELLE S, DUCHAUD E, KUNST F, et al. Identification,characterization, and regulation of a cluster of genes involved in carbapenem biosynthesis in Photorhabdus luminescens[J]. Applied and Environmental Microbiology, 2002, 68(8): 3780-3789. DOI:10.1128/ AEM.68.8.3780-3789.2002.
[20] MILLER M B, BASSLER B L. Quorum sensing in bacteria[J]. Annual Review of Microbiology, 2001, 55: 165-199. DOI:10.1146/annurev. micro.55.1.165.
[21] MILLER M B, SKORUPSKI K, LENZ D H, et al. Parallel quorum sensing systems converge to regulate virulence in Vibrio cholerae[J]. Cel l, 2002, 110(3): 303-314. DOI:10.1016/S0092-8674(02)00829-2.
[22] MORRISON D A, LEE M S. Regulation of competence for genetic transformation in Streptococcus pneumoniae: a link between quorum sensing and DNA processing genes[J]. Research in Microbiology,2000, 151(6): 445-451. DOI:10.1016/S0923-2508(00)00171-6.
[23] 张香美, 李平兰. 产Ⅱ类细菌素乳酸菌群体感应及其应用[J]. 微生物学报, 2011, 51(9): 1152-1157.
[24] THOMPSON J A, OLIVEIRA R A, DJUKOVIC A, et al. Manipulation of the quorum sensing signal AI-2 affects the antibiotic-treated gut microbiota[J]. Cell Reports, 2015, 10(11): 1861-1871.
[25] HOLM A, VIKSTROM E. Quorum s ensing communication between bacteria and human cells: signals, targets, and functions[J]. Frontiers in Plant Science, 2014, 5: 309. DOI:10.3389/fpls.2014.00309.
[26] KAPER J B, SPERANDIO V. Bacteria l cell-to-cell signaling in the gastrointestinal tract[J]. Infection and Immunity, 2005, 73(6): 3197-3209. DOI:10.1128/IAI.73.6.3197-3209.2005.
[27] REZZONICO F, SMITS T H, DUFFY B. Detection of AI-2 receptors in genomes of Enterobacteriaceae suggests a role of type-2 quorum sensing in closed ecosystems[J]. Sensors (Basel, Switzerland), 2012,12(5): 6645-6665. DOI:10.3390/s120506645.
[28] SCHAUDER S, SHOKAT K, SURETTE M G, et al. The LuxS family of bacterial autoinducers: biosynthesis of a novel quorum-sensing signal molecule[J]. Molecular Microbiology, 2001, 41(2): 463-476. DOI:10.1046/j.1365-2958.2001.02532.x.
[29] de KEERSMAECKER S C, SONCK K, VA NDERLEYDEN J. Let LuxS speak up in AI-2 signaling[J]. Trends in Microbiology, 2006,14(3): 114-119. DOI:10.1016/j.tim.2006.01.003.
[30] 韩先干, 白灏, 刘蕾, 等. 禽致病性大肠杆菌安徽分离株luxS和pfs基因的克隆、表达与细胞外合成AI-2活性检测[J]. 微生物学报, 2012,52(9): 1167-1172.
[31] 白灏, 韩先干, 刘蕾, 等. 影响禽致病性大肠杆菌信号分子AI-2产生的因素分析[J]. 中国农业科学, 2013, 46(15): 3220-3226.
[32] MILLER S T, XAVIER K B, CAMPAGNA S R, et al. Salmonella typhimurium recognizes a chemically distinct form of the bacterial quorum-sensing signal AI-2[J]. Molecular Cell, 2004, 15(5): 677-687. DOI:10.1016/j.molcel.2004.07.020.
[33] RAUT N, JOEL S, PASINI P, et al. Bacterial autoinducer-2 detection via an engineered quorum sensing protein[J]. Analytical Chemistry,2015, 87(5): 2608-14. DOI:10.1021/ac504172f.
[34] NEIDITCH M B, FEDERLE M J, MILLER S T, et al. Regulation of LuxPQ receptor activity by the quorum-sensing signal autoinducer-2[J]. Mollecular Cell, 2005, 18(5): 507-518. DOI:10.1016/ j.molcel.2005.04.020.
[35] TAGA M E, BASSLER B L. Chemical communication among bacteria[J]. Proceedings of National Academy of Sciences of the United States of America, 2003, 100(Suppl 2): 14549-14554. DOI:10.1073/pnas.1934514100.
[36] HAN X, LIU L, FAN G, et al. Riemerella anatipestifer lacks luxS, but can uptake exogenous autoinducer-2 to regulate biofi lm formation[J]. Research in Microbiology, 2015, 166(6): 486-493. DOI:10.1016/ j.resmic.2015.06.004.
[37] DUANIS-ASSAF D, STEINBERG D, CHAI Y, et al. The LuxS based quorum sensing governs lactose induced biofi lm formation by Bacillus subtilis[J]. Frontiers in Microbiology, 2015, 6: 1517. DOI:10.3389/ fmicb.2015.01517.
[38] BACHTIAR E W, BACHTIAR B M, JAROSZ L M, et al. AI-2 of Aggregatibacter actinomycetemcomitans inhibits Candida albicans biofilm formation[J]. Frontiers in Cellular Infection Microbiology,2014, 4(18): 94. DOI:10.3389/fcimb.2014.00094.
[39] GRILLO-PUERTAS M, VILLEGAS J M, RINTOUL M R, et al. Polyphosphate degradation in stationary phase triggers biofilm formation via LuxS quorum sensing system in Escherichia coli[J]. PLoS ONE, 2012, 7(11): e50368. DOI:10.1371/journal.pone.0050368.[40] SUN Z K, HE X, BRANCACCIO V F, et al. Bifidobacteria exhibit LuxS-dependent autoinducer 2 activity and biofi lm formation[J]. PLoS ONE, 2014, 9(2): e88260. DOI:10.1371/journal.pone.0088260.
[41] LEBEER S, CLAES I J, VERHOEVEN T L, et al. Impact of luxS and suppressor mutations on the gastrointestinal transit of Lactobacillus rhamnosus GG[J]. Applied and Environmental Microbiology, 2008,74(15): 4711-4718. DOI:10.1128/AEM.00133-08.
[42] LI H, LI X, WANG Z, et al. Autoinducer-2 regulates Pseudomonas aeruginosa PAO1 biofilm formation and virulence production in a dose-dependent manner[J]. BMC Microbiology, 2015, 15(1): 192. DOI:10.1186/s12866-015-0529-y.
[43] ANDERSON J K, HUANG J Y, WREDEN C, et al. Chemorepulsion from the quorum signal autoinducer-2 promotes Helicobacter pylori biofilm dispersal[J]. mBio, 2015, 6(4): e379. DOI:10.1128/ mBio.00379-15.
[44] XUE T, NI J, SHANG F, et al. Autoinducer-2 increases biofilm formation via an ica- and bhp-dependent manner in Staphylococcus epidermidis RP62A[J]. Microbes and Infection, 2015, 17(5): 345-352. DOI:10.1016/j.micinf.2015.01.003.
[45] WANG Y, YI L, ZHANG Z, et al. Biofilm formation, host-cell adherence, and virulence genes regulation of Streptococcus suis in response to autoinducer-2 signaling[J]. Current Microbiology, 2014,68(5): 575-580. DOI:10.1007/s00284-013-0509-0.
[46] YU D, ZHAO L, XUE T, et al. Staphylococcus aureus autoinducer-2 quorum sensing decreases biofilm formation in an icaR-dependent manner[J]. BMC Microbiology, 2012, 12(1): 1-12. DOI:10.1186/1471-2180-12-288.
[47] REDANZ S, STANDAR K, PODBIELSKI A, et al. Heterologous expression of sahH reveals that biofilm formation is autoinducer-2-independent in Streptococcus sanguinis but is associated with an intact activated methionine cycle[J]. Journal of Biological Chemistry, 2012,287(43): 36111-36122. DOI:10.1074/jbc.M112.379230.
[48] 白灏, 韩先干, 刘蕾, 等. 信号分子AI-2对禽致病性大肠杆菌的调控作用[J]. 中国农业科学, 2012, 45(24): 5110-5116. DOI:10.3864/ j.issn.0578-1752.2012.24.017.
[49] 刘蕾, 韩先干, 刘瑞, 等. AI-2对鸭疫里默氏杆菌粘附入侵Vero细胞及其相关基因转录水平的影响[J]. 微生物学报, 2013, 53(3): 313-319.
[50] DONG Y H, WANG L H, XU J L, et al. Quenching quorum-sensingdependent bacterial infection by an N-acyl homoserine lactonase[J]. Nature, 2001, 411: 813-817. DOI:10.1038/35081101.
[51] SHEN G, RAJAN R, ZHU J, et al. Design and synthesis of substrate and intermediate analogue inhibitors of S-ribosylhomocysteinase[J]. Journal of Medicinal Chemistry, 2006, 49(10): 3003-3011. DOI:10.1038/35081101.
[52] HAN X, LU C. Biological activity and identification of a peptide inhibitor of LuxS from Streptococcus suis serotype 2[J]. FEMS Microbiology Letters, 2009, 294(1): 16-23. DOI:10.1111/j.1574-6968.2009.01534.x.
[53] ZHANG M, JIAO X D, HU Y H, et al. Attenuation of Edwardsiella tarda virulence by small peptides that interfere with LuxS/autoinducer type 2 quorum sensing[J]. Applied and Environmental Microbiology,2009, 75(12): 3882-3890. DOI:10.1128/AEM.02690-08.
[54] LEE J E, SINGH V, EVANS G B, et al. Structural rationale for the affinity of pico- and femtomolar transition state analogues of Escherichia coli 5-methylthioadenosine/S-adenosylhomocysteine nucleosidase[J]. Journal of Biological Chemistry, 2005, 280(18): 18274-18282. DOI:10.1074/jbc.M414471200.
[55] NI N, LI M, WANG J, et al. Inhibitors and antagonists of bacterial quorum sensing[J]. Medicinal Research Reviews, 2009, 29(1): 65-124. DOI:10.1002/med.20145.
[56] ROY V, MEYER M T, SMITH J A, et al. AI-2 analogs and antibiotics: a synergistic approach to reduce bacterial biofilms[J]. Applied Microbiology and Biotechnology, 2013, 97(6): 2627-2638. DOI:10.1007/s00253-012-4404-6.
[57] REN D, ZUO R, GONZALEZ B A, et al. Differential gene expression for investigation of Escherichia coli biofilm inhibition by plant extract ursolic acid[J]. Applied and Environmental Microbiology, 2005, 71(7): 4022-4034. DOI:10.1128/AEM.71.7.4022-4034.2005.
[58] BRACKMAN G, CELEN S, BARUAH K, et al. AI-2 quorum-sensing inhibitors affect the starvation response and reduce virulence in several Vibrio species, most likely by interfering with LuxPQ[J]. Microbiology,2009, 155(Pt 12): 4114-4122. DOI:10.1099/mic.0.032474-0.
[59] BRACKMAN G, DEFOIRDT T, MIYAMOTO C, et al. Cinnamaldehyde and cinnamaldehyde derivatives reduce virulence in Vibrio spp. by decreasing the DNA-binding activity of the quorum sensing response regulator LuxR[J]. BMC Microbiology, 2008, 8(1): 149. DOI:10.1186/1471-2180-8-149.
[60] BRACKMAN G, CELEN S, HILLAERT U, et al. Structure-activity relationship of cinnamaldehyde analogs as inhibitors of AI-2 based quorum sensing and their effect on virulence of Vibrio spp.[J]. PLoS ONE, 2011, 6(1): 16084. DOI:10.1371/journal.pone.0016084.
[61] LYNCH M J, SWIFT S, KIRKE D F, et al. The regulation of biofilm development by quorum sensing in Aeromonas hydrophila[J]. Environmental Microbiology, 2002, 4(1): 18-28. DOI:10.1046/j.1462-2920.2002.00264.x.
[62] JANSSENS J C, STEENACKERS H, ROBIJNS S, et al. Brominated furanones inhibit biofilm formation by Salmonella enterica serovar Typhimurium[J]. Applied and Environmental Microbiology, 2008,74(21): 6639-6648. DOI:10.1128/AEM.01262-08.
[63] LONN-STENSRUD J, LANDIN M A, BENNECHE T, et al. Furanones, potential agents for preventing Staphylococcus epidermidis biofilm infections?[J]. Journal of Antimicrobial Chemotherapy, 2009,63(2): 309-316. DOI:10.1093/jac/dkn501.
[64] REN D, BEDZYK L A, YE R W, et al. Differential gene expression shows natural brominated furanones interfere with the autoinducer-2 bacterial signaling system of Escherichia coli[J]. Biotechnology and Bioengineering, 2004, 88(5): 630-642. DOI: 10.1002/bit.20259.
[65] REN D, SIMS J J, WOOD T K. Inhibition of biofilm formation and swarming of Bacillus subtilis by (5Z)-4-bromo-5-(bromomethylene)-3-butyl-2(5H)-furanone[J]. Letters in Applied Microbiology, 2002,34(4): 293-299. DOI:10.1046/j.1472-765x.2002.01087.x.
[66] HE Z, WANG Q, HU Y, et al. Use of the quorum sensing inhibitor furanone C-30 to interfere with biofilm formation by Streptococcus mutans and its luxS mutant strain[J]. International Journal of Antimicrobial Agents, 2012, 40(1): 30-35. DOI:10.1016/ j.ijantimicag.2012.03.016.
[67] HUME E B, BAVEJA J, MUIR B, et al. The control of Staphylococcus epidermidis biofilm formation and in vivo infection rates by covalently bound furanones[J]. Biomaterials, 2004, 25(20): 5023-5030. DOI:10.1016/j.biomaterials.2004.01.048.
[68] BRACKMAN G, HILLAERT U, van CALENBERGH S, et al. Use of quorum sensing inhibitors to interfere with biofilm formation and development in Burkholderia multivorans and Burkholderia cenocepacia[J]. Research in Microbiology, 2009, 160(2): 144-151. DOI:10.1016/j.resmic.2008.12.003.
[69] NIU C, GILBERT E S. Colorimetric method for identifying plant essential oil components that affect biofilm formation and structure[J]. Applied and Environmental Microbiology, 2004, 70(12): 6951-6956. DOI:10.1128/AEM.70.12.6951-6956.2004.
[70] HAMMER B K, BASSLER B L. Regulatory small RNAs circumvent the conventional quorum sensing pathway in pandemic Vibrio cholerae[J]. Proceedings of the National Academy of Sciences of the United States of American, 2007, 104(27): 11145-11149.DOI:10.1073/pnas.0703860104.
[71] HENKE J M, BASSLER B L. Quorum sensing regulates type III secretion in Vibrio harveyi and Vibrio parahaemolyticus[J]. Journal of Bacteriology, 2004, 186(12): 3794-3805. DOI:10.1128/ JB.186.12.3794-3805.2004.
[72] VIDAL J E, LUDEWICK H P, KUNKEL R M, et al. The LuxS-dependent quorum-sensing system regulates early biofilm formation by Streptococcus pneumoniae strain D39[J]. Infection and Immunity,2011, 79(10): 4050-4060. DOI:10.1128/IAI.05186-11.
[73] LI L, XU Z, ZHOU Y, et al. Analysis on Actinobacillus pleuropneumoniae LuxS regulated genes reveals pleiotropic roles of LuxS/AI-2 on biofilm formation, adhesion ability and iron metabolism[J]. Microbial Pathogenesis, 2011, 50(6): 293-302.DOI:10.1016/j.micpath.2011.02.002.
[74] THOMPSON J A, OLIVEIRA R A, XAVIER K B. Can chatter between microbes prevent cholera?[J]. Trends in Microbiology, 2014,22(12): 660-662. DOI:10.1016/j.tim.2014.10.006.
[75] DAO D N, KESSIN R H, ENNIS H L. Developmental cheating and the evolutionary biology of Dictyostelium and Myxococcus[J]. Microbiology, 2000, 146(Pt 7): 1505-1512. DOI:10.1099/00221287-146-7-1505.
[76] STRASSMANN J E, ZHU Y, QUELLER D C. Altruism and social cheating in the social amoeba Dictyostelium discoideum[J]. Nature,2000, 408(6815): 965-967. DOI:10.1038/35050087.
[77] SHIMKETS L J. Intercellular signaling during fruiting-body development of Myxococcus xanthus[J]. Annual Review of Microbiology, 1999, 53: 525-549. DOI:10.1146/annurev. micro.53.1.525.
[78] DUAN K, DAMMEL C, STEIN J, et al. Modulation of Pseudomonas aeruginosa gene expression by host microflora through interspecies communication[J]. Molecular Microbiology, 2003, 50(5): 1477-1491.DOI:10.1046/j.1365-2958.2003.03803.x.
[79] BAMFORD C V, D’MELLO A, NOBBS A H, et al. Streptococcus gordonii modulates Candida albicans biofilm formation through intergeneric communication[J]. Infection and Immunity, 2009, 77(9):3696-3704. DOI:10.1128/IAI.00438-09.
[80] GIVSKOV M, de NYS R, MANEFIELD M, et al. Eukaryotic interference with homoserine lactone-mediated prokaryotic signalling[J]. Journal of Bacteriology, 1996, 178(22): 6618-6622.
[81] PEREIRA C S, MCAULEY J R, TAGA M E, et al. Sinorhizobium meliloti, a bacterium lacking the autoinducer-2 (AI-2) synthase,responds to AI-2 supplied by other bacteria[J]. Molecular Microbiology, 2008, 70(5): 1223-1235. DOI:10.1111/j.1365-2958.2008.06477.x.
Progress in Research on Biofilm Formation Regulated by LuxS/AI-2 Quorum Sensing
LIU Lei1, GUI Meng2, WU Ruiyun1,3, LI Pinglan1,*
(1. Beijing Advanced Innovation Center for Food Nutrition and Human Health, College of Food Science and Nutritional Engineering,China Agricultural University, Beijing 100083, China; 2. Beijing Fisheries Research Institute, Beijing 100068, China;3. College of Life Sciences, Inner Mongolia University, Hohhot 010021, China)
The majority of bacteria form biofi lms for growth and development and bacteria within biofi lms may better adapt to environment than their planktonic counterparts. LuxS-dependent quorum sensing is a widespread system used by bacteria for cell-to-cell communication, which can regulate biofi lm formation in a cell density-dependent manner. Autoinducer 2 (AI-2)produced by LuxS, is a species-nonspecific signal used by both gram-negative and gram-positive bacteria for biofilm formation. Currently, several inhibitors of LuxS/AI-2 quorum sensing have been determined to infl uence biofi lm formation based on their anti-AI-2 communication mechanisms. Recently, there has been a surging interest in the mechanism of biofi lm regulation by LuxS/AI-2 quorum sensing system, which is important to better understand the relationship between LuxS-dependent QS system and biofi lm formation.
biofilms; LuxS/AI-2 quorum sensing; autoinducer 2; quorum sensing inhibitor; regulation mechanism
10.7506/spkx1002-6630-201619043
Q939.99
A
1002-6630(2016)19-0254-09
刘蕾, 桂萌, 武瑞赟, 等. LuxS/AI-2型群体感应系统调控细菌生物被膜形成研究进展[J]. 食品科学, 2016, 37(19): 254-262.
10.7506/spkx1002-6630-201619043. http://www.spkx.net.cn
2016-05-13
国家自然科学基金面上项目(31271827;31471707;31671831);北京市自然科学基金项目(6164033)
刘蕾(1988—),女,博士研究生,研究方向为食品微生物。E-mail:liulei0606@gmail.com
李平兰(1964—),女,教授,博士,研究方向为食品微生物。E-mail:lipinglan@cau.edu.cn
