量子点标记免疫技术在食品中小分子有害物检测中的应用
2016-11-09戴尽波
戴尽波
(广东顺德工业设计研究院(广东顺德创新设计研究院),广东 佛山 528311)
量子点标记免疫技术在食品中小分子有害物检测中的应用
戴尽波
(广东顺德工业设计研究院(广东顺德创新设计研究院),广东 佛山 528311)
量子点(quantum dots,QDs)是一种荧光纳米颗粒,具有荧光量子产率高、发射光谱窄、发射波长可调等优点,是近几年发展起来的一种新型荧光标记物,在食品中小分子有害物免疫检测中的应用已成为研究热点。本文总结介绍了3 种常用的QDs与抗体/抗原偶联方法及其各自优缺点,并对基于QDs的荧光免疫分析方法在食品小分子有害物检测中的应用进行了详细综述。
量子点;偶联;食品安全;小分子;荧光免疫分析
食品中小分子有害物质是引起食源性疾病的主要因素,如果蔬中的有机磷、氨基甲酸酯类等农药残留,动物性食品中的磺胺类、喹诺酮类等兽药残留,谷物中的黄曲霉毒素、玉米赤霉烯酮毒素等真菌毒素,还有一些人为非法添加的如三聚氰胺、苏丹红等有害物质,对这些物质建立快速、准确的检测方法成为当今食品安全中的研究热点。标记免疫分析方法因具有快速灵敏、成本低廉、适宜现场检测等优点,被广泛应用于食品中小分子有害物质的快速检测中。
目前常用的标记免疫分析技术有酶免疫分析、胶体金免疫分析、发光免疫分析和荧光免疫分析,对应的标记物分别是酶、胶体金、化学或生物发光体系、荧光物质。在这些标记物中,酶自身不稳定,容易失活,灵敏度较低;胶体金虽然稳定性好,检测结果易观察,但灵敏度低,无法进行定量检测;化学和生物发光分析法的灵敏度虽然很高,但发光时间短,易受外部环境影响,结果重现性较差;荧光探针虽然克服了以上不足,但传统的有机荧光染料中存在着激发光谱窄、荧光稳定性差的缺点,难以对分析物进行高通量的检测[1-2]。
量子点(quantum dots,QDs)是一种半导体荧光纳米材料,具有优良的光谱特征和光化学稳定性。与传统荧光染料相比,其激发光谱宽、发射光谱窄、斯托克斯位移大、发光效率高、发光寿命长、发光颜色可调、光稳定性好,十分适合作为荧光标记物,基于QDs建立的标记免疫分析方法具有灵敏度高、稳定性好、可用于高通量检测的优点,被广泛应用于食品安全快速检测领域[3-4]。本文就常用的QDs抗体/抗原偶联方法、QDs标记荧光免疫技术在食品小分子有害物质检测方面的应用研究做了综述。
1 QDs与生物分子偶联方法
QDs标记免疫技术将QDs作为荧光标记物,首先需要将QDs与抗体或抗原进行偶联,制备荧光探针用于分析检测。目前,QDs与抗体或抗原偶联的常用方法有活泼酯法、马来酰亚胺法、生物素-亲和素间接连接法(图1)。
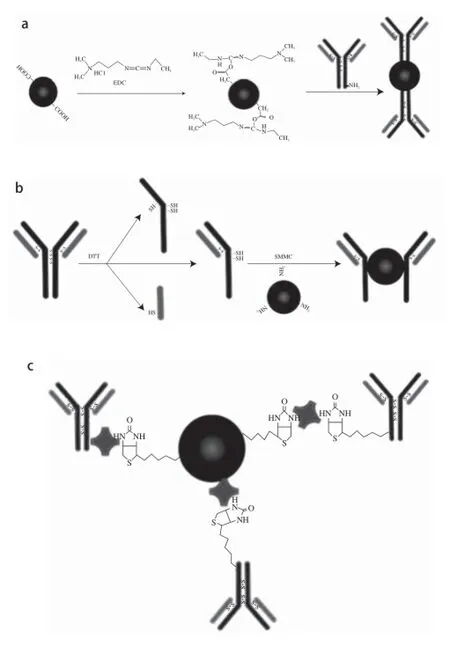
图1 不同QDs-抗体/抗原生物偶联方法[8-10]Fig.1 Schematic diagram showing various methods for QD-antibody bioconjugation[8-10]
1.1活泼酯法
活泼酯法主要是用于羧基QDs与抗体/抗原的氨基连接。常用EDC为交联剂,由于EDC与羧基反应的中间产物不稳定,活化时还需加入N-羟基硫代琥珀酰亚胺(N-Hydroxysuccinimide,NHS),活化后的羧基和抗体/抗原表面的氨基形成酰胺键,生成共价结合的偶联物(图1a)[5]。
该方法优点是大部分抗体或抗原都含有氨基和羧基,与QDs偶联之前不需要进行化学修饰,且偶联过程中不需特殊试剂、成本低、只需一步反应。但该方法也存在以下缺点:1)EDC的最佳反应pH值为酸性,而带羧基QDs需在碱性条件下才能保持较高的溶解度和较好的稳定性;2)反应的不定向性,即在与抗体的反应过程中,QDs可能会与抗体的结合位点连接,造成非特异性封闭,降低抗体的亲和性;3)生物分子之间容易发生交联反应,发生聚沉。如抗体与抗体之间容易发生交联,产生沉淀,所以实验过程中QDs与抗体的比例应该严格控制,以减少抗体之间的交联反应[6-8]。
1.2马来酰亚胺法
马来酰胺亚法主要是通过抗体片段的巯基(-SH)与QDs表面的氨基进行连接。首先要利用DTT的还原性,将抗体上两条重链之间的二硫键还原,断裂生成-SH。为了保证断裂生成的抗体片段仍然具有抗原结合能力,还原过程中需要精确控制DTT的添加量,保证只有抗体两条重链之间的二硫键发生还原断裂,而轻链与重链之间的二硫键不发生还原断裂。经过还原生成的抗体片段(一条重链加一条轻链,分子质量为75 kD)有两个-SH基团能与QDs的氨基进行偶联,用大约长0.83 nm的SMCC作为交联剂进行连接。偶联时QDs上的氨基先与交联剂的琥珀酰亚胺酯基反应,然后抗体片段上的-SH与交联剂的马来酰亚胺基团反应,最终量子点与抗体片段之间通过SMCC连接形成偶联物(图1b)[9-10]。
该方法的最大优点是抗体与QDs偶联具有方向性,即QDs只与抗体重链上的-SH反应,不会占据抗体上的抗原结合位点,但在与QDs偶联之前,需要用还原剂对抗体进行分解,容易造成重链与轻链之间的二硫键断裂,抗体活性损失大,与QDs标记后活性较低。
1.3生物素桥间接偶联
生物素-亲和素系统非共价连接法主要是利用生物素和亲和素之间的高度亲和力将QDs与生物分子连接(图1c)。该方法主要通过QDs修饰亲和素或生物素来实现:1)QDs修饰亲和素,生物分子修饰生物素,首先通过静电吸附或共价交联的方法将亲和素修饰到QDs表面,然后再与修饰了生物素的生物分子混合反应,生物素-亲和素非共价结合将QDs与抗体连接;2)QDs修饰生物素,生物分子修饰亲和素,带氨基功能基团的QDs在交联剂作用下与生物素羧基共价连接,或者先将生物素与聚合物共价偶联,然后再将聚合物修饰到QDs表面。然后将生物素化的QDs与亲和素修饰的生物分子混合反应连接;3)将QDs和生物分子同时修饰生物素,然后将两者混合后加入亲和素进行连接[11-15]。
生物素-亲和素优点是结合物比较稳定,能够放大反应信号;缺点是试剂价格昂贵,操作复杂,此外由于蛋白上的生物素或亲和素连接的位置不能严格控制,生物素可能接近于抗体的抗原识别区,导致抗体亲和力降低。
2 QDs标记免疫技术在食品小分子有害物质检测中的应用
QDs标记免疫技术是基于免疫反应对待测物进行检测的一项食品检测新技术,是一种超微量测定技术,已成为食品安全检测的重要工具之一。食品安全快速检测中常用的QDs标记免疫分析方法有荧光酶联免疫分析(fluorescence-linked immunosorbent assays,FLISA)法、荧光免疫层析(immunochromatographic assay,ICA)法。
2.1FLISA法
酶联免疫吸附分析(enzyme linked immunosorbent assay,ELISA)法是在小分子免疫检测中使用最广泛的一类免疫分析方法,其原理是先将酶标记在抗体或抗原上,然后将标记物进行免疫反应,洗涤后加入酶底物,检测酶催化底物产生的信号,信号的强度与被检测物质浓度成比例关系。同样的可以将QDs作为荧光材料与抗原或抗体偶联,建立FLISA,建立的方法不仅灵敏度更高,而且操作更简便,不需要添加底物反应显色。
Chen Junxia等[16]以QDs标记的羊抗鼠二抗为检测信号,建立了检测鸡肉中的恩诺沙星残留的间接竞争FLISA(indirect competitive FLISA,icFLISA),该方法的线性检测范围为1~100 ng/mL,检测限(limit of detection,LOD)达到2.5 ng/mL。Chen Yiping等[17]同样的利用QDs标记的羊抗鼠二抗,建立快速检测饮用水中毒死蜱的icFLISA,该方法LOD为8.4 ng/mL,与传统ELISA相比,不仅灵敏度提高1.5 倍,检测时间也缩短0.5 h;Sun Meimei等[18]分别用生物素、链霉亲和素标记羊抗兔二抗、QDs,利用生物素-亲和素放大系统,建立检测水中17 β-雌二醇的icFLISA,该方法的检测线性范围0.01~10 000 ng/mL,LOD达到0.005 42 ng/mL。以上研究都是基于QDs标记二抗为信号建立的icFLISA,该方法主要优点是QDs标记的二抗可以直接购买,减少标记步骤,降低对一抗活性的影响,但检测中要求使用二抗,需要分两步进行反应,操作较复杂,整个检测过程耗时较长。
研究者将QDs直接标记一抗上,建立直接竞争FLISA(direct competitive FLISA,dcFLISA),这样只需一步反应就可以达到分析目的,检测时间大大缩短,提高检测效率。Shen Jianzhong等[19]首先通过DTT/SMCC将QDs与抗磺胺二甲嘧啶(sulfadimidine,SMZ)单克隆抗体偶联,并利用聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)及毛细管电泳技术对标记物进行鉴定,最终建立了检测牛奶中SMZ的dcFLISA,该方法检测牛奶时半数抑制浓度(half maximal inhibitory concentration,IC50)及LOD分别达到4.3、0.6 ng/mL。Chen Yiping等[20]用生物素及链霉亲和素分别修饰毒死蜱单克隆抗体和CdTe量子点,建立了检测饮用水中的dcFLISA,该方法的IC50及LOD分别达到28.5、3.8 ng/mL,比传统的ELISA灵敏度提高了5.5 倍,检测时间缩短了1 h。Liu Jingkun等[21]通过EDC/NHS方法将CdTe量子点与氰戊菊酯单克隆抗体偶联,建立检测水及蔬菜中氰戊菊酯残留的dcFLSA,该方法LOD达到25 ng/mL。Zhang Zhaowei等[22]通过EDC方法将CdTe与黄曲霉毒素B1(aflatoxin B1,AFB1)单克隆抗体偶联,建立检测黄曲霉毒素的dcFLISA方法,检测花生样品时IC50达到0.149 ng/mL,LOD达到0.016 ng/mL,回收率达到85%~117%。
但有研究发现当将QDs与抗体偶联时,QDs会占据部分抗体的抗原结合位点,使抗体的亲和力下降,降低方法的灵敏度。故有研究者通过标记抗原建立dcFLISA对食品中小分子有害物进行检测。Trapiella-Alfonso等[23]先将孕酮半抗原与牛血清蛋白(bovine albumin,BSA)偶联,然后通过EDC/NHS将QDs标记在孕酮半抗原衍生物(progesterone-BSA)上,建立检测牛奶中孕酮的dcFLISA,该方法的IC50达到2.2 ng/mL,LOD达到0.1 ng/mL。Beloglazova等[24]将QDs分别与玉米烯酮(zearalenone,ZEN)单克隆抗体、玉米烯酮-鸡卵白蛋白(ovalbumin,OVA)抗原偶联,研究中发现QDs标记后的抗体活性下降,原因可能是QDs标记导致抗体的构象发生变化,同时非特异性封闭了抗体的抗原结合位点,从而导致QD-抗体结合物的反应活性下降。故使用QDs标记的ZEN-OVA为检测信号,建立检测小麦中ZEN的dcFLISA,该方法的灵敏度IC50达到0.1 ng/mL,相比ELISA灵敏度提高了4 倍。Beloglazova等[25]随后对该方法进行了改进,先利用脂质体将多个QDs包裹形成大颗粒的荧光微球,然后再将荧光微球与ZEN-OVA偶联后建立dcFLISA,该方法的灵敏度比单纯用QDs与ZEN-OVA偶联建立的方法灵敏度要高30 倍。并以同样的方法建立检测牛奶中黄曲霉毒素M1的dcFLISA,LOD达到0.002 5 ng/g[26]。
2.2ICA法
目前免疫层析产品主要为胶体金免疫层析试纸条,其在食品安全检测领域得到了迅速发展,但是这种分析方法也存在着不足,如检测灵敏度不高、仅限用于定性或半定量分析等。将QDs作为标记物应用于免疫层析技术中,不仅充分体现了免疫层析技术的简便、快速、特异性强的优点,而且展示了QDs的高灵敏度,以及它的荧光特性,可用于定量分析,显示出巨大的优势。
胡华军等[27]将C d Te/Z n S e Q D s与克伦特罗(clenbuterol,CLE)多克隆抗体结合,作为指示CLE分子的荧光标记物,制备出一种用于检测的荧光免疫层析试纸条,其最低检测限可达1 ng/mL,但该方法只能用于定性检测。后来Berlina等[28]通过EDC/NHS方法将发射波长为625 nm的QDs与氯霉素单克隆抗体偶联,制备了可用于牛奶中氯霉素定性及定量检测的荧光试纸条,当定量检测时LOD达到0.3 ng/mL。Zhou Changhua等[29]为提高检测方法的稳定性,先对CdSe/ZnS QDs进行改进,用原硅酸四乙酯对CdSe/ZnS修饰二氧化硅层,然后在二氧化硅表面接枝聚合物进行亲水性处理,得到高稳定性QDs,再与莱克多巴胺单克隆抗体连接,制备用于检测猪尿中莱克多巴胺的荧光试纸条,该方法LOD达到0.1 ng/mL,相比其他商业化的试纸条灵敏度提高30 倍。
同样为了提高QDs稳定性及试纸条的检测灵敏度,Ren Meiling等[30]利用聚合物聚甲基丙烯酸甲酯(polymethylmethacrylate,PMMA)包裹CdSe/ZnS QDs制备量子点荧光微球(quantum dot beads,QBs),制备的QBs荧光强度比单纯的CdSe/ZnS QDs要高2 863 倍,同时稳定性也大大提高,然后将QBs通过EDC与AFB1抗体偶联得到荧光探针,以此建立定量检测玉米中AFB1的量子点免疫层析试纸条,该方法的IC50比单纯用QDs制备的要低39 倍,LOD比传统的胶体金试纸条要低2 个数量级,与ELISA、液相色谱-串联质谱(liquid chromatography tandem mass spectrometry,LC-MS/MS)方法相当。随后Duan Hong等[31]以同样的方法建立了定量检测ZEN的量子点免疫层析试纸条,该方法线性范围为0.125~10 ng/mL,LOD可达0.062 5 ng/mL,比胶体金试纸条的低5.6 倍。
2.3小分子有害物高通量检测
免疫分析的最大优势在于抗原抗体反应具有高度特异性,但是在一些分析检测中,要求在同一个样品中同时检测多种不同的分析物,使用酶免疫测定或者有机荧光染料的免疫分析均不能达到要求,因为它们的发射光谱宽容易发生重叠,而将QDs作为荧光探针时,利用其一元激发多元发射的光学特性,可以将发射波长不同的QDs标记到针对不同分析物的特异性抗体/抗原上,得到不同的荧光光谱的强度进行高通量检测。
Peng Chifang等[15]首次利用量子点的多色性建立抗生素多残留FLISA检测方法,该方法首先用亲和素修饰对应发射波长为520、545、570、590、635 nm 的QDs,然后用生物素分别修饰抗地塞米松抗体、抗庆大霉素抗体、抗氯销西泮抗体、抗醋酸甲地孕酮抗体和抗头孢噻呋抗体5 种抗体,通过亲和素-生物素桥连作用,制备出5 种荧光标记物,然后建立了多重QDs标记的FLISA荧光免疫分析方法。该方法能够检测猪肉中地塞米松、庆大霉素、氯销西泮、醋酸甲地孕酮和头孢噻呋5种药物的残留,LOD分别可达0.13、0.16、0.07、0.06、0.14 μg/kg。但该方法只能对每种药物进行分别检测,而不能同时检测,因为选择的5 种QDs发射光谱 较宽,各发射波长重叠严重,因此在同时检测多种目标化合物时,互相干扰比较严重,而影响检测效果。
Zhu Ku等[32]用QDs的荧光多色性,将发射波长为605 nm的QDs通过亲和素-生物桥连作用标记在针对磺胺类药物的抗克隆抗体上,将655 nm QDs标记羊抗鼠二抗来识别喹诺酮类药物的单抗,然后将两 类药物的包被原混合包被,建立的dcFLISA可实现同时检测11 种喹诺酮类药物和6 种磺胺类药物残留,检测牛奶中喹诺酮类、磺胺类药物的LOD分别为 0.18、0.17 ng/mL。但是该方法操作复杂,不利于实际应用,同时此方法采用的是广谱性的抗体,不能检测具体的某种药物,而只能分别检测出两类药物的总量。
Beloglazova等[33]利用多色QDs建立了同时检测两种真菌毒素的FLISA,做到真正的多组分同时检测。首先分别将AFB1抗原(AFB1-BSA)、ZEN抗原(ZENBSA)与发射波长为540、594 nm的QDs连接,然后在同一个板孔中混合包被两种抗体,建立可同时检测AFB1和ZEN的dcFLISA,该方法检测AFB1和ZEN的LOD分别为1、1.8 ng/g,实现多组分的同时检测。
Song Erqun等[34]利用QDs多色标记,建立了阵列可视化检测牛奶中多抗生素残留,该方法首先将荧光发射波长为520、565、610 mn的QDs分别与抗链霉素抗体、抗四环素抗体和抗青霉素G抗体偶联制备QDs-抗体探针,然后将对应的抗原分别包被在同一块酶标板的不同孔上,反应后在酶标板上通过阵列分析实现对牛奶中3 种抗生素残留的同时检测,通过空间分辨及QDs的波长分辨,实现3 种抗生素的同时检测,3 种抗生素的LOD均达到了0.005 ng/mL,比传统ELISA方法更灵敏、更准确。
Taranova等[35]首次采用QDs的多色性与免疫层析技术相结合,建立了牛奶中多种抗生素残留检测的免疫层析方法,该方法将525、585、625 nm 3种发射波长的QDs分别标记抗氧氟沙星(ofloxacin ,OFL)抗体、抗氯霉素(chloramphenicol,CAP)抗体、抗链霉素(streptomycin,STM)抗体,在试纸条上不同区域划上3 条检测线(对应OFL、CAP、STM抗原),然后在紫外照射下采用电荷耦合图像传感器读取检测线与控制线的荧光强度,建立了可同时检测3 种抗生素残留的免疫层析试纸条,对OFL、CAP、STM 3 种抗生素的LOD分别达到0.3、0.12、0.2 ng/mL,比使用相同抗体建立的ELISA方法灵敏度要高80~200 倍,检测时间更短。
基于QDs的多组分免疫分析方法与同样具有同时检测多种组分的色谱方法相比,具有操作简单、成本低、可同时检测、样品量大等优点,可为食品中多种分析物的实时检测提供了宝贵的工具。
3 结 语
QDs作为一种新型的荧光探针,与传统的有机荧光染料相比,其具有优越的荧光强度强和稳定性,因此可以取代有机荧光染料进行荧光标记免疫分析。
有效地将抗体或抗原偶联在QDs表面并保持其生物学活性,是QDs免疫分析应用中至关重要的一步。QDs与抗体或抗原偶联后存在水溶性降低、容易聚沉、荧光容易猝灭等问题,研究者通过对量子点进行改性,修饰或包裹二氧化硅、PMMA、脂质体等材料,制备QBs,避免QDs直接跟外部环境接触,提高了QDs稳定性及荧光强度。但这些存在方法操作复杂、成本较高的问题,不利于实际应用,所以研究更为简单、高效的QDs修饰方法是未来量子点免疫检测应用的重要研究方向之一。目前QDs常用与抗体进行偶联制备荧光探针,但研究发现QDs会占据部分抗体的抗原结合位点,使抗体的亲和力下降,导致检测方法的灵敏度下降,有研究者通过标记抗原建立免疫分析方法,能够有效地提高检测灵敏度,同时也有研究者直接将QDs与链霉亲和素进行偶联,然后用小分子的生物素与抗体连接,降低对对抗体活性的影响,同时利用链霉亲和素-生物素放大系统,提高了检测灵敏度。
利用QDs的多色标记,可实现食品中的多组分同时检测,大大提高检测效率,目前常用于多组分分析的主要是FLISA,该方法大部分只能同时检测两种分析物,检测过多分析物时,QDs的波长容易重叠,造成干扰。有研究者通过免疫层析的方法建立多组分分析方法,在膜上的不同区域进行划线,利用空间分辨及QDs的波长分辨建立多组分免疫分析,可有效避免波长之间的干扰,可同时检测更多组分,与FLISA相比具有快速、简便的优点,但目前基于免疫层析建立多组分检测方法较少,开发具有高通量、选择性强、快速、便捷等要求的量子点新技术,是当前研究者们集中探索的重大任务之一。随着QDs点制备工艺研究的不断深入,标记方法的不断改良,相信QDs标记免疫分析技术在未来的食品安全检测,尤其在多组分检测领域的应用将会越来越广泛。
[1] 杨代凤, 刘腾飞, 邓金花, 等. 标记免疫分析在农兽药残留检测中的应用研究进展[J]. 中国农学通报, 2012, 28(30): 218-225. DOI:10.3969/j.issn.1000-6850.2012.30.040.
[2] 王宇, 沈玉栋, 雷红涛, 等. 免疫分析标记技术研究进展[J]. 食品工业科技, 2007, 28(10): 221-225. DOI:10.3969/j.issn.1002-0306.2007.10.072.
[3] 王传涛, 刘道杰, 王术皓. 量子点在标记免疫分析中的应用研究进展[J]. 临床检验杂志, 2007, 25(1): 73-74. DOI:10.3969/j.issn.1001-764X.2007.01.028.
[4] 李文君, 侯玉泽, 胡骁飞, 等. 量子点标记技术在免疫学检测中的应用[J]. 中国免疫学杂志, 2012, 28(10): 953-956. DOI:10.3969/ j.issn.1000-484X.2012.10.021.
[5] WANG S P, MAMEDOVA N, KOTOV N A, et al. Antigen/antibody immunocomplex from CdTe nanoparticle bioconjugates[J]. Nano Letters, 2002, 2(8): 817-822. DOI:10.1021/nl0255193.
[6] ALGAR W R, TAVARES A J, KRULL U J. Beyond labels: a review of the application of quantum dots as integrate d components of assays,bioprobes, and biosensors utilizing optical transduction[J]. Analytica Chinica Acta, 2010, 673(1): 1-25. DOI:10.1016/j.aca.2010.05.026.
[7] HUA X, LIU T, CAO Y, et al. Characterization of the coupling of quantum dots and immunoglobulin antibodies[J]. Analytical and Bioanalytical Chemistry, 2006, 386(6): 1665-1671. DOI:10.1007/ s00216-006-0807-5.
[8] BLANCO-CANOSA J B, WU M, SUSUMU K, et al. Recent progress in the bioconjugation of quantum dots[J]. Coordination Chemistry Reviews, 2014, 263(8): 101-137. DOI:10.1016/j.ccr.2013.08.030.
[9] 邢仕歌, 熊齐荣, 钟强, 等. 量子点抗体偶联技术研究进展[J]. 分析化学, 2013, 41(6): 949-955. DOI:10.3724/SP.J.1096.2013.21071.
[10] MAHMOUD W, ROUSSERIE G, REVEIL B, et al. Advanced procedures for labeling of antibodies with quantum dots[J]. Analytical Biochemistry, 2011, 416(2): 180-185. DOI:10.1016/j.ab.2011.05.018.
[11] XING Y, CHAUDRY Q, SHEN C, et al. Bioconjugated quantum dots for multiplexed and quantitative immunohistochemistry[J]. Nat Protoc,2007, 2(5): 1152-1165. DOI:10.1038/nprot.2007.107.
[12] HLAVACEK A, BOUCHAL P, SKLÁDAL P. Biotinylation of quantum dots for application in fluoroimmunoassays with biotinavidin amplifi cation[J]. Microchimica Acta, 2012, 176(3/4): 287-293. DOI:10.1007/s00604-011-0729-6.
[13] GOLDMAN E R, BALIGHIAN E D, MATTOUSSI H, et al. Avidin: a natural bridge for quantum dot-antibody conjugates[J]. Journal of the American Chemical Society, 2002, 124(22): 6378-6382. DOI:10.1021/ ja0125570.
[14] SAPSFORD K E, ALGAR W R, BERTI L, et al. Functionalizing nanoparticles with biological molecules: developing chemistries that facilitate nanotechnology[J]. Chemical Reviews, 2013, 113(3): 1904-2074. DOI:10.1021/cr300143v.
[15] PENG C F, LI Z, ZHU Y, et al. Simultaneous and sensitive determination of multiplex chemical residues based on multicolor quantum dot probes[J]. Biosensors and Bioelectronics, 2009, 24(12): 3657-3662. DOI:10.1016/j.bios.2009.05.031.
[16] CHEN J X, XU F, JIANG H, et al. A novel quantum dot-based fluoroimmunoassay method for detection of Enrofloxacin residue in chicken muscle tissue[J]. Food Chemistry, 2009, 113(4): 1197-1201. DOI:10.1016/j.foodchem.2008.08.006.
[17] CHEN Y P, NING B, LIU N, et al. A rapid and sensitive fluoroimmunoassay based on quantum dot for the detection of chlorpyrifos residue in drinking water[J]. Journal of Environmental Science and Health. Part B. Pesticides Food Contaminants and Agricultural Wastes, 2010, 45(6): 508-515. DOI:10.1080/03601234.20 10.493476.
[18] SUN M M, DU L, GAO S, et al. Determination of 17 beta-oestradiol by fl uorescence immunoassay with streptavidin-conjugated quantum dots as label[J]. Steroids, 2010, 75(6): 400-403. DOI:10.1016/ j.steroids.2010.02.002.
[19] SHEN J Z, XU F, JIANG H, et al. Characterization and application of quantum dot nanocrystal-monoclonal antibody conjugates for the determination of sulfamethazine in milk by fluoroimmunoassay[J]. Analytical and Bioanalytical Chemistry, 2007, 389(7/8): 2243-2250.
[20] CHEN Y P, REN H L, LIU N, et al. A fl uoroimmunoassay based on quantum dot-streptavidin conjugate for the detection of chlorpyrifos[J]. Journal of Agricultural and Food Chemistry, 2010, 58(16): 8895-8903. DOI:10.1007/s00216-007-1609-0.
[21] LIU J K, ZHANG Q, ZHANG W, et al. Development of a fluorescence-linked immunoassay based on quantum dots for fenvalerate[J]. Food and Agricultural Immunology, 2014, 25(1): 82-93. DOI:10.1080/09540105.2012.749220.
[22] ZHANG Z W, LI Y, LI P, et al. Monoclonal antibody-quantum dots CdTe conjugate-based fluoroimmunoassay for the determination of aflatoxin B1in peanuts[J]. Food Chemistry, 2014, 146: 314-319. DOI:10.1016/j.foodchem.2013.09.048.
[23] TRAPIELLA-ALFONSO L, COSTA-FERNANDEZ J M,PEREIRO R, et al. Development of a quantum dot-based fl uorescent immunoassay for progesterone determination in bovine milk[J]. Biosensors and Bioelectronics, 2011, 26(12): 4753-4759. DOI:10.1016/ j.bios.2011.05.044.
[24] BELOGLAZOVA N V, SPERANSKAYA E S, de SAEGER S, et al. Quantum dot based rapid tests for zearalenone detection[J]. Analytical and Bioanalytical Chemistry, 2012, 403(10): 3013-3024. DOI:10.1007/ s00216-012-5981-z.
[25] BELOGLAZOVA N V, SHMELIN P S, SPERANSKAYA E S,et al. Quantum dot loaded liposomes as fluorescent labels for immunoassay[J]. Analytical Chemistry, 2013, 85(15): 7197-7204. DOI:10.1021/ac401729y.
[26] BELOGLAZOVA N V, SHMELIN P S, GORYACHEVA I Y, et al. Liposomes loaded with quantum dots for ultrasensitive on-site determination of aflatoxin M1in milk products[J]. Analytical and Bioanalytical Chemistry, 2013, 405(24): 7795-7802. DOI:10.1007/ s00216-013-7096-6.
[27] 胡华军, 付涛, 张明洲, 等. CdTe/ZnSe核壳量子点免疫层析试纸条检测克伦特罗的研究[J]. 分析化学, 2010(12): 1727-1731. DOI:10.3724/SP.J.1096.2010.01727.
[28] BERLINA A N, TARANOVA N A, ZHERDEV A V, et al. Quantum dot-based lateral fl ow immunoassay for detection of chloramphenicol in milk[J]. Analytical and Bioanalytical Chemistry, 2013, 405(14): 4997-5000. DOI:10.1007/s00216-013-6876-3.
[29] ZHOU C H, YUAN H, WANG X, et al. CdSe/ZnS quantum dots with multi-shell protection: synthesis and application in the detection of ractopamine residue in swine Urine[J]. Science of Advanced Materials,2013, 5(3): 285-294. DOI:10.1166/sam.2013.1457.
[30] REN M L, XU H, HUANG X, et al. Immunochromatographic assay for ultrasensitive detection of aflatoxin b1 in maize by highly luminescent quantum dot beads[J]. ACS Applied Materials & Interfaces, 2014, 6(16): 14215-14222. DOI:10.1021/am503517s.
[31] DUAN H, CHEN X, XU W, et al. Quantum-dot submicrobead-based immunochromatographic assay for quantitative and sensitive detection of zearalenone[J]. Talanta, 2015, 132: 126-131. DOI:10.1016/ j.talanta.2014.08.076.
[32] ZHU K, LI J, WANG Z, et al. Simultaneous detection of multiple chemical residues in milk using broad-specificity antibodies in a hybrid immunosorbent assay[J]. Biosensors and Bioelectronics, 2011,26(5): 2716-2719. DOI:10.1016/j.bios.2010.09.011.
[33] BELOGLAZOVA N V, SPERANSKAYA E S, WU A, et al. Novel multiplex fluorescent immunoassays based on quantum dot nanolabels for mycotoxins determination[J]. Biosensors and Bioelectronics, 2014,62(6): 59-65. DOI:10.1016/j.bios.2014.06.021.
[34] SONG E Q, YU M, WANG Y, et al. Multi-color quantum dot-based fluorescence immunoassay array for simultaneous visual detection of multiple antibiotic residues in milk[J]. Biosensors and Bioelectronics,2015, 72(5): 320-325. DOI:10.1016/j.bios.2015.05.018.
[35] TARANOVA N A, BERLINA A N, ZHERDEV A V, et al. ‘Traffic light’ immunochromatographic test based on multicolor quantum dots for the simultaneous detection of several antibiotics in milk[J]. Biosensors and Bioelectronics, 2015, 63(7): 255-261. DOI:10.1016/ j.bios.2014.07.049.
A Review of the Application of Quantum Dots as Probes in Fluorescent Immunoassays of Low Molecular Weight Food Contaminants
DAI Jinbo
(Guangdong Shunde Industrial Design Institute(Guangdong Shunde Innovative Design Institute), Foshan 528311, China)
Quantum dots (QDs) are semiconductor nanoparticles with very interesting optical properties like high quantum yield, and narrow and size-tunable fluorescence spectra. QDs are applied widely, especially as fluorescence labels in food safety detection that has received increased attention recently. In this review, three methods for coupling antibody/antigen to QDs are discussed. The development of QD-based fluorescent immunoassays for the detection of low molecular weight hazardous compounds in the food safety area is also demonstrated.
quantum dots; conjugation; food safety; low molecular weight compounds; fluorescent immunoassays
10.7506/spkx1002-6630-201619049
TS201.6
A
1002-6630(2016)19-0296-06
戴尽波. 量子点标记免疫技术在食品中小分子有害物检测中的应用[J]. 食品科学, 2016, 37(19): 296-301. DOI:10.7506/ spkx1002-6630-201619049. http://www.spkx.net.cn
DAI Jinbo. A review of the application of quantum dots as probes in fluorescent immunoassays of low molecular weight food contaminants[J]. Food Science, 2016, 37(19): 296-301. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201619049. http://www.spkx.net.cn
2015-12-31
戴尽波(1988—),男,硕士研究生,研究方向为食品安全。E-mail:jinbodai@126.com
