猪繁殖与呼吸综合征病毒微载体培养试验研究
2016-11-04刘晓航夏一今哈药集团生物疫苗有限公司李一经东北农业大学动物医学学院
刘晓航 夏一今/哈药集团生物疫苗有限公司李一经/东北农业大学动物医学学院
猪繁殖与呼吸综合征病毒微载体培养试验研究
刘晓航 夏一今/哈药集团生物疫苗有限公司
李一经/东北农业大学动物医学学院
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome, PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种以感染猪发热、厌食,妊娠母猪晚期流产、早产、产死胎、弱胎和木乃伊胎,各种年龄猪(特别是仔猪)呼吸障碍为特征的高度传染性疾病。郭宝清等(1996)首次从国内疑似PRRS感染猪群中分离出PRRSV,从而证实了本病在我国的存在。此病常为地方流行性,长期危害养猪生产,给养猪业造成巨大的经济损失。
目前,猪繁殖与呼吸综合征灭活疫苗的生产主要是转瓶细胞培养的传统培养方式,进而增殖PRRSV。但转瓶培养细胞增殖较为缓慢而且生产过程中对细胞和病毒的培养条件,如pH、溶氧、糖耗等难以监控和适时补给,无法提供最佳的培养条件,造成该方法自动化程度低,劳动强度大,并因为转瓶细胞培养环境的不可控性,导致存在生产的产品质量稳定性不够、批间差较大、产量低等问题。
本研究摸索了利用微载体大规模培养Marc-145细胞增殖PRRSV病毒的条件,根据试验结果确定最佳增殖条件,为以哺乳动物细胞为基质大规模增殖病毒及制备蓝耳病疫苗提供依据。
一、材料与方法
1.毒株与细胞。PRRSV Hun4 F112株病毒由中国农业科学院哈尔滨兽医研究所猪病分子诊断实验室惠赠;Marc-145细胞由本单位保存,传代培养至54代。
2.主要设备与试剂。5 L生物反应器(B5,Sartorius,Germany);Cytodex-1购自GE Healthcare公司;DMEM购自Life technology;其他试剂均为进口或国产分析纯产品。
3.静置培养。Marc-145细胞生长至3 d~4 d后,细胞基本铺满方瓶时,先用PBS清洗2次,再加入0.25%胰酶(含0.02% EDTA)溶液消化,倾去胰酶,加含10%血清的DMEM培养基,吹打,T75方瓶以1∶3~1∶4的比率传代。
4.微载体培养。
(1)微载体处理。用无Ca2+、Mg2+离子的磷酸缓冲液清洗并浸泡至少3 h后,经121℃高压蒸汽灭菌25 min,冷却后储于4℃密封待用。使用前用37℃的细胞培养液清洗2遍。
(2)Marc-145细胞的反应器培养优化。
①不同初始密度细胞对细胞生长的影响。不同初始密度1.5×105个细胞/ml、3.0×105个细胞/ml、4.5×105个细胞/ml的Marc-145细胞分别接种于5 L反应器中,微载体用量为3 g/L,观察不同初始密度对细胞生长的影响,确定最佳接种细胞密度。
②搅拌速度对细胞生长的影响。本实验分别考察了搅拌速度为50/min、75 r/min和100 r/min时Marc-145细胞在DMEM培养基中的生长情况,微载体浓度为3 g/L。以3.0×105cells/ml细胞密度接种于5 L反应器中,工作体积为2 L,每隔8 h进行监测,取样计数细胞。
③不同微载体浓度对细胞生长的影响。微载体供应商GE公司推荐的微载体浓度为2~3 g/L,分批培养细胞时一般不超过5 g/L。本实验考察了微载体浓度为1 g/L、3 g/L和5 g/L时细胞的生长情况。
④代谢产物对细胞生长的影响。Marc-145细胞培养过程中,乳酸和葡萄糖的代谢情况是细胞生长的主要指标。因此,本研究检测细胞生长过程中葡萄糖、乳酸代谢情况,并对灌注策略进行分析。
5.微载体培养PRRSV病毒条件优化。
(1)病毒感染量(MOI)的确定。细胞培养48 h后,分别以MOI=0.01、0.1、0.5、1和5接种病毒,检测病毒滴度。
(2)病毒感染时间(TOI)的确定。细胞分别培养24、48、72和96 h后,以1.3.1中优化的MOI接种病毒,检测病毒滴度。
(3)病毒测定。样品TCID50测定:将在含血清培养基中培养好的Marc-145细胞消化,稀释至所需的细胞密度(0.8~1.0×105cells/ml,即每孔8 000~10 000个细胞),向96孔板中每孔加100μl细胞悬液;置培养箱中37℃孵育24 h至细胞铺成单层约60%丰度;取出孔板,吸去培养液,每孔添加约100μl PBS摇晃洗涤2遍以除去血清;将10倍比系列稀释好的病毒液加到96孔板上,每孔100μl,从1到11作11个梯度,从A到H作8个重复,最后一列(A12-H12)做阴性对照(各加100μl病毒稀释液),置培养箱37℃孵育1 h;吸除病毒液,加入100μl细胞维持液;置培养箱37℃培养,逐日观察细胞病变和对照,共观察2~5日,并记录细胞病变的孔数,按照Reed-Muench法计算病毒的TCID50。同时以相同的方法对用转瓶培养的PRRS病毒液进行TCID50测定。以此作为对照组。
6.高致病性猪繁殖与呼吸综合征活疫苗免疫原性实验。免疫攻毒测定:用5~6周龄健康易感仔猪15头,随机分为3组,每组5头。一组用供试疫苗进行免疫保护,另一组用转瓶苗进行保护;两组试验猪各颈部肌肉注射疫苗1头份。第三组不接种疫苗,作为对照,在相同条件下隔离饲养。28日后,所有猪各肌肉注射检验用强毒HuN4株的病毒培养液(104.0TCID50/ml)1 ml,每头滴鼻2 ml,每日测温并观察21日。
二、结果
1.初始细胞密度的确定。当微载体用量为3 g/L时,初始细胞密度1.5×105个细胞/ml、3.0×105个细胞/ml和4.5×105个细胞/ml使得Marc-145细胞在微载体上生长曲线有所差异(图1)。低初始密度 (1.5×105个细胞/ml)使Marc-145细胞的延迟期延长,这是由于单个微载体上分布的细胞过少,同时微载体的空球率较高 (图2A),细胞生长缺乏初始密度效应而造成生长相对缓慢,最大细胞密度也最低,但细胞存活率始终维持在较高水平。4.5×105个细胞/ml的初始密度可以使Marc-145细胞快速进入生长期,但细胞存活率相对较低,这是由于接种后细胞存在聚团和游离细胞不黏附的现象,虽然单个微载体上分配的细胞个数很多,但不能提供有效的黏附生长表面,不利于细胞生长(图2C)。所以细胞接种于微载体上培养时,合适的细胞初始密度(3×105个细胞/ml)既能均匀分布细胞于每个微载体表面,促使细胞快速生长,同时也为细胞的生长预留了充裕的生长表面,最终获得较好的培养效果,维持较高的细胞存活率(图2B)。细胞不同密度接种对细胞的增殖会有较明显的影响,初始密度过小和过大均不利于细胞的增殖,中密度接种较为适合。

图1 不同初始密度的Marc-145细胞在3g/L微载体上生长曲线

图2 不同初始密度的Marc-145细胞在3g/L微载体上培养6 h时的黏附效率比较
2.搅拌速度对细胞生长的影响。微载体培养过程中为了使微载体充分悬浮,必须要有足够高的搅拌速度;但过度的搅拌会延长细胞贴壁时间,严重损伤已贴壁细胞,尤其对有丝分裂周期细胞的伤害更大,导致细胞密度降低。因此本实验分别考察了搅拌速度为80/min、100 r/min和120 r/min时Marc-145细胞在DMEM培养基中的生长情况。结果如图3所示,当搅拌速度为80 r/min时,细胞密度缓慢上升,最高细胞密度仅为8.3×105cell/ml,这可能是因为搅拌速度过低,转瓶中氧传质速度不能满足细胞消耗,因此细胞生长不出现对数生长期;搅拌速度为120 r/min时,最高密度大于前者,但也明显小于当搅拌速度为100 r/min时的最高细胞密度,说明这时搅拌过度,对细胞产生了严重的剪切伤害。搅拌速度为100 r/min时,细胞快速进入对数生长期,56 h时细胞最高密度为1.8×106cell/ml,因此我们确定100 r/min为最佳搅拌速度。

图3 搅拌速度对微载体培养MDCK细胞生长的影响
3.微载体浓度的确定。微载体浓度影响种子细胞的准备量、最高细胞密度、细胞代数、换液频率和策略,又因为微载体价格昂贵,对培养成本也有很大影响,所以选择合适的微载体浓度对大规模工业化细胞培养有重要意义。微载体供应商GE公司推荐的微载体浓度为2~3 g/L。本实验考察了微载体浓度为1 g/L、3 g/L和5 g/L时细胞的生长情况,实验结果如图4所示,微载体浓度为1g/L时,不能提供足够的表面积供细胞生长,细胞受到较严重的接触抑制,56 h时细胞密度只有5.0×105cell/ml;而微载体浓度为3 g/L和5 g/L时,36 h前细胞密度无明显差别,36~60 h前者细胞密度略高于后者,最高细胞密度分别为1.5×106cell/ml和1.3×106cell/ml。考虑到使用成本,选择3 g/L作为微载体的使用重量。

图4 微载体浓度对微载体培养Marc-145细胞生长的影响
4.生物反应器细胞培养代谢分析和灌注策略。在Marc-145细胞进入对数生长期过程中葡萄糖含量迅速下降到最低值5 mmol/L,代谢乳酸由0 mmol/L快速升高到20 mmol/L,随着细胞总数接近最大值,细胞的葡萄糖消耗逐渐趋于稳定,同时乳酸含量也下降到一个较低的水平(图5)。由于1分子葡萄糖完全代谢为乳酸的情况下,可以生成2分子乳酸。在细胞生长期,葡萄糖消耗量略低于乳酸生成量,说明葡萄糖不是完全代谢生成乳酸,低于50%的葡萄糖完全氧化供给细胞能量。因此,在细胞放大培养过程中,早期细胞以葡萄糖代谢产生大量乳酸为特征,灌注培养基以控制乳酸浓度在较低水平为目的,灌注量3~4体积;中后期以细胞维持生存为灌注目的,灌注量1~2体积,逐步减少以达到较高培养基利用率。

图5 5L生物反应器MDCK细胞葡萄糖、乳酸含量曲线
5.反应器参数控制。激流式生物反应器的使用方法,按产品使用和操作方法说明进行。反应器运行过程中主要参考设置如表1所示。
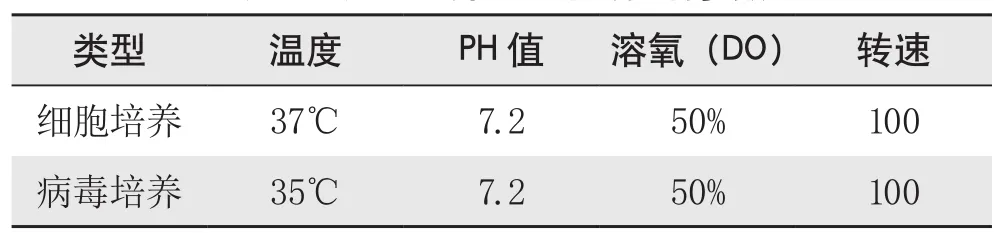
表1 反应器培养过程中的控制参数
(1)PRRSV病毒感染Marc145细胞的条件优化。
①病毒感染量(MOI)及收毒时间的确定。不同的感染复数对PRRSV增殖效价的影响结果如表2所示。过高或过低的感染复数(5和0.01)均导致较低的PRRSV增殖效价,说明接毒剂量直接影响病毒的增殖效率。感染复数为0.10时可以获得最高的PRRSV增殖效价,达到108.0TCID50/ml。此外各组试验结果均显示,接毒后48h的病毒效价均高于接毒后72 h的病毒效价,说明接毒后48h可以作为收获病毒的最适时间。对上述工艺共进行3次验证,在5L反应器中获得比较稳定的细胞生长及病毒增殖效果,病毒增殖效价均高于108.0TCID50/ml,优于传统的转瓶生产效价。
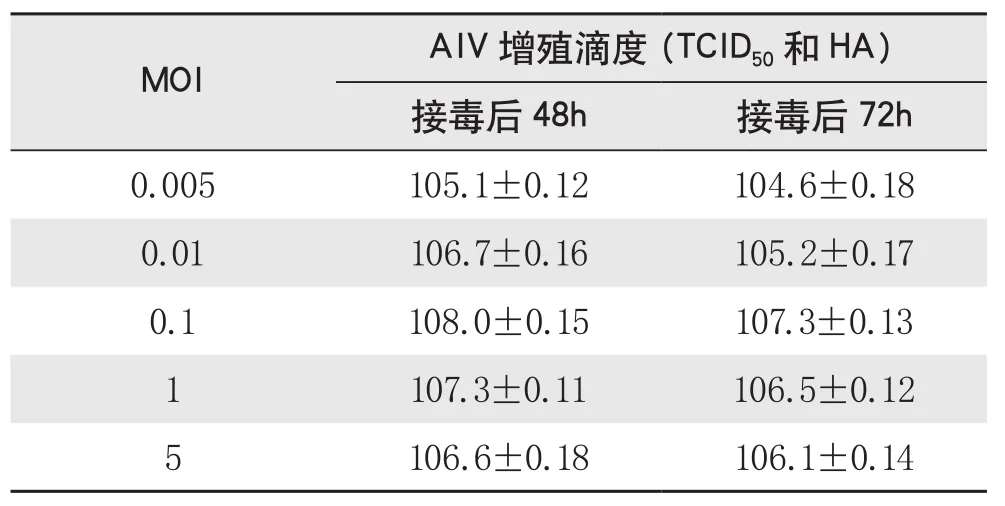
表2 不同感染复数(MOI)对PRRSV增殖效价的影响
②病毒维持液血清浓度的确定。分别选择1.5%、2%、2.5%血清浓度维持液,培养结束后,分别对含毒细胞培养液的病毒含量进行测定,以确定最佳血清浓度的维持液。
实验结果见表3,从表3可以看出,血清浓度对病毒的增值有一定的影响,当血清浓度为2%时,病毒含量为107.6TCID50/0.1ml,明显高于血清浓度为1.5%时的病毒含量。但与2.5%和3.0%比较时,结果差异不显著,因此选择血清浓度为2%的维持液培养病毒。

表3 不同血清浓度维持液对病毒增殖的影响
6.高致病性猪繁殖与呼吸综合征活疫苗的效力试验。由表4的结果可以看出,本生产的活疫苗保护率在90%,而转瓶生产的疫苗保护率为70%,实验证明病毒悬浮培养生产的活疫苗比转瓶生产的疫苗有更好的保护效果。
表4 活疫苗对PRRSV强毒攻击的保护力
三、结论
实验得出,用悬浮培养制备的活疫苗病毒含量高且免疫保护效果好,通过与传统转瓶培养病毒制备的疫苗免疫效果对比,免疫保护效力要显著优于传统转瓶制备的活疫苗对猪的免疫保护效力。悬浮培养PRRSV生产方法,体现了连续培养和规模化生产动物细胞和病毒的趋势,与传统的转瓶培养工艺相比,具有病毒含量高、抗原效价提高显著的优点,且产品质量均一;生产工艺简化,产量大,提高生产效率,降低生产成本。
(略)
