丹酚酸B 对人牙周膜细胞成骨分化的影响
2016-11-04马玥任嫒姝付钢
马玥任嫒姝付钢
1.重庆医科大学附属口腔医院正畸科;2.口腔疾病与生物医学重庆市重点实验室;3.重庆市高校市级口腔生物医学工程重点实验室,重庆 401147
丹酚酸B 对人牙周膜细胞成骨分化的影响
马玥1,2任嫒姝1,2付钢3
1.重庆医科大学附属口腔医院正畸科;2.口腔疾病与生物医学重庆市重点实验室;3.重庆市高校市级口腔生物医学工程重点实验室,重庆 401147
目的 探讨中药丹参主要活性成分丹酚酸B(Sal B)对人牙周膜细胞(hPDLCs)成骨分化的影响。方法 取第3代hPDLCs进行实验,运用甲基噻唑基四唑(MTT)法检测不同浓度丹酚酸B对hPDLCs增殖活性影响,通过检测碱性磷酸酶(ALP)活性、矿化结节染色、骨钙素(OCN)mRNA表达来探讨丹酚酸B对hPDLCs成骨分化的影响。结果 丹酚酸B对hPDLCs增殖活性无影响。当丹酚酸B浓度为0.5、1、5 μmol·L-1时均能增加hPDLCs的ALP活性和OCN mRNA表达,与OIM组比较差异有统计学意义(P<0.05);且当丹酚酸B浓度为0.5、1、5 μmol·L-1时hPDLCs形成矿化结节数量明显高于OIM组。结论 适宜浓度的丹酚酸B能有效促进hPDLCs成骨分化。
丹酚酸B; 人牙周膜细胞; 成骨分化; 碱性磷酸酶活性; 矿化结节
牙周炎是成年人口腔中失牙最主要的原因,其标志性的特征是发生牙槽骨的病理性吸收。牙周组织的修复与再生一直都是牙周炎治疗的重要研究课题之一。人牙周膜细胞(human periodontal ligament cells,hPDLCs)是包括了大量成纤维细胞、少量干细胞、成牙骨质细胞和成骨细胞的特异细胞群[1],其具有干性和成骨分化的潜能,是牙周组织再生的主要细胞来源。丹酚酸B(salvianolic acid B,Sal B)是我国中药丹参的水溶性提取物之一,也是水溶性提取物中活性最强的成分之一,占水溶性药用成分总含量的70%。研究[2-3]表明丹酚酸B主要具有促增殖、抗氧化和细胞保护等作用,广泛用于心血管疾病[4-5],且对神经细胞具有保护作用[6-7],还能防止肝纤维化。近年来研究[8]发现,丹酚酸B能防治糖皮质激素引起的大鼠骨质疏松,进一步研究[9]表明其能促进间充质干细胞成骨分化。而丹酚酸B对hPDLCs的成骨影响尚未见报道,本实验旨在通过研究丹酚酸B对hPDLCs成骨的影响为牙周组织再生中的牙槽骨重建提供新的思考。
1 材料和方法
1.1 主要材料和仪器
丹酚酸B(重庆博培生物公司),胎牛血清(fetal bovine serum,FBS)、DMEM/F12培养基(Gibco公司,美国),青霉素/链霉素(Hyclone公司,美国),茜素红S、抗坏血酸、β-磷酸甘油磷酸钠、二甲基亚砜(dimethyl sulfoxide,DMSO)、碱性磷酸酶(alkaline phosphatase,ALP)染色试剂盒、地塞米松(Sigma公司,美国),ALP定量检测试剂盒(南京建成生物工程研究所),BCA蛋白浓度测定试剂盒(吴江近岸蛋白质科技有限公司),real-time聚合酶链反应(polymerase chain reaction,PCR)试剂盒、引物合成(Takara公司,日本),波形蛋白抗体、角蛋白抗体、通用型免疫组化检测试剂盒、DAB试剂盒(北京中杉金桥生物技术有限公司)。倒置显微镜(尼康公司,日本),荧光定量PCR仪(Bio-Rad公司,美国),酶标仪(PerkinElmer公司,美国)。
1.2 方法
1.2.1 hPDLCs的取材和培养 取10~12岁因正畸需要而拔除的健康前磨牙进行hPDLCs培养。所有患者知情同意,实验操作严格遵守重庆医科大学医学研究伦理委员会的要求。拔牙后将离体牙立即置于含青霉素、链霉素的DMEM/F12培养液中。无菌条件下反复冲洗后,刮取牙根中1/3的牙周膜组织,用剪刀剪碎后平铺于25 mL培养瓶底,加入含血清的DMEM/ F12培养液(含100 μg·mL-1青霉素、100 μg·mL-1链霉素、10%FBS),翻转培养瓶放入CO2孵箱(37 ℃、5%CO2、100%湿度)。12 h后待组织块贴壁,将培养瓶缓慢翻转后继续培养。此后每间隔3 d换液1次,待细胞长至培养瓶底约80%时,用0.25%胰蛋白酶消化,按1∶2传代培养。取第3代细胞进行实验。
1.2.2 hPDLCs的鉴定 倒置显微镜观察细胞形态和生长情况。选取第3代细胞按二步法进行波形蛋白和角蛋白的免疫细胞化学染色,鉴定细胞来源。
1.2.3 细胞毒性实验 将第3代hPDLCs以密度为每孔4×103个接种于96孔板中,细胞贴壁后,分别加入含0、0.1、0.5、1、5 μmol·L-1丹酚酸B的含药培养基[8-9],在药物作用1、3、5、7 d后,采用甲基噻唑基四唑(methyl thiazolyl tetrazolium,MTT)法,每孔加入20 μL MTT溶液(0.5 mg·mL-1)孵育4 h后,吸去孔内液体,加入150 μL DMSO振荡10 min后,490 nm波长测各孔光密度(optical density,OD)值。
1.2.4 丹酚酸B影响hPDLCs成骨分化 实验分为对照组(Con组):DMEM/F12+胎牛血清;标准成骨诱导培养基组(OIM组):DMEM/F12+5%FBS、10 mmol·L-1β-甘油磷酸钠、50 mg·L-1抗坏血酸、1×10-8mol·L-1地塞米松;丹酚酸B+标准成骨培养基组(Sal B+OIM组):标准成骨培养基分别加入浓度为0.1、0.5、1、5 μmol·L-1的丹酚酸B。
1.2.5 ALP活性测定 将第3代hPDLCs以密度为每孔5×104个接种于24孔板中,待细胞生长至80%汇合后,按预先设置的分组对细胞进行诱导培养,即为Con组、OIM组、Sal B+OIM(0.1、0.5、1、5 μmol·L-1)组,培养7 d后去上清液,PBS冲洗2遍,加入0.2% TritonX-100 100 μL裂解2 h后,吹打1 min,取50 μL裂解液至96孔板中,按试剂盒说明进行OD值测定,并用BCA法测定细胞内的总蛋白量,校正ALP的活性结果。
1.2.6 ALP染色 将第3代hPDLCs以密度为每孔5×104个接种于24孔板中,待细胞生长至80%汇合后,按预先设置的分组对细胞进行诱导培养,培养7 d后去上清液,PBS冲洗2遍,95%乙醇固定30 min后PBS冲洗2遍,加入按试剂盒要求配置的染液染色10 min,蒸馏水冲洗2遍后镜下观察成像。
1.2.7 矿化结节染色 将第3代hPDLCs以密度为每孔4×104个接种于24孔板中,待细胞生长至60%汇合后,按预先设置的分组对细胞进行诱导培养,培养20 d后去上清液,PBS冲洗2遍,95%乙醇固定30 min后PBS冲洗2遍,加入0.2%茜素红染液(pH 8.4),37 ℃染色30 min,蒸馏水冲洗2遍后镜下观察成像。
1.2.8 real-time PCR检测骨钙素(osteocalcin,OCN)表达 取第3代hPDLCs,以密度为每孔3×105个接种于6孔板中,待细胞生长至80%汇合后,按预先设置的分组对细胞进行诱导培养,培养10 d后按照RNA提取试剂盒说明书提取RNA,将提取的总RNA用分光光度计定量,A260/A280比值在1.9~2.1之间表明RNA纯度较好,同时采用凝胶电泳检测RNA完整性,测定RNA浓度后取1 μg逆转录成cDNA,real-time PCR检测成骨标志基因OCN mRNA的表达,β-actin作为内参。数据分析采用ΔΔCT法,数据取3次重复的平均值。实验引物序列如下。OCN上游引物序列:5’-CGCTACCTGTATCAATGGCTGG-3’,下游引物序列:5’-ATGTGGTCAGCCAACTCGTCA-3’。β-actin上游引物序列:5’-CCACGAAACTACCTTCAACTCC-3’,下游引物序列:5’-GTGATCTCCTTCTGCATCCTGT-3’。
1.3 统计学处理
采用SPSS 19.0软件包的单因素方差分析对实验数据进行处理,以P<0.05为差异有统计学意义。
2 结果
2.1 hPDLCs形态学观察及鉴定
倒置显微镜下观察到8~10 d内细胞从组织块中游出,可见组织块周围出现梭形细胞,胞核清晰。继续培养,组织块周围细胞增多,围绕组织块成放射状、旋涡状(图1)。细胞免疫组织化学染色结果可见,波形丝蛋白染色阳性,表现为胞质棕黄色着色;角蛋白染色阴性,未见着色(图2),说明细胞来源于中胚层。
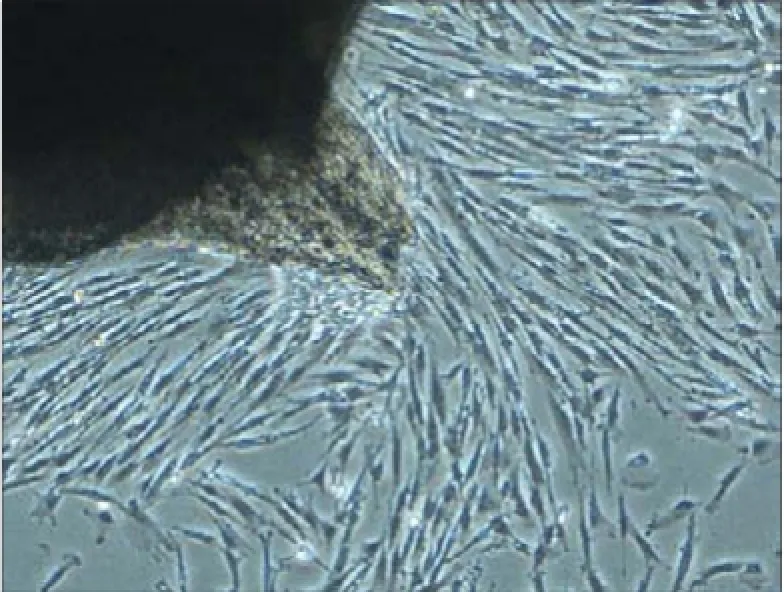
图 1 组织块周围出现细胞 倒置显微镜 × 40Fig 1 Cells grew around the tissue inverted microscope × 40
2.2 丹酚酸B对hPDLCs增殖活性的影响
通过MTT法检测丹酚酸B对hPDLCs增殖活性有无影响,结果显示在丹酚酸B浓度为0.1、0.5、1、5 μmol·L-1时其对hPDLCs增殖活性无影响(图3)。
2.3 丹酚酸B提高hPDLCs的ALP活性
ALP是hPDLCs成骨分化的标志,ALP读数和染色能反映其活性。Con组,OIM组,0.1、0.5、1、5 μmol·L-1Sal B+OIM组ALP检测结果分别为(0.933± 0.029)、(1.110±0.037)、(1.140±0.023)、(1.362± 0.022)、(1.307±0.084)、(1.451±0.057)金氏单位·gprot-1。结果表明在矿化诱导条件下,丹酚酸B能增加hPDLCs的ALP活性,OIM组ALP表达较Con组高(P<0.05),且当丹酚酸B浓度为0.5、1、5 μmol·L-1时其ALP活性读数与OIM组比较差异有统计学意义(P<0.05),ALP活性随丹酚酸B浓度升高而增加,5 μmol·L-1与0.5 μmol·L-1组、1 μmol·L-1组比较差异具有统计学意义(P<0.05)。ALP染色显示Sal B+OIM组与Con组和OIM组比较胞质蓝染较深且较多,与ALP活性读数有相似规律(图4)。
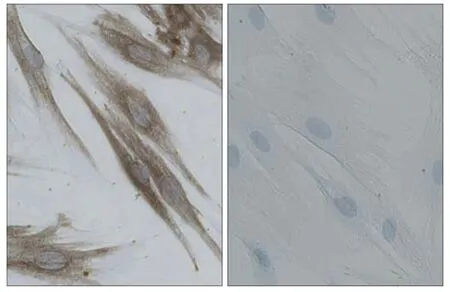
图 2 波形丝蛋白染色阳性(左),角蛋白染色阴性(右) 免疫组织化学染色 × 200Fig 2 Positive expression of vimentin(left), negative expression of keratin(right) immunohistochemistry × 200
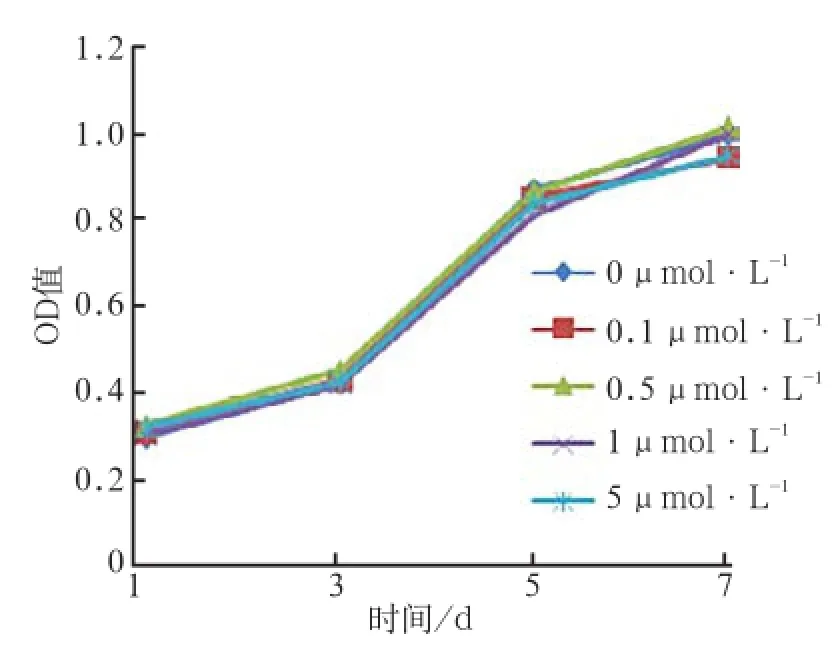
图 3 不同浓度丹酚酸B对hPDLCs活性的影响Fig 3 Effects of Sal B on hPDLCs activity
2.4 丹酚酸B促进hPDLCs矿化
细胞培养20 d后茜素红染色结果显示Con组未见矿化结节形成,OIM组可见散在矿化结节。而当丹酚酸B浓度为0.5、1、5 μmol·L-1时的Sal B+OIM组可见大量矿化结节,且矿化结节数量较OIM组明显提高(图5),上述结果提示一定浓度的丹酚酸B可以促进hPDLCs成骨分化形成矿化结节。
2.5 丹酚酸B提高hPDLCs的OCN mRNA表达
hPDLCs在不同条件培养基培养后应用real-time PCR检测第10天的OCN mRNA表达(图6)。OIM组OCN mRNA表达较Con组高(P<0.05),丹酚酸B各浓度组在矿化诱导培养液中均能促进OCN mRNA的表达,与Con组比较差异有统计学意义(P<0.05),0.5、1、5 μmol·L-1Sal B+OIM组与OIM组比较差异有统计学意义(P<0.05)。当丹酚酸B浓度为5 μmol·L-1时OCN mRNA表达最高,但5 μmol·L-1组与0.5 μmol·L-1组、1 μmol·L-1组比较差异无统计学意义。
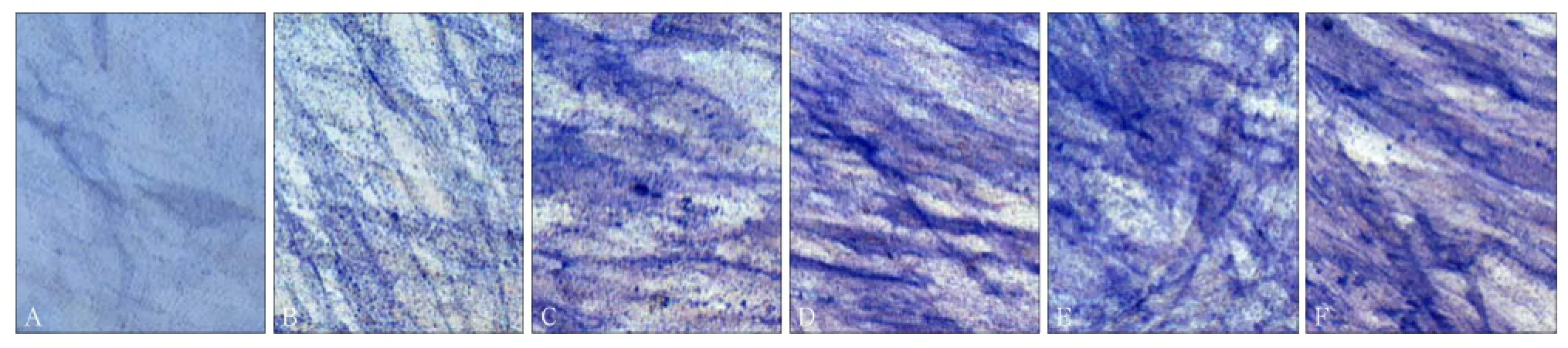
图 4 hPDLCs在不同条件下诱导7 d时ALP染色结果 ALP染色 × 200Fig 4 ALP staining results of hPDLCs under different conditions for 7 d ALP staining × 200
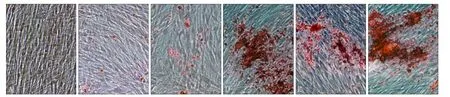
图 5 hPDLCs在不同条件下诱导20 d时茜素红染色结果 茜素红染色 × 100Fig 5 Alizarin red staining results of hPDLCs under different conditions for 20 d alizarin red staining × 100
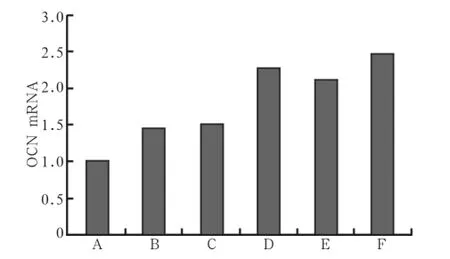
图 6 不同浓度丹酚酸B对OCN mRNA表达的影响Fig 6 Effects of different concentrations Sal B on OCN mRNA ex- pression
3 讨论
丹参是一味古老的具有活血化瘀作用的中草药,具有抗氧化、改善微循环防止血栓形成等多种功能。近年发现丹参可促进骨愈合,在预防股骨头坏死及骨质疏松治疗中有很好的疗效。在动物模型中发现丹参可减轻牙周组织在矫治中的损伤,包括缺氧性损伤与炎症性损伤,另一方面,丹参可以提高牙周组织的修复能力,包括清除变性坏死组织的能力和形成新生牙周组织的功能,丹参还能促进牙周膜成纤维细胞增殖及成骨分化增加其骨保护素分泌[10]。有研究[11]指出丹参提取物能有效地治疗由糖皮质激素引起的大鼠骨质疏松。
丹酚酸B是丹参中的一种有效的提取物,分子式为C36H30O16,相对分子质量为718,呈淡黄色絮状结晶,为三分子丹参素与一分子咖啡酸缩合而成,为丹参中含量最高活性最强的水溶性单体成分,具有很强的抗脂质过氧化和清除自由基作用。研究表明丹酚酸B能促进多种组织细胞增殖,具有抗氧化[3]和细胞保护等作用,其可通过介导多种途径对骨髓干细胞进行保护,减少其凋亡[2]。有研究表明丹酚酸B能通过ET途径对鼠心肌细胞进行保护[4],且能通过抑制炎症反应和促进内皮依赖性血管舒张改善血管功能[5],这使其能被广泛应用于心血管疾病的治疗,而且使其成为治疗内皮功能障碍相关的心血管疾病的一个有力的候选物质。研究[6-7]表明丹酚酸B具有神经细胞保护作用且发挥神经保护活性经由抗炎和抗氧化作用,并且丹酚酸B可以是阿尔茨海默氏病治疗的潜在候选物资,不仅如此它还能防止肝纤维化。有学者[8]研究发现丹酚酸B通过刺激成骨、骨髓血管生成和抑制脂肪形成起到防止糖皮质激素引起的骨质疏松的作用,另有学者[9]通过体外实验对其刺激成骨能力进行研究表明,它能通过增强细胞外信号调节激酶通路促进间充质干细胞成骨分化。而牙周炎的主要病理改变是牙槽骨吸收和牙周袋形成,恢复附着丧失形成牙周新附着一直是治疗牙周病的最终目标。hPDLCs是构成牙周膜的细胞群,实验表明其具有干细胞特性,有成骨分化能力,丹酚酸B刺激间充质干细胞的成骨能力如能作用于hPDLCs将对牙周炎中根周病理性吸收的牙槽骨的再生治疗提供新的思考和方向,本实验对丹酚酸B对hPDLCs成骨分化能力的影响研究结果显示,丹酚酸B还具有促进hPDLCs成骨分化的作用。
为了评价丹酚酸B对hPDLCs成骨分化的影响,笔者首先检测了hPDLCs的ALP活性,ALP作为早期成骨分化的标志物,其活性能反映成骨细胞成熟状态[12-15]。其可使局部钙、磷浓度升高,有助于矿化机制的进行,是促进骨间质矿化的重要酶。本实验结果表明当丹酚酸B浓度在0.5、1、5 μmol·L-1时能有效提高hPDLCs的ALP活性,从而增强其成骨活性,且在本实验浓度范围内其ALP活性随丹酚酸B浓度升高而提高。
OCN是成骨细胞合成分泌的一种非胶原蛋白,是反映成骨细胞分化成熟的指标,能表示成骨细胞的活性,它能准确反映成骨细胞的成骨功能[16-17]。其主要生理作用是反映骨转换的指标,当骨形成和骨吸收解偶联时,OCN是反映骨形成的特异指标。本实验中,hPDLCs在加入了0.5、1、5 μmol·L-1丹酚酸B的矿化培养液中培养能被显著增强OCN mRNA的表达,且在浓度为5 μmol·L-1时表达最强,但在此实验浓度范围内无明显浓度依赖性。丹酚酸B能有效促进hPDLCs成骨分化,从而在牙周组织再生中起到重要作用,而OCN作为骨形成的重要指标其mRNA表达增加有利于发挥它在生物矿化中的特有作用。
笔者对丹酚酸B对hPDLCs矿化能力的影响进行了检测。钙盐沉积是中晚期的成骨指标[18],结果发现在丹酚酸B浓度为0.5、1、5 μmol·L-1这几个有效浓度下hPDLCs较未加丹酚酸B的普通矿化培养基下的hPDLCs更早出现细胞聚集,并出现了更多和更大的矿化结节。这表明丹酚酸B能显著提高hPDLCs的矿化能力,促进其形成矿化结节。
综上所述,适宜浓度的丹酚酸B能够有效促进hPDLCs成骨分化,且有可能是通过提高hPDLCs的ALP活性和促进其OCN mRNA表达而实现。本实验为进一步研究丹酚酸B对牙周炎的治疗作用奠定了重要基础,有助于牙周炎组织再生的实现,但其具体机制及应用于体内模型中的作用与方法尚待深入研究。笔者将在后续实验中研究其体外促进成骨机制且采用动物模型模拟牙周炎时骨缺损状态用以进一步探讨丹酚酸B的实际应用价值。
[1] Seo BM, Miura M, Gronthos S, et al. Investigation of multipotent postnatal stem cells from human periodontal ligament[J]. Lancet, 2004, 364(9429):149-155.
[2] 王凤美, 陈军辉, 李磊, 等. 高纯度丹酚酸B的制备工艺研究[J]. 时珍国医国药, 2005, 16(6):3-5.
Wang FM, Chen JH, Li L, et al. Study on the preparation of salvianolic acid B of high purity[J]. LiShiZhen Med Mater Med Res, 2005, 16(6):3-5.
[3] Lu B, Ye Z, Deng Y, et al. MEK/ERK pathway mediates cytoprotection of salvianolic acid B against oxidative stressinduced apoptosis in rat bone marrow stem cells[J]. Cell Biol Int, 2010, 34(11):1063-1068.
[4] He H, Shi M, Zeng X, et al. Cardioprotective effect of salvianolic acid B on large myocardial infarction mediated by reversing upregulation of leptin, endothelin pathways, and abnormal expression of SERCA2a, phospholamban in rats [J]. J Ethnopharmacol, 2008, 118(1):35-45.
[5] Joe Y, Zheng M, Kim HJ, et al. Salvianolic acid B exerts vasoprotective effects through the modulation of heme oxygenase-1 and arginase activities[J]. J Pharmacol Exp Ther, 2012, 341(3):850-858.
[6] Kim DH, Park SJ, Kim JM, et al. Cognitive dysfunctions induced by a cholinergic blockade and Aβ 25-35 peptide are attenuated by salvianolic acid B[J]. Neuropharmacology, 2011, 61(8):1432-1440.
[7] Lee YW, Kim DH, Jeon SJ, et al. Neuroprotective effects of salvianolic acid B on an Aβ25-35 peptide-induced mouse model of Alzheimer’s disease[J]. Eur J Pharmacol, 2013, 704(1/2/3):70-77.
[8] Cui L, Li T, Liu Y, et al. Salvianolic acid B prevents bone loss in prednisone-treated rats through stimulation of osteogenesis and bone marrow angiogenesis[J]. PLoS ONE, 2012, 7(4):e34647.
[9] Xu D, Xu L, Zhou C, et al. Salvianolic acid B promotes osteogenesis of human mesenchymal stem cells through activating ERK signaling pathway[J]. Int J Biochem Cell Biol, 2014, 51:1-9.
[10] 杜红江, 陈学鹏, 严洪海. 丹参对人牙周膜成纤维细胞骨保护素表达的影响[J]. 上海口腔医学, 2010, 19(5):530-533.
Du HJ, Chen XP, Yan HH. Effect of salvia miltiorrhiza bunge on expression of osteoprotegerin in cultured human periodontal ligament fibroblasts[J]. Shanghai J Stomatol, 2010, 19(5):530-533.
[11] 于琼, 崔燎, 吴铁. 三种丹参水提有效部位群对糖皮质激素性骨质疏松大鼠的影响[J]. 中国骨质疏松杂志, 2012, 18(8):695-699.
Yu Q, Cui L, Wu T. The effect of three effective fractions of water extract of Danshen on glucocorticoid-induced osteoporosis in rats[J]. Chin J Osteoporos, 2012, 18(8):695-699.
[12] Orimo H. The mechanism of mineralization and the role of alkaline phosphatase in health and disease[J]. J Nippon Med Sch, 2010, 77(1):4-12.
[13] Orimo H, Shimada T. The role of tissue-nonspecific alkaline phosphatase in the phosphate-induced activation of alkaline phosphatase and mineralization in SaOS-2 human osteoblastlike cells[J]. Mol Cell Biochem, 2008, 315(1/2):338-345.
[14] Lv XC, Bi LJ, Jiang Y, et al. Effects of icariin on the alkline phosphatase activity of human periodontal ligament cells inhibited by lipopolysaccharide[J]. 2013, 8(5):1411-1415.
[15] Ikeda H, Sumita Y, Ikeda M, et al. Engineering bone formation from human dental pulp- and periodontal ligamentderived cells[J]. Ann Biomed Eng, 2011, 39(1):26-34.
[16] Guo S, Guo W, Ding Y, et al. Comparative study of human dental follicle cell sheets and periodontal ligament cell sheets for periodontal tissue regeneration[J]. Cell Transplant, 2013, 22(6):1061-1073.
[17] Gordon JA, Tye CE, Sampaio AV, et al. Bonesialoprotein expression enhances osteoblast differentiation and matrix mineralization in vitro[J]. Bone, 2007, 41(3):462-473.
[18] Wada N, Maeda H, Hasegawa D, et al. Semaphorin 3A induces mesenchymal-stem-like properties in human periodontal ligament cells[J]. Stem Cells Dev, 2014, 23(18):2225-2236.
(本文编辑 杜冰)
Effects of salvianolic acid B on osteogenic differentiation of human periodontal ligament cells
Ma Yue1,2, Ren Aishu1,2, Fu Gang3.
(1. Dept. of Orthodontics, Stomatological Hospital of Chongqing Medical University, Chongqing 401147, China; 2. Chongqing Key Laboratory of Oral Diseases and Biomedical Sciences, Chongqing 401147, China; 3. Chongqing Municipal Key Laboratory of Oral Biomedical Engineering of Higher Education, Chongqing 401147, China)
Supported by: Scientific and Technological Research Program of Chongqing Yuzhong (20140128); Project Supported by Health Bureau of Chongqing (2011-2-180); Program for Innovation Team Building at Institutions of Higher Education in Chongqing in 2013 (KJTD201314). Correspondence: Ren Aishu, E-mail: rasras@163.com.
Objective This study investigated the effects of salvianolic acid B (Sal B), a major bioactive component of the Chinese medicine salvia miltiorrhiza, on osteogenic differentiation of human periodontal ligament cells (hPDLCs). Methods Third passage PDLCs were used in this experiment. Methyl thiazolyl tetrazolium (MTT) method was employed to observe the effects of different Sal B concentrations on proliferation activity of hPDLCs. Alkaline phosphatase (ALP) activity and mineralization capability were measured, and mRNA expression of osteocalcin (OCN) was detected to investigate the effects of Sal B on osteogenesis of hPDLCs. Results Sal B did not influence the viability of hPDLCs. The ALP activity and OCN mRNA expression levels of hPDLCs were both significantly improved (P<0.05) under treatment with different Sal B concentrations (0.5, 1, and 5 μmol·L-1) compared with those in OIM group. Moreover, the number of mineralized nodules formed by hPDLCs were considerably higher under treatment with different Sal B concentrations (0.5, 1, and 5 μmol·L-1) than that in the OIM group. Conclusion Appropriate Sal B concentration can improve the osteogenic differentiation of hPDLCs.
salvianolic acid B; human periodontal ligament cells; osteogenic differentiation; alkaline phosphatase activity; mineralized nodules
R 781.4
A [doi] 10.7518/hxkq.2016.05.007
2016-01-06;
2016-07-12
重庆市渝中区科委基金(20140128);重庆市卫生局基金资助项目(2011-2-180);2013年重庆高校创新团队建设计划资助项目(KJTD201314)
马玥,硕士,E-mail:yaotong6@hotmail.com
任嫒姝,副教授,博士,E-mail:rasras@163.com
