硒催化4-氨基吡啶与硝基芳烃羰基化合成4-吡啶基脲
2016-11-02张晓鹏李政伟牛雪利张贵生
张晓鹏, 李政伟, 王 岩, 牛雪利, 张贵生
(河南师范大学化学化工学院, 绿色化学介质与反应省部共建教育部重点实验室,精细化学品绿色制造河南省协同创新中心, 新乡453007)
硒催化4-氨基吡啶与硝基芳烃羰基化合成4-吡啶基脲
张晓鹏, 李政伟, 王岩, 牛雪利, 张贵生
(河南师范大学化学化工学院, 绿色化学介质与反应省部共建教育部重点实验室,精细化学品绿色制造河南省协同创新中心, 新乡453007)
以非金属硒为催化剂, 三乙胺为助催化剂, 用CO替代剧毒光气作为羰基化试剂, 通过鼓泡方式经硒催化“一锅煮”的4-氨基吡啶与硝基芳烃的氧化还原羰基化反应合成4-吡啶基脲. 通过探究反应温度、 反应时间、 溶剂及碱的种类等因素的影响, 获得了反应的优化条件. 在优化条件的基础上, 以中等到良好的收率制得4-吡啶基脲类化合物, 反应底物硝基芳烃的普遍适用性较好; 还提出了该反应的可能机理.
硒催化; 羰基化; 4-吡啶基脲

Scheme 1 Selenium-catalyzed carbonylation approach to 4-pyridinylureas
4-吡啶基脲类化合物由于分子内既有肽键, 又有含氮杂环, 故大多具有生物活性, 在医学上可用作抗菌剂[1]和抗痉挛药物[2,3], 在生物领域可用作植物细胞分裂素[4,5]和Rho激酶抑制剂[6]; 此外, 该类物质还可用作环氧化物开环聚合制备环氧树脂的潜在引发剂[7,8].
4-吡啶基脲的主要合成方法有: (1) 光气法[9]: 由4-氨基吡啶与芳胺在光气存在下反应制得目标产物, 但该方法不但用到了剧毒的光气, 而且制备过程中还产生大量含氯腐蚀性废物, 导致环境污染及腐蚀设备严重, 安全性差. (2) 光气衍生物法[9~11]: 用三光气或羰基二咪唑等光气衍生物替代光气来合成目标产物, 但仅其中的羰基进入到了目标产物中, 其余部分全部变为副产物, 故原子经济性差、 成本高, 另外也相当于间接使用了光气. (3) 异氰酸酯法[1,12,13]: 采用相应胺与异氰酸酯加成可得到目标产物, 但该方法所用的异氰酸酯成本高、 刺激性强、 操作条件苛刻, 而且其通常也由光气衍生而来. (4) 酰基叠氮法[14,15]: 通过酰基叠氮与胺反应制备目标产物, 但酰基叠氮成本高且来源不便. (5) 1-芳基脲与4-卤代吡啶或4-吡啶基硼酸的N-芳基化反应[16~18]: 该方法所用原料结构比较复杂, 成本高. (6) 芳香氨基甲酸酯与4-氨基吡啶的胺解反应[19,20]: 所用原料之一的芳香氨基甲酸酯结构比较复杂、 成本高、 来源不便, 且反应的原子经济性差.
研究发现, 非金属硒能有效活化CO来替代剧毒光气进行羰基化反应, 具有诸多优点: 所用原料简单, 来源方便; 与传统的贵金属催化活化CO相比, 硒廉价易得且能有效活化CO, 分离回收方便且可循环使用, 其催化活性保持不变; 反应成本低, 原子经济性高, 无腐蚀性废物排放, 环境相对友好[21~23]. 鉴于此, 本文将Se/CO催化体系引入到4-吡啶基脲的合成中, 以4-氨基吡啶和芳香硝基化合物为起始原料, 通过CO鼓泡方式, 经硒催化“一锅煮”的氧化还原羰基化反应来合成目标产物. 合成路线如Scheme 1所示.
1 实验部分
1.1试剂与仪器
硒粉(纯度为99. 95%, 上海兴塔化工厂); CO钢瓶气体(纯度为99. 9%, 北京华通精科气体化工公司); 其余试剂均为分析纯, 使用前未做进一步处理. XT4型数字显示显微熔点仪(北京科仪电光仪器厂); Bruker DPX-400型核磁共振谱仪(内标TMS, 溶剂DMSO-d6, 美国CIL公司).
1.24-吡啶脲的合成
将硒粉(0.25 mmol)、 4-氨基吡啶(5 mmol)、 三乙胺(5 mmol)、 硝基芳烃(1, 5 mmol)和10 mLN,N-二甲基甲酰胺(DMF)依次加入装有冷凝管的50 mL三颈烧瓶中, 用CO置换空气3次后, 将三颈瓶放入130 ℃的恒温油浴中, 同时将CO通入三颈瓶内的反应液中开始鼓泡, 同时搅拌进行反应. 5 h后停止加热与鼓泡, 待反应液冷却至室温后, 放掉残余气体, 将反应液置于空气中再搅拌一段时间以使硒充分沉淀析出, 然后抽滤回收单质硒. 滤液经减压蒸馏除去DMF, 然后经柱色谱分离[淋洗液:V(乙酸乙酯)∶V(甲醇)=10∶1]得到无色针状固体4-吡啶脲(2). 化合物2a~2i的物性数据列于表1,1H NMR及13C NMR数据列于表2.

Table 1 Melting points and CAS number for compounds 2a—2i

Table 2 1H NMR and 13C NMR data for compounds 2h—2i
2 结果与讨论
2.1反应条件的优化
为了获得优化的反应条件, 以硒催化4-氨基吡啶与硝基苯的氧化反应还原羰基化为模型, 分别考察了反应温度、 反应时间、 溶剂及碱的种类等因素对反应的影响, 结果如表3所示.
实验中发现, 温度对该反应影响明显. 在90 ℃反应5 h后, 4-吡啶基脲的收率仅为13%, 同时还有一些经4-氨基吡啶自身羰基化反应生成的副产物——对称的二(4-吡啶基)脲(表3, Entry 1). 这可能是由于低温下硝基苯难以被还原为苯胺, 进而难以发生4-氨基吡啶与苯胺分子间的羰基化反应所致. 随着反应温度的升高, 副产物对称脲的比例逐渐减小, 而目标产物的收率相应地提高, 在130 ℃时目标产物的收率可达78%(表3, Entries 2, 3), 副产物对称的二(4-吡啶基)脲仅有痕量存在. 继续升高反应温度至150 ℃, 目标产物产率并无相应的提升(表3, Entry 4).
反应时间优化结果表明, 当反应在130 ℃进行3 h时, 4-吡啶基脲的收率为50%(表3, Entry 5). 随着反应时间的延长, 4-吡啶基脲的收率也相应地提高, 并在5 h时达到峰值(表3, Entries 3, 6); 继续延长反应时间至6 h, 4-吡啶基脲的收率并无变化(表3, Entry 7), 说明5 h内反应体系已达平衡.
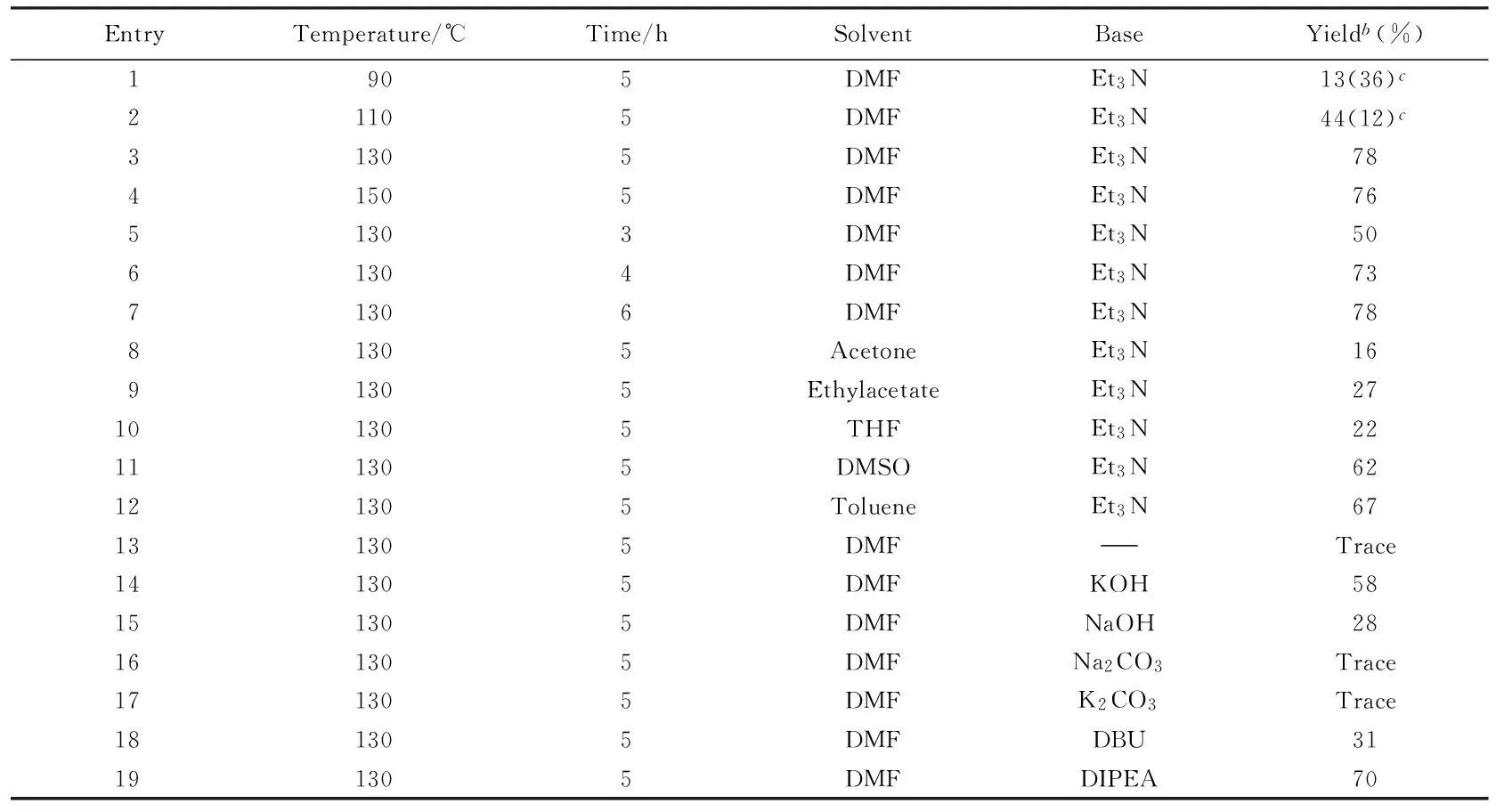
Table 3 Optimization of reaction conditionsa
a. Reaction conditions: 4-amionpyridine(5 mmol), nitrobenzene(5 mmol), Se(0.25 mmol), 10 mL solvent, base(5 mmol), CO bubble;b. isolated yield of 4-pyridinylurea;c. isolated yield of di(4-pyridinyl)urea.
实验中还发现, 常见的低沸点溶剂如丙酮、 乙酸乙酯和四氢呋喃等用于该反应体系中效果不好(表3, Entries 8~10), 这很可能是由于在130 ℃进行反应时, 这些低沸点溶剂容易气化从而导致反应体系溶剂量减少而影响反应的进行. 而选用沸点较高的溶剂如DMF、 二甲基亚砜和甲苯进行反应时, 效果良好(表3, Entries 3, 11, 12), 特别是在DMF中反应效果最佳, 目标产物收率可达78%.
据文献[21,23]报道, 在硒催化的羰基化反应中, 用合适的碱作助催化剂必不可少. 助催化剂碱的作用是可以稳定活性中间体羰基硒(COSe), 从而促使其更好地生成. 实验中发现, 当不加碱时, 反应难以进行, 只得到痕量的4-吡啶基脲(表3, Entry 13). 随后考察了无机碱如KOH, NaOH, Na2CO3和K2CO3及有机碱三乙胺(Et3N), 1,8-二氮杂二环十一碳-7-烯(DBU)和N,N-二异丙基乙胺(DIPEA)作助催化剂时的反应效果, 发现无机碱KOH作助催化剂反应效果较好, 而有机碱三乙胺和N,N-二异丙基乙胺的效果良好, 其中以三乙胺效果最佳(表3, Entries 3, 14~19).
综上所述, 得出该反应的优化条件: 4-氨基吡啶5 mmol, 硝基苯5 mmol, 硒0.25 mmol,N,N-二甲基甲酰胺10 mL, 三乙胺5 mmol, CO鼓泡, 130 ℃, 5 h.
2.2反应底物的适用性
为了探寻该方法的底物适用性, 在优化条件的基础上, 尝试用带不同取代基的硝基芳烃及脂肪族硝基化合物作底物与4-氨基吡啶进行硒催化的羰基化反应, 结果如表4所示. 当用硝基芳烃作底物时, 反应均能顺利进行, 4-吡啶基脲的产率从中等到良好(表4, Entries 1~9). 电子效应及空间位阻效应对反应影响明显, 总体上, 带供电基团的硝基苯如对甲基硝基苯、 对甲氧基硝基苯以及对硝基苯酚的反应活性要比带吸电子基团如Cl, Br等的取代硝基苯反应活性高, 因而前者所对应的4-吡啶基脲的产率(表4, Entries 6~8)高于后者(表4, Entries 2~5); 位阻越大, 反应越不易进行, 因而4-吡啶基脲的产率也相应较低(表4, Entries 2, 3). 将该反应体系用于稠环硝基芳烃1-硝基萘与4-氨基吡啶的羰基化反应中, 结果发现反应同样能顺利进行, 且以65%的收率得到4-吡啶基脲(表4, Entry 9). 此外, 还尝试用脂肪族硝基化合物如硝基甲烷、 硝基乙烷作底物与4-氨基吡啶进行羰基化反应来合成相应的4-吡啶基脲, 结果发现无目标产物生成(表4, Entries 10, 11).
2.3反应机理
如Scheme 2所示, 在助催化剂(如Et3N)存在下, Se首先与CO反应原位生成SeCO(Ⅰ)[21,23]. 反应体系中存在的痕量H2O可与SeCO反应生成H2Se(Ⅱ), 同时释放出CO2[21,23]. H2Se生成后可将硝基芳烃还原为相应的胺, 同时自身被氧化分解为Se和H2O参与下一轮的催化循环反应. 4-氨基吡啶与经过还原得到的芳胺可对SeCO进行亲核进攻生成中间体(Ⅳ), 随后中间体再经消除反应得到目标产物4-吡啶基脲(Ⅴ), 同时释放出H2Se参与下一轮的氧化还原反应.
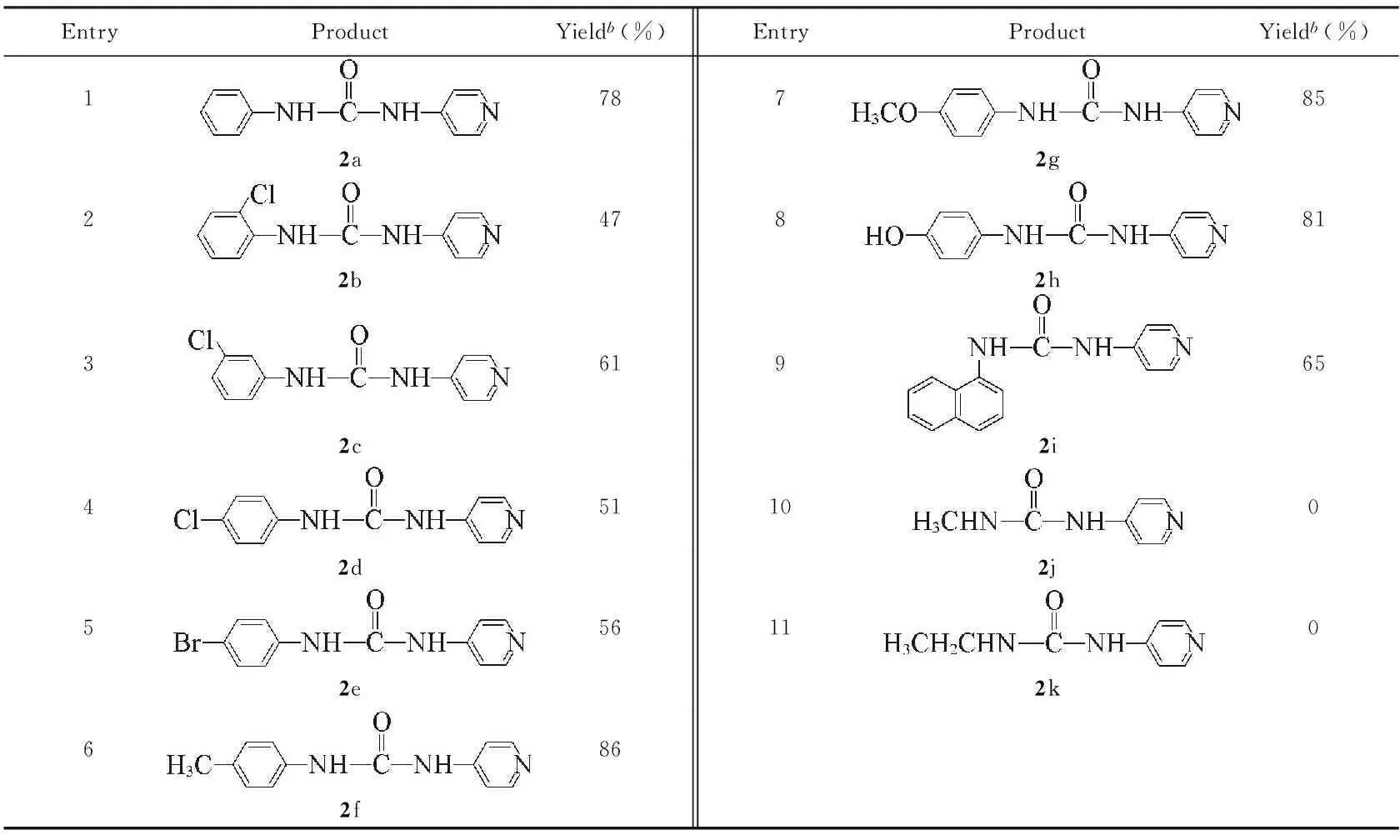
Table 4 Substrates scope for the productsa
a. Reaction conditions: 4-amionpyridine(5 mmol), nitroaromatic(5 mmol), Se(0.25 mmol), 10 mL DMF, Et3N(5 mmol), CO bubble;b. isolated yield of 4-pyridinylurea.

Scheme 2 Proposed reaction pathway to 4-pyridinylureas
综上所述, 建立了一种简易、 经济且环境相对友好的方法合成了4-吡啶基脲类化合物. 以廉价易得的非金属硒作催化剂, CO替代剧毒光气作羰基化试剂, 在优化条件下, 通过鼓泡方式, 经“一锅煮”的硒催化4-氨基吡啶与硝基芳烃的氧化还原羰基化反应, 以中等到良好的收率直接制得4-吡啶基脲类化合物, 反应底物硝基芳烃的普遍适用性良好.
[ 1 ]Pandurangan K., Kitchen J. A., Blasco S., Paradisi F., Gunnlaugsson T.,Chem.Commun., 2014, 50, 10819—10822
[ 2 ]Pavia M. R., Lobbestael S. J., Taylor C. P., Hershenson F. M., Miskell D. L.,J.Med.Chem., 1990, 33(2), 854—861
[ 3 ]Hemmateenejad B., Miri R., Tabarzad M., Jafarpour M., Zand F.,J.Mol.Struct., 2004, 684, 43—49
[ 4 ]Fujimoto Y., Nagata R., Fukasawa H., Yano K., Azuma M., Iida A., Sugimoto S., Shudo K., Hashimoto Y.,Eur.J.Biochem., 1998, 258, 794—802
[ 5 ]Zawadzki P., S’lsarek G., Boryski J., Wojtaszek P.,Biol.Chem., 2010, 391, 43—53
[ 6 ]Takami A., Iwakubo M., Okada Y., Kawata T., Odai H., Takahashi N., Shindo K., Kimura K., Tagami Y., Miyake M., Fukushima K., Inagaki M., Amano M., Kaibuchi K., Iijima H.,Bioorg.Med.Chem., 2004, 12, 2115—2137
[ 7 ]Makiuchi N., Sudo A., Endo T.,J.Polym.Sci.,PartA:Polym.Chem., 2015, 53, 2569—2574
[ 8 ]Makiuchi N., Sudo A., Endo T.,J.Polym.Sci.,PartA:Polym.Chem., 2014, 52, 2518—2522
[ 9 ]Chen Z. C., Venkatesan A. M., Santos O. D., Santos E. D., Dehnhardt C. M., Ayral-Kaloustian S., Ashcroft J., McDonald L. A., Mansour T. S.,J.Org.Chem., 2010, 75(5), 1643—1651
[10]Saurat T., Buron F., Rodrigues N., Tauzia M. L., Colliandre L., Bourg S., Bonnet P., Guillaumet G., Akssira M., Corlu A., Guillouzo C., Berthier P., Rio P., Jourdan M. L., Bénédetti H., Routier S.,J.Med.Chem., 2014, 57, 613—631
[11]Zhang Y. Q., Anderson M., Weisman J. L., Lu M., Choy C. J., Boyd V. A., Price J., Sigal M., Clark J., Connelly M., Zhu F. Y., Guiguemde W. A., Jeffries C., Yang L., Lemoff A., Liou A. P., Webb T. R., DeRisi J. L., Guy R. K.,ACSMed.Chem.Lett., 2010, 1, 460—465
[12]Venkatesan A. M., Chen Z. C., Santos O. D., Dehnhardt C., Santos E. D., Ayral-Kaloustian S., Mallon R., Hollander I., Feldberg L., Lucas J., Yu K., Chaudhary I., Mansour T. S.,Bioorg.Med.Chem.Lett., 2010, 20, 5869—5873
[13]Zhao Q. L., Yang X. J., Jia C. D., Wu B.,Inorg.Chem.Commun., 2010, 13, 873—877
[14]Celia S. P., Josep V. M., Consuelo A., Antonio A. S., Antonio A. F.,Org.Biomol.Chem., 2011, 9, 4863—4872

[16]Kotecki B. J., Fernando D. P., Haight A. R., Lukin K. A.,Org.Lett., 2009, 11(4), 947—950
[17]Gavade S. N., Balaskar R. S., Mane M. S., Pabrekar P. N., Shingare M. S., Mane D. V.,Chin.Chem.Lett., 2011, 22, 675—678
[18]Gavade S., Balaskar R., Mane M., Pabrekar P. N., Mane D.,Synth.Commun., 2012, 42, 1704—1714
[19]Atwal K. S., Grover G. J., Ahmed S. Z., Ferrara F. N., Harper T. W., Kim K. S., Sleph P. G., Dzwonczyk S., Russell A. D.,J.Med.Chem., 1993, 36(24), 3971—3974
[20]Honma T., Hayashi K., Aoyama T., Hashimoto N., Machida T., Fukasawa K., Iwama T., Ikeura C., Ikuta M., Suzuki-Takahashi I., Iwasawa Y., Hayama T., Nishimura S., Morishima H.,J.Med.Chem., 2001, 44, 4615—4627
[21]Zhang X. P., Miao J. H., Sun Y. B.,ChineseJ.Org.Chem., 2009, 29(10), 1555—1563(张晓鹏, 苗江欢, 孙玉标. 有机化学, 2009, 29(10), 1555—1563)
[22]Zhang X. P., Lu S. W.,Chem.J.ChineseUniversities, 2008, 29(6), 1137—1140(张晓鹏, 陆世维. 高等学校化学学报, 2008, 29(16), 1137—1140)
[23]Sonoda N.,PureAppl.Chem., 1993, 65(4), 699—706
[24]Pavia M. R., Lobbestael S. J., Taylor C. P., Hershenson F. M., Miskell D. V.,J.Med.Chem., 1990, 33(2), 854—861
[25]Soshiro T., Koichi S., Toshihiko O., Kumiko Y., Yo I.,Phytochemistry, 1978, 17, 1201—1207
(Ed.: P, H, F, K)
Selenium-catalyzed Carbonylation of 4-Aminopyridine with Nitro Aromatics to 4-Pyridinylureas†
ZHANG Xiaopeng*, LI Zhengwei, WANG Yan, NIU Xueli, ZHANG Guisheng
(CollaborativeInnovationCenterofHenanProvinceforGreenManufacturingofFineChemicals,KeyLaboratoryofGreenChemicalMediaandReactions,MinistryofEducation,SchoolofChemistryandChemicalEngineering,HenanNormalUniversity,Xinxiang453007,China)
A facile, economical and environment-friendly approach to 4-pyridinylureas was reported. With cheap and easily available nonmetal selenium as the catalyst, triethylamine as the cocatalyst, carbon monoxide instead of virulent phosgene as the carbonylation reagent, the target products could be obtainedviaselenium-catalyzed redox carbonylation of 4-aminopyridine with nitro aromatics by bubbling of CO. The optimal reaction conditions were obtained by exploring the effects of main factors on the carbonylation reaction such as reaction temperature, reaction time, kinds of solvents and bases. Under the optimal conditions, 4-pyridinylureas could be obtained in moderate to good yields. The applicability of the substrates nitro aromatics was good. The possible reaction mechanism was also proposed at the end of this paper.
Selenium-catalysis; Carbonylation; 4-Pyridinylurea
10.7503/cjcu20160410
2016-06-07. 网络出版日期: 2016-08-23.
河南省高校科技创新团队支持计划项目(批准号: 15IRTSTHN003)、 河南省高等学校青年骨干教师项目(批准号: 2013GGJS-059)和河南师范大学青年骨干教师项目(批准号: 2011-8)资助.
O621.3
A
联系人简介: 张晓鹏, 男, 博士, 副教授, 主要从事绿色有机合成方面的研究. E-mail: zhangxiaopengv@sina.com
† Supported by the Program for Innovative Research Team in Science and Technology in University of Henan Province, China(No.15IRTSTHN003), the Young Backbone Teachers Training Fund of Education Department of Henan Province, China(No.2013GGJS-059) and the Young Backbone Teachers Training Fund of Henan Normal University, China(No.2011-8).
