基于罗丹明荧光信号报告基团的细胞通透性铜离子荧光探针
2016-11-02米小龙焦晓洁曾宪顺
米小龙, 焦晓洁, 刘 畅, 何 松, 曾宪顺
(天津理工大学材料科学与工程学院, 显示材料与光电器件省部共建教育部重点实验室, 天津 300384)
基于罗丹明荧光信号报告基团的细胞通透性铜离子荧光探针
米小龙, 焦晓洁, 刘畅, 何松, 曾宪顺
(天津理工大学材料科学与工程学院, 显示材料与光电器件省部共建教育部重点实验室, 天津 300384)
分别以罗丹明B和罗丹明6G为荧光信号报告基团, 以增强水溶性为目的的羟乙基肼为修饰基团, 合成了反应型的Cu2+离子选择性荧光探针分子L1和L2. 紫外光谱和荧光光谱等分析结果表明, 探针分子L1和L2对Cu2+离子具有高灵敏度、 高选择性的光谱识别行为. 探针分子对Cu2+离子的识别过程是通过Cu2+离子催化水解控制氧杂蒽荧光信号的螺环酰肼基团实现荧光信号的开启, 从而达到识别检测Cu2+离子的目的, 对Cu2+离子的检出限均可达到10-8mol/L量级. 同时, 探针分子对常见金属离子和铵离子均具有较强的抗干扰能力. 由于羟乙基肼的引入增强了探针的水溶性, 使得探针L1和L2具有良好的细胞通透性和低毒性, 实现了其对β-胰岛细胞(INS-1细胞)中Cu2+离子的荧光成像检测.
罗丹明; 酰肼; 二价铜离子; 荧光探针; 荧光成像
铜在生物体和自然界中都是不可或缺的重要过渡金属元素. 在生物体内, Cu2+离子作为金属酶和转录过程中重要的辅助因子参与了很多重要的生理过程[1]; 在自然界中, 铜是人类最早使用的金属之一, 环境中常常可以检测出Cu2+离子的存在. 然而, 过量存在的Cu2+离子对生物体和环境均有不利影响[2,3]. 诸多神经退行性疾病, 如阿尔兹海默病[4]、 帕金森病[5]及威尔森病[6]等都与人体中存在过量的Cu2+离子所导致的氧化应激和神经紊乱有关; 而Cu2+离子对环境中水的污染也很严重, 饮用水中如含有过量的Cu2+离子会引起人胃肠功能紊乱和肝肾功能损伤[7]; 同时, 在自然环境中存在的高浓度Cu2+离子会损害海洋、 河流的自净能力[8]. 因此, 监控生物体内和环境载体中Cu2+离子的浓度十分必要.
荧光检测方法具有响应快速、 灵敏度高和探针易制备[9,10]等优点, 基于荧光检测方法的Cu2+离子探针的研究近年来备受关注. 已报道的Cu2+离子荧光探针主要基于2种化学作用机制: Cu2+离子与探针配位形成配合物[11~14], 或Cu2+离子引发探针发生一些特殊的化学反应[15~17]. 由于Cu2+离子自身的顺磁性特点[18,19], 通过探针分子与Cu2+离子配位进行Cu2+离子检测的方法往往会引起探针的荧光信号猝灭[20~22], 从检测灵敏度角度考虑, 猝灭型的荧光检测并不是分析检测的最佳方式. 同时, 由Irving-Williams序列规则可知, 通过配位作用识别Cu2+离子的荧光探针容易被其它等电荷过渡金属离子如Mn2+, Fe2+, Co2+和Ni2+等离子干扰. 因此, 设计由Cu2+离子引发探针发生特定的化学反应而引起紫外或荧光光谱信号发生变化的Cu2+离子荧光探针已成为近年来的研究热点. 这类由Cu2+离子引发化学反应的荧光探针往往会表现出荧光增强的效果[23~26], 有助于消除其它过渡金属离子造成的干扰. 其中, 具有内酰肼螺环结构的罗丹明类染料[27~29]就是一类典型的反应型荧光探针. 在氧杂蒽的π共轭体系中引入一个特殊的化学键形成内酰肼, 使荧光信号报告基团的π共轭体系处于不发光的非共轭状态; 当探针分子与Cu2+离子发生作用时, Cu2+离子可引发反应断开该化学键, 开启共轭体系, 恢复罗丹明荧光团的发光性能, 从而达到检测Cu2+离子的目的.
本文基于Cu2+离子可促进α-氨基酸酯水解和Cu2+离子可对罗丹明螺环内酰胺水解的机制[27,30,31], 分别以罗丹明B和罗丹明6G为荧光信号报告基团, 设计合成了以羟乙基肼增强水溶性的Cu2+离子选择性反应型螺环酰肼荧光探针分子L1和L2. 实验结果表明, 引入2-羟乙基官能团不但增强了探针的水溶性并保持了其肼类衍生物的识别性能, 还表现出良好的细胞穿透能力及低毒性等性能, 可实现活细胞中Cu2+离子的荧光成像检测.
1 实验部分
1.1试剂与仪器
罗丹明B和罗丹明6G购自上海晶纯试剂有限公司; 丙酮酸钠购自天津科密欧化学试剂有限公司; 2-羟乙基肼购自韶远科技有限公司; 浓硫酸、 碳酸氢钠、 氯化钠、 二氯甲烷、 甲醇、 乙腈、 乙醇、N,N-二甲基甲酰胺、 乙酸乙酯、β-巯基乙醇、 磷酸氢钠(PBS)缓冲液、 二甲基亚砜和硅胶(100~200目)均购自天津恒山化工科技有限公司; 光谱分析所用水为二次蒸馏水, 无荧光杂质.
RY-2型熔点仪(天津市分析仪器厂); Bruker AVANCE Ⅲ型核磁共振波谱仪(1H NMR, 400 MHz, TMS为内标, CDCl3为溶剂); UV-2550型紫外-可见(UV-Vis)分光光度计(日本Shimadzu公司); F-4600型荧光光谱仪(日本Hitachi公司); ZAB-HS型质谱仪(英国VG公司); FV-1000型激光共聚焦显微镜(日本Olympus公司).
1.2探针分子的合成
探针分子L1和L2的合成路线如Scheme 1所示.

Scheme 1 Synthetic routes for probes L1 and L2
探针分子L1的合成: 称取1.82 g(4.1 mmol)罗丹明B置于100 mL圆底烧瓶中, 加入15 mL甲醇溶解. 在搅拌下缓慢滴入4 mL浓H2SO4, 回流36 h. 将反应混合物倒入100 mL水中, 用碳酸氢钠中和至中性, 用二氯甲烷萃取(100 mL×3), 分离出的有机相用饱和食盐水洗涤(50 mL×2), 收集有机相并干燥, 得到1.98 g粗产品1, 粗产品1未经纯化直接用于下一步反应. 称取262.8 mg(0.533 mmol)粗产品1置于25 mL圆底烧瓶中, 加入5 mL甲醇和250 μL 2-羟乙基肼(2), 在氩气气氛中加热回流52 h. 旋转蒸干溶剂后, 固体混合物经柱色谱分离[V(SiO2)∶V(CH2Cl2/CH3COOC2H5)=5∶3], 得到107 mg紫色固体化合物L1, 产率41%, m. p. 190~192 ℃.1H NMR(400 MHz, CDCl3)(图S1, 见本文支持信息),δ: 7.92(d,J=8 Hz, 1H), 7.53~7.47(m, 2H), 7.14(d,J=8 Hz, 1H), 6.45~6.40(m, 4H), 6.26(d,J=12 Hz, 2H), 3.33(q,J=6.7 Hz, 10H), 2.45(s, 2H), 1.16(t,J=8 Hz, 12H);13C NMR(100 MHz, CDCl3)(图S2, 见本文支持信息),δ: 168.3, 153.9, 151.5, 149.0, 133.1, 130.0, 128.5, 124.2, 123.0, 108.0, 105.3, 98.0, 66.4, 58.8, 52.8, 44.5, 29.8, 12.7; HRMS,m/z: 501.2862[M+H]+.
探针分子L2的合成: 称取200 mg(0.452 mmol)罗丹明6G置于50 mL圆底烧瓶中, 加入5 mL无水乙醇, 再加入200 μL 2-羟乙基肼(2), 加热回流反应72 h, 然后旋转蒸干溶剂, 所得粗产物在乙醇中重结晶, 得到122.9 mg粉红色晶体L2, 产率58%, m. p. 273~275 ℃;1H NMR(400MHz, CDCl3)(图S3, 见本文支持信息),δ: 7.95~7.93(m, 1H), 7.52~7.50(m, 2H), 7.11~7.09(m, 1H), 6.38(s, 2H), 6.20(s, 2H), 3.32(bs, 2H), 3.21(q,J=8 Hz, 4H), 2.42(bs, 2H), 1.90(s, 6H), 1.32(t,J=6 Hz, 6H);13C NMR(100 MHz, CDCl3)(图S4, 见本文支持信息),δ: 168.2, 152.3, 151.7, 147.7, 133.2, 129.9, 128.5, 128.1, 124.1, 123.1, 117.9, 105.7, 96.8, 66.4, 58.7, 52.7, 38.5, 16.8, 14.8; HRMS,m/z: 473.2560[M+H]+.
1.3溶液的配制
实验所用分析溶液是将一定体积的探针分子浓溶液(1×10-2mol/L, DMF)与相应体积各种金属离子的水溶液(1×10-2mol/L)混合, 再用乙腈/水混合溶剂(体积比1∶5)稀释, 将分析溶液体系定容到3 mL. 在室温下, 将上述分析溶液摇匀并静置10 min后测定光谱数据.
1.4细胞的荧光成像
实验选用细胞为β-胰岛细胞(INS-1细胞), 培养基为RPMI1640培养基, 其中加入10%血清、 5×10-5mol/L的β-巯基乙醇、 1×10-6mol/L丙酮酸和500 μL双抗. 先将探针分子溶于DMSO中, 取一定量该溶液加入到含有培养好的INS-1细胞的培养板中, 最终浓度为2×10-7mol/L, 再置于细胞培养箱中孵育30 min, 用PBS缓冲液漂洗3次, 然后用倒置荧光显微镜观察; 再加入Cu2+离子的水溶液, 使其最终浓度为2×10-6mol/L, 在培养箱中孵育30 min, 最后用激光共聚焦显微镜观察.
2 结果与讨论
2.1紫外-可见光谱分析
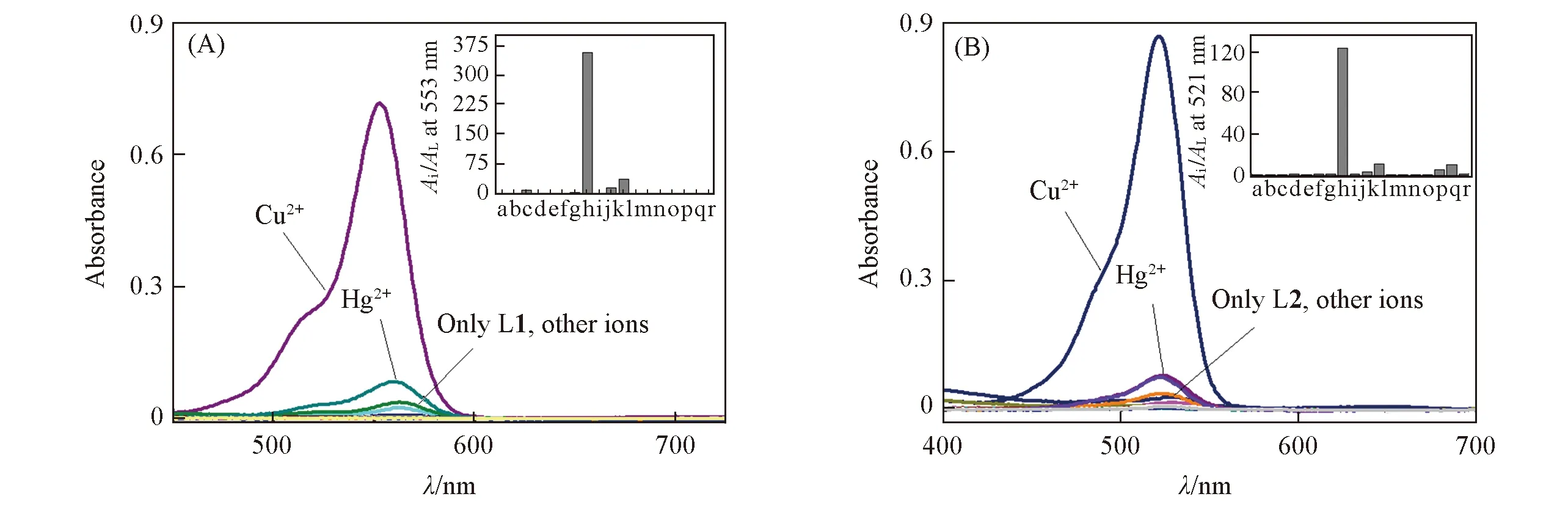
Fig.1 UV-Vis spectra of probes L1(A) and L2(B)(1×10-5 mol/L) in the presence of nitrate salts of metal ions(5×10-5 mol/L ) in MeCN/H2O(volume ratio 1∶5) solventInset: histogram representing the absorbance enhancement of probe L1 at 553 nm and probe L2 at 521 nm, respectively, in the presence of different metal ions. a. No other ions; b. Ag+; c. Al3+; d. Ca2+; e. Cd2+; f. Co2+; g. Cr3+; h. Cu2+; i. Fe2+; j. Fe3+; k. Hg2+; l. K+; m. Mg2+; n. Na+; o.p. Ni2+; q. Pb2+; r. Zn2+.
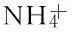
2.2荧光光谱性质
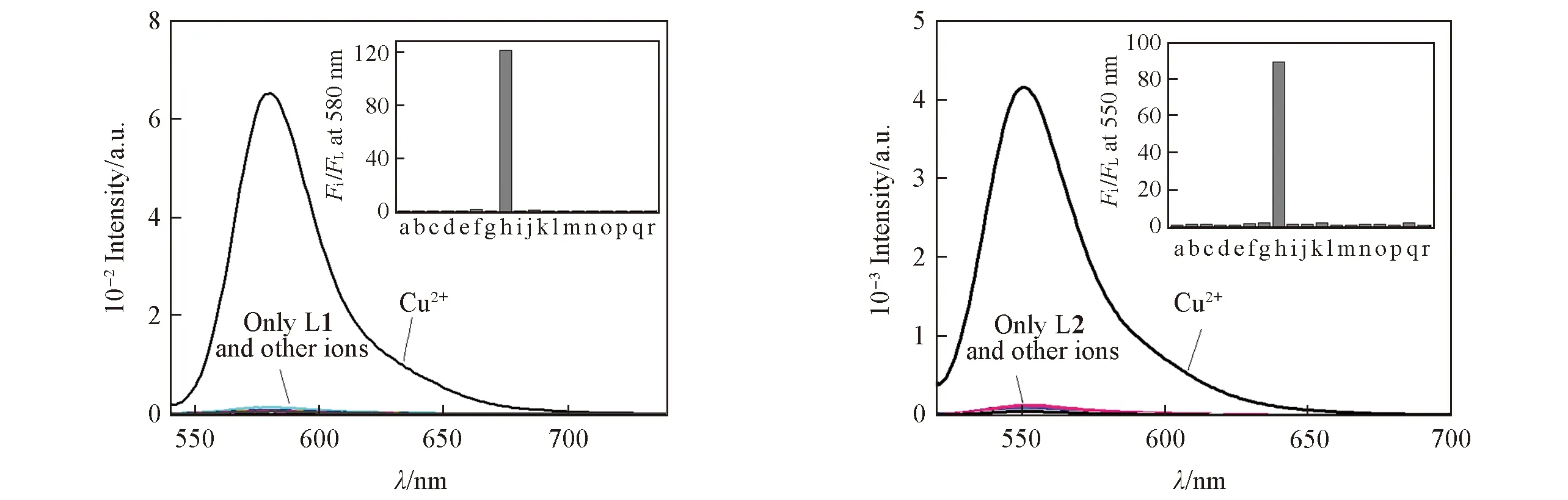
Fig.2 Fluorescence emission spectra of probes L1(A) and L2(B)(1×10-6 mol/L) in the presence of nitrate salts of metal ions(5×10-6 mol/L) in MeCN/H2O(volume ratio 1∶5)Inset: histogram representing the fluorescence enhancement of probe L in the presence of different metal ions. a. No other ions; b. Ag+; c. Al3+; d. Ca2+; e. Cd2+; f. Co2+; g. Cr3+; h. Cu2+; i. Fe2+; j. Fe3+; k. Hg2+; l. K+; m. Mg2+; n. Na+; o.p. Ni2+; q. Pb2+; r. Zn2+. Excitation was performed at 520 nm(A) and 500 nm(B). Excitation/emission slit width: 2.5 nm/5 nm.

Fig.3 Fluorescent titration spectra of probes L1(1×10-6 mol/L) in the presence of different concentrations of Cu2+ in MeCN/H2O(volume ratio 1∶5) [Cu2+]/(μmol·L-1): 0, 0.2, 0.6, 1.0, 1.8, 2.6, 3.4, 5.0, 6.6, 8.2, 9.8, 11.4, 13.0, 14.6, 16.2, 19.4, 22.6, 25.8, 30.6. Excitation was performed at 520 nm. Excitation/emission slit width: 2.5 nm/5 nm. Inset: plot of fluorescent intensity of L1 at 580 nm versus [Cu2+].
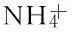
为了进一步考察探针分子对Cu2+离子识别时荧光强度变化与Cu2+离子浓度之间的关系, 进行了2种探针分子与不同浓度的Cu2+离子荧光光谱连续滴定实验, 结果见图3和图S5(见本文支持信息). 在滴定过程中, 随着Cu2+离子浓度的不断增大, 探针分子与Cu2+离子反应后的荧光光谱在580 nm(L1)和550 nm(L2)处逐渐增强. Cu2+离子浓度增量分别达到15倍(L1)和13倍(L2)时, 识别体系的荧光强度接近饱和. 而且连续滴定的荧光光谱数据很好地符合了Sigmoidal拟合曲线, 从而计算出探针分子L1和L2对Cu2+离子的荧光“开启”常数K(L1-turn-on)=2.08 μmol/L(R2=0.9998),K(L2-turn-on)=2.6 μmol/L(R2=0.9991)[33]. 另一方面, 在低浓度Cu2+离子区域, 荧光变化与Cu2+离子浓度呈现线性关系(图S6, 见本文支持信息), 利用三倍标准差法, 推测出探针分子对Cu2+离子的检出限分别为8.4×10-9mol/L(L1)和1.0×10-8mol/L(L2), 该检出限远低于美国环境保护署(EPA)对饮用水中Cu2+离子安全线规定(2×10-5mol/L)[34]的要求, 表明2种探针分子都可开发作为饮用水和工业排放废水中Cu2+离子检测或监控的荧光探针.
2.3竞争离子和pH值对体系的干扰
为了考察探针在实际复杂环境下对Cu2+离子的选择性响应, 进行了竞争离子的干扰实验. 实验结果(图4)表明, 在5倍浓度的竞争金属离子(Ag+, Al3+, Ca2+, Cd2+, Co2+, Cr3+, Fe2+, Fe3+, Hg2+, K+, Mg2+, Na+, NH+4, Ni2+, Pb2+和Zn2+)存在下, 探针分子仍可与5倍浓度的Cu2+离子发生较稳定的荧光开启行为. 如图4所示, 除了Ag+(对L1), Ni2+和Co2+(对L2)离子对探针分子的干扰达到约15%以外, 其余离子的存在均对探针分子L1和L2的荧光识别体系的影响较小, 它们之间变化差值均在12%以内. 这说明2种探针分子的抗离子干扰能力都较强, 是实际环境检测中良好的Cu2+离子识别探针.
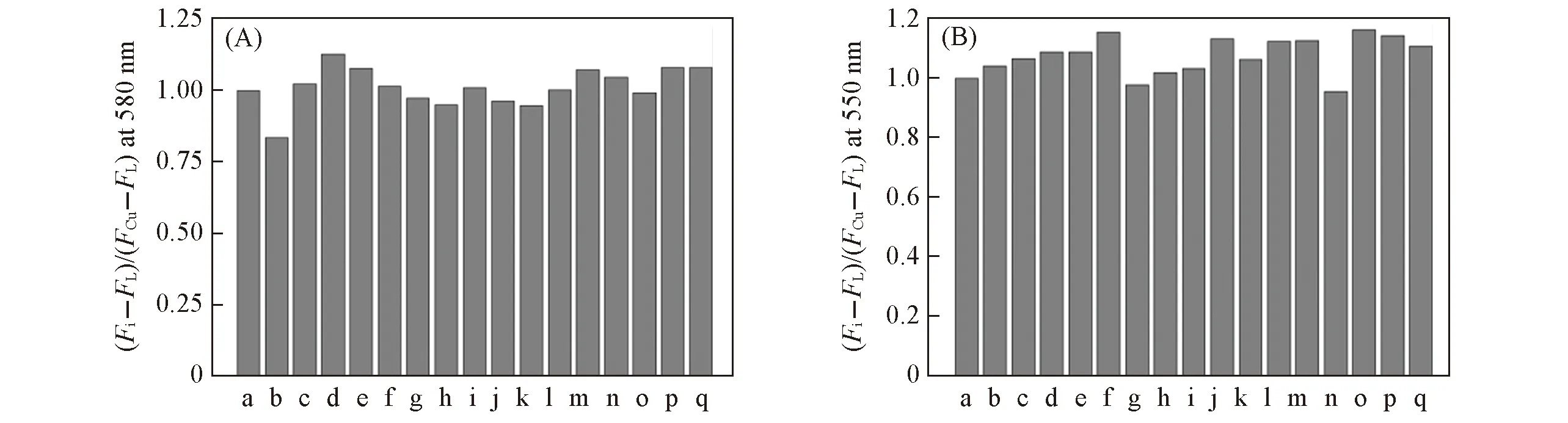
Fig.4 Relative fluorescent intensity change ratios[(Fi-FL)/(FCu2+-FL)] of probes L1(A) and L2(B)(1×10-6 mol/L) upon addition of Cu2+(5×10-6 mol/L) in the presence of metal ions(5×10-6 mol/L) in MeCN/H2O(volume ratio 1∶5)a. Cu2+; b. Cu2++Ag+; c. Cu2++Al3+; d. Cu2++Ca2+; e. Cu2++Cd2+; f. Cu2++Co2+; g. Cu2++Cr3+; h. Cu2++Fe2+; i. Cu2++Fe3+; j. Cu2++Hg2+; k. Cu2++K+; l. Cu2++Mg2+; m. Cu2++Na+; n.p. Cu2++Pb2+; q. Cu2++Zn2+. Excitation was performed at 520 nm(A) and 500 nm(B). Excitation/emission slit width: 2.5 nm/5 nm.

Fig.5 Profile of pH dependence of the fluorescence intensity of probes L1(A)(1×10-6 mol/L) at 580 nm and L2(B)(1×10-6 mol/L) at 550 nm in the absence(a) and presence(b) of Cu2+(5×10-6 mol/L) in MeCN/H2O(volume ratio 1∶5) Excitation was performed at 520 nm(A) and 500 nm(B). Excitation/emission slit width: 2.5 nm/5 nm.
此外, 还考察了不同pH体系对探针分子离子识别的影响. 由图5可见, 在未加入Cu2+离子时, 探针分子L1和L2在pH=5~12范围内荧光强度基本保持不变; 而在加入5倍浓度的Cu2+离子后, 探针分子L1和L2在pH=6~8范围内都能保持相对稳定的荧光变化, 说明它们在此范围内对体系pH变化不敏感. 以上结果表明, 探针L1和L2可分别在弱酸至弱碱的环境下直接用于Cu2+离子的检测.
2.4识别机理
通常情况下, 罗丹明类染料形成的内酰肼螺环结构对铜离子的识别是通过Cu2+离子对探针分子结构中的内酰肼螺环结构进行水解, 恢复氧杂蒽的π-共轭体系实现的[27]. 由于探针分子L1和L2结构相似, 本文以探针分子L1与Cu2+离子作用后的高分辨质谱为代表, 说明2种探针分子的识别机理(图S7, 见本文支持信息). 探针分子L1在识别Cu2+离子时荧光行为开启, 表明Cu2+离子与羟乙基酰肼的NO2识别位点结合后, 打开了探针分子L1中的螺环结构, 随着Cu2+离子进一步水解羟乙基酰肼, 溶液变为以罗丹明B为主的体系. 质谱中有明显的罗丹明B产物分子的高分辨质谱峰(m/z443.2347)以及少量没有发生水解反应的探针分子L1的质谱峰(m/z500.2738). 这些数据证实了Cu2+离子催化并水解机理的正确性. 另外, 为了进一步分析探针L1对Cu2+离子的识别模式, 向含有探针分子L1(1×10-6mol/L)和Cu2+离子(1.5×10-5mol/L)体系中加入30倍浓度的S2-离子, 发现荧光强度并没有减弱(图S8, 见本文支持信息), 表明Cu2+离子和探针分子L1发生了不可逆的水解反应而非可逆的配位结合模式.
2.5细胞内Cu2+离子的荧光成像检测

Fig.6 Bright field images(A, D), fluorescence images(B, E) and overlay images(C, F) of INS-1 cells incubated with L1(A—C) as well as L1 and Cu2+(D—F) Excitation wavelength: 559 nm.
由于探针分子L1和L2对Cu2+离子具有高灵敏度的荧光开启性能, 同时它们又具有潜在的膜通透性(良好的水溶性), 因此利用激光共聚焦显微镜考察了2种探针分子对β-胰岛细胞(INS-1细胞)中Cu2+离子的成像行为. 从图6和图7可以看出, 探针分子L1和L2能够顺利进入细胞对Cu2+离子进行成像. 由图6(A)可见, 探针分子L1(2×10-7mol/L)和细胞共培养30 min后, 无死细胞出现, 并且细胞形貌无明显变化, 说明L1毒性低, 对细胞生长不产生影响. 在559 nm波长的激光激发下, 并未观察到明显的荧光发射信号[图6(B)和(C)]; 相反, 尽管在加入2×10-6mol/L的Cu2+离子孵育30 min后细胞形貌无明显变化[图6(D)], 但在激光共聚焦显微镜下可观察到细胞中的部分区域呈现显著红色荧光信号[图6(E)]. 通过比较明场和暗场荧光重叠图可以看出, 强荧光信号发射主要集中在核周区的细胞质处中[图6(F)], 该结果充分表明探针分子L1进入细胞后主要集中在细胞质中, 可与进入细胞质中的Cu2+离子作用, 将探针分子L1中的螺环内酰肼结构水解, 恢复氧杂蒽的π共轭体系从而实现荧光信号开启型检测细胞质中的Cu2+离子. 同样, 探针分子L2呈现与L1相同的荧光成像识别检测行为(见图7), 在488 nm波长激光的激发下, 加入Cu2+离子前, 并未在细胞中观察到明显的荧光发射信号[图7(B)和(C)]; 加入Cu2+离子共培养后, L2在INS-1细胞的核周区呈现显著的绿色荧光信号, 表明探针L2进入细胞后主要分布在细胞质中[图7(E)和(F)]. 以上结果表明, 探针分子L1和L2均具有良好的细胞通透性和低毒性, 可作为细胞内Cu2+离子荧光成像检测的荧光探针.

Fig.7 Bright field images(A, D), fluorescence images(B, E) and overlay images(C, F) of INS-1 cells incubated with L2(A—C) as well as L2 and Cu2+(D—F) Excitation wavelength: 488 nm.
3 结 论
分别以罗丹明B和罗丹明6G为荧光信号报告基团, 设计合成了以羟乙基肼增强水溶性的高灵敏度、 高选择性反应型Cu2+离子荧光探针L1和L2. 通过Cu2+离子催化水解控制氧杂蒽荧光信号的螺环酰肼基团, 探针L1和L2对Cu2+离子表现出独特的荧光开启型识别检测行为和对常见离子的抗干扰能力, 检出限分别达到10-8mol/L和10-9mol/L量级, 满足环保部门对饮用水中Cu2+离子检出限的要求. 同时, 由于探针具有良好的细胞穿透能力和低毒性, 以L1和L2为荧光检测探针实现了对β-胰岛细胞(INS-1细胞)中Cu2+离子的荧光成像检测. 总之, L1和L2为高灵敏度、 高选择性反应型Cu2+离子荧光探针, 具有开发为实际应用前景的铜离子荧光探针和活细胞中Cu2+离子荧光成像检测探针的潜力.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20160402.
[ 1 ]Cowan J. A.,InorganicBiochemistry:AnIntroduction, Wiley-VCH, New York, 1997, 133—134
[ 2 ]High B., Bruce D., Richter M. M.,Anal.Chim.Acta, 2001, 449, 17—22
[ 3 ]Tapia L., Suazo M., Hodar C., Cambiazo V., Gonzalez M.,Bio.Metals, 2003, 16, 169—174
[ 4 ]Barnham K. J., Masters C. L., Bush A. I.,Nat.Rev.DrugDiscovery, 2004, 3, 205—214
[ 5 ]Gorell J. M., Johnson C. C., Rybicki B. A., Peterson E. L., Kortsha G. X., Brown G. G., Richardson R. J.,Neurotoxicology, 1999, 20, 239—247
[ 6 ]Waggoner D. J., Bartnikas T. B., Gitlin J. D.,Neurobiol.Dis., 1999, 6, 221—230
[ 7 ]Georgopoulos P. G., Roy A., Yonone-Lioy M. J., Opiekun R. E., Lioy P. J.,J.Toxicol.Environ.Health,PartB, 2001, 4, 341—394
[ 8 ]Zhao Y., Zhang X., Han Z., Qiao L., Li C., Jian L., Shen G., Yu R.,Anal.Chem., 2009, 81(16), 7022—7030
[ 9 ]de Silva A. P., Gunaratne H. Q. N., Gunnlaugsson T., Huxley A. J. M., McCoy C. P., RademacherJ. T., Rice T. E.,Chem.Rev., 1997, 97, 1515—1566
[10]Prodi L., Bolletta F., Montalti M., Zaccheroni N.,Coord.Chem.Rev., 2000, 205, 59—83
[11]Grandini P., Mancin P., Tecilla P., Scrimin P., Tonellato U.,Angew.Chem.Int.Ed., 1999, 38(20), 3061—3064
[12]Lee Y. H., Park N., Park Y. B., Hwang Y. J., Kang C., Kim J. S.,Chem.Commun., 2014, 50, 3197—3200
[13]Xue X., Fang H., Chen H., Zhang C., Zhu C., Bai Y., He W., Guo Z.,DyesandPigments, 2016, 130, 116—121
[14]Wang X., Ma X., Yang Z., Zhang Z., Wen J., Geng Z., Wang Z.,Chem.Commun., 2013, 49, 11263—11265
[15]Fan J., Zhan P., Hu M., Sun W., Tang J., Wang J., Sun S., Song F., Peng X.,Org.Lett., 2013, 15, 492—495
[16]Swamy K. M. K., Ko S. K., Kwon S. K., Lee H. N., Mao C., Kim J. M., Lee K. H., Kim J., Shin I., Yoon J.,Chem.Commun., 2008, 5915—5917
[17]Zhou Z., Li N., Tong A.,Anal.Chim.Acta, 2011, 702, 81—86
[18]Andréasson J., Kodis G., Terazono Y., Liddell P. A., Bandyopadhyay S., Mitchell R. H., Moore A. L., Gust D.,J.Am.Chem.Soc., 2004, 126(49), 15926—15927
[19]Malkondu S., Turhan D., Kocak A.,TetrahedronLett., 2015, 56, 162—167
[20]Liu Z., Zhang C., Wang X., He W., Guo Z.,Org.Lett., 2012, 14, 378—4381
[21]Wang H., Yang L., Zhang W., Zhou Y., Zhao B., Li X.,Inorg.ChimicaActa, 2012, 381, 111—116
[22]Li C., Liu Z., Miao Y., Zhou X., Wu X.,DyesandPigments, 2016, 125, 292—298
[23]Kim M. H., Jang H. H., Yi S., Chang S. K., Han M. S.,Chem.Commun., 2009, 4838—4840
[24]Wu C., Bian Q. N., Zhang B. G., Cai X., Zhang S. D., Zheng H., Yang S. Y., Jiang Y. B.,Org.Lett., 2012, 14, 4198—4201
[25]Wang D., Shirashi Y., Hirai T.,Chem.Commun., 2011, 47, 2673—2675
[26]Liang L., Zhao L., Zeng X.,J.Fluoresc., 2014, 24, 1671—1677
[27]Dujols V., Ford F., Czarnik A. W.,J.Am.Chem.Soc., 1997, 119, 7386—7387
[28]Kwon J. Y., Jang Y. J., Lee Y. J., Kim K. M., Seo M. S., Nam W., Yoon J.,J.Am.Chem.Soc., 2005, 127, 10107—10111
[29]Cao L., Jia C., Zhang Q., Chen D., Zhang C., Qian Y.,Chem.Res.ChineseUniversities, 2014, 30(3), 362—367
[30]Bender M. L., Turnquest B. W.,J.Am.Chem.Soc., 1957, 79, 1889—1893
[31]Liu K., Shang H., Meng F., Liu Y., Lin W.,Talanta, 2016, 147, 193—198
[32]Zhang X. F., Zhang Y., Liu L.,J.Lumin. 2014, 145, 448—453
[33]Du P., Lippard S. J.,Inorg.Chem., 2010, 49, 10753—10755
[34]World Health Organization,GuidelinesforDrinking-WaterQuality, Geneva, 1996
(Ed.: N, K)
† Supported by the National Natural Science Foundation of China(Nos.21272172, 11432016, 21074093) and the Tianjin Key Research Program of Application Foundation and Advanced Technology, China(No.12JCZDJC21000).
Rhodamine-based Cell Permeable Fluoresecent Turn-on Probes for Cupric Ion†
MI Xiaolong, JIAO Xiaojie, LIU Chang, HE Song*, ZENG Xianshun*
(KeyLaboratoryofDisplayMaterialsandPhotoelectricDevices(MinistryofEducation),SchoolofMaterialsScience&Engineering,TianjinUniversityofTechnology,Tianjin300384,China)
Two rhodamine-based fluorescent turn-on probes L1 and L2 were designed and synthesized for the detection of Cu2+ion. L1 and L2 exhibit high selectivity toward Cu2+ion over a wide range of metal ions in MeCN/H2O(volume ratio 1∶5). The detection limits of the probes are down to 10-8mol/L range. Moreover, L1 and L2 can function as excellent fluorescence probes for imaging of cellular Cu2+by means of fluorescence microscopy.
Rhodamine; Hydrazide; Cupric ion; Fluorescence probe; Fluorescence imaging
10.7503/cjcu20160402
2016-06-06. 网络出版时间: 2016-09-18.
国家自然科学基金(批准号: 21272172, 11432016, 21074093)和天津市自然科学基金(批准号: 12JCZDJC21000)资助.
O657; O626
A
联系人简介: 曾宪顺, 男, 博士, 研究员, 博士生导师, 主要从事主-客体化学和超分子化学研究. E-mail: xshzeng@tjut.edu.cn
何松, 女, 博士, 副教授, 主要从事超分子化学研究. E-mail: hesong@tjut.edu.cn
