TCF21基因对肺腺癌A549细胞DDP化疗及放疗敏感性的影响*
2016-11-01陆晓,冼磊
陆 晓,冼 磊
(广西医科大学第一附属医院心胸外科,南宁 530021)
·论著·doi:10.3969/j.issn.1671-8348.2016.27.002
TCF21基因对肺腺癌A549细胞DDP化疗及放疗敏感性的影响*
陆晓,冼磊△
(广西医科大学第一附属医院心胸外科,南宁 530021)
目的为探讨转录因子21(TCF21)基因对人肺癌A549细胞放化疗敏感性的影响。方法利用慢病毒转染技术在肺癌A549细胞中高表达TCF21基因,以荧光定量PCR、Western blot分析目的基因的表达,用四甲基偶氮唑蓝(MTT)法检测高表达TCF21肺腺癌A549细胞对顺铂(DDP)化疗敏感性的影响,平板克隆实验检测高表达TCF21肺腺癌A549细胞对放疗敏感性的影响。结果在72 h时,随着DDP浓度的增高(0、0.625、1.250、2.500、5.000、10.000 mg/L),各组细胞的抑制率相应增高,高表达组各个药物浓度时的抑制率明显高于空载体组与未转染组(P<0.05),而后两者之间无明显差异;过表达TCF21组随着药物浓度及时间及的增加,高表达组抑制率相应增高(P<0.05);接受X照射后,未转染组、未转染+放疗组、空载体组、空载体+放疗组、高表达组及高表达+放疗组克隆形成率分别为:95.17%±2.85%、88.20%±2.03%、93.80%±4.17%、85.60%±2.42%、71.67%±3.21%、56.00%±2.65%。结论TCF21基因高表达能显著增强肺癌A549细胞对放疗及DDP化疗敏感性。
肺肿瘤;放射疗法;药物疗法;A549;TCF21;敏感性
肺癌发病率和病死率均占恶性肿瘤的第一位[1]。其中约85%~90%为非小细胞肺癌(non-small cell lung cancer,NSCLC)。由于大部分患者就诊时已处于中晚期,存在局部及远处转移,放、化疗作为综合性治疗的一部分,是临床上肺癌主要治疗方法之一。转录因子21(transcription factor 21,TCF-21)基因是近几年开始研究的一个较新的基因,位于人染色体6q23-q24,属于基本螺旋环螺旋转录因子(basic helix-loop-helix transcription factors,bHLH)家族。bHLH家族的转录因子具有中胚层特异性,对中胚层组织细胞增殖、分化、凋亡以及肿瘤发生发挥重要作用[2]。研究表明TCF-21的表达与多种肿瘤(头颈部肿瘤、肺癌、肾透明细胞癌、黑色素瘤、胃癌)的发生发展相关[3-7],但其作用的具体机制尚不明朗。本实验观察了TCF21基因对非小细胞肺癌细胞株(A549)顺铂(DDP)化疗以及放疗敏感性增敏作用并探讨机制,初步判断TCF21基因是否能作为一种新的化疗及放射增敏靶点用于临床以便提高NSCLC 的5年生存率。
1 材料与方法
1.1实验材料NSCLC 细胞株(A-549)由华中科技大学同济医学院免疫学教研室提供;RPMI 1640、10%胎牛血清购于Hyclone公司;兔抗人多克隆抗TCF21抗体购自Abcam公司(ab32981);顺铂购于美国Sigma公司,荧光定量PCR仪(Step one plus)。
1.2实验方法
1.2.1细胞培养人肺腺癌A549细胞株,用含10%胎牛血清的1640培养基(并添加1%的青霉素链霉素)于37℃、5% CO2条件下培养。
1.2.2慢病毒转染及细胞稳定转染株筛选将细胞分为高表达组 (含目的基因TCF21高表达组)、空载体组(阴性对照组)和未转染组(即未处理组),转染试剂由上海吉凯基因公司提供。转染流程按照吉凯基因公司说明书进行。转染前8 h取对数生长期细胞,调整细胞浓度为每毫升3×104个,取A549细胞100 μL接种至96孔板,总液体量为每孔2 mL;待细胞融合率达到50%~60%时开始转染,转染MOI值为50;8字混匀后于37℃、5% CO2条件下培养。转染10 h后将液体换为含10%胎牛血清的1640培养基。待细胞处于对数生长期,在高表达组和空载体组分别加入终浓度为2 μg/mL的puromycin,7 d后puromycin浓度减半,药物筛选约15 d后,随机选取多个视野,分别计数白光与荧光条件下的可见细胞数,通过相同视野中荧光条件下可见细胞数与白光条件下可见细胞数之比计算平均转染效率。
1.2.3实时荧光定量PCR检测细胞中TCF21的表达AxyGen RNA提取试剂盒提取细胞总RNA,取1 μg RNA作为模板进行逆转录,合成cDNA,以GAPDH作为内参,使用TIANGEN生物公司的SYBR Green Master Mix进行荧光定量PCR。PCR进行40个循环,循环参数为(94℃ 10 min,54.5℃ 30 s,72℃ 32 s)引物如下:TCF21上游5′-CCA GCT ACA TCG CCC ACT TG-3′,下游5′-CTT TCA GGT CAC TCT CGG GTT TC-3′,GAPDH上游5′-ACC ACA GTC CAT GCC ATC AC-3′,下游5′-TCC ACC ACC CTG TTG CTG TA-3′。反应体系为:SYBR super Mix荧光混合物10 μL,模板混合液(上、下游引物)1 μL,水8 μL,cDNA 1 μL。RT-PCR结果分析,采用相对定量法检测转染组与对照组之间的差异化表达,以GAPDH作为内参照。根据扩增曲线,按照2-ΔΔCt法通过管家基因GAPDH进行校正。
1.2.4Western blot检测细胞中TCF21蛋白的表达提取各组细胞中的总蛋白。蛋白跑胶(SDS-PAGE:5%浓缩胶,10%分离胶)后转膜至0.22 μm的PVDF膜上。5%牛奶封闭0.5 h,4℃孵育TCF21(1∶2 000稀释)和GAPDH(1∶5 000稀释)一抗过夜。充分洗膜后室温孵育二抗1 h,再次洗膜后进行ECL发光,柯达胶片显影、定影。
1.2.5四甲基偶氮唑蓝(MTT)法检测高表达TCF21后A549细胞对化疗药物的敏感性取培养各组细胞,分别细胞计数,调整细胞浓度为每毫升3×104。胞悬液接种于96孔培养板,每孔100 μL,培养8 h 细胞贴壁后分别加入DDP至终浓度0、0.625、1.250、2.500、5.000、10.000 mg/L,每组各设5复孔。置37℃、5% CO2的饱和湿度培养箱分别培养24、48、72、96 h后,各孔加MTT 20 μL。上述条件继续培养4 h,弃上清液后,每孔加二甲基亚砜溶液(DMSO)150 μL终止反应,微量振荡器振荡10 min,置酶标仪设置在570 nm下,测定各孔的吸光度A值。药物对肿瘤细胞抑制率计算公式:药物对肿瘤细胞抑制率= [1-(药物孔平均A值/肿瘤细胞阴性对照孔平均A值)]×100%[8]。
1.2.6平板克隆形成实验检测高表达TCF21对A549细胞放疗敏感性的影响取培养的各组细胞分别计数,取400个细胞接种于6 孔板中,补充含10%胎牛血清的1640至每孔2 mL,每组细胞接种3孔。8 h贴壁后接受2 Gy 的X 线照射(照射条件:6 MV光子线,源皮距(SSD)为100 cm,照射野10 cm×10 cm,剂量DT =2 Gy,射野覆盖全细胞培养板),然后置于37℃,体积分数为5% CO2的恒温培养箱中培养10~14 d, 甲醇固定,结晶紫染色,低倍镜下计数大于50 个细胞的克隆,以上实验重复3 次取均数。实验计算克隆形成率(%)=细胞克隆数/接种细胞数×100 %。

2 结 果
2.1TCF21高表达慢病毒成功转染细胞为检测慢病毒转染的转染效率,运用荧光显微镜对转染后经筛选的稳转株进行观察计数。高表达组和空载体组均可见绿色荧光蛋白表达,且平均转染效率为85%(图1)。

图1 TCF21在肺癌细胞A549中的表达(×160)
2.2RT-PCR检测TCF21基因mRNA的表达水平为检测TCF21是否成功高表达,对转染后经筛选的稳转株进行了荧光定量PCR检测。结果表明高表达组mRNA表达量(20 452.65±190.12)远高于未转染组和空载体组的TCF21 mRNA表达量(1.00±0.21和0.75±0.16,P<0.05,图2A)。
2.3Western blot检测TCF21蛋白的表达水平为检测TCF21蛋白是否成功高表达,采用Western blot技术检测各组细胞中TCF21蛋白表水平。结果表明相较于未转染组,高表达组TCF21蛋白表达量明显增高,而空载体组和未转染组均未见明显TCF21蛋白表达。这与荧光定量PCR的检测结果一致,进一步说明肺腺癌A549细胞中成功高表达了TCF21(图2B)。
2.4MTT法检测高表达TCF21对肺腺癌A549细胞DDP化疗敏感性的影响为检测高表达TCF21对肺腺癌A549细胞DDP化疗敏感性的影响,对不同浓度DDP、不同时间作用后的各组细胞采用MTT法进行了细胞活性检测。实验结果显示:在72 h时,随着DDP浓度的增高(0、0.625、1.250、2.500、5.000、10.000 mg/L),除药物浓度为0 mg/L外各组细胞的抑制率相应增高(表1),且高表达组各个药物浓度时的抑制率相较于空载体组与未转染组均明显增高(P<0.05),而后两者之间无明显差异;且过表达TCF21组随着药物浓度及时间及的增加,除药物浓度为0 mg/L外各时间段抑制率相应增高(表2,P<0.05)。说明TCF21能增强肺腺癌A549细胞对DDP化疗敏感性(图3)。

A:荧光定量PCT;B:Western blot检测。
图2荧光定量PCR及Western blot检测TCF21在各组中的表达
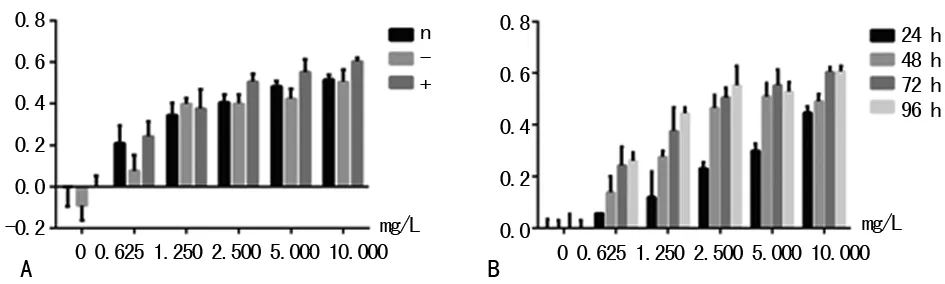
A:72h时不同浓度DDP对各组细胞化疗敏感性的影响(n:未转染组;-:空载体组、+:高表达组);B:不同浓度DDP及不同时间对高表达TCF21组化疗敏感性的影响。
图3MTT检测DDP对化疗敏感性的影响

A、B、C未接受X线照射,D、E、F接受X线照射。

图4 平板克隆实验检测高表达TCF21对A549细胞放疗敏感性的影响(结晶紫×80)
2.5平板克隆形成实验检测高表达TCF21对A549细胞放疗敏感性的影响为检测高表达TCF21对A549细胞放疗敏感性的影响,采用平板克隆形成实验对接受2 Gy的X线照射后的各组细胞进行了增殖活性检测。结果表明:2周后,未转染组、未转染+放疗组、空载体组、空载体+放疗组、高表达组及高表达+放疗组克隆形成率分别为:95.17%±2.85%、88.20%±2.03%、93.80%±4.17%、85.60%±2.42%、71.67%±3.21%、56.00%±2.65%。实验结果显示高表达组细胞克隆形成率低于其他各组,差异有统计学意义(P<0.05),见图4。

表2 实验组不同药物浓度DDP及不同药物作用时间对各组细胞的抑制率±s)
3 讨 论
肺腺癌在我国的发病率有上升趋势,已成为我国最常见的病理类型。肺腺癌约占原发性肺癌的50%,但其发生机制尚不明朗。研究表明多种抑癌基因(如p53、PTEN、Rb等)启动子异常甲基化导致基因表达异常与肺癌发生密切相关[9-13]。TCF21是新进发现的抑癌基因。研究表明TCF21在多种肿瘤中存在启动子区域甲基化,且其在肿瘤组织中的表达量较正常组织明显降低。本课题组前期研究表明抑癌基因TCF21可抑制A549细胞的增殖和迁移、诱导凋亡[14]。
当前LAC 的治疗手段主要包括手术、放疗和化疗等。但肺癌的多重耐药(multi-drug resistance,MDR)一直严重影响着LAC 的化疗效果和预后。临床多以联合化疗、联合放疗等来提高治疗效果。同时作用强而毒副作用较小的放、化疗增敏剂越来越受到大家的关注。
TCF-21属于bHLH家族成员。bHLH蛋白在HLH区域构成非共价二聚体,形成一对DNA结合基序,竟而结合至E盒(CANNTG)的共同DNA序列,通过调节在多种发育相关基因的启动子和(或)增强子而发挥其转录激活或阻抑作用[15]。对TCF21基因所属的bHLH家族研究发现,经典的bHLH转录因子DEC1/2突变或缺失与多种肿瘤如口腔癌、乳腺癌的发生及转移特征密切相关[16-23]。DEC1/2作为PI3K/AKT信号传导途径的靶基因调节c-Myc的表达参与乏氧诱导的细胞增殖[24]。还有研究发现,TCF-21基因作为肾母细胞瘤抑制基因1(Wilms′ tumour suppressor gene 1,WT1)基因的下游,WT1可直接结合TCF-21上游区域调控TCF-21基因的表达[25]。而WT1可通过PI3K/AKT信号通路影响DDP对肺癌的化疗敏感性[25]。
众所周知,PI3K/AKT信号通路在正常生理和致癌过程对细胞增殖、分化起着重要作用。此外,异常的激活PI3K/AKT/mTOR途径是获得性耐药的机制之一[25-26]。由于TCF-21基因所属的bHLH家族中的经典转录因子是PI3K/AKT信号传导途径的一个重要的靶基因,而且TCF-21基因有可能通过PI3K/AKT信号通路影响DDP对肺癌的化疗敏感性。因此,作者提出假设:TCF-21有无可能是通过PI3K/AKT信号通路影响肿瘤细胞的增殖,也通过PI3K/AKT信号通路影响DDP对肺癌的化疗敏感性?
本研究通过体外细胞培养进一步探索TCF21高表达对肺腺癌A549细胞DDP化疗及放疗敏感性的影响,结果发现TCF21基因高表达能显著增强肺癌A549细胞对放疗及DDP化疗敏感性。那么TCF21是否是通过PI3K/AKT信号通路影响DDP对肺癌的化疗敏感性,这一猜想尚需实验证实。另一方面,作为癌症中频繁被激活的信号通路之一,PI3K/AKT通路在多种癌症中表达异常。那么TCF21是否通过PI3K/AKT通路实现抑癌作用,这需要进一步拓展研究。
本研究通过肺腺癌细胞株A549体外细胞培养来探索TCF21高表达对肺腺癌A549细胞顺铂化疗及放疗敏感性的影响,问题在于体外细胞实验不能够完全模拟体内生理环境,故实验存在一定的局限性。对于本研究中TCF21基因高表达引起的放、化疗增敏作用,为进一步确定其准确性,应该进一步检测细胞增殖和凋亡相关mRNA及蛋白的表达量,以及小鼠体内实验。这也为后期研究留下了空间。
[1]支修益,吴一龙,马胜林,等.原发性肺癌诊疗规范(2011年版)[J].中国肺癌杂志,2012,15(12):677-688.
[2]Robb L,Mifsud L,Hartley L,et al.Epicardin:a novel basic helix-loop-helix transcription factor gene expressed in epicardium,branchial arch myoblasts,and mesenchyme of developing lung,gut,kidney,and gonads[J].Dev Dyn,1998,213(1):105-113.
[3]Smith LT,Lin M,Brena RM,et al.Epigenetic regulation of the tumor suppressor gene TCF21 on 6q23-q24 in lung and head and neck cancer[J].Proc Natl Acad Sci U S A,2006,103(4):982-987.
[4]Arab K,Smith LT,Gast A,et al.Epigenetic deregulation of TCF21 inhibits metastasis suppressor KISS1 in metastatic melanoma[J].Carcinogenesis,2011,32(10):1467-1473.
[5]Richards KL,Zhang B,Sun M,et al.Methylation of the candidate biomarker TCF21 is very frequent across a spectrum of early-stage nonsmall cell lung cancers[J].Cancer,2011,117(3):606-617.
[6]Ye YW,Jiang ZM,Li WH,et al.Down-regulation of TCF21 is associated with poor survival in clear cell renal cell carcinoma[J].Neoplasma,2012,59(6):599-605.
[7]Funato N,Ohyama K,Kuroda T,et al.Basic helix-loop-helix transcription factor epicardin/capsulin/Pod-1 suppresses differentiation by negative regulation of transcription[J].J Biol Chem,2003,278(9):7486-7493.
[8]董立新,李向春,董淑芬,等.不同化疗药物对口腔鳞状细胞癌抑制率的体外实验分析[J].山东医药,2011,51(24):69-70.
[9]Wu DW,Lee MC,Wang J,et al.DDX3 loss by p53 inactivation promotes tumor malignancy via the MDM2/Slug/E-cadherin pathway and poor patient outcome in non-small-cell lung cancer[J].Oncogene,2014,33(12):1515-1526.
[10]Shimizu K,Yamagata K,Kurokawa MA,et al.Roles of AML1/RUNX1 in T-cell malignancy induced by loss of p53[J].Cancer Sci,2013,104(8):1033-1038.
[11]Cheng T,Zhang JG,Cheng YH,et al.Relationship between PTEN and Livin expression and malignancy of renal cell carcinomas[J].Asian Pac J Cancer Prev,2012,13(6):2681-2685.
[12]Zheng H,Takahashi H,Murai Y,et al.Low expression of FHIT and PTEN correlates with malignancy of gastric carcinomas:tissue-array findings[J].Appl Immunohistochem Mol Morphol,2007,15(4):432-440.
[13]Ropke M,Boltze C,Meyer B,et al.Rb-loss is associated with high malignancy in chondrosarcoma[J].Oncol Rep,2006,15(1):89-95.
[14]胡松.抑癌基因TCF21对肺癌细胞A549增殖,迁移和凋亡的影响[J].中国肺癌杂志,2014,17(4):302-307.
[15]Quaggin SE,Vanden Heuvel GB,Igarashi P.Pod-1,a mesoderm-specific basic-helix-loop-helix protein expressed in mesenchymal and glomerular epithelial cells in the developing kidney[J].Mech Dev,1998,71(1/2):37-48.
[16]Wu YY,Sato F,Yamada T,et al.The BHLH transcription factor DEC1 plays an important role in the epithelial-mesenchymal transition of pancreatic cancer[J].Int J Oncol,2012,41(4):1337-1346.
[17]Xu Q,Ma P,Hu C,et al.Overexpression of the DEC1 protein induces senescence in vitro and is related to better survival in esophageal squamous cell carcinoma[J].PLoS One,2012,7(7):e41862.
[18]Liu Y,Miao Y,Wang J,et al.DEC1 is positively associated with the malignant phenotype of invasive breast cancers and negatively correlated with the expression of claudin-1[J].Int J Mol Med,2013,31(4):855-860.
[19]Liu Y,Wang L,Lin XY,et al.The transcription factor DEC1 (BHLHE40/STRA13/SHARP-2) is negatively associated with TNM stage in non-small-cell lung cancer and inhibits the proliferation through cyclin D1 in A549 and BE1 cells[J].Tumour Biol,2013,34(3):1641-1650.
[20]Zhu Y,Xu L,Zhang J,et al.Sunitinib induces cellular senescence via p53/Dec1 activation in renal cell carcinoma cells[J].Cancer Sci,2013,104(8):1052-1061.
[21]Wu Y,Sato H,Suzuki T,et al.Involvement of c-Myc in the proliferation of MCF-7 human breast cancer cells induced by bHLH transcription factor DEC2[J].Int J Mol Med,2015,35(3):815-820.
[22]You JM,Lin L,Liu Q,et al.The correlation between the expression of differentiated embryo-chondrocyte expressed gene l and oral squamous cell carcinoma[J].Eur J Med Res,2014,19:21.
[23]Suzuki M,Sato F,Bhawal UK.The basic helix-loop-helix (bHLH) transcription factor DEC2 negatively regulates Twist1 through an E-box element[J].Biochem Biophys Res Commun,2014,455(3/4):390-395.
[24]Li Y,Bi Z.Ultravlolet-B induced expression of hypoxia-inducible factor 1α,transferrin receptor through EGFR/PI3K/AKT/DEC1 pathway[J].Front Med China,2007,1(1):79-86.
[25]Bandiera R,Vidal VP,Motamedi FJ,et al.WT1 maintains adrenal-gonadal primordium identity and marks a population of AGP-like progenitors within the adrenal gland[J].Dev Cell,2013,27(1):5-18.
[26]Fumarola C,Bonelli MA,Petronini PG,et al.Targeting PI3K/AKT/mTOR pathway in non small cell lung cancer[J].Biochem Pharmacol,2014,90(3):1.
The effects of TCF21 genes on radiation and chemotherapy sensitivity of A549 lung adenocarcinoma cells*
Lu Xiao,Xian Lei△
(DepartmentofCardiothoracicSurgery,theFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning,Guangxi530021,China)
ObjectiveTo investigate the transcription factor 21 (transcription factor 21,TCF21) gene on human lung cancer A549 cells sensitivity to chemotherapy.MethodsUsing lentivirus technology in A549 lung cancer cells highly expressed genes TCF21,fluorescence quantitative PCR,Western Blot analysis were used to analyse the expression of the target gene,MTT assay was used to detect the effect of TCF21 lung adenocarcinoma A549 cells on cisplatin (cis-Dichlorodiamineplatinum,DDP) chemosensitivity,and colony assay was used to detect the effect of overexpression of TCF21 lung adenocarcinoma A549 cells on radiosensitivity.ResultsAfter 72 h,with the increasing concentration of DDP (0,0.625,1.250,2.500,5.000,10.000 mg/L),corresponding inhibition rates in each group increased,and the inhibition rate of the high expression group was significantly higher in empty vector group and untransfected group (P<0.05),no significant difference between the two then;overexpression TCF21 group with drug concentration and time and increase the rate of high expression inhibition corresponding increase (P<0.05) ;after receiving X radiation,non-transfected group,untransfected plus radiotherapy group,vector group,vector plus radiotherapy group,high expression and high expression + radiotherapy colony formation rates were:95.17%±2.85%,88.20%±2.03%,93.80%±4.17%,85.60%±2.42%,71.67%±3.21%,56.00%±2.65%.ConclusionTCF21 gene expression can significantly enhance the sensitivity to radiotherapy and chemotherapy DDP A549 lung cancer cells.
lung neoplasms;radiotherapy;chemotherapy;A549;TCF21;sensitivity
广西自然科学基金资助项目(2013GXNSFAA019270)。作者简介:陆晓(1989-),住院医师,硕士,主要从事肺癌基础与临床研究。△
,E-mail:xianlei59@163.com。
R734.2
A
1671-8348(2016)27-3748-05
2016-02-18
2016-04-06)
