卡托普利联合非诺贝特对糖尿病大鼠视网膜病变保护作用的研究
2016-10-24李凌冰赵跃萍
李凌冰,赵跃萍,徐 葳,邰 贺*
卡托普利联合非诺贝特对糖尿病大鼠视网膜病变保护作用的研究
李凌冰1,赵跃萍1,徐葳2,邰贺1*
目的研究卡托普利联合非诺贝特对糖尿病大鼠视网膜细胞凋亡作用、外周血血管内皮生长因子(Vascular endothelial growth factor,VEGF)及其氧化相关物质的影响,以明确其保护糖尿病视网膜病变(Diabetic retinopathy,DR)的作用机制。方法选取清洁级性成熟SD大鼠100只,随机分为5组(每组20只):A组(假造模组,普通饲料喂养并灌胃相同体积的生理盐水)、B组[模型组,高脂饲料喂养4周后给予腹腔注射链脲佐菌素(Streptozotocin,STZ),给予相同体积生理盐水8周]、C组(卡托普利干预组,高脂饲料喂养4周后给予腹腔注射链脲佐菌素,给予卡托普利干预8周)、D组(非诺贝特干预组,高脂饲料喂养4周后给予腹腔注射链脲佐菌素,给予非诺贝特干预8周)、E组(卡托普利+非诺贝特联合干预组,高脂饲料喂养4周后给予腹腔注射链脲佐菌素,给予卡托普利+非诺贝特干预8周),抽取外周血检测外周血清甘肽过氧化物酶(Glutathione peroxidase,GSH-PX)、超氧化物歧化酶(Superioxide dismutase,SOD)、活性氧类物质(Reactive oxygen species,ROS)、丙二醛(Malondialdehyde,MDA)、VEGF浓度,处死大鼠,取出眼球,用Tunel染色法检测视网膜细胞凋亡情况。结果A组大鼠外周血清GSH-PX、SOD活性值均高于其他4组(P<0.05),而ROS、MDA、VEGF和Tunel指数均低于其他4组(P<0.05);B组大鼠外周血清GSH-PX、SOD活性值均低于其他4组(P<0.05),而ROS、MDA、VEGF与Tunel指数均高于其他4组(P<0.05);E组大鼠外周血清GSH-PX、SOD活性值均高于C组、D组(P<0.05),而ROS、MDA、VEGF与Tunel指数均低于C组、D组(P<0.05);D组大鼠外周血清GSH-PX、SOD活性均高于C组(P<0.05),而ROS、MDA与Tunel指数均低于C组(P<0.05);D组大鼠外周血清VEGF浓度值低于C组(P<0.05)。结论卡托普利及非诺贝特均能改善DR,通过抑制凋亡与抗氧化对视网膜起到很好的保护作用,但两药联合应用效果更佳。
糖尿病视网膜病变;大鼠;卡托普利;非诺贝特;血管内皮生长因子;氧化;凋亡
0 引言
糖尿病视网膜病变(Diabetic retinopathy,DR)是糖尿病较常见的微血管并发症之一,是四大致盲性眼病之一,DR的发病率随着糖尿病发病率的升高逐年升高[1]。大量实验证实,血管紧张素转化酶抑制剂(Angiotensin converting enzyme inhibitors,ACEI)能很好地抑制糖尿病肾病(Diabetic nephrosis,DN)的进展[2-3]。非诺贝特是一种过氧化物酶体激活型增殖体受体α(Peroxisome proliferator activated receptor α)激动剂,具有一定的抑制新生血管生成和改善血管内皮的功能[1],此外,非诺贝特作为一种降脂药,能降低机体的氧化应激反应[4]。目前研究表明,DR进展过程中氧化应激能导致细胞发生凋亡[5]。本研究以SD大鼠为DR模型,研究卡托普利联合非诺贝特对DR大鼠眼底病变的抑制作用及其作用机制。
1 材料与方法
1.1实验动物100只SD大鼠由中国医科大学实验动物中心提供:周龄9~10周,体重370~390 g(雄鼠),260~270 g(雌鼠)。5组大鼠周龄、性别比、体重差异均无统计学意义(P>0.05)。
1.2方法
1.2.1实验动物分组及处理将100只大鼠随机分为A、B、C、D、E 5组,每组20只,雌、雄鼠分开饲养,控温20~26 ℃,12 h光照,12 h黑暗,颗粒饲料喂养,自由饮水取食。除A组外(给予普通饲料喂养),其余4组均给予高脂饲料(脂肪含量36%)连续喂养4周,禁食水12 h后,将除A组(注射相同体积的浓度为0.1 mmol/L、pH值为4.4的枸橼酸钠)外的其余4组腹腔注射STZ 50 mg/kg(美国Sigma公司产品,用新鲜配制的0.1 mmol/L、pH值为4.4的枸橼酸钠缓冲液配制),2周后尾缘静脉抽血测非空腹血糖(血糖仪为One ToucuⅡ型,由美国LifeScan公司提供),血糖>11.1 mmol/L为糖尿病大鼠模型[6]。将造模成功的大鼠进行如下处理:A组(假造模组,普通饲料喂养并且灌胃相同体积的生理盐水8周)、B组(模型组,高脂饲料喂养并给予相同体积生理盐水灌胃8周)、C组[卡托普利对抗组,高脂饲料喂养并给予卡托普利10 mg/(kg·d)干预8周,商品名:开博通,原料由中美上海施贵宝制药有限公司提供]、D组[非诺贝特对抗组,高脂饲料喂养并给予非诺贝特200 mg/(kg·d)干预8周,商品名:力平之,原料由法国利博福尼制药公司提供]、E组[卡托普利+非诺贝特联合对抗组,高脂饲料喂养并给予卡托普利10 mg/(kg·d)+非诺贝特200 mg/(kg·d)干预8周],非诺贝特与卡托普利均用0.9%氯化钠制成混悬液,现用现配。8周干预结束后、禁食水12 h后、抽取尾缘静脉血检测GSH-PX、SOD、ROS酶活性与MDA、VEGF浓度后立即处死大鼠(ELISA检测试剂盒为Sigma公司产品,GSH-PX、SOD、ROS检测试剂盒均为南京建成生物科技公司产品),在专业眼科医生指导下取小鼠眼球,并在冰台上显微镜下快速仔细分离视网膜组织行Tunel染色(免疫组织化学试剂盒为中杉金桥公司产品)。

1.2.3GSH-PX、SOD、ROS酶活性与MDA、VEGF浓度测定抽取大鼠尾缘静脉血,用酶联免疫法(ELISA)法测定VEGF浓度,检测GSH-PX活性、SOD活性、MDA含量、ROS活性。将血清在离心机10 000~15 000 r/min离心,匀浆时间10 s/次,间隙30 s,连续3~4次,温度4 ℃,按试剂盒说明测定GSH-PX、SOD与ROS活性,并检测MDA含量。所取标本均在1周内测定。
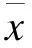
2 结果
2.1各组造模成功情况四组成功造模情况比较差异无统计学意义(P>0.05),见表1。
2.2视网膜细胞Tunel指数检测B组大鼠眼球视网膜细胞Tunel指数高于其他4组(P<0.05),E组大鼠眼球视网膜细胞Tunel指数低于C组、D组(P<0.05),D组大鼠眼球视网膜细胞Tunel指数低于C组(P<0.05),结果见图1、表2。

表1 四组造模成功情况(例,%)
2.3GSH-PX活性、SOD活性、MDA含量、ROS活性检测结果A组大鼠外周血清GSH-PX、SOD活性值均高于其他4组(P<0.05),而ROS、MDA、VEGF均低于其他4组(P<0.05);B组大鼠外周血清GSH-PX、SOD活性值均低于其他4组(P<0.05),而ROS、MDA、VEGF均高于其他4组(P<0.05);E组大鼠外周血清GSH-PX、SOD活性值均高于C组、D组(P<0.05),而ROS、MDA、VEGF均低于C组、D组(P<0.05);D组大鼠外周血清GSH-PX、SOD活性高于C组(P<0.05),而ROS、MDA均低于C组(P<0.05),结果见表3、表4。
2.4VEGF浓度检测结果A组大鼠外周血清VEGF均低于其他4组(P<0.05);B组大鼠外周血清VEGF均高于其他4组(P<0.05);E组大鼠外周血清VEGF均低于C组、D组(P<0.05);D组大鼠外周血清VEGF浓度值低于C组(P<0.05),结果见表4。

图1 视网膜组织Tunel染色表达情况(×400)

表2 Tunel指数
注:与A组比较,*P<0.05;与B组比较,#P<0.05;与C组比较,△P<0.05;与D组比较,▽P<0.05
3 讨论
近年来大量研究证实,DR的发生、发展与视网膜毛细血管周细胞、内皮细胞及神经细胞的凋亡有关[7],且糖尿病导致的神经细胞凋亡远早于微血管病变[8]。目前关于DR视网膜细胞凋亡机制的研究集中在氧化应激损伤方面[9]。细胞在发生凋亡时,会激活一些DNA内切酶,其会切断核小体间的基因组DNA,常采用Tunel染色法检测凋亡细胞,匡洪宇等[10]研究表明,高糖状态下,牛视网膜细胞发生凋亡,Tunel指数升高。GSH-PX是人体内重要的抗氧化酶,能清除自由基,促进SOD的抗氧化活力,阻断超氧离子诱导的自由基连锁反应,这两种酶的活性反映了组织氧化与抗氧化间的平衡[11]。DR患者外周血往往存在过氧化反应,导致ROS活性和MDA浓度升高[12]。
视网膜组织Tunel染色结果表明,非诺贝特和卡托普利均能抑制DR眼球视网膜细胞凋亡,且非诺贝特效果优于卡托普利,既往曾有研究证实,非诺贝特、卡托普利均能抑制心肌肥厚细胞发生凋亡[13-14]。两药抑制DR视网膜细胞的研究较少,而两药合作效果优于单药应用。
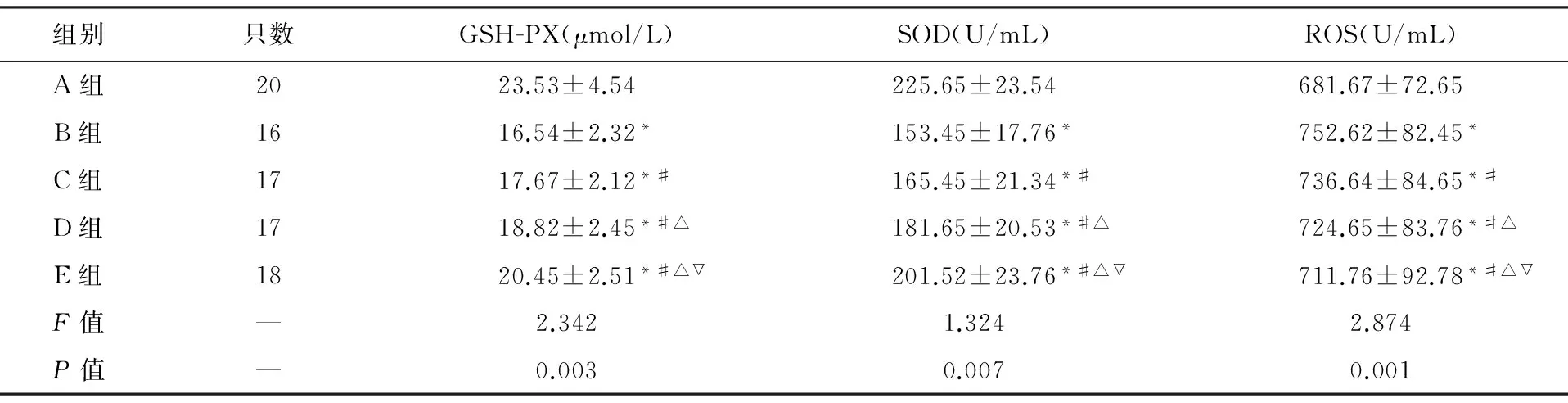
表3 外周血GSH-PX、SOD、ROS活性
注:与A组比较,*P<0.05;与B组比较,#P<0.05;与C组比较,△P<0.05;与D组比较,▽P<0.05

表4 外周血VEGF、MDA浓度
注:与A组比较,*P<0.05;与B组比较,#P<0.05;与C组比较,△P<0.05;与D组比较,▽P<0.05
本实验结果表明,非诺贝特和卡托普利均能抑制过氧化反应,而非诺贝特抑制效果强于卡托普利,两药联合效果更佳。A组大鼠外周血清VEGF低于其他4组;B组大鼠外周血清VEGF高于其他4组;E组大鼠外周血清VEGF低于C组、D组;D组大鼠外周血清VEGF浓度值低于C组,进一步证实了非诺贝特与卡托普利均能抑制VEGF,与以往实验结果相同[1,3]。
本实验仅仅研究了作用8周后的作用效果,今后需要增加作用时间点,进一步了解视网膜细胞的凋亡变化情况。本研究结果表明,卡托普利联合非诺贝特能很好地抑制糖尿病大鼠视网膜细胞发生凋亡,为今后的临床及预防工作提供了一定的理论基础。
[1]易呁敏,易敬林,王慧珍,等.非诺贝特治疗非增期糖尿病视网膜病变研究[J].中国实用眼科杂志,2014,32(4):438-442.
[2]洪小平,张欣洲,贺晓蕾,等.福辛普利对糖尿病大鼠基因表达的影响[J].中国老年学杂志,2008,28(8):1460-1462.
[3]谢熹玮,赵平.卡托普利和缬沙坦防治大鼠糖尿病性视网膜病变的实验性研究[J].中华眼科杂志,2004,40(11):770-773.
[4]周卫凤,沈馨如,汪凌云,等.非诺贝特对高脂血症大鼠肝脏氧化应激和内质网应激的影响[J].实用医学杂志,2014,30(17):2718-2721.
[5]Role AP,Palmeira CM.Diabetes and mitochondrial function:role of hyperglycemia and oxidative stress[J].Toxicol Appl Pharmacol,2006,212(2):167-178.
[6]Luo J,Quan J,Tsai J,et al.Nogenetic mouse model of non-insulin-dependent diabetes mellitus[J].Metabolism,1998,47(5):663-668.
[7]Triebel J,Macotela Y,Escalera GM,et al.Prolactin and vasoinhibins:endogenous players in diabetic retinopathy[J].Lubmb Life,2011,63(10):806-810.
[8]Barber AJ,Gardner TW,Abcouwer SF,et al.The significance of vascular and neural apoptosis to the pathology of diabetic retinopathy[J].Invest Ophthalmol Vis Sci,2011,52(2):1156-1163.
[9]Rolo AP,Palmeira CM.Diabetes and mitochondrial function:role of hyperglycemia and oxidative stress[J].Toxicol Appl Pharmacol,2006,212(2):167-178.
[10]匡洪宇,马丽丽,江红,等.持续及间断高糖培养对牛视网膜血管周细胞凋亡的影响[J].中国糖尿病杂志,2008,18(8):498-500.
[11]Raunig JM,Yamauchi Y,Ward MA,et al.Placental inflammation and oxidative stress in the mouse model of assisted reproduction[J].Placenta,2011,32(11):852-858.
[12]汪红,匡洪宇.氧化应激在高糖诱导的牛视网膜毛细血管周细胞凋亡中的作用[J].中国综合临床,2012,28(5):466-468.
[13]刘刚琼,贾占奎,薛瑞,等.高迁移率蛋白B-1在非诺贝特特治心肌肥厚过程中的作用[J].中华实验外科杂志,2014,34(12):2782-2785.
[14]辛雪,薛明明.福辛普利对压力超负荷性心肌肥厚大鼠左心室心肌细胞bcl-2及bax基因表达的影响[J].内蒙古医科大学学报,2014,36(5):408-411.
Study on the protective effect of captopril combined with fenofibrate on diabetic retinopathy in diabetic rats
LI Ling-bing1,ZHAO Yue-ping1,XU Wei2,TAI He1*
(1.Department of Endocrinology,Liaoning Provincial Corps Hospital of Chinese People′s Armed Police Forces,Shenyang 110034,China;2.Medicinal Chemistry and Pharmaceutical Analysis Section,Logistics University of Chinese People′s Armed Police Forces,Tianjin 300300,China)
ObjectiveTo study the mechanism of captopril combined with fenofibrate in protecting diabetic retinopathy and detect the apoptosis in the eyes,and the VEGF,oxidizing material in the serum.MethodsTotally 100 viripotent SD rats were randomly divided into five groups,20 rats in each group.Group A (Sham group,rats being given common forage and injected with sodium chloride),group B (Model group,exposure to high-fat diet for 4 weeks,rats being injected intraperitoneally with STZ,then lavaged with sodium chloride for 8 weeks),group C (Captopril intervention group,exposure to high-fat diet for 4 weeks,rats being injected intraperitoneally with STZ,then lavaged with captopril for 8 weeks),group D (Fenofibrate intervention group,exposure to high-fat diet for 4 weeks,rats being injected intraperitoneally with STZ,then lavaged with fenofibrate for 8 weeks),group E (captopril combined with fenofibrate intervention group,exposure to high-fat diet for 4 weeks,rats being injected intraperitoneally with STZ,then lavaged with fosinopril combined with fenofibrate for 8 weeks).Blood was taken to detect the activity of GSH-PX,SOD,ROS and the concentration of MDA,VEGF,then the rats were euthanized,and the apoptosis of retinal cells was detected through the Tunel staining method in the eyes.ResultsThe activity of GSH-PX and SOD in group A was higher than those of other four groups (P<0.05),but the concentration of ROS,MDA,VEGF and the Tunel index was lower (P<0.05).The activity of GSH-PX and SOD in group B was lower than other four groups (P<0.05),but the concentration of ROS,MDA,VEGF and the Tunel index was higher (P<0.05).The activity of GSH-PX and SOD in group E was lower than that of group C and group D (P<0.05),but the concentration of ROS,MDA,VEGF and the Tunel index was higher (P<0.05).The activity of GSH-PX and SOD in group D was higher than that of group C (P<0.05),but the concentration of ROS,MDA and the Tunel index was lower (P<0.05).The concentration of VEGF in group D was lower than that of group C (P<0.05).ConclusionCaptopril and fenofibrate can both improve the diabetic retinopathy;through inhibiting the apoptosis and oxidation,and the combination of captopril with fenofibrate can get better effect.
Diabetic retinopathy;Rat;Captopril;Fenofibrate;Vascular endothelial growth factor;Oxidation;Apoptosis
2015-12-31
1.武警辽宁省总队医院内分泌科,沈阳 110034;2.武警后勤学院药物化学与药物分析教研室,天津 300300
10.14053/j.cnki.ppcr.201609006
