Lactobacillusparacsei L9冷冻保护剂的优化
2016-10-21李让武永超葛绍阳桑跃刘松玲任发政崔建云赵亮
李让,武永超,葛绍阳,桑跃,刘松玲,任发政,崔建云,赵亮*
1(中国农业大学 食品科学与营养工程学院,北京,100083) 2(教育部-北京市共建功能乳品重点实验室,北京,100083)
LactobacillusparacseiL9冷冻保护剂的优化
李让1,武永超1,葛绍阳1,桑跃2,刘松玲2,任发政1,崔建云1,赵亮1*
1(中国农业大学 食品科学与营养工程学院,北京,100083) 2(教育部-北京市共建功能乳品重点实验室,北京,100083)
副干酪乳杆菌L9(LactobacillusparacseiL9)是1株具有突出益生功能及生产性能的益生菌菌株,现阶段高性能发酵剂的制备是其成功应用于工业化生产的关键技术。而液氮深冷技术是高性能发酵剂制备的有效手段,其中保护剂的应用是液氮深冷工艺的关键因素。该研究以菌种存活率作为评价指标,在已有研究基础上对液氮深冷保护剂种类进行筛选,对保护剂浓度进行正交优化,并确定菌体与保护剂最佳混合比例。结果表明脱脂乳粉、果糖、海藻酸钠及Vc四种保护剂能对副干酪乳杆菌L9 起到良好的保护作用;通过正交实验优化了保护剂配方:脱脂乳粉质量分数为10%,果糖质量分数为5%,海藻酸钠质量分数为5%,Vc质量分数为0.075%,可使菌体冷冻后存活率达到(92.23±0.86)%,显著提高在冻藏过程中菌体的存活率(P<0.05),较好地优化了LactobacillusparacseiL9发酵剂的制备技术,并为实际的生产提供了理论依据。
液氮深冷;保护剂优化;副干酪乳杆菌L9
副干酪乳杆菌L9(LactobacillusparacseiL9)分离自健康人肠道,益生功能突出。已有研究证明L9具有调节免疫[1],缓解过敏[2],改善健康人群肠环境等功能[3],是极具潜力的益生菌。同时L9发酵性能优良[4],具有广阔的应用及开发前景。
发酵剂的制备是益生菌应用的关键技术,传统的发酵剂制备方法主要是采用真空冷冻干燥的方法,但存在设备复杂、生产成本较高、菌种存活率低及发酵剂投料后复活时间较长等问题[5]。因此发酵剂制备工艺的改善及发酵剂活力的提高成为发酵剂研究的重要目标。液氮深冷发酵剂制备方式因操作简便、处理过程中菌体损伤较小、菌体复活速度快、活力高等优势成为极具潜力的发酵剂制备新技术[6]。发酵剂制备工艺中保护剂的选择是影响发酵剂性能的关键因素。根据保护剂的作用机理,可以分为渗透性保护剂,半渗透保护剂,非渗透保护剂及抗氧化保护剂,不同作用类型保护剂的有效组合成为提高保护剂性能的重要手段。
本研究在已有研究基础上进一步深入,依据保护剂的常用类型,采用单因素试验确定不同类型中的有效保护剂[7],通过正交实验对保护剂组成及浓度进行优化,获得最佳保护剂配方,并进一步确定菌体与保护剂的最佳配比。通过研究获取最佳保护剂应用方案,提高发酵剂中LactobacillusparacaseiL9的存活率及菌株工业化生产效率。
1 材料与方法
1.1菌种
LactobacillusparacaseiL9 (CGMCC No.9800),由教育部北京市共建功能乳品实验室分离保藏。
1.2材料
MRS培养基;甘油、二甲基亚矾(天津市登峰化学试剂厂);海藻酸钠、果糖、海藻糖、葡萄糖、蔗糖、山梨醇、甘露醇(北京世纪华林科技有限公司);工业用脱脂乳粉、淀粉、酵母粉、纤维素、β-环糊精(新西兰OCC公司);Vc、Cys、L-Glu(国药集团化学试剂北京有限公司);液氮(中科院半导体研究所);其他试剂为化学纯试剂。
1.3主要设备(表1)

表1 实验仪器与设备
1.4菌株培养
将保藏的菌种接种至液体MRS培养基活化2代,镜检培养液菌体形态,将活化好的菌种以接种量1%(107CFU/mL)接种至1 L培养瓶,37 ℃培养12 h,4 000 r/min离心10 min,收集菌泥。
1.5液氮深冷直投式发酵剂制备流程
按照表2及表3所示比例将保护剂加入菌泥,振荡摇匀,得到的菌体与保护剂混合液,通过颗粒炸蒸法[8],用无菌滴管取1 mL混合液滴入装有液氮的离心管中,形成球状颗粒,倒掉液氮,发酵剂颗粒保存于-80℃超低温冰箱。

表2 保护剂单因素筛选水平设计
1.6菌株计数
冷冻后取出冷冻浓缩物,每管加入9 mL生理盐水,室温融化,摇匀,进行10倍梯度稀释,于MRS琼脂培养基中培养48 h计数。
1.7细菌存活率计算
细胞存活率/%=深冷处理后样品测得的活菌总数/深冷处理前样品测得的活菌总数×100
1.8数据分析
采用Excel及SPSS对实验数据进行分析处理。
2 结果与分析
2.1保护剂的单因素筛选
保护剂按照类型可主要分为渗透性保护剂、半渗透保护剂、非渗透性保护剂及抗氧化保护剂[9]。本实验在已有分类的基础上,选择不同类型保护剂,通过单因素试验进一步探究甘油、二甲基亚砜、海藻糖、蔗糖、果糖、葡萄糖、山梨醇、甘露醇、脱脂乳粉、淀粉、酵母粉、纤维素、β-环糊精、Vc、Cys及L-Glu保护剂在冷冻过程中对菌体的保护效果。
2.1.1渗透性保护剂
如图1所示,在渗透性保护剂中选取常用的甘油与DMSO(二甲基亚砜),相比空白对照组,甘油对菌种的保护效果更为明显。甘油属于小分子物质,易与溶液中的水分子水合,增加溶液黏性,阻碍水的结晶过程,可对菌种细胞起到保护作用,而DMSO作用效果不明显,可能是由于对菌种产生了毒害作用[10]。

图1 渗透性保护剂对冷冻后菌体存活率的影响Fig.1 The effect of the permeable protective agent on viable count after freezing带有相同字母代表各组菌体存活率没有显著性差异(P > 0.05)
有研究表明,甘油可较好地渗透到细胞内部,其羟基与细胞内大分子形成氢键,在缺水条件下仍能保证生物体中的蛋白质、碳水化合物及脂肪等大分子化合物保持原有结构,利于与水紧密结合,防止细胞过多脱水,并能阻止细胞内大冰晶形成,较好的维持生物活性。但考虑到后续需对菌体进行冷冻干燥处理,而甘油无法冻干,因此渗透性的保护剂不予添加。
2.1.2半渗透性保护剂
由图2可知,半渗透性保护剂可对菌体起到较好保护作用。单糖果糖的效果最好,天然多糖海藻酸钠其次,整体上糖类保护剂效果优于醇类保护剂。

图2 半渗透性保护剂对冷冻后活菌数的影响Fig.2 The effect of semi permeable protective agent on viable count after freezing带有相同字母代表各组菌体存活率没有显著性差异(P> 0.05)
果糖为低分子半渗透性保护剂,能够进入细胞膜,在溶液中与水分子强烈结合,增加溶液黏性。在低温条件下,溶液内冰晶的增长速度减缓,水转化为冰的效率降低,在一定程度上减弱了由于细胞外溶质浓度升高所导致的细胞膜系统损伤。同时,由于低分子保护剂能够进入细胞,升高细胞内溶质浓度,使细胞内外压力相近,细胞外结冰引起的细胞脱水皱缩的程度减轻,从而降低了低温细胞造成的损伤[11]。
天然多糖海藻酸钠在已有的研究中,广泛用于保护剂及微胶囊壁材中[12],具有成膜黏性及网状类似蜂窝状的孔隙结构,有较高的机械强度,可在菌体表面设置屏障,阻挡外界冷热等不良因素的破坏,保证菌体在极端条件下有较高存活率[13]。
2.1.3非渗透性保护剂
由图3可知,非渗透性保护剂中,脱脂乳粉的保护效果最好,而其他保护剂的保护效果不显著。

图3 非渗透性保护剂对冷冻后菌体存活率的影响Fig.3 The effect of non permeable protective agent on viable count after freezing带有相同字母代表各组菌体存活率没有显著性差异(P> 0.05)
脱脂乳粉含有较高比例的大分子物质,可在细胞表面形成保护层,增加细胞周围溶液的黏性,抑制冰晶的生成,从而保护细胞使其免受冰晶的引起的机械损伤[9]。同时脱脂乳中含的蛋白质对菌体有较好地保护作用,可以取代其他添加物大分子的作用,因此在保护剂的配方优化中,选取脱脂乳粉作为主要影响因素。
2.1.4抗氧化保护剂
LactobacillusparacseiL9是兼性厌氧菌,易受具有氧化作用的因子影响。因此保护剂中需要加入抗氧化成分,由图4可知,Vc的保护效果高于Cys和L-Glu。

图4 抗氧化保护剂对冷冻后菌体存活率的影响Fig.4 The effects of antioxidant protective agent on viable count after freezing带有相同字母代表各组菌体存活率没有显著性差异(P > 0.05)
根据单因素实验结果最终选取脱脂乳粉、果糖、海藻酸钠及Vc作为保护剂主要因素。
2.2正交实验优化配方浓度
为进一步选取最优配方浓度,设计四因素三水平正交试验,在已有研究基础上选取脱脂乳粉质量分数为:5%、10%、15%;果糖质量分数为:2.5%、5%、7.5%; 海藻酸钠质量分数为:2.5%、5%、7.5%;Vc质量分数为:0.025%、0.05%、0.075%;实验因素及水平设计如表3所示,结果如表4所示。
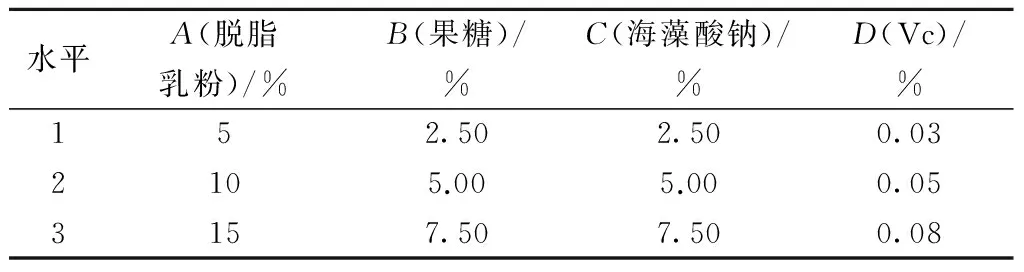
表3 正交分析因素与水平

表4 正交设计数据及结果
从表4中可以看出,因素水平不同造成试验指标的变异RA=11.10,RB=3.30,RC=10.13,RD=4.02。所以保护剂最佳搭配方式为A2B2C2D3,通过正交实验及验证实验确定最佳配方为脱脂乳粉10%,果糖5%,海藻酸钠5%,Vc 0.075%,冷冻后菌体存活率达到(92.23±0.86)%,显著提高了冷冻过程中菌体的存活率(P< 0.05)。
2.3保护剂配比优化
为获得更好保护效果,进行保护剂对菌泥的质量倍数的优化。由图5可知,添加保护剂可对菌体起到较为明显地保护作用,随着保护剂倍数的增加,活菌数出现了先增加,后减小的趋势,结合相关研究推断,保护剂倍数较少时,渗透及半渗透型保护剂不能充分进入细胞内部与溶剂相作用,影响对细胞的保护效果;非渗透型保护剂在部分细胞的表面覆盖程度不够,从而影响外部保护结构的建立,在冷冻时细胞保护的机械强度不够,从而引起菌体存活率下降;而保护剂倍数过高,对细胞易产生一定程度的毒害作用,同时较厚的保护剂包裹对细胞的通透性影响较大,也易对细胞存活率产生影响[14]。本实验确定保护剂对菌泥的质量倍数为6倍时保护效果最好。

图5 保护剂对菌泥的质量倍数对冷冻后菌体存活率的影响Fig.5 The effect of the mass ratio of protective agent to bacterial sludge on viable count after freezing带有相同字母代表各组菌体存活率没有显著性差异(P> 0.05)
2.4保护剂效果验证
2.4.1冷冻后的菌体存活率
采用实验优选保护剂配方及最佳配比,将添加保护剂的与未添加保护剂的直投发酵剂同时进行液氮深冷处理,采用梯度稀释倒板的方式进行活菌计数,计算菌体的存活率,以冷冻处理前的菌液进行对照,结果如图6所示。
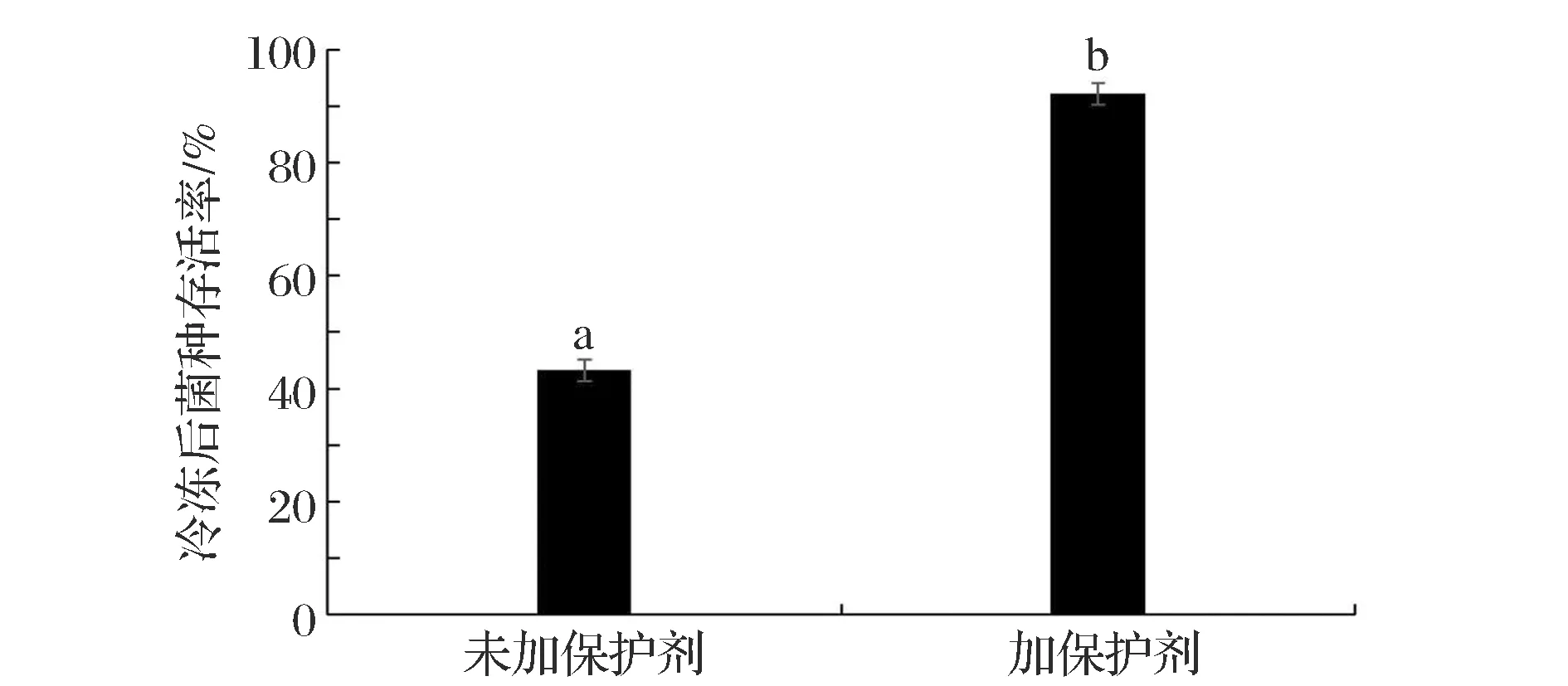
图6 保护剂菌体存活率的影响Fig.6 The effect of protective agent ratio on viable count after freezing带有不同字母代表各组菌体存活率有显著性差异(P< 0.05)
加入保护剂的菌液在液氮深冷处理后,存活率可达(95.32±1.11)%,显著高于未加保护剂的实验组(P<0.05),可说明实验获得的保护剂配方可用于液氮深冷法制备直投式发酵剂,可保证较高的菌体存活率。
2.4.2冷冻后菌体产酸性能
将添加保护剂的与未添加保护剂的直投发酵剂同时进行液氮深冷处理,以2%的接种量接入脱脂乳中,用滴定酸度的方式研究其产酸特性,以冷冻处理前的菌液作为对照。结果如图7所示,加入保护剂的发酵剂产酸曲线与未添加保护剂的相比产酸能力有了一定的提高,说明保护剂可以起到一定程度对菌种产酸性能的保护作用。与冷冻处理前的菌液产酸能力相比,较为接近。说明本保护剂可使得液氮深冷方式制备的发酵剂在产酸能力上维持在较理想的水平。

图7 保护剂对深冷发酵剂产酸能力的影响Fig.7 The effect of protective agent ratio on acid producing after freezing
3 讨论
为研究液氮深冷发酵剂耐储藏性能,将制得的直投式发酵剂置于-80 ℃冰箱中储藏3个月,对储藏过程中发酵剂的菌体存活率和产酸能力进行测定。结果显示在3个月的储藏过程中,菌体的存活率及产酸能力均未发生显著变化,说明保护剂可使液氮深冷法制备的发酵剂在储藏过程中保持较好的发酵稳定性[15]。同时优化保护剂后液氮深冷法制备发酵剂的菌体存活率可达(93.72%±4.24)%,显著高于传统真空冷冻干燥法(77.58±5.33)%,且其产酸性能也显著高于真空冷冻干燥法[15]。
本研究采用的液氮深冷制备技术,具有操作简便、菌种的存活率高、能耗小等优点,为发酵剂的制备提供了更高效便捷的制备方式。本文对保护剂种类进行筛选,确定脱脂乳粉、果糖、海藻酸钠及Vc四种保护剂对LactobacillusparacseiL9在液氮中的处理起到良好的保护作用;借助正交实验及验证实验对保护剂浓度进行优化,确定保护剂配方为脱脂乳粉质量分数为10%,果糖质量分数为5%,海藻酸钠质量分数为5%,Vc质量分数为0.075%;确定保护剂对菌泥的质量倍数为6 倍时,保护效果最佳。液氮深冷发酵剂的储存期试验证明,在为期3个月-80 ℃条件下的储藏过程中,优化保护剂的发酵剂可以保持稳定活性;相较于传统真空冷冻干燥工艺较好地提高了菌种存活率及产酸性能。优化的LactobacillusparacseiL9液氮深冷保护剂配方,可显著提高在冻藏过程中菌体的存活率及发酵稳定性(P<0.05),提高菌株工业化生产效率。
[1]ZHU Yuan-bo, ZHU Jun, ZHAO Liang, et al. Effect of oral administration ofLactobacillusparacaseiL9 on mouse systemic immunity and the immune response in the intestine[J]. Archives of Biological Sciences, 2016,68(2):311-318.
[2]YANG Jing,REN Fa-zheng,ZHANG Hao,et al.Induction of regulatory dendritic cells byLactobacillusparacaseiL9 prevents allergic sensitization to bovine beta-lactoglobulin in mice[J]. Journal of Microbiology and Biotechnology, 2015, 25(10):1 687-1 696.
[3]王然,谢俊华,陈善斌,等.干酪乳杆菌L9对健康人群肠道健康的影响[C].中国食品科学技术学会.天津:乳酸菌与营养健康:第九届乳酸菌与健康国际研讨会, 2014.
[4]宋静颐,张明,刘松玲,等.副干酪乳杆菌L9安全性评价[J].中国奶牛,2015(21):27-31.
[5]TIAN Wen,SHAO Xiu-zhi,CHEN Wen-jia,et al.Study on freeze-dried protection on direct vat set in pickle[J].China Condiment,2012, 6:49-52.
[6]POP O L, DIACONEASA Z, BRANDAU T,et al.Effect of glycerol, as cryoprotectant in the encapsulation and freeze drying of microspheres containing probiotic cells[J]. Food Science and Technology,2015,72(1):27-32.
[7]CHEN He,CHEN Shi-wei,LI Chuan-na,et al.Response surface optimization of lyoprotectant forLactobacillusbulgaricusduring vacuum freeze-drying[J].Preparative Biochemistry & Biotechnology,2015,45(5):463-475.
[8]高雅,王继红,许海涛,等.两种不同冷冻方法对犬冷冻精液品质的影响[J].北京农学院学报, 2008,23(2):39-42.
[9]许倩,张兰威,于鹏.几种保护剂对液氮冷冻处理的保加利亚乳杆菌细胞的冻伤保护[J].食品科技,2006,27(9):37-40.
[10] HUBALEK Z. Protectants used in the cryopreservation of microorganisms[J]. Cryobiology,2003,46(3):205-229.
[11]朱敖兰,杨洁.生物制品冻干保护剂及其保护机理的研究进展[J].喀什师范学院学报,2007,28(6):46-50.
[12]吕利军,季海峰,单达聪,等.乳酸菌类微生物制剂微胶囊化的研究进展[J].黑龙江畜牧兽医,2008(8):17-19.
[13]NANCHEVA I.The cryoprotective effect of some hydrocolloids during freeze-drying of acidified milk foodstuffs [J].Khranitelnovkusova Promishlenost,2001,50(5):6-8.
[14]PYAR H, PEH K K. Effect of cryoprotective agents on survival and stability ofLactobacillusacidophiluscultured in food-grade medium[J].International Journal of Dairy Technology,2011,64(4):578-584.
[15]李让,葛绍阳,刘松玲,等.副干酪乳杆菌L9直投式深冷发酵剂制备工艺研究[J].中国奶牛,2015(17):51-55.
The optimization of cryogenic protectant forLactobacillusparacaseiL9
LI Rang1, WU Yong-chao1, GE Shao-yang1, SANG Yue2,LIU Song-ling2, REN Fa-zheng1,CUI Jian-yun1, ZHAO Liang1*
1(College of Food Science and Nutritional Engineering,China Agricultural University,Beijing 100083,China)2(Key Laboratory of Functional Dairy Co-constructed by Ministry of Education and Beijing Government,Beijing 100083,China)
LactobacillusparacseiL9 was a probiotic strain with health benefit and productive performances. The preparation of high-performance starter was the key technology for successful application in industrial production. To improve starter's activity, the liquid nitrogen cryogenic treatment was employed in the preparation of starter cultures, and protective agents were important to strain activity during the liquid nitrogen cryogenic process. The optimal formula of cryoprotectant was determined by single-factor experiments. Then the concentration of preferred cryoprotectant was optimized by orthogonal test. The definitive protection formulations wereω(skim milk powder) 10%,ω(fructose) 5%,ω(alginate) 5%, andω(Vc) 0.075%. The viability of bacteria cells could reach (92.23±0.86)% after freezing with our cryoprotectant. It indicated that the optimized cryoprotectant could improve the viability of L9 cells during the freezing and storage process.
liquid nitrogen freeze;LactobacillusparacaseiL9; the optimization of anti-freeze
10.13995/j.cnki.11-1802/ts.201608012
硕士研究生(赵亮副教授为通讯作者)。
中央在京高校重大成果转化项目“益生菌生产关键科技成果转化中”。
2016-01-16,改回日期:2016-03-25
