阿胶的半巢式-多重PCR鉴别方法研究
2016-10-18张慧孙海新许娜黄金发孙丕春
张慧,孙海新,*,许娜,黄金发,孙丕春
(1.山东世通检测评价技术服务有限公司,山东青岛266000;2.青岛世通检测技术研究院,山东青岛266000)
阿胶的半巢式-多重PCR鉴别方法研究
张慧1,2,孙海新1,2,*,许娜1,2,黄金发1,2,孙丕春1,2
(1.山东世通检测评价技术服务有限公司,山东青岛266000;2.青岛世通检测技术研究院,山东青岛266000)
采用半巢式-多重PCR(聚合酶链式反应)法鉴别阿胶中是否掺杂有马、猪和牛源性成分。首先采用液氮研磨法从阿胶中提取高质量的DNA(脱氧核糖核酸),以通用引物P1和P2进行第一轮扩增,并将扩增产物作为第二轮PCR的模板;再以包含通用引物P1和4种物种(驴、马、猪和牛)特异性引物A、B、C和D的混合引物进行第二轮多重PCR扩增;最后电泳检测第二轮扩增产物,根据电泳条带的分子量大小,判断阿胶产品的动物原材料是否掺假。结果表明,采用本方法可观察到不同动物DNA分子量之间的明显差异,通过DNA电泳结果直接判断阿胶产品中是否掺假。
半巢式-多重PCR法;阿胶;鉴别;通用引物;特异性引物
阿胶在中国有上千年的食用历史,具有补血止血,滋阴润肺的功效。它是驴皮熬制后形成的一种特殊中药材,主要成分为胶原蛋白[1]。纯正的阿胶必需来自百分百的驴皮,方能保证产品的营养功效。由于阿胶功效独特,供不应求,多地均出现假冒伪劣产品。这些劣质胶多采用猪、牛、马等动物皮、骨、结缔组织熬制,用肉眼难以鉴别,常规的鉴别方法也难以区分,临床使用后不仅达不到治疗效果,反而会出现中毒现象[2-7]。
2002卫生部发布的《关于进一步规范保健食品原料管理的通知》,规定了阿胶既是食品又是药品。阿胶在《中国药典2010》有相关质量规定:以驴皮熬制的胶为阿胶正品[1]。但作为食品和保健品,目前还没有国家标准,这就造成阿胶监管体系的滞后,同时也为阿胶造假提供了较大的空间。这些伪劣产品的存在严重干扰了市场正常秩序,损害消费者利益。为了取缔和预防假冒伪劣阿胶产品,除了需要质量监管部门加大执法力度,首要前提就是要具备科学可靠的检测方法。
目前常见的阿胶真伪鉴别方法有:(1)免疫化学法:将阿胶通过偶联剂与丙种球蛋白联接,免疫青紫蓝灰兔,使之产生相应的抗体,经对流免疫电泳检查该抗体与阿胶-人丙种球蛋白发生良好的免疫应答,而其它动物皮胶或伪胶均无免疫应答反应[8]。(2)热分析法:采用差示扫描量热法对驴皮胶,黄牛皮胶和猪皮胶在四个温度段的DSC曲线进行了分析,发现不同胶样在不同温度阶段出现了异于其它胶的DSC特征曲线,且有较好的重现性[9]。(3)电泳法:利用等电聚焦电泳法对正品阿胶和3种伪品阿胶进行鉴别,发现各样品都有清晰的等电聚焦电泳图谱,此法不仅可以鉴别药材真伪,还可以确定样品中主要蛋白质的等电点和成分含量[10-11]。(4)利用不同胶的圆二色光谱图的明显差异性来鉴别阿胶真伪[12]。(5)采用高效液相色谱质谱联用技术对猪皮胶、牛皮胶和驴皮胶酶解产物进行分析,制作HPLC指纹图谱,为阿胶鉴别提供依据等[13-16],而采用分子生物学技术在基因水平上对产品是否可靠进行鉴别的技术少有报道,因此,本文研究了半巢式-多重PCR、通过PCR产物电泳条带差异来鉴别阿胶真伪的方法,现将结果汇总如下。
1 材料与方法
1.1试验设备与材料
TC-96/H/G型PCR仪:杭州博日科技有限公司;DYY-11型凝胶电泳仪:北京六一机械厂;AlphaImager HP型Alpha凝胶成像系统:美国Alpha Inotech。
液氮:青岛城阳长松气体有限公司;研钵:北京金志业仪器设备有限公司;1.5 mL EP离心管:Crystalgen;TE裂解液、10%SDS溶液、RNA酶:Sigma;蛋白酶K、PCR酶、PCR Buffer:Takara;醋酸钾溶液、酚∶氯仿∶异戊醇(25∶24∶1,体积比)溶液、异丙醇、乙醇:上海索莱宝生物科技有限公司;引物:Sangon Biotech。
1.24种动物(驴、马、猪和牛)DNA提取[17]
1)称取适量(0.2 g)的样品,放入用液氮预冷的研钵中,向研钵中加入液氮,迅速研磨,直到样品成细微的粉末状,置于1.5 mL离心管中;
2)向上述离心管中加入600μL预冷的TE裂解液,然后再加入60 μL的10%SDS溶液和10 μL的蛋白酶K,55℃放置3 h~5 h;
3)将上述消化液降至室温,加入无DNA酶的RNA酶10 μL,37℃放置0.5 h~1 h;
4)将样品放置冷却至室温后加入200μL的醋酸钾溶液,在振荡器上剧烈振荡20 s,使其充分混合,4℃下12 000 r/min离心5 min;
5)将上清液转移到另一个1.5 mL离心管中,加入等体积的酚∶氯仿∶异戊醇(25∶24∶1,体积比)溶液,充分混合后,12 000 r/min离心5 min,重复此步骤2次~3次,直到两相间无明显的变性蛋白质;
6)取上清液,加入等体积异丙醇,上下颠倒混匀后12 000 r/min离心5 min,弃上清液,加入1 mL 70%的乙醇溶液,颠倒离心管数次,12 000 r/min离心5 min。弃上清液,空气中干燥DNA沉淀15 min;
7)将DNA溶解于30 μL TE(pH7.6)或者超纯水中,-20℃保存备用。
1.3引物设计
根据驴、马、猪、牛4个物种线粒体同源序列设计半巢式-多重PCR的引物序列[18-20]。使用的引物包括第一轮PCR所使用的正向通用引物P1和反向通用引物P2,第二轮多重PCR使用的正向引物仍为P1,反向引物为A(驴)、B(马)、C(猪)和D(牛)。引物P1和P2进行第一轮PCR反应,可以同时扩增出4个目标物种691 bp的同源序列作为第二轮多重PCR的模板。引物序列见表1。

表1 引物序列Table 1Primer sequences
1.4PCR条件和电泳条件
1.4.1PCR条件
1)引物浓度:引物P1、P2、A、B、C、D浓度均为1 μM;
2)多重PCR引物配比:P1∶A∶B∶C∶D=4∶1∶1∶1∶1(质量比)。
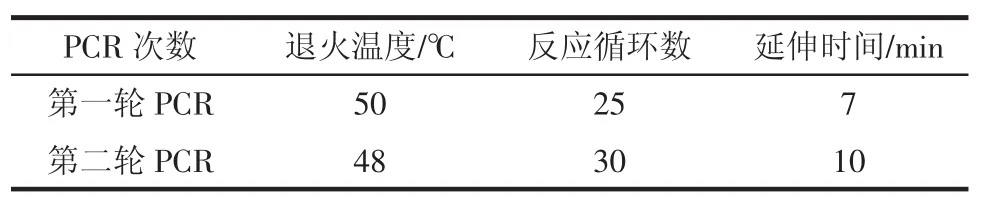
表2 PCR反应条件Table 2PCR reaction conditions
1.4.2电泳条件
1)DNA电泳条件:恒压110 V,琼脂糖凝胶浓度0.4,电泳时间40 min;
2)PCR产物电泳条件:恒压110 V,琼脂糖凝胶浓度1.0,电泳时间40 min。
1.5引物特异性验证
以1.2所提取的4种动物皮DNA为模板、按照1.3反应条件,用P1和P2作为引物进行第一轮PCR反应,再取1μL反应产物作为模板,使用P1、A、B、C和D混合引物进行第二轮多重PCR反应,取10 μL产物进行琼脂糖凝胶电泳,验证引物特异性。
1.6阿胶DNA提取
阿胶为市售正品,参照1.2进行DNA提取。
1.7阿胶真伪鉴别
将1.6中所提取阿胶DNA分为三等份(5 μL),分别编为1号管、2号管、3号管,分别向1号管、2号管中加入等体积的牛DNA、马DNA,3号管不添加任何外源DNA;另设4号管和5号管,4号管加入牛和马DNA各5 μL,5号管中加入猪和牛DNA各5 μL。
将上述1~5号管中DNA稀释50倍,取1 μL DNA做模板,加入1μM引物P1和P2各1μL,Taq酶0.5μL,10×Loading Buffer 1 μL,ddH2O 5.5 μL构建成10 μL反应体系进行第一轮PCR反应,再取1 μL反应产物作为模板,使用P1、A、B、C和D混合引物构建10 μL反应体系进行第二轮多重PCR反应,取2 μL产物进行琼脂糖凝胶电泳。
2 结果与分析
2.14种动物(驴、马、猪和牛)皮DNA提取
采用方法1.2所提取的动物皮DNA琼脂糖凝胶电泳如图1所示,结果表明,4种动物皮DNA条带清晰,所提取质量较好,可以用作PCR模板。
2.2引物特异性
以4种动物皮中提取的DNA为模板,经过两轮PCR扩增,扩增产物的电泳图如图2所示,可以看出,PCR扩增产物电泳图条带清晰,条带大小与1.3引物设计中的预期一致,表明引物特异性良好。
2.3阿胶DNA提取

图1 动物皮DNA电泳图Fig.1DNA electrophoresis of Animal skins

图2 引物特异性电泳图Fig.2DNA primer specificity electrophoresis M-Maker标记
按照1.2中步骤提取阿胶DNA,从已提取好的DNA中各取1 μL,进行琼脂糖凝胶电泳,电泳结果如图3所示,阿胶DNA有拖带情况,这应该是阿胶经过多次加工造成其DNA降解所致。

图3 阿胶DNA电泳图Fig.3DNA electrophoresis of gelatin
2.4阿胶真伪鉴别

图4 半巢式-多重PCR电泳图Fig.4Semi-nested multiplex PCR electrophoresis
阿胶真伪鉴别结果如图4所示,可以看出,1号管中含有两条明显的电泳条带,根据条带大小判断应该为驴和牛两种DNA成分;2号管中应为驴和马两种DNA成分,3号管中应为纯正阿胶DNA,4号管中应为牛和马两种DNA成分,5号管中应为猪和牛两种DNA成分,与预期结果一致,上述结果表明,本研究采用的半巢式-多重PCR法可以有效鉴别阿胶中是否掺杂有马、猪和牛源性成分,具有较好的准确性和专属性。
3 讨论
随着人们生活水平的提高,阿胶的市场需求量逐年迅速增加,同时对阿胶的质量要求也越来越严格。目前,虽然在阿胶真伪鉴别方面已经建立了多种方法,并在生产实践中较好地发挥了作用,但这些方法均有自身的局限性。目前较先进的鉴定方法是分子生物学法,即基于DNA的分子技术来进行物种鉴定,因为DNA组成是物种最根本、最稳定的。目前,有关阿胶的质量标准还不完善,GenBank等核酸数据库中有关驴的基因序列数目较少,国内外对阿胶的研究也相对较少,应引起我们的重视,加强对阿胶鉴别的分子生物学研究,重点在于提高方法的标准性、实用性和批量性。
本研究就是以高度保守稳定的线粒体细胞色素B基因为基础设计引物,采用半巢式-多重PCR法鉴别阿胶中是否掺杂有马,猪和牛源性成分,经验证效果良好。基于市场上阿胶存在单一成分和多种成分掺假的现象,在研究过程中采用添加外源DNA的方法,即添加单一外源DNA和两种外源DNA相结合的方式,模拟掺假劣质阿胶,通过半巢式-多重PCR法鉴别,能够清楚分辨所添加的源性成分,实现快速、直读判断,具有较强的实用性。当然,从建立该检验方法的理论完整性、科学严谨性等方面考虑,还需将最终PCR产物进行测序,这需要在后续工作中作进一步的完善。
[1]国家药典委员会.中华人民共和国药典(2010版,一部)[M].北京:中国医药科技出版社,2010:175-176
[2]唐双焱,傅文,陈永久,等.中药材鹿鞭的分子鉴定研究[J].中国中药杂志,2002,27(8):573-575
[3]韩云南.阿胶优劣真伪鉴别[J].江西中医学院学报,2000,12(S1):288
[4]侯桂霞,王惠霞.阿胶与伪品的性状鉴别[J].陕西中医,2007,22(10):634
[5]毛跟年,郭倩,瞿建波,等.阿胶化学成分及药理作用研究进展[J].动物医学进展,2010,31(11):83-85
[6]高景会,王蕊,范锋.阿胶现代研究进展[J].中国药事,2011(4):396-401
[7]刘春梅,张琨,张艳梅,等.浅析阿胶的真伪鉴别[J].中国实用医药,2011,6(36):233-234
[8]张华远,万宗举,吴冬明,等.阿胶的真伪鉴别与内在质量的研究VI·用免疫化学法鉴别真伪阿胶[J].药物分析杂志,1992,12(4):203-205
[9]陈栋华,刘雪峰,黄艳,等.阿胶的差示扫描量热鉴别法研究[J].中草药,1993,24(6):314-315
[10]李峰,张振秋,韩家珩,等.阿胶的凝胶电泳鉴别[J].时珍国医国药,1999,10(5):346-347
[11]古今,刘萍,胡景华.三种动物胶的SDS不连续聚丙烯酰胺电泳法鉴别[J].北京中医杂志,2003,22(1):33-34
[12]翟乙娟,任孝通,都恒青,等.阿胶、鹿角胶、龟甲胶圆二色谱鉴别[J].中药材,1998,21(12):66-68
[13]王若光,尤昭玲,刘小丽,等.基于激光解析/离子化-飞行时间质谱技术的中药阿胶蛋白质组分析[J].中国组织工程研究与临床康复,2007,11(13):2518-2521
[14]汪冰,肖新月,程显隆,等.凝胶排阻色谱法研究阿胶中蛋白质及多肽相对分子质量分布规律[J].药物分析杂志,2009(11):1886-1891
[15]于海英,周永妍,程秀民.阿胶、龟甲胶中脂溶性成分的高效液相色谱指纹图谱[J].色谱,2009,27(4):447-452
[16]王晓坤,程秀民,于海英,等.阿胶水溶性成分HPLC指纹图谱研究[J].上海中医药杂志,2008,42(2):66-69
[17]饶刚,李明,牛屹东,等.皮张中DNA提取的新方法[J].动物学杂志,2001,36(4):53-57
[18]Partis L,Croan D,Guo Z,et al.Evaluation of a DNA fingerprint-ingmethod for determining the species origin of meats[J].Meat Science,2000,54(4):369-376
[19]Iciar Martineza,Ingrid Malmheden Yman.Species identification in meat products by RAPD analysis[J].Food Research International,1998,31(6/7):459-466
[20]汪小龙,潘洁,王师,等.细胞色素B基因PCR-RFLP鉴定阿胶原料[J].中国海洋大学学报(自然科学版),2006,36(4):645-648
Study on Semi-nested Multiplex PCR Identification Method of Gelatin
ZHANG Hui1,2,SUN Hai-xin1,2,*,XU Na1,2,HUANG Jin-fa1,2,SUN Pi-chun1,2
(1.Shandong Seatone Detection and Evaluation of Technical Services Ltd.,Qingdao 266000,Shandong,China;2.Qingdao Seatone Institute of Detection and Technology,Qingdao 266000,Shandong,China)
In this study,semi-nested multiplex PCR method were used to identify whether gelatin doped with horses,pigs and cattle-derived ingredients.Firstly,liquid nitrogen grinding method was used to extract high quality DNA from gelatin.Universal primer P1 and P2 were used for the first round of amplification,and the amplified product was used as the templates of the second round PCR.Then mixed primers containing universal primer P1 and specific primers(A,B,C and D)was used to do multiplex PCR amplification of second rounds. Final the second round of amplification products with electrophoresis was detected,and authenticity of gelatin was determined according to molecular weight of the electrophoretic bands.The results showed that it can observe the significant differences of the DNA molecular weight of different animals with the method and directly judge whether gelatin is adulterated by DNA electrophoresis results.
semi nested-multiplex PCR method;gelatin;identification;universal primer;specific primers
10.3969/j.issn.1005-6521.2016.17.024
2015-10-13
国家火炬计划项目(2015GH581533);青岛市技术创新平台建设计划项目(14-7-2-36-gx)
张慧(1987—),女(汉),助理工程师,硕士,研究方向:微生物与生化药学。
孙海新(1978—),男,高级工程师,博士,研究方向:食品科学。
