冰岛刺参和南非花刺参脑苷脂分子种的比较*
2016-10-18贾子才丛培旭陶素媛李兆杰薛长湖
曹 建, 贾子才, 丛培旭, 陶素媛, 李兆杰, 徐 杰, 薛长湖
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
冰岛刺参和南非花刺参脑苷脂分子种的比较*
曹建, 贾子才, 丛培旭, 陶素媛, 李兆杰, 徐杰❋❋, 薛长湖
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
利用高效液相色谱-四极杆-飞行时间串联质谱法(LC-Q-TOF)分析比较冰岛刺参(Cucumariafrondosa)和南非花刺参(Stichopusvariegatus)脑苷脂的分子种组成。以氯仿-甲醇(2∶1,V/V)溶液提取,经皂化和SPE净化,在正离子模式下,通过自动二级(MS/MS)方式同时获取脑苷脂分子的一级和二级质谱图。筛取含180Da中性丢失碎片的分子,再结合二级质谱中的长链碱和脂肪酸碎片,确定每种脑苷脂分子的结构。研究表明:一次性从冰岛刺参中分析出56种脑苷脂分子,从南非花刺参中分析出109种脑苷脂分子;南非花刺参含长链碱种类较多,为15种,冰岛刺参含长链碱11种。冰岛刺参脑苷脂中鞘氨醇型长链碱占91.84%,南非花刺参脑苷脂中鞘氨醇型长链碱占85.97%;脂肪酸的组成均为17~25碳的饱和或单不饱和脂肪酸,且以24碳脂肪酸为主。冰岛刺参脑苷脂中2-羟基脂肪酸占总脂肪酸的33.50%,饱和脂肪酸∶单不饱和脂肪酸≈2∶3;南非花刺参脑苷脂中2-羟基脂肪酸占总脂肪酸的76.73%,饱和脂肪酸∶单不饱和脂肪酸≈2∶1。研究结果显示,在抑制肿瘤细胞增长、预防癌症方面南非花刺参脑苷脂较冰岛刺参脑苷脂可能具有更好的生物活性。本研究为不同海参脑苷脂的活性研究和营养评价提供了参考与借鉴。
脑苷脂;高效液相色谱-四极杆-飞行时间串联质谱法;冰岛刺参;南非花刺参;分子种
引用格式:曹建, 贾子才, 丛培旭, 等. 冰岛刺参和南非花刺参脑苷脂分子种的比较[J]. 中国海洋大学学报(自然科学版), 2016, 46(9): 38-44.
CAO Jian, JIA Zi-Cai, CONG Pei-Xu, et al. Comparison of cerebroside molecular species from sea cucumbersCucumariafrondosaandStichopusvariegatus[J]. Periodical of Ocean University of China, 2016, 46(9): 38-44.
脑苷脂又称酰基鞘氨醇己糖苷,是存在于细胞膜中的内源性活性化合物,由神经酰胺(Cer)连接一分子己糖构成,神经酰胺通过C-1位上羟基与己糖通过β糖苷键连接而成,包括葡萄糖脑苷脂和半乳糖脑苷脂,属于神经鞘脂类[1]。神经酰胺是由长链脂肪酸中的羧基与神经鞘氨醇(又称长链碱(Long-chain base,LCB))的氨基经脱水以酰胺键相连形成的一类酰胺类化合物[2]。神经鞘氨醇是最简单的鞘脂[3],根据神经鞘氨醇的不同,脑苷脂可以分为鞘氨醇型脑苷脂(d型)和植物鞘氨醇型脑苷脂(t型)。鞘氨醇羟基位于C-1和C-3位上,氨基位于C-2位上。植物鞘氨醇羟基位于C-1、C-3和C-4位上,氨基位于C-2位上。不同结构的神经酰胺和长链碱在体内的吸收和代谢不完全相同,Sugawara等[1]研究发现小肠上皮细胞内的一种转运机制使得植物鞘氨醇的吸收利用率远低于鞘氨醇。
脑苷脂脂肪酸一般为16~25个碳的2-羟基和非羟基脂肪酸,包括饱和及单不饱和脂肪酸。哺乳动物脑苷脂的鞘氨醇主要为d18∶1和d18∶2;而植物脑苷脂的鞘氨醇主要为d18∶1、d18∶0,植物鞘氨醇t18∶0也较为常见[5][6]。而海参脑苷脂结构新颖,与哺乳动物和植物脑苷脂相比有显著不同[7],不但含有哺乳动物和植物体内常见的d型鞘氨醇,还含有t型鞘氨醇,如d18∶3、d19∶3、t19∶3。脑苷脂的生物活性主要体现在抗菌[8]、抗肿瘤[9]、抗肝毒[10]等方面。武风娟等研究发现海参脑苷脂对H2O2诱导的PC12细胞的氧化损伤具有一定的保护作用[11]。董喆等研究表明海参脑苷脂对酵母浸粉诱导的高尿酸血症有明显改善作用[12]。Xu等从海地瓜中得到的脑苷脂类化合物显示出显著的抗脂肪肝活性[2]。研究海参脑苷脂的结构对于其活性及营养评价具有重要意义。
海参脑苷脂的结构组成是其活性研究与营养评价的基础,传统的长链碱和脂肪酸结构分析主要通过薄层色谱法(TLC)、高效液相色谱法(HPLC)、气相色谱(GC)或者气相色谱-质谱联用法(GC-MS)[3]。以上方法步骤冗繁、样品消耗量大且效率不高。随着软电离技术、高分辨质量分析技术和串联技术的发展,脑苷脂分子种组成的测定工作取得了较大进步。Xu等[3]通过液相色谱-离子阱-飞行时间串联质谱法(LCMS-IT-TOF)测定了海地瓜、北大西洋海参和仿刺参脑苷脂,分别鉴定出12、52、26种葡萄糖脑苷脂分子,但该法灵敏度相对较低。邢培培等利用液相色谱-四极杆-飞行时间串联质谱法(LC-Q-TOF)一次性分析出123种美国红参脑苷脂分子[2]。Xie等研究表明LC-Q-TOF具较高的灵敏度与分辨率,分析速度快且质量范围宽[14]。因此,在分析结构复杂的脑苷脂化合物方面,LC-Q-TOF法具有更强的适用性。
海参作为海洋中重要的生物,长久以来为人们食用,其中所含的海参多糖[15]、胶原蛋白、海参磷脂等物质在降血脂、抗肿瘤、治疗糖尿病、提高免疫力方面功能显著[16-19]。不同产地的海参营养成分受到其生长环境的影响而不同。冰岛刺参(Cucumariafrondosa)又称叶瓜参,属于棘皮动物门(Echinodermata)海参纲(Holothuroidea)枝手目(Dendrochirota)瓜参科(Cucumariidae)海洋动物,主要产于寒带水域,分布于格陵兰到马萨诸塞的西大西洋水域,挪威、英国、俄罗斯都有分布。其体壁总脂含量高达13.51%[20],具有较高的研究价值。南非花刺参(Stichopusvariegatus)属棘皮动物门(Echinodermata)海参纲(Holothuroidea)楯手目(Aspidochirota)刺参科(Stichopodidae),生长于南非,处于副热带高压带,是重要的食用海参之一。我国台湾、广东、广西以及海南岛海域均有分布。本文通过LC-Q-TOF法高通量分析冰岛刺参和南非花刺参的脑苷脂分子种,比较不同生长环境下2种海参脑苷脂的差异性,为不同海参之间脑苷脂种类的分析比较提供了参考。
1 实验部分
1.1 仪器、试剂与材料
1290 Infinity Series液相色谱仪,G6540 Q-TOF质谱仪(美国Agilent公司);AB 135-S分析天平(梅特勒-托利多集团);T10 basic分散机(德国IKA公司);DTU-1C氮吹仪(日本TAITEC公司);Milli-QA超纯水系统(美国Millipore公司)。
甲醇(色谱纯,德国Merck公司),乙酸铵,乙酸(色谱纯,美国Sigma公司);其它试剂均为国产分析纯;SGF254薄层色谱硅胶预制板(烟台市化学工业研究所);柱层析硅胶(试剂级,300~400目,青岛海洋化工厂);Supelclean ENVI-18固相萃取柱(3mL,美国Supelco公司);0.22μm有机滤膜(美国Agela公司生产)。
冰岛刺参(Cucumariafrondosa)、南非花刺参(Stichopusvariegatus)干品,购于青岛市南山市场。
1.2 样品制备
冰岛刺参和南非花刺参各取6只干品粉碎为干粉(100~200目),混合均匀后各称取0.1g(每种海参样品平行3份)。加入氯仿∶甲醇(2∶1,V/V)5mL振摇5min,超声浸提30min,过滤,反复浸提5遍。滤液用氮气浓缩至干。加入100μL的4mol/L氢氧化钾溶液以及1.0mL甲醇,置于37 ℃水浴中皂化1h,再分散于0.8mL水中,用2mL氯仿萃取5遍,有机相用氮气浓缩至干,得到冰岛刺参和南非花刺参脑苷脂粗提物。再通过Supelclean ENVI-18 SPE正相硅胶柱(3mL)净化,以氯仿/甲醇溶液梯度洗脱(100∶0~90∶10,V/V),分部收集洗脱液,采用TLC法初步检测收集物的组成及脑苷脂纯度,合并脑苷脂组分,氮吹后,以500μL甲醇溶解,待LC-Q-TOF分析。
1.3 LC-Q-TOF操作条件
1.3.1 液相色谱条件采用Agilent Plus C18色谱柱(100mm×2.1mm,3.5μm);流速0.2mL/min;95%甲醇-水溶液(含5mmol/L乙酸铵和0.05%乙酸)等度洗脱;柱温30℃;进样体积5μL。
1.3.2 质谱条件电喷雾离子源(ESI);正离子扫描模式;干燥气(N2)流速5L/min,温度280℃;毛细管电压3.5kV;喷雾气压2.1×105Pa;鞘气(N2)流速11L/min,温度280℃;喷嘴电压500V;裂解电压135V。一级质谱采集范围m/z700~900,扫描速率100ms;自动二级质谱采集范围m/z100~900,扫描速率100ms;每个循环最大分析母离子数为5,离子计数阈值为2 000,碰撞能25eV。
2 结果与讨论
2.1 LC-Q-TOF法分析冰岛刺参脑苷脂分子种结果
采用1.3方法,正离子扫描模式下,不同分子在所采用的反相液相色谱条件下依照疏水性不同而分离。图1为冰岛刺参(见图1a)、南非花刺参(见图1b)脑苷脂的总离子流(TIC)图及提取180Da中性碎片(质谱提取离子窗口设为±0.2)后的提取离子流(pNLC)图,色谱峰重合且信噪比大于10即可判定为脑苷脂色谱峰,依此筛选母离子。然后依次提取不同母离子的二级质谱图,解析其结构。
图2为d17∶1-C24∶1的二级质谱图,可发现LCB(m/z250.252 6)离子碎片,并有脂肪酸(FA)子离子碎片(m/z366.368 4),据此可推测出长链碱为d17∶1,其脂肪酸链为C24∶1。高分辨质谱测得[M+H]+峰的精确质量数为796.661 8,偏差为-5.9×10-6,长链碱偏差为-4.12×10-6,可计算出其分子式为C47H89NO8,验证其结构为d17∶1-C24∶1。另外,将其一级离子提取色谱图的离子峰以及脱水峰的积分面积进行加和,采用面积归一化法,得到该结构脑苷脂的相对含量。同理,可分析出冰岛刺参脑苷脂的其他分子种和南非花刺参脑苷脂分子种及相对含量。
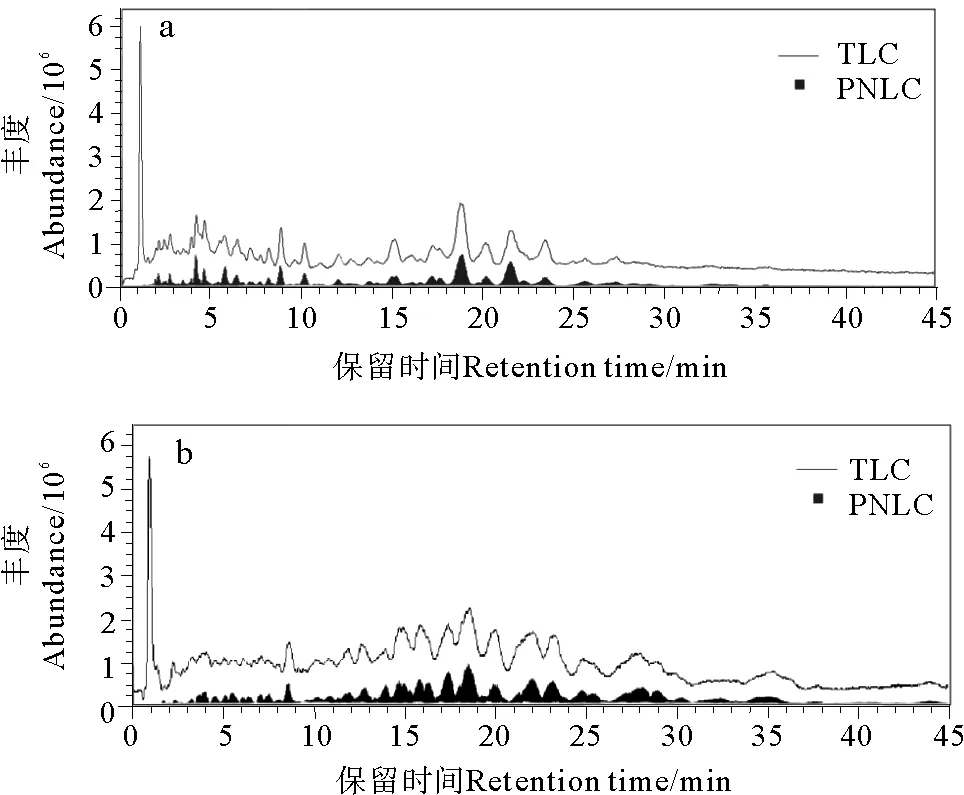
(a.冰岛刺参脑苷脂 Cerebrosides fromCucumariafrondosa; b.南非花刺参脑苷脂Cerebrosides fromStichopusvariegatus)
图1脑苷脂的总离子流图(TIC)和母离子的中性丢失离子流图(pNLC)
Fig.1Total ion chromatogram (TIC) and precursor neutral loss chromatogram (pNLC) of cerebrosides
采用该方法分析脑苷脂分子种,发现在不同保留时间会出现分子式相同的分子种(如保留时间4.05和5.64min的峰均为t19∶3-C24∶1h),推测两者的LCB双键位置不同或LCB末端存在异丙基(iso-)和反异丙基(ante-iso)取代情况[21]。
采用1.3.2方法,分析出4种冰岛刺参脑苷脂系列物(见表1,系列物I:普通鞘氨醇-非羟基型脂肪酸;系列物-II:普通鞘氨醇-羟基型脂肪酸;系列物-III:植物鞘氨醇-羟基型脂肪酸)和3种南非花刺参脑苷脂系列物(见表1,系列物I、系列物-II、系列物-III),包括56种冰岛刺参脑苷脂分子和109种南非花刺参脑苷脂分子。
2.2 冰岛刺参和南非花刺参脑苷脂分子种分析比较
冰岛刺参中含量最高的脑苷脂为系列物I,含量较高的脑苷脂分子种为d17∶1-C24∶1(16.14%)、d17∶1-C24∶1h(10.52%)、d18∶2-C18∶0(8.53%)、t17∶0-C24∶1h(6.11%)等;南非花刺参中含量最高的为脑苷脂系列物-II,含量较高的脑苷脂分子种为t18∶0-C24∶0h(10.16%)、d17∶1-C24∶1h(5.69%)、d17∶1-C22∶0h(4.59%)、d18∶2-C18∶0(4.35%),误差均在±10×10-6以内。相比于冰岛刺参,南非花刺参脑苷脂分子种类繁多,结构复杂。
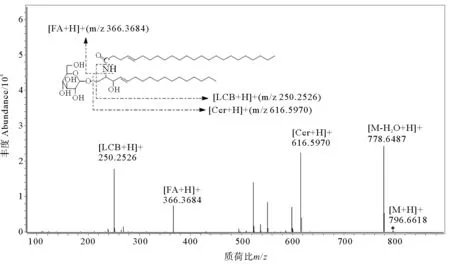
(FA:脂肪酸Fatty acids;LCB:长链碱Long-chain base;Cer:神经酰胺Ceramide)

脑苷脂系列物Cerebrosideseries相对含量①/%冰岛刺参②南非花刺参③I66.5023.27II25.3362.70III8.1614.03
Note: ①Relative content; ②Cucumariafrondosa; ③Stichopusvariegatus
通过本方法分析出冰岛刺参脑苷脂的长链碱11种,其中d17∶1(56.13%)、d18∶2(16.71%)、d19∶2(8.87%)、t17∶0(6.29)为其主要长链碱;南非花刺参脑苷脂的长链碱15种,其中d17∶1(33.10%)、d18∶1(16.07%)、d18∶2(16.06%)、t18∶0(10.69%)为其主要长链碱(见图3)。南非花刺参脑苷脂长链碱种类较多,且植物鞘氨醇的相对含量略高于冰岛刺参,长链碱可诱导多种肿瘤细胞的凋亡,且其双键个数、羟基个数、链长对抗癌活性影响显著[22],故推测南非花刺参脑苷脂在抑制肿瘤增殖方面具有更好的生物活性。
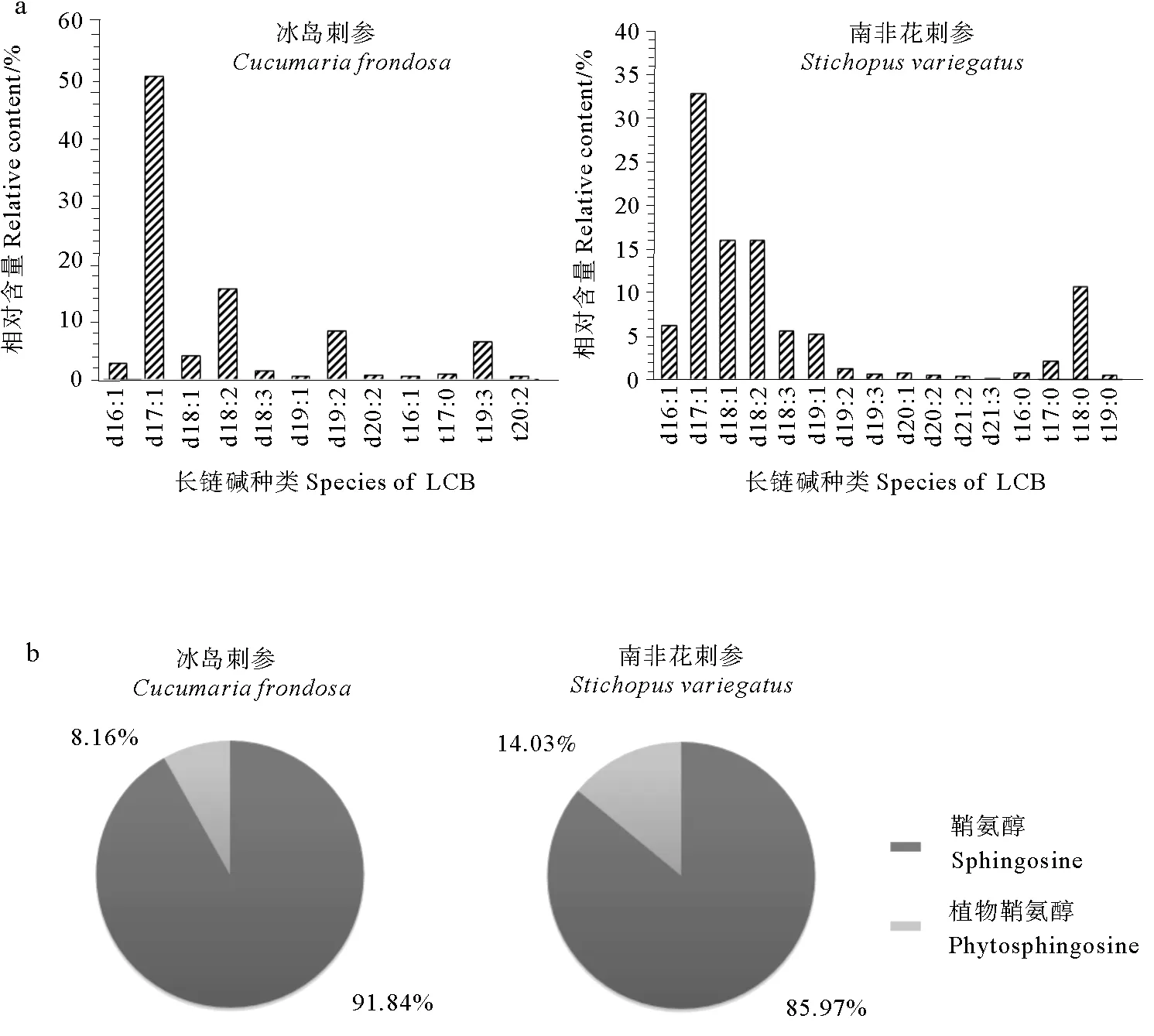
(a.不同种类长链碱的相对含量; b.植物鞘氨醇长链碱与鞘氨醇长链碱相对含量比例。a.The percent of different species of LCB; b.The ratio of phytosphingosine and sphingosine.)
图3冰岛刺参和南非花刺参脑苷脂中长链碱的相对含量
Fig.3The percent of LCB from sea cucumberCucumariafrondosaandStichopusvariegatus
冰岛刺参和南非花刺参脑苷脂分子中脂肪酸链主要为碳数17~25的脂肪酸,其中既包括非羟基脂肪酸(NFA)和2-羟基脂肪酸(HFA),以及饱和脂肪酸(SFA)也包括单不饱和脂肪酸(MUFA)。两者都以24碳为主,冰岛刺参脑苷脂分子中24碳脂肪酸比例为50.01%,南非花刺参脑苷脂分子中24碳脂肪酸比例为43.44%。冰岛刺参脑苷脂分子中HFA占33.50%,NFA占66.50%,而南非花刺参脑苷脂分子中HFA占76.73%,NFA占23.27%(见图4);SFA与MUFA的比例而言,冰岛刺参约为2∶3,南非花刺参约为2∶1,可见2种海参脑苷脂分子脂肪酸碳数以及主要脂肪酸虽相似,但南非花刺参脑苷脂分子脂肪酸羟基化程度更高,有研究表明,羟基脂肪酸对于哺乳动物细胞功能的调节作用显著[23],尤其对于维持中枢髓鞘的结构和功能有重要影响[24]。本实验室开展了海参脑苷脂的神经营养活性研究,结果表明冰岛刺参脑苷脂系列物(I,II,III)对PC12细胞具有一定的促分化作用,并能促进相关神经生长因子突触素和神经生长蛋白(GAP-43)的表达,其中脑苷脂系列物III的效果最为显著。由此,推测南非花刺参脑苷脂可能具有更好的生物活性。
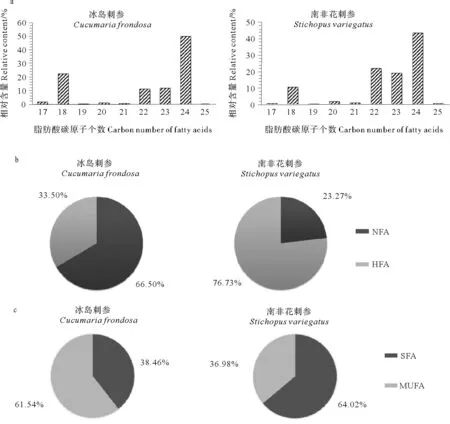
(a.不同碳数脂肪酸的相对含量;b.非羟基脂肪酸与2-羟基脂肪酸的相对含量比例;c.饱和脂肪酸与单不饱和脂肪酸的相对含量比例。a.Relative contents of different carbon numbers of fatty acids; b.Relative contents of non-hydroxyl fatty acids and 2-hydroxyl fatty acids; c.Relative contents of saturated fatty acids and monounsaturated fatty acids. NFA:非羟基脂肪酸Non-hydroxyl fatty acids;HFA:2-羟基脂肪酸2-hydroxyl fatty acids;SFA:饱和脂肪酸Saturated fatty acids;MUFA:单不饱和脂肪酸Monounsaturated fatty acids.)
图4冰岛刺参和南非花刺参脑苷脂中脂肪酸的相对含量
Fig.4Relative contents of different species of fatty acids in cerebrosides from sea cucumberCucumariafrondosaandStichopusvariegatus
3 结论
本文分析比较了冰岛刺参和南非花刺参脑苷脂的分子种组成。共分析出56种冰岛刺参脑苷脂分子,109种南非花刺参脑苷脂分子,其中南非花刺参所含长链碱种类较多,含有15种,冰岛刺参含有长链碱11种,且南非花刺参脂肪酸羟基化程度更高,预示着南非花刺参脑苷脂在抑制肿瘤细胞增长、预防癌症方面较冰岛刺参脑苷脂可能具有更好的生物活性。本文也为不同海参脑苷脂的活性研究及营养评价提供了基础。
[1]Koynova R, Caffrey M. Phases and phase transitions of the phingolipids[J]. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids, 1995, 1255(3): 213-236.
[2]邢培培, 徐杰, 丛培旭, 等. 液相色谱-四极杆-飞行时间串联质谱法高通量分析美国红参的脑苷脂分子种[J]. 色谱, 2014, 32(1): 26-33.
Xing P P, Xu J, Cong P X, et al. High throughtput analysis of cerebroside molecular species from sea cucumberParastichopuscalifornicusby liquid chromatography-quadrupole-time-of-flight mass spectrometry[J]. Chinese Journal of Chromatography, 2014, 32(1): 26-33.
[3]Xu J, Duan J J, Xue C H, et al. Analysis and comparison of glucocerebroside species from three edible sea cucumbers using liquid chromatography-ion trap-time-of-flight mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2011, 59(22): 46-53.
[4]Sugawara T, M Kinoshita, M Ohnishi, et al. Digestion of maize sphingolipids in rats and uptake of sphingadienine by Caco-2 cells[J]. Journal of Nutriention, 2003, 133: 2777-2782.
[5] Petra Sperling, Ernst Heinz. Plant sphingolipids: Structural diversity, biosynthesis, first genes and functions[J]. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids, 2003, 1632: 1-15.
[6]Warnecke D, Heinz E. Recently discovered functions of glucosylceramides in plants and fungi[J]. Cellular and Molecular Life Sciences, 2003, 60(5): 919-941.
[7]Ohashi Y, Tanaka T, Akashi S, et al. Squid nerve sphingomyelin containing an unusual sphingoidbase[J]. Journal of Lipid Research, 2000, 41: 1118-1124.
[8]Cateni F, Zilic J, Falsone G, et al. New cerebrosides fromEuphorbiapeplisL: antimicrobial activity evaluation[J]. Bioorganic and Medicinal Chemistry Letters, 2003, 13(24): 4345-4350.
[9]Duan R D, Nilsson A. Metabolism of sphingolipids in the gut and its relation to inflammation and cancer development[J]. Progress in Lipid Research, 2009, 48(1): 62-72.
[10]Zigmond E, Papo O, Zangen S, et al. Treatment of non-alcoholic steatohepatitis by beta-glucosylceramide: A phase I/II clinical study[J]. Hepatology, 2006, 44: 657-658.
[11]武风娟, 杜磊, 徐杰, 等. 海参脑苷脂对H2O2致PC12细胞氧化损伤的保护作用[J]. 卫生研究, 2012, 41(4): 612-616.
Wu F J, Du L, Xu J, et al. Protective effects of cerebroside from sea cucumber on the oxidative damage of PC12 cells induced by H2O2[J]. Journal of Hygiene Research, 2012, 41(4): 612-616.
[12]董喆, 丁宁, 崔洁, 等. 海参脑苷脂及神经酰胺对小鼠高尿酸血症的改善作用[J]. 中国海洋药物, 2013, 32(6): 65-71.
Dong Z, Ding N, Cui J, et al. The effect of cerebroside and ceramide from sea cucumber on hyperuricemia in mice[J]. Chinese Journal of Marine Drugs, 2013, 32(6): 65-71.
[13]Xu J, Wang Y M, Feng T Y, et al. Isolation and anti-fatty liver activity of a novel cerebroside from the sea cucumberAcaudinamolpadioides[J]. Bioscience, Biotechnology and Biochemistry, 2010, 75(8): 1466-1471.
[14]Xie C, Zhong D, Yu K, et al. Recent advances in metabolite identification and quantitative bioanalysis by LC-Q-TOF MS[J]. Bioanalysis, 2012, 4(8): 937-959.
[15]Chen S G, Xue C H, Yin L A, et al. Comparison of structures and anticoagulant activities of fucosylated chondroitin sulfates from different sea cucumbers[J]. Carbohydrate Polymers, 2011, 83(2): 688-696.
[16]Cui F X, Xue C H, Li Z J, et al. Characterization and subunit composition of collagen from the body wall of sea cucumberStichopusjaponicus[J]. Food Chemistry, 2007, 100(3): 1120-1125.
[17]Kisa F, Yamada K, Kaneko M, et al. Constituents of holothuroidea, 14. Isolation and structure of new glucocerebroside molecular species from the sea cucumberStichopusjaponicas[J]. Chemical Pharmaceutical Bulletin, 2005, 53(4): 382-386.
[18]樊绘曾, 陈菊娣, 吕培宏, 等. 玉足海参酸性多糖的研究[J]. 药学学报, 1983, 18(3): 203-205.
Fan H Z, Chen J D, LU P H, et al. Acidic polysaccharides fromHolothurialeucospilota[J]. Acta Pharmaceutica Sinica, 1983, 18(3): 203-205.
[19]钟志贵. 海参为主治疗糖尿病[J]. 中医杂志, 1989, 12: 5-6.
Zhong Z. Sea cucumber-based treatment of diabetes[J]. Journal of Traditional Chinese Medicine 1989, 12: 5-6.
[20]Hu S W, Xu L L, Shi D, et al. Eicosapentaenoic acid-enriched phosphatidylcholine isolated fromCucumariafrondosaexhibits anti-hyperglycemic effects via activating phosphoinositide 3-kinase/protein kinase B signal pathway[J]. Journal of Bioscience and Bioengineering, 2014, 117(4): 457-463.
[21]Sugawara T, Aida K, Duan J J, et al. Analysis of glucosylceramides from various sources by liquid chromatography-ion trap mass spectrometry[J]. Journal of Oleo Science, 2010, 59(7): 387-394.
[22]Aida K, Kinoshita M, Sugawara T, et al. Apoptosis inducement by plant and fungus sphingoid bases in human colon cancer cells[J]. Journal of Oleo Science, 2004, 53(10): 503-510.
[23]Nagano M, Takahara K, Fujimoto M, et al. Arabidopsis sphingolipid fatty acid 2-hydroxylases (AtFAH1 and AtFAH2) are functionally differentiated in fatty acid 2-hydroxylation and stress responses[J]. Plant Physiology, 2012, 159(3): 1138-1148.
[24]Chrast R, Saher G, Nave K A, et al. Lipid metabolism in myelinating glial cells: Lessons from human inherited disorders and mouse models[J]. Journal of Lipid Research, 2011, 52(3): 419-434.
责任编辑朱宝象
Comparison of Cerebroside Molecular Species from Sea CucumbersCucumariafrondosaandStichopusvariegatus
CAO Jian, JIA Zi-Cai, CONG Pei-Xu, TAO Su-Yuan, LI Zhao-Jie, XU Jie, XUE Chang-Hu
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
To compare cerebroside molecular species from sea cucumbersCucumariafrondosaandStichopusvariegatus, liquid chromatography—quadrupole-time-of-flight (LC-Q-TOF) mass spectrometry was used. The cerebrosides from sea cucumbers were extracted with chloroform-methanol (2∶1, V/V) solution, saponified, and purified by a SPE cartridge. In positive electrospray ionization (ESI) mode, the mass spectra of precursor ion scan and product ion scan were obtained simultaneously through the automatic MS/MS mode. Cerebroside molecules were separated and identified on the basis of both mass and hydrophobicity. According to total ion chromatogram (TIC) and neutral loss chromatogram (NLC) of 180 Da, the shapes of TLC and NLC were nearly the same. Cerebroside molecular species were screened by identifying overlapping peaks with signal to noise ratio (S/N) > 10. Fifty-six cerebroside molecular species fromCucumariafrondosaand 109 cerebroside molecular species fromStichopusvariegatuswere identified rapidly. After comparison, more than 15 long-chain bases (LCB) of cerebrosides were found inStichopusvariegatusthan inCucumariafrondosa(11 LCB). The percentage of the total sphingosines of cerebrosides inCucumariafrondosaandStichopusvariegatuswas 91.84% and 85.97%, respectively. For fatty acids, the carbon number varied between 17 and 25. The 24 carbon fatty acids were predominant. The relative ratio of saturated fatty acids to monounsaturated fatty acids of cerebrosides fromCucumariafrondosawas about 2∶3, and the percentage of 2-hydroxy fatty acids was about 33.50%. The relative ratio of saturated fatty acids and monounsaturated fatty acids fromStichopusvariegatuswas about 2∶1, and the percentage of 2-hydroxy fatty acids was about 76.73%. Major fatty acids composition of cerebroside molecular species fromStichopusvariegatuswas similar to that fromCucuma-riafrondosa; however they were highly hydroxylated, which regulate mammalian cell function significantly. This study indicated that cerebrosides fromStichopusvariegatusmight have a better perspective than those fromCucumariafrondosain inhibiting tumor cell growth and preventing cancer. In addition, the study provided a basis for the evaluation of bioactivity and nutrition of cerebrosides from different sea cucumbers.
cerebroside; liquid chromatography-quadrupole-time-of-flight mass spectrometry;Cucumariafrondosa;Stichopusvariegatus; molecular species
国家自然科学基金项目(31201329)资助
2015-06-01;
2016-04-01
曹建(1990-),男,硕士生。E-mail: caozijian1106@163.com
❋❋通讯作者:E-mail: xujie9@ouc.edu.cn
TS254.1
A
1672-5174(2016)09-038-07
10.16441/j.cnki.hdxb.20150196
Supported by National Natural Science Foundation of China(31201329)
