小檗碱对3T3-L1前体脂肪细胞增殖与分化的影响
2016-10-12李东伟曹美霞宋阳阳于立恒李永民李焰焰屈长青
李东伟,曹美霞,宋阳阳,于立恒,李永民,李焰焰,屈长青
(1.阜阳师范学院 生物与食品工程学院,安徽 阜阳 236037;2.抗衰老中草药安徽省工程技术研究中心,安徽 阜阳236037;3.阜阳市人民医院 中西医结合科,安徽 阜阳 236000)
小檗碱对3T3-L1前体脂肪细胞增殖与分化的影响
李东伟1,2,曹美霞1,2,宋阳阳1,2,于立恒3,李永民1,2,李焰焰1,2,屈长青1,2
(1.阜阳师范学院 生物与食品工程学院,安徽 阜阳 236037;2.抗衰老中草药安徽省工程技术研究中心,安徽 阜阳236037;3.阜阳市人民医院 中西医结合科,安徽 阜阳 236000)
为探讨小檗碱对前体脂肪细胞增殖和分化的影响,本文通过MTT法检测3T3-L1前体脂肪细胞增殖和油红O染色与酶标仪检测细胞内甘油三酯含量等分析小檗碱对其细胞形态及功能的影响;通过实时荧光定量PCR方法检测前体脂肪细胞成脂分化相关基因的表达水平,分析小檗碱影响其成脂分化可能的作用途径。结果表明,小檗碱浓度高于20 μmol·L-1时抑制3T3-L1细胞增殖,甚至出现部分细胞死亡,而5 μmol·L-1小檗碱对其抑制作用较弱;小檗碱浓度越大对3T3-L1细胞内脂滴堆积的抑制作用越明显;实时荧光定量PCR检测表明,不同浓度的小檗碱明显抑制C/EBPβ和SREBP-1c的基因表达,且其能够通过影响miRNA表达而发挥更广泛的作用。
小檗碱;前体脂肪细胞;增殖;分化;影响
小檗碱(berberine,BBR)是黄莲的主要活性成分,故又名黄连素,为黄色针晶或核晶,主要存在于小檗科、罂栗科、毛莨科、芸香科等植物中,属于异喹啉类生物碱。BBR作为主要成份的中成药品种,具有广谱抗菌作用,对多种革兰阳性菌、革兰阴性细菌以及真菌均有抑制和杀灭作用,近年还陆续发现它有抗心律失常、利胆、改善充血性心力衰竭、降血糖、降血脂等药理作用[1],其中降血脂功能倍受关注,特别是在糖尿病的临床治疗中[2,3,4],但对于其作用机理仍不明确。本实验通过细胞培养和实时荧光定量PCR试验等观察BBR 对3T3-L1前体脂肪细胞成脂分化过程中细胞变化及其标志基因表达的影响等,为研究BBR在脂类代谢中的作用机理提供参考依据。
1 材料与方法
1.1材料
3T3-L1细胞株购自中科院上海生命科学院生物化学与细胞生物学研究所;DMEM细胞培养液、胎牛血清和胰蛋白酶购自Hyclone;BBR,二甲基亚砜(DMSO),3-异丁基-1-甲基黄嘌呤(IBMX),MTT,油红O,地塞米松,胰岛素,罗格列酮,Trizol 和lipo2000购自Sigma;Dual-Glo Luciferase Assay System购自Promega;miR-143 mimics和inhibitor购自上海吉玛公司;反转录和荧光定量PCR试剂盒及miRNA通用下游引物购自TaKa-Ra,其余引物由上海生工公司合成。
倒置荧光显微镜购自奥林巴斯公司;CO2培养箱和Nanodrop分光光度计购自赛默飞世尔公司;酶标仪购自BioTeK公司;梯度PCR仪购自Bio-Rad公司;实时荧光定量PCR仪购自ABI公司。
1.2方法
1.2.13T3-L1前体脂肪细胞的培养和诱导分化
使用含10%FBS的DMEM高糖培养基在5%CO2、37℃及饱和湿度下的细胞培养箱中培养3T3-L1细胞,隔天换液,待细胞生长汇合度达约90%时进行传代。当生长状态良好的3T3-L1细胞增殖至接触抑制后,使用含有地塞米松1.0 μmol·L-1、IBMX 0.5 mmol·L-1、胰岛素0.2 mg·L-1、罗格列酮5.0 μmol·L-1和10%FBS的高糖DMEM进行诱导成脂培养48 h,之后换用含胰岛素0.2 mg·L-1、地塞米松1.0 μmol·L-1和10%FBS的高糖DMEM维持培养48 h,再换用含10%FBS的高糖DMEM培养基继续培养,每2 d换液1次,至8~12 d观察3T3-L1细胞成脂分化程度。在开始诱导成脂分化时BBR处理组培养基中分别加入5、10和20 μmol·L-1的BBR。
1.2.2MTT检测BBR对3T3-L1前体脂肪细胞
增殖和成脂分化的影响
将3T3-L1前体脂肪细胞以1×104mL-1接种到96孔板,每孔200 μL,在5%CO2、37℃和饱和湿度的细胞培养箱里培养,24 h后小檗碱处理组培养基更换为分别含有5、10和20 μmol·L-1BBR的完全培养基继续培养,48 h后每孔加入5 mg· mL-1的MTT 20 μL再培养4 h,随后吸出培养液,加入150 μL DMSO,摇晃10 min后使用酶标仪测490 nm处吸光度。
将3T3-L1前体脂肪细胞按上述方法进行诱导成脂分化8 d后,进行油红O染色,拍摄照片;异丙醇萃取甘油三酯(triglyceride,TG),使用酶标仪测量490 nm处吸光度。
1.2.3BBR对3T3-L1脂代谢相关基因表达影响
将3T3-L1前体脂肪细胞进行诱导成脂分化4和8天后使用Trizol试剂抽提法分别抽提总RNA,Nanodrop分光光度计检测其质量。使用Takara D358试剂盒将各组细胞合格的总RNA等量逆转录成cDNA,而后进行实时荧光定量PCR检测。基因标识号及合成引物见表1;反应体系为20 μl,反应条件:95℃30 s,95℃5 s,60℃31 s,40个循环。U6为内参基因,以2-ΔΔCt计算基因的相对表达量。
1.2.4双色荧光素酶活性检测试验
将含目的基因3'UTR区域片段克隆至pMIR质粒中,通过测序检测,证明删除突变成功;如图1进行相应分组;EP管中分别加入300 μL serumfree DMEM培养基,再分别加入各组质粒,每孔1μg pMIR质粒,0.1 μg Renilla质粒,miRNA mimics终浓度为20 nmol·L-1;转染试剂直接加入serum-free DMEM medium,静置后将含lipo2000的培养基等体积加到含质粒的培养基中;混合培养液静置20 min后,加入HEK293T细胞生长旺盛的培养液中,每孔约100 μL;6 h后,更换新鲜培养基,48 h后收集细胞进行双色荧光素酶活性检测。
1.3统计学分析
实验数据以平均数±标准差(mean±SD)表示,采用SPSS 13.0软件对数据进行单因素方差分析(ONE WAYANOVA),方差分析采用LSD法。

表1 引物合成
2 结果
2.1BBR抑制3T3-L1前体脂肪细胞的增殖
含有不同浓度BBR的培养液培养3T3-L1细胞,培养4 d和8 d均抑制其增殖,含20 μmol·L-1BBR的培养液培养4 d和8 d时均显示了较强的抑制作用,而含5 μmol·L-1BBR的培养液培养4 d时其抑制作用较弱(图1)。
2.2BBR对3T3L1前体脂肪细胞成脂分化作用
成脂诱导前48 h,将BBR加入诱分化培养液进行培养,细胞正常生长4天或8天后经油红O染色和异丙醇萃取TG检测判断BBR对3T3-L1成脂分化的影响。结果显示:BBR浓度越高越抑制3T3-L1细胞的成脂分化(表2);3T3-L1细胞在分化前呈成纤维细胞样生长,在分化诱导后细胞里出现脂滴而趋圆变大,但在试验过程中可以观察到脂滴较少聚集或聚集速率较慢(图2)。
2.3BBR对3T3-L1细胞成脂分化相关基因表达的影响
3T3-L1细胞诱导分化过程中加入不同浓度BBR培养四天后收集细胞,提取总RNA反转录后进行实时荧光定量PCR检测,分析BBR对成脂分化相关基因表达的影响。结果显示不同浓度BBR抑制C/EBPβ和SREBP-1c基因表达,对miR-143基因表达影响呈先升后降变化(图3)。
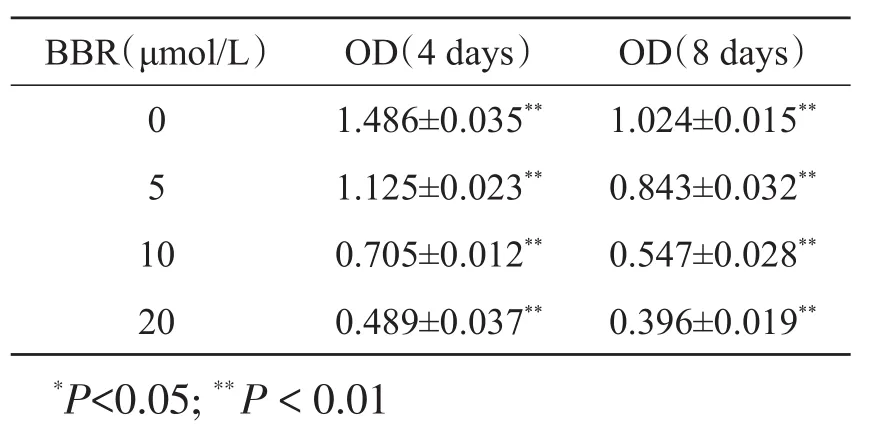
表2 不同浓度BBR对细胞TG含量的影响

图2 BBR对细胞成脂分化的影响(油红O染色,×100)
2.4miR-143靶向调控MAP2K5
通过生物信息学预测和分析miR-143的候选靶基因,选定MAP2K5作为miR-143的待验证靶基因进行双荧光素酶活性检测实验,结果表明:miR-143能够引起MAP2K5表达下调,表明其是miR-143潜在的靶基因(图4);通过荧光定量RTPCR检测亦发现,miR-143表达水平高,则MAP2K5 mRNA表达水平较低(图5)。
3 讨论
肥胖是常见的能量代谢性疾病,是引起糖尿病、高血压和心脑血管等多种疾病的主要因素,目前认为其主要是由机体脂肪细胞数目增多和体积增大引起的。近年来,脂肪细胞分化的调控与肥胖和糖尿病发病机制的关系等一直是国内外研究的热点。研究中药对脂肪细胞分化的影响,对于防治与肥胖和胰岛素抵抗密切相关的糖尿病、血脂异常、动脉粥样硬化及高血压等代谢性疾病的发生及减轻其危害有重要意义。

图3 BBR对3T3-L1前体脂肪细胞成脂分化相关基因表达的影响(*P<0.05;**P<0.01)

图4 双色荧光素酶活性试验检测miR-143 对MAP2K5的调控

图5 荧光定量RT-PCR检测MAP2K5表达水平
BBR在传统中医中被长期用于治疗由细菌感染引起的肠胃疾病,目前其降血脂的功效已得到部分实验证实。Yin等[5]报道,BBR对实验大鼠脂代谢有显著的改善作用,能使普食鼠和高脂鼠的血清游离脂肪酸分别下降14%和24%。孔维佳等[6]在实验研究中发现高血脂金黄地鼠每千克灌胃小檗碱100 mg,10天后血清胆固醇和低密度脂蛋白胆固醇浓度都有明显的下降,还可以上调金黄地鼠肝脏中LDLR mRNA和蛋白质的表达水平,而且能明显减少肝组织中中性脂肪的含量。对小檗碱作用机理研究的部分结果表明,小檗碱能明显抑制3T3-L1脂肪细胞的分化程度及脂肪细胞分化相关基因PPARγ和C/EBPα基因的表达[7];小檗碱加成脂诱导剂能明显降低3T3-L1前脂肪细胞分化为脂肪细胞时TG的堆积与合成[8]。本文实验结果表明,培养液中含高剂量BBR时能够抑制3T3-L1前体脂肪细胞增殖,而当BBR剂量低于5 μmol·L-1时,其抑制作用较弱。已有研究也表明,低浓度小檗碱可以显著促进前脂肪细胞的增殖,抑制脂肪细胞的增殖[9,10],可见BBR对脂肪沉积的作用与其浓度有关。通过小檗碱加诱导剂培养3T3-L1前体脂肪细胞成脂分化后,经油红O染色和细胞内甘油三酯含量检测,证实小檗碱抑制其成脂分化,剂量高或作用时间长其抑制作用越明显。通过实时荧光定量PCR检测成脂分化相关基因C/EBPβ和SREBP-1c,证实BBR抑制C/EBPβ和SREBP-1c表达,有研究表明这两基因有助于PPARγ基因表达[11],也有文献报道小檗碱抑制PPARγ和C/EBPαmRNA表达[12],显示BBR抑制前体脂肪细胞分化成熟可能是通过调控一系列脂分化相关基因的表达实现的,AMPK信号通路也可能参与其中[13]。另外还有研究显示,BBR涉及miRNA调控,例如BBR诱导肝细胞癌P53上调就可能与miR-23a调控网络有关[14]。miRNA是一类长约22个核苷酸的单链小分子非编码RNA,通过转录后调控靶基因表达来调节细胞功能。其中,miR-143参与脂肪分化过程被广泛报道。较早研究显示,高脂饲喂的小鼠脂肪沉积与miR-143表达上调有关[15],miR-143能够通过调控ERK5促进脂肪前体细胞分化[16],也能够通过调控PTN促进脂肪分化[17],或是通过下调肥胖小鼠体内的氧化固醇结合蛋白8而消弱胰岛素刺激对AKT的激活作用和血糖平衡[18]。全基因组及计算模型分析都显示一个miRNA可以靶向调控数百个基因[19,20],miRNA通过共调控功能相关的多个基因从而产生巨大作用[21]。在本实验中,我们通过双色荧光素酶活性检测试验和荧光定量RT-PCR检测揭示了miR-143也可以靶向负调控MAP2K5,从而对MAPK信号通路产生影响。已有研究表明,MAPK信号同路与脂肪细胞分化密切相关[22,23]。在脂肪细胞生长过程中,BBR浓度与miR-143表达量存在负相关,低浓度的BBR能够促进miR-143表达,而高浓度BBR会抑制miR-143表达。BBR的存在能够影响脂肪细胞中miR-143的表达,进而可以影响miR-143对MAPK信号通路的调控。
目前,健康养生已是衣食无忧的人们关心的重要话题之一了,传统中药用于健康养生也深入民心,而肥胖症和糖尿病等的发病率也是逐年攀升。深入研究传统中药的作用机理,将为推广加快传统中药发展奠定牢固的基石。黄莲是具有悠久历史的传统中药,其作用广泛,药效显著,因此我们应该对其有效成分的作用机理深入研究,让其为人们的健康养生做出更大的贡献。
[1] 李波,朱维良,陈凯先.小檗碱及其衍生物的研究进展[J].药学学报,2008,43(8):773-787.
[2] Lan J R,Zhao Y Y,Dong F X,et al.Meta-analysis of the effect and safety of berberine in the treatment of type 2 diabetes mellitus hyperlipemia and hypertension.Journal of Ethnopharmacology[J],2015,161:69-81
[3] 吴惠玲.小檗碱对胰岛β细胞的保护作用及其机制研究[J].中国病理生理杂志,2014,30(12):2213-2218.
[4] 薛瑞,李芳,李凡,等.小檗碱降血糖作用及其机制的实验研究[J].陕西中医,2014,35(12):1678-1679.
[5]Yin J,Chen M D,Tang J F,et al.Effects of berberine on glucose and lipid metabolism in animal experiment [J].Chin J Diabetes,2004,12:215-218
[6] 孔维佳.小檗碱降低血清胆固醇的作用与分子机理研究[D].北京:中国协和医科大学,2004.
[7] 刘毅,娄少颖,何燕铭,等.小檗碱对3T3-L1前脂肪细胞增殖及分化相关基因PPARγ、C/EBPαmRNA和蛋白表达的影响[J].中国中西医结合杂志,2008,28(11):1005-1009.
[8] Cao S J,Zhou Y,Xu P X,et al.Berberine metabolites exhibit triglyceride-lowering effects via activation of AMP-activated protein kinase in Hep G2 cells[J].Journal of Ethnopharmacology,2013,149(2):576-582.
[9] 郭晓农.小檗碱对3T3-L1脂肪细胞增殖及糖代谢的影响[J].中药材,2011,34(4):602-604.
[10]周丽斌,陈名道,王晓,等.小檗碱对脂肪细胞分化的影响[J].中华医学杂志,2003,83(4):338-340.
[11]Regina P B,Jae B K,Hu E D,et al.Adipocyte differentiation:a transcriptional regulatory cascade[J].Current Opinion in Cell Biology,1996,8(6):826-832.
[12]王树海,王文健,汪雪峰,等.黄芪多糖和小檗碱对3T3-L1脂肪细胞糖代谢及细胞分化的影响[J].中国中西医结合杂志,2004,24(10):926-928.
[13]王宁,张娟,建方方,等.小檗碱激活AMPK抑制3T3-L1脂肪细胞分化[J].放射免疫学杂志,2012,25(3):273-275.
[14]Wang N,Zhu M,Wang X,et al.Berberine-induced tumor suppressor p53 up-regulation gets involved in the regulatory network of MIR-23a in hepatocellular carcinoma[J].Biochimica et Biophysica acta,2014,1839 (9):849-857.
[15]Takanabe R,Ono K Y,Abe Y,et al.Up-regulated expression of microRNA-143 in association with obesity in adipose tissue of mice fed high-fat diet.Biochem[J]. Biochemical&Biophysical Research Communications.2008,376:728-732.
[16]Esau C,Kang X,Peralta E,et al.MicroRNA-143 regulates adipocyte differentiation[J].Journal of Biological Chemistry,2004,279,:52361-52365.
[17]Yi C,Xie W D,Li F,et al.MiR-143 enhances adipogenic differentiation of 3T3-L1 cells through targeting the coding region of mouse pleiotrophin[J].FEBS Letters,2011,585(20):3303-3309.
[18]Jordan S D,Krueger M,Willmes D M,et al.Obesityinduced over expression of miRNA-143 inhibits insulin-stimulated AKT activation and impairs glucose metabolism[J].Nature Cell Biology,2011,13(4):434-U208.
[19]Lim L P,Lau N C,Garrett-Engele P,et al.Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs[J].Nature,2005,433 (727):769-773.
[20]Grimson A,Farh K K,Johnston W K,et al.MicroRNA targeting specificity in mammals:Determinants beyond seed pairing[J].Molecular Cell,2007,27(1):91-105.
[21]He J,Zhang J F,Yi C,et al.miRNA-Mediated functional changes through Co-Regulating function related genes[J].PLOS One,2010,5(10):e13558.
[22]Rask-Andersen M,Jacobsson J A,Moschonis G,et al. The MAP2K5-linked SNP rs2241423 is associated with BMI and obesity in two cohorts of Swedish and Greek children[Z],2012:36.
[23]吕雯,芦荣胜,李捷,等.MAPK信号通路对脂肪细胞分化的调控[J].动物医学进展,2012,33(3):110-114.
Effects of berberine on 3T3-L1 preadipocytes proliferation and differentiation
LI Dong-wei1,2,CAO Mei-xia1,2,SONG Yang-yang1,2,YU Li-heng3,LI Yong-min1,2,LIYan-yan1,2,QU Chang-qing1,2
(1.School of Biological and Food Engineering,Fuyang Normal University,Fuyang Anhui 236037,China;2.Anhui Province Engineering Technology Research Center of Anti-aging Chinese Herbal Medicine,Fuyang Anhui 236037,China;3.Department of Integrated Chinese and Western Medicine,People's Hospital of Fuyang,Fuyang Anhui 236000,China)
To investigate the effects of berberine on the proliferation and differentiation of preadipocytes,the multiplication of 3T3-L1 preadipocytes was detected by MTT method,and lipid droplets accumulated in preadipocytes were observed by oil O staining and quantified by colorimetry,and the expression of genes related to preadipocytes differetiation was analyzed by realtime RT-PCR.The results showed that the concentration of berberine over 20 μmol·L-1could lead to the inhibitation of 3T3-L1 preadipocytes proliferation,cells death,and the inhibitory effect of 5 μmol·L-1berberine was weak on its proliferation;Meanwhile,the accumulation of intracellular lipid droplets was more suppressed when 3T3-L1 preadipocytes treated with higher concentration of berberine;The expression of differentiation related factor C/EBPβ and SREBP-1c was downregulated and the effect on miR-143 gene expression displayed a dose-dependent manner by real-time PCR analysis.BBR weakens adipogenesis by impairing miR-143 expression maybe indirectly and provokes comprehensive changes in function.
berberine;preadipocytes;proliferation;differentiation;effects
Q291;R285.5
A
1004-4329(2016)02-050-05
10.14096/j.cnki.cn34-1069/n/1004-4329(2016)02-050-05
2016-01-15
阜阳师范学院省级科研机构委托专项(2013KSLZX01);大学生创新创业训练计划项目(AH201310371043);教育部高校博士点专项(20113418120002);安徽省高校优秀青年人才计划重点项目(gxyqZD2016195);安徽省自然科学基金项目(1508085QC59);国家自然科学基金项目(31101696)资助。
李东伟(1978-),男,博士,讲师,研究方向:动物遗传发育研究。
