酶解法分离与同源血清培养SD大鼠胃Cajal间质细胞的实验研究
2016-10-11宁海恩凌江红王煜姣上官鑫超广西医科大学第一附属医院广西南宁530021
宁海恩,凌江红,张 智,王煜姣,上官鑫超(广西医科大学第一附属医院,广西南宁530021)
酶解法分离与同源血清培养SD大鼠胃Cajal间质细胞的实验研究
宁海恩,凌江红,张智,王煜姣,上官鑫超
(广西医科大学第一附属医院,广西南宁530021)
[目的]探讨体外酶解法分离、同源血清培养SD大鼠胃Cajal间质细胞(ICC)的实验方法。[方法]无菌条件下分离大鼠胃窦组织,酶解法分离制备ICC细胞悬液,接种于M199完全培养基(含10%大鼠同源血清,不含胎牛血清及重组鼠类干细胞因子)进行培养,倒置显微镜下观察细胞形态变化,适时换液,MTT法测定ICC对数生长曲线,C-kit特异性抗体免疫荧光染色法鉴定ICC,并取对数生长期细胞进行传代培养。[结果]同源血清培养ICC成活并体现其特有的生长曲线及形态学特征,C-kit特异性抗体免疫荧光染色证实细胞为ICC,且细胞传代培养成功。[结论]酶解法可以对SD大鼠胃窦ICC进行分离,在不使用胎牛血清(FBS)及重组鼠类干细胞因子(SCF)培养的条件下,含大鼠同源血清的M199完全培养基可以完成ICC原代培养及传代培养。该项培养方法可行,为研究ICC生物学特性及其与胃肠病学的临床和基础关系奠定基础。
Cajal间质细胞;胃窦;SD大鼠;同源血清;细胞培养技术
胃肠道Cajal间质细胞(interstitial cells of cajal,ICC)作为胃肠运动的起搏细胞,可以产生自主节律性慢波电位,通过突起和缝隙连接作用于胃肠平滑肌细胞,促进平滑肌的节律性舒缩;胃肠神经递质通过ICC介导影响平滑肌,形成“肠神经–ICC-平滑肌细胞”功能结合体进行调控胃肠道的电生理和胃肠动力。因此,ICC的细胞学特性与胃肠动力障碍性疾病的相关研究成为近年来的研究热点,对于该细胞的分离与培养成为胃肠病学基础研究的重要前提。目前国内外学者已对Wistar大鼠、Balb/c小鼠、成年C57BL/6小鼠及KM小鼠的胃[1-2]、小肠[3-5]、膀胱[6]、阴茎海绵体[7]等部位的ICC成功进行了分离、培养,其中培养方法不尽相同,主要以胎牛血清作为基础血清,并主张利用重组鼠类干细胞因子(SCF)进行诱导、促进ICC生长,但成本较高、操作繁琐,且对于分离、培养过程中需要注意的相关问题尚无系统的报道。经查阅文献,目前对SD大鼠胃窦ICC进行分离和培养尚无报道。本实验采用酶解法制备单细胞悬液,不使用胎牛血清及重组鼠类干细胞因子,采用同源血清进行培养ICC,探讨这一实验培养方法的可行性。
1 材料和方法
1.1材料SPF级SD大鼠,鼠龄约2个月,体重150±5 g,雌雄不限,由广西医科大学实验动物中心提供,合格证号:SCXK桂2009-0002。适应性饲养1周,自由进食、进水,保持环境通气、干燥。实验前禁食8 h,不禁水。
1.2试剂M199培养液(美国Hyclone公司);SD大鼠动脉血清(自制);Ⅱ型胶原酶(美国GIBCO公司);CD117/c-kit antibody一抗(美国pierce公司,下简称“一抗”);DylightTM488 Conjugate Goat anti-Rabbit IgG二抗(杭州联科生物技术有限公司,下简称“二抗”);抗荧光淬灭封片液(上海碧云天生物技术有限公司);MTT(上海江莱生物科技有限公司);二甲基亚砜DMSO(上海慧颖生物科技有限公司);PBS液、胰酶0.25%+0.02%EDTA、青霉素-链霉素溶液(杭州吉诺生物医药技术有限公司);Ficoll 400、台盼蓝溶液(北京索莱宝科技有限公司);水合氯醛、25%戊二醛(成都市科龙试剂有限公司)。
1.3仪器酶标仪(Multiskan Ascent,芬兰产);激光共聚焦显微镜META510(德国ZEISS公司);光学倒置显微镜(Olympus公司);电子天平BS423S(Sartorius AG);SW-CJ-2FD超净工作台(苏州安泰空气技术有限公司);超低温冰箱(中国海尔集团);TYK-4021型超纯水机(乌鲁木齐超纯水机厂);S/ N27709-1462CO2培养箱(美国Forma公司);eppendorf/5430R台式高速冷冻离心机(德国Eppendorf AG);S/N高压消毒锅(日本三洋公司)。
1.4方法
1.4.1大鼠同源血清制备取上述SD大鼠5只,行腹主动脉采血。10%水合氯醛(0.3 ml/100 g)腹腔麻醉,待麻醉稳定后,取大鼠腹部皮肤消毒,打开腹腔,充分分离暴露腹主动脉,使用无菌注射器于腹主动脉进行采血,置无菌离心管内,室温下静置至有血清析出;离心(3 000 r/min,15 min,4℃),分离血清,56℃水浴中灭活30 min,用0.22 μm微孔滤膜过滤除菌,无菌操作进行分装,置-80℃保存备用。用M199培养液稀释成10%血清浓度。
1.4.2酶解法分离制备胃窦ICC细胞悬液取SD大鼠3只/次,以10%水合氯醛进行腹腔麻醉,25%戊二醛进行术前消毒,开腹取长约3 cm胃窦,沿胃小弯切开,置于无菌玻璃皿内,PBS液(4℃预冷)冲洗3次,快速更换无菌玻璃皿置于冰上,皿中倒入预冷的PBS液,开始进行锐性剥离胃黏膜及黏膜下层,将每次分离出的肌肉组织及时置于冰下预冷的M199完全培养基(10%大鼠同源血清、1%青霉素-链霉素溶液)内保持活性,取肌条浸于上述培养基内,剪切成0.1 cm× 0.1 cm大小的条块,1 300 r/min离心1.5 min,弃上清液,加入Ⅱ型胶原酶消化液(M199完全培养基配置,浓度8±2 mg/ml),37℃水浴箱消化45~55 min,1 300 r/min离心1.5 min,弃上清液,PBS液重悬洗去消化液,再1 300 r/min离心3 min,重复3次,最后弃PBS液,加入M199完全培养基,轻轻地缓慢吹打15 min,200目筛网过筛、形成细胞悬液,收集于离心管内,加入等比例Ficoll 400,1 900 r/min离心15 min,取交界面细胞,加入M199完全培养基重悬细胞,接种于细胞培养瓶(约4 ml/瓶),置37℃、5%CO2培养箱培养。
1.4.3ICC培养及形态学动态观察ICC接种6 h后完全贴壁并进行首次换液,之后开始进行倒置显微镜下观察细胞生长情况,视培养基颜色改变及有无浑浊情况每隔1~2 d换液1次,每次加入M199培养完全基,培养的第1天、第3天、第6天、第8天于倒置显微镜下分别观察细胞形态变化,并拍照。
1.4.4ICC原代培养生长对数期测定采用MTT法测定。制备ICC细胞悬液后,调整ICC细胞浓度为0.05×103/μl,接种至96孔培养板,置37℃、5%CO2培养箱培养,细胞完全贴壁后,第1天取5孔细胞,加入MTT溶液作用4 h,去掉MTT液,加入DMSO,振荡,酶标仪单波长490 nm处测OD值,之后分别在细胞培养的第2~14 d重复上述操作。以培养细胞的天数(d)为横坐标,以OD值为纵坐标,制作细胞生长曲线。
1.4.5ICC免疫荧光鉴定采用C-kit特异性抗体免疫荧光染色法。分别取培养第3天、第6天、第8天贴壁良好的ICC细胞,经PBS液清洗后,无水甲醛(20℃预冷)固定,5%脱脂奶粉封闭10 min,加入一抗(1∶30),设立阴性对照组以PBS液代替一抗,4℃冰箱孵育过夜,PBS液冲洗3遍,加入二抗(1∶200)标记,37℃培养箱孵育1 h,抗淬灭封片液封片后置共聚焦显微镜下观察并拍照。
1.4.6ICC原代细胞传代培养取对数生长期(第8天)细胞,吸弃旧培养基,取适量预温PBS液冲洗2次,吸去PBS,加入0.25%胰蛋白酶溶液2 ml,于37℃消化2~3 min,倒置显微镜下观察,待细胞明显收缩、脱落,加入1 ml M199完全培养基终止消化,轻轻冲洗3min,收集细胞入离心管,1200r/min离心3 min,弃上清液;台盼蓝染色确定细胞活力在90%左右,加入6 ml M199完全培养基重悬并吹打均匀,用血球计数板计数细胞数并调节浓度为1.5×105/ml,分别接种于新的培养瓶中,每瓶3 ml。
2 结果
2.1ICC形态观察在倒置显微镜下观察,第1天:细胞完全贴壁,呈梭形、菱形或三角形,可见细胞突起;第3天:可见梭形、菱形、三角形,每个细胞都有1~2个核,核大,核周胞浆少,并从核区向胞体发出2~5条长突起,与邻近ICC突起、胞体相互连接,形成网络状,同时由于这种连接细胞之间也呈现出聚集成团生长的现象。第6天、第8天ICC网络状、聚集现象最明显。传代培养后的ICC于第1天、第3天、第8天也比较明显地呈现上述特征。见图1。

图1 倒置显微镜下的培养细胞形态观察
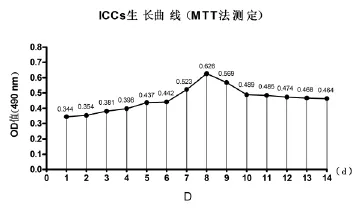
图2 ICC生长曲线
2.2ICC对数生长曲线第1~3天细胞处于潜伏期,第4~8天细胞处于对数生长期,其中第6~8天生长最为明显,第9天后逐渐进入平台期。见图2。
2.3ICC免疫荧光鉴定第3天、第6天和第8天可见ICC形态特征,细胞胞体呈三角形、圆形或梭形;细胞核大,核周有少量胞浆;从胞体发出2~5条长突起,并与临近细胞形成网络;表面C-kit蛋白呈阳性表达,胞体和突起均明显着色,呈绿色阳性显色。见图3。
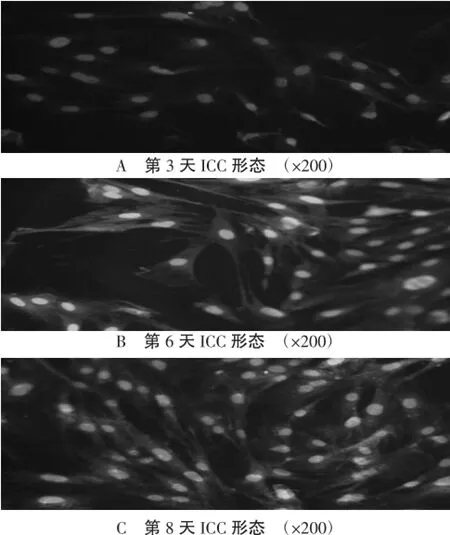
图3 荧光显微镜下免疫染色的ICC形态
3 讨论
胃肠道Cajal间质细胞作为一种与神经系统密切相关的特殊类型的间质细胞,以网络状广泛分布于胃肠道,是胃肠道活动的起搏者和调节者[8],同时也是胃肠道壁内神经信息的传递者,体现在ICC相互之间、与神经纤维和平滑肌细胞之间通过紧密的缝隙连接,形成“肠神经–ICC-平滑肌细胞”的胃肠动力的基本功能单位[9],对胃肠道活动有着重要的影响[10]。有关研究发现,胃肠动力障碍性疾病伴有ICC数量的减少或缺失、网络结构破坏,导致该细胞活性的减弱或消失[11-14]。胃肠Cajal间质细胞异常变化可能是胃癌出现胃肠动力障碍性疾病的重要发病机制[15]。因此,探讨体外分离、培养ICC的实验方法,对于阐明胃肠动力障碍性疾病的发病机制而言,是基础研究的重要前提,同时也具有临床实际意义。
采用酶解法制备ICC单细胞悬液是目前国内外运用较多的实验方法[16-18]。选择适当的酶浓度及消化时间非常关键,酶浓度过高或者消化时间过长都会对ICC产生损害[19],反之又将取不出细胞或者所取得的数量极少。本实验能够成功分离制备SD大鼠胃窦ICC细胞悬液,主要是依实际条件和情况进行了适当改良操作:将Ⅱ型胶原酶浓度由一般使用量1.3 mg/ml增加到8±2 mg/ml,消化时间持续50±5 min。如大量肌条明显消失,消化液转浑浊,可见明显絮状组织悬浮物,即可判断组织消化基本完全。此外,解剖后的胃组织肌条剪切越细越有利于酶解分离。
离心时间要充分,收集细胞数量才有保障。我们在ICC原代细胞传代培养时,胰酶消化细胞脱落、收集后,曾摸索不同离心条件收集细胞的效果:①900 r/min离心2.5 min,离心管底无细胞团;②改为1 010 r/min离心5.5 min,离心管底有极微小细胞团;③再改为1 300 r/min离心3.5 min,离心管底有明显细胞团,弃上清,培养基重悬培养,细胞可以保持90%以上的成活率。这提示离心效果对于细胞分离、提取的重要性。因此,离心转速可由常规800~900 r/min提升至1 300 r/ min,细胞存活不受影响。此外,在解剖、清洗组织、去除胃黏膜和黏膜下层过程中,严格无菌操作,预防污染,并尽可能使用较小的机械性拉力,避免过度牵拉肌组织,保持肌块组织的完整,吹打组织消化液时采用轻吹慢打5~10 min,都是有效分离的操作关键。
血清含有类似于生物机体内环境条件下多种促进细胞生长的营养成分和生长因子,成为细胞培养的基本成分之一。不同培养基与血清的培养体系对细胞培养影响不同。胎牛血清(FBS)在各类细胞培养中一直扮演着十分重要的角色,其内存在各种细胞的生长刺激和(或)抑制因素,在细胞培养的过程中可使细胞得到充足营养,同时起着保持或改变细胞生物学特性的作用。培养基中加入干细胞诱导细胞生长也是重要的措施,ICC的培养也不例外。有文献报道,重组鼠类SCF对胃肠道ICC分化、生长、发育、表型的维持具有至关重要的作用[20-21]。目前绝大多数的细胞培养技术中都涉及基础培养液、FBS浓度、细胞因子种类、细胞接种密度、抗生素预防污染等,但其中主要局限在使用FBS作为基础血清并添加相关的细胞因子,成本比较高,实验步骤显得繁琐。
自体血清(AS)富含齐全的自体基本营养成分、活性物质以及对细胞生存、生长具有调控和(或)促进作用的细胞因子等,在应用上具备生物安全性、稳定性、多样性和相容性等特点和优势。采用自体血清进行细胞培养是一种被证实的可行、有效实验方法。高群等[22]通过探讨不同细胞培养基及血清的培养体系对细胞因子诱导杀伤(CIK)细胞的增殖和功能的影响发现,GT-T551培养基加患者自体血清的培养体系更有利于CIK细胞的增殖、细胞因子分泌及发挥杀伤功能,可推荐作为CIK细胞最佳培养体系。张鹏等[23]利用自体血清培养人外周血来源内皮祖细胞,结果优于胎牛血清组,证实M199培养液中添加自体血清是一种简单、高效的培养内皮祖细胞方法。戴如飞等[24]发现自体血清、脐带血清、AB血清、胎牛血清均可维持骨髓间充质干细胞(BMSCs)的体外培养,而自体血清解决异种和异体血清带来的一些潜在的风险,更为安全。刘立强等[25]研究发现自体血清能完全替代胎牛血清对口腔黏膜角质细胞进行培养,且培养的口腔黏膜上皮组织分化优于胎牛血清。董震等[26]发现应用自体血清可成功培养骨髓间充质干细胞,并在体外条件下定向诱导分化为神经元样细胞。张洪涛等[27]发现,可利用自体血清培养骨髓基质干细胞,进一步诱导为神经元样细胞,有望用于神经系统损伤的修复。张勇刚等[28]研究发现,使用自体血清培养脐血间充质干细胞较使用胎牛血清有较高的成功率,而且,自体血清培养的脐血间充质干细胞也能成功地进行多向诱导分化。
从上述自体血清培养细胞的研究得到启示:同源血清虽然不完全等同于自体血清,但是其种属来源的性质是相同的,在血清来源与细胞生长要素方面比胎牛血清更贴近同属物种体内生长环境所需的基础生理物质条件,其培养作用也更加亲和、直接、显效。
不同浓度的血清对细胞培养的影响不同。进行体外细胞培养时应充分考虑细胞培养介质及所添加血清的浓度[29]。研究报道,Stute N等[30]发现,对于培养、促进成骨细胞的分化而言,10%的自体血清更优于其他血清培养。傅欣等[31]发现同异体体积分数10%的胎牛血清相比,体积分数10%的自体血清培养的兔软骨细胞生长速度快,且在大部分指标上可以较好地保持细胞表型。张颖等[32]发现羊自体血清培养骨髓间充质干细胞(bMSCs)是可行的,10%浓度自体血清是最佳培养浓度。对于ICC培养而言,血清浓度过低或过高都不利于ICC生长,且高浓度血清中含有大量促进细胞增殖分化的因子,容易使细胞过早出现老化。段小宁等[33]通过比较自体血清与胎牛血清体外培养大鼠关节软骨细胞生物学行为的差异,发现10%自体血清培养大鼠软骨细胞生长速度快,且仍可以较好保持细胞表型,并推测在可能条件下使用浓度较高的自体血清可以缩短体外培养时间而达到较多细胞保持表型的目的。
因此,该实验采用10%同源血清对SD大鼠胃窦ICC进行培养并经细胞鉴定获得成功,提示该实验方法具有可行性,其操作简便,相比使用FBS及重组鼠类SCF进行培养,既降低了费用,也减少了添加细胞因子的种类,明显提高了细胞培养的效率,体现其特有的实用性,为研究ICC生物学特性及其与胃肠病学的临床和基础关系提供了细胞模型。至于同源血清培养ICC的具体机制及其培养效能的深度优化与对比则有待进一步的研究。
[1]高显奎,余跃,李京培,等.胃Cajal间质细胞的分离和培养[J].安徽医科大学学报,2009,44(4):522-524.
[2]柳利明,农晰婷,秦榕,等.体外分离培养小鼠胃Cajal间质细胞的实验方法研究[J].昆明医学院学报,2010,31(3):11-13,31.
[3]王曙逢,仇广林,赵志浩,等.大鼠小肠Cajal间质细胞的体外分离、培养及鉴定[J].中国普通外科杂志,2014,23(4):494-498.
[4]刘登群,龙爽,王军平,等.成年C57BL/6小鼠空肠Cajal间质细胞的分离、培养及鉴定[J].胃肠病学和肝病学杂志,2011,20(6):538-541.
[5]吴志轩,余保平,夏虹,等.小鼠空肠Cajal间质细胞的分离与培养[J].胃肠病学和肝病学杂志,2005,14(5):455-457.
[6]张永革,贾卓敏,方强,等.大鼠膀胱Cajal间质细胞的分离、培养和鉴定[J].现代生物医学进展,2009,9(9):1682-1683.
[7]付卫华,沈文浩,李为兵,等.成年大鼠阴茎海绵体cajal间质细胞的分离、培养与鉴定[J].现代生物医学进展,2010,10(16):3004-3006.
[8]Sanders K M,Koh S D,Ward S M.Interstitial Cells of Cajal as Pacemakers in the Gastrointestinal Tract[J].Annu Rev Physiol,2006,68(1):307-343.
[9]Wang X Y,Vannucchi M G,Nieuwmeyer F,et al.Changes in interstitial cells of Cajal at the deep muscular plexus are associated with loss of distention-induced burst-type muscle activity in mice infected By Trichinella spiralis[J].American Journal of Pathology,2005,167(2):437-453.
[10]Al-Shboul O A.The importance of interstitial cells of cajal in the gastrointestinal tract[J].Saudi J Gastroenterol,2013,19(1):3-15.
[11]Zarate N,Mearin F,Wang X Y,et al.Severe idiopathic gastro-paresis due to neuronal and interstitial cells of Cajal degeneration pathological findings and management[J]. Gut,2003,52(7):966-970.
[12]Shafik A,Ahmed I,Sibai O E,et al.Interstitial cells of Cajal in reflux esophagitis:role in the pathogenesis of the disease[J].Med Sci Monit,2006,11(12):BR452-456.
[13]Nardo G D,Stanghellini V,Cucchiara S,et al.Enteric neuropathology of congenital intestinal obstruction:A case report[J].World J Gastroenterol,2006,12(32):5229-5233.
[14]Wang X Y,Huizinga J D,Diamond J,et al.Loss of intramuscular and submuscular interstitial cells of Cajal and associated enteric nerves is related to decreased gastric emptying in streptozotocin-induced diabetes[J].Neurogastroenterology&Motility,2009,21(10):1095–e92.
[15]胡俊华,王琦,卢光新,等.Cajal间质细胞在胃癌胃肠动力障碍中作用的实验研究[J].胃肠病学和肝病学杂志,2014,23(5):513-515.
[16]刘勇,齐清会.大鼠胃Cajal间质细胞的分离与培养[J].世界华人消化杂志,2005,13(4):495-498.
[17]李春穴,童卫东,刘宝华,等.Cajal间质细胞的分离、培养方法探讨[J].消化外科,2004,3(4):267-269.
[18]Bitar K N,Burgess G M,Putney J W,et al.Source of activator calcium in isolated guinea pig and human gastric muscle cells[J].American journal of physiology,1986,250(3): 280-286.
[19]Lee J C,Thuneberg L,Berezin I,et al.Generation of slow waves in membrane potential is an intrinsic property of interstitial cells of Cajal[J].American journal of physiology,1999,277:G409-G423.
[20]Wu J J,Rothman T P,Gershon M D.Development of the interstitial cell of Cajal:origin,kit dependence and neuronal and nonneuronal sources of kit ligand[J].Neurosci Res,2000,59(3):384-401.
[21]Jie Chen,Lei Du,Yong-Tao Xiao,et al.Disruption of interstitial cells of Cajal networks after massive small bowel resection[J].World Journal of Gastroenterology,2013,22: 3415-3422.
[22]高群,王菲,王丽萍,等.不同培养基与血清的培养体系对细胞因子诱导杀伤细胞增殖和功能的影响[J].中国肿瘤生物治疗杂志,2014,21(6):680-686.
[23]张鹏,任雨笙,梁春,等.利用自体血清培养人外周血内皮祖细胞[J].中国组织工程研究,2012,16(27):5022-5027.
[24]戴如飞,叶英,曾因明,等.不同来源血清体外培养骨髓间充质干细胞的研究[J].国际麻醉学与复苏杂志,2009,30(5):390-393,398.
[25]刘立强,李森恺,范金财,等.自体血清与胎牛血清培养口腔黏膜角质细胞及上皮组织的实验研究[J].中国修复重建外科杂志,2006,20(4):467-470.
[26]董震,张洪涛,范月超,等.自体血清培养人骨髓间充质干细胞及其向神经细胞分化[J].中国组织工程研究与临床康复,2007,11(42):8520-8523.
[27]张洪涛,王雄伟,杨晋生,等.自体血清培养人骨髓基质干细胞及向神经细胞分化机制的研究[J].脑与神经疾病杂志,2006,14(1):34-37.
[28]张勇刚,王黎明,杨明理,等.自体血清培养人脐血间充质干细胞的实验研究[J].生物医学工程学杂志,2008,25(5):1155-1160.
[29]杨永鹏,董萍,丁克祥,等.不同血清浓度及介质对体外培养小鼠成纤维细胞L929细胞系生长曲线和细胞形态的影响[J].国际老年医学杂志,2010,31(6):241-249.
[30]Stute N,Holtz K,Bubenheim M,et al.Autologous serum for isolation and expansion of human mesenchymal stem cells for clinical use[J].Exp Hematol,2004,32(12):1212-1225.
[31]傅欣,段小宁,张继英,等.自体血清与胎牛血清培养兔关节软骨细胞的生物学特性[J].中国组织工程研究,2012,16(46):8599-8606.
[32]张颖,杨柳,段小军,等.不同浓度羊自体血清对骨髓间充质干细胞增殖能力影响的研究[J].第三军医大学学报,2008,30(21):2041-2043.
[33]段小宁,张继英,傅欣,等.应用自体血清培养大鼠关节软骨细胞生物学行为研究[J].中国运动医学杂志,2011,30(3):244-249,264.
(编辑陈明伟)
R329.2
A
2095-4441(2016)01-0008-05
2016-02-06
国家自然科学基金项目(编号:81360544)
凌江红,E-mail:459183870@qq.com
