大麻素受体1对肾癌细胞786-O增殖及迁移能力的影响
2016-09-27王建丰徐云泽黄翼然
王建丰,徐云泽,黄翼然,张 进
(上海交通大学医学院附属仁济医院泌尿外科,上海 200127)
·基础研究·
大麻素受体1对肾癌细胞786-O增殖及迁移能力的影响
王建丰,徐云泽,黄翼然,张进
(上海交通大学医学院附属仁济医院泌尿外科,上海200127)
目的探索大麻素受体1(CB1)在肾癌组织中表达及对肾癌细胞系786-O相关生物学功能的影响。方法采用免疫组化实验方法检测肾癌组织标本中CB1表达情况;应用CB1拮抗剂AM251处理786-O肾癌细胞株,观察细胞的增殖及迁移能力的改变。 结果免疫组化结果显示相对于癌旁组织,肾癌组织中CB1表达量较高;通过CB1拮抗剂AM251处理后,786-O肾癌细胞增值能力明显下降:25μmol/L组48h和72h抑制率分别为 28.09±2.99和32.83±1.53;50μmol/L组48h和72h抑制率分别为78.59±5.69和88.02±5.34,其IC50在48h和72h分别为(38.20±4.75)μmol/L和(35.30±4.80)μmol/L;经过CB1拮抗剂AM251处理后迁移能力发生显著下降:与对照组细胞迁移数目(184.33±11.06)相比,20μmol/LAM251处理组(114±9.64,P=0.001 7)、30μmol/LAM251处理组(41.67±3.51,P=0.001 5)随着药物浓度的升高迁移细胞呈明显减少趋势。结论CB1可能参与肾癌发生发展,为寻找潜在的新的治疗靶点提供理论依据。
癌;肾癌;786-O;大麻素受体1;AM251
大麻素受体(cannabinoidreceptor)早在二十世纪九十年代初就已被人们发现[1],早期对大麻素的研究主要集中于精神和神经系统领域。近年来,不断有研究报道大麻素在抗肿瘤方面也具有显著功效。在胰腺癌、神经胶质瘤等相关研究中,大麻素具有不同程度的抗肿瘤作用[2-3],但是在肾癌方面罕有研究报道。本研究旨在探讨大麻素受体1(CB1)在肾癌中表达及对肾癌细胞细胞系786-O的相关肿瘤学生物功能的影响,初步研究其在肾癌发生发展中的作用。
1 实验方法
1.1肾癌组织免疫组化
1.1.1标本的收集75例标本选自上海交通大学医学院附属仁济医院泌尿外科2014年7月至2015年3月间进行肾癌根治患者的手术标本,男50例,女25例,年龄29~82岁,平均年龄为58岁;肾癌的临床分期采用AJCC第七版肾癌分期,其中T1期33例、T2期24例、T3期17例、T4期1例;术后病理均为透明细胞癌,分级采用Fuhrman分级方法,并在此基础上分成高分化、低分化两类,高分化(Ⅰ、Ⅱ、Ⅰ~Ⅱ)39例, 低分化(Ⅱ~Ⅲ,Ⅲ)36例。所有患者术前均无远处转移且无其他肿瘤史,术前均未进行化疗及靶向治疗。
1.1.2免疫组化及结果鉴定首先将收集的患者组织制作成组织芯片,免疫组化染色采用CP法,严格按照说明书进行染色。通过脱蜡、敷一抗(采用兔抗人CB1多克隆抗体(英国Abcam公司)1∶300稀释)、敷生物素二抗及DAB显色(武汉博士德生物公司),最后用NikonEclipseE1000采图摄像系统进行照相。阳性结果为细胞质和细胞核均有比较鲜明的棕黄色染色,以PBS代替一抗进行染色作为阴性对照。本研究中采用两个指标来共同判断该指标的表达情况,即表达强度和表达阳性率,同时也采用第三个结合染色强度和阳性率的指标,即染色综合指数来判断该指标的总体表达情况;染色强度:1、1.5、2、2.5、3代表染色由浅到深的5个等级。阳性率:癌或上皮细胞阳性细胞数所占同类细胞数的百分比。染色综合指数:染色强度×阳性率。
1.2肾癌细胞株功能实验
1.2.1AM251对肾癌细胞株增值活性的影响首先将肾癌细胞786-O培养处于对数生长期,然后加入含10%胎牛血清的1640培养基,使细胞浓度为2×104/mL,以每孔90μL体积种于96孔板中,待12h后细胞完全贴壁后加CB1拮抗剂AM251。药物母液浓度为10mmol/L,以首浓度50μmol/L,2倍梯度稀释药物8个梯度配置药物,用排枪每孔加入10μL的不同浓度的药物,每个浓度设置6个副孔,对照孔加入等量的生理盐水,混匀后放于细胞培养箱孵育。24、48、72h后用磺酰罗丹明B(SulforhodamineB,SRB)比色法染色:首先每孔加100μL4 ℃预冷10%TCA于4 ℃冰箱固定1h,然后用去离子水洗板5遍,室温晾干后加SRB染液染色30min,然后用1%冰醋酸冲洗96孔板并室温晾干,最后每孔加100μL非缓冲Tris-base碱液用酶标仪以560nm波长,用空白孔调零,检测96孔板吸光度(A)值,同样实验步骤重复3次。最后计算细胞抑制率并绘制抑制率曲线。
1.2.2AM251对肾癌细胞株786-O迁移能的影响取处于对数生长期的肾癌细胞用无血清的1640混成5×105/mL的细胞悬液,分别取适量的细胞悬液加入AM251药物,配成不同浓度药物下的细胞悬液,并等量接种于transwell小室(直径6.5mm,孔径8.0μm),每孔100μL细胞悬液,下室加600μL含血清的1640培养基,分别配成与上室同样的药物浓度,最后置于培养箱中培养。24h后经90%乙醇固定、0.1%结晶紫染色、擦拭风干后于倒置显微镜下观察拍照,每次取400倍3个视野进行细胞计数并拍照,分别统计实验组和对照组的迁移细胞数目。同样的实验步骤进行3次。
2 结 果
2.1肾癌组织免疫组化免疫组化结果显示,CB1受体在肾癌组织及癌旁组织均有表达(图1),并且肿瘤组织表达高于癌旁组织(P<0.05,表1)。经过统计分析,肿瘤组织中CB1的表达与性别、肿瘤分期等无明显相关性(P>0.05)。
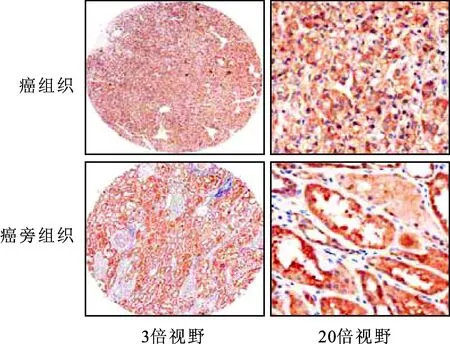
图1 CB1在癌和癌旁中的免疫组化染色
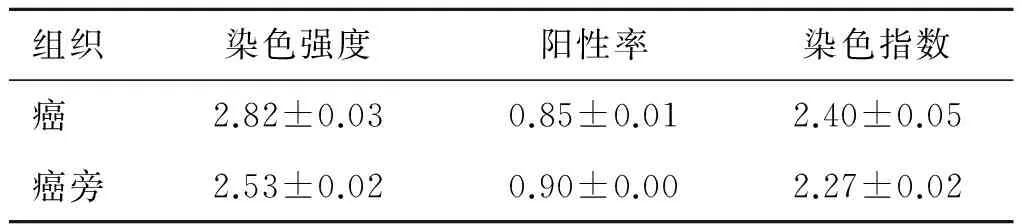
P<0.05。
2.2AM251对肾癌细胞增殖的影响细胞增殖实验结果显示CB1受体抑制剂AM251可以显著抑制肾癌细胞株786-O的增殖活力(图2)。重复实验3次。结果显示12.5μmol/L组、25μmol/L组、50μmol/L组在不同时间其抑制率有明显差异(P<0.05),药物作用72h后抑制率趋于稳定(表2),48h、72h时间段的IC50分别为(38.20±4.75)μmol/L和(35.30±4.80)μmol/L。
表2不同浓度AM251在不同时间段对786-O的抑制率
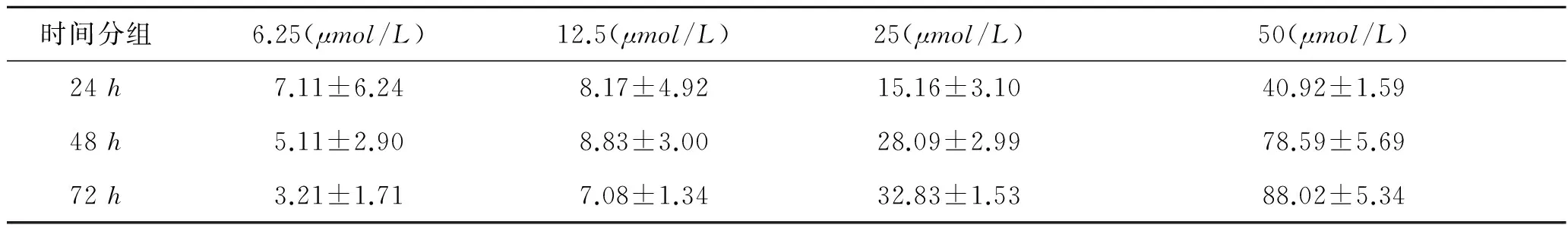
时间分组6.25(μmol/L)12.5(μmol/L)25(μmol/L)50(μmol/L)24h7.11±6.248.17±4.9215.16±3.1040.92±1.5948h5.11±2.908.83±3.0028.09±2.9978.59±5.6972h3.21±1.717.08±1.3432.83±1.5388.02±5.34
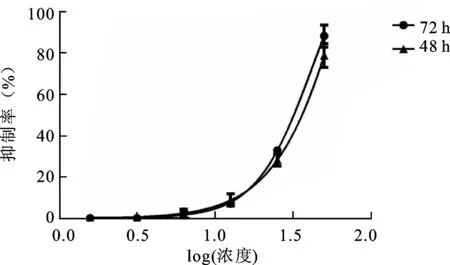
图2AM251作用于786-O48、72h的浓度梯度抑制曲线
2.3AM251对肾癌细胞迁移能力的影响细胞迁移实验结果显示,CB1拮抗剂AM251能够明显抑制肾癌细胞786-O的迁移能力(图3A)。实验组中,20μmol/L组(114±9.64,P=0.001 7)及30μmol/L组(41.67±3.51,P=0.0015)与对照组(184.33±11.06)相比,迁移细胞数目明显减少,相对迁移率明显随着浓度升高而降低(图3B)。
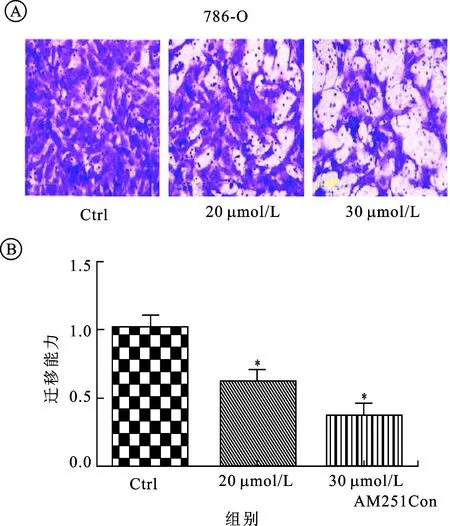
图3 AM251对肾癌细胞株786-O迁移能力的改变
A:不同药物浓度作用后显微镜所见(×400);B:迁移能力(以加药组迁移细胞数目/未加药组迁移细胞数目来表示,Ctrl组为未加药组,其余为不同浓度加药组)。
3 讨 论
肾癌,全称肾细胞癌(renalcellcarcinoma),是起源于肾实质泌尿小管上皮系统的恶性肿瘤,为常见的泌尿系肿瘤。据最新的国外统计资料显示,肾及肾盂肿瘤发生率占所有新发肿瘤的3%~5%,每年的死亡人数高达14 080人[4]。对于早期的肾脏肿瘤,绝大多数可通过手术等方式治愈,但是一旦出现转移,预后较差。事实上,约有30%的RCC患者初次就诊就已经发生转移,而且转移性RCC放化疗效果不佳,治疗有效率低于20%[5]。目前,晚期肾癌的治疗主要以靶向治疗为主,美国及欧洲共同批准的有sorafenib、sunitinib、bevacizumad、pazopanib等7种靶向药物,能显著提高晚期肾癌患者的预后[6]。但是,在临床的应用中,靶向药物在使用一段时间后基本上都会出现耐药现象,因此,寻找和研究新的分子机制和治疗靶点仍然是该领域的重要课题。
大麻素受体(CB)是一种G蛋白耦联受体,主要介导Δ-9四氢大麻素(Δ-9-tetrahydrocannabinol,THC)对精神系统的作用[7]。1990年人们首次发现大麻素受体,包括大麻素受体1(CB1)和大麻素受体2(CB2)[8],研究发现,CB1受体主要分布在中枢和外周,可能参与食欲及脂肪代谢的调节;CB2受体主要分布于外周,与免疫应答和炎症反应等有关。CB1受体及内源性四氢大麻素分子(endocannabinoids)例如N-arachidonoylethanolamide(AEA)及2-arachidonoylglycerol(2-AG)在人类的精神神经系统领域已被广泛研究[9],近年来,研究者们发现内源性和合成大麻素具有明显的抗肿瘤作用,已有报道在乳腺癌、前列腺癌、胃癌、肝癌、肺癌等大麻素受体明显表达,且具有不同程度的抗肿瘤作用[10-13]。但是,不同肿瘤组织中大麻素受体的表达量与肿瘤的恶性程度及预后之间的关系不一致,有的甚至出现相反的结论[14-15]。2009年CHUNG等[14]对399例前列腺癌肿瘤组织标本的研究发现:大麻素CB1受体表达水平Gleason评分可作为评估前列腺癌患者预后的独立因素;高表达CB1受体与肿瘤恶性程度高及预后差密切相关。但在肝癌中,CB1受体高表达预后好[15]。所以,大麻素对不同肿瘤作用仍然需要各个领域的进一步探索。大麻素在肾癌方面的研究罕有报道,仅有的研究也只是阐述CB1受体在肾癌的不同病理类型组织中表达量的差异,没有进一步的实验证明大麻素对肾癌具体是否有抗肿瘤作用。 据此,我们将继续研究大麻素受体的表达与肾癌之间的关系,探索大麻素受体1在肾癌的发生发展中作用。
本研究关注的重点是大麻素受体1在肾癌中表达情况及其对肾癌细胞株786-O增殖及迁移能力的影响。2010年西班牙学者LARRINAGA等[16]研究大麻素受体(CB1及CB2受体)在肾癌组织中的表达,结果显示:20例透明细胞癌中,CB1受体蛋白表达下调;CB2受体蛋白无表达。我们采用免疫组化的方法检测75例肾癌组织标本中CB1表达情况,结果显示CB1受体在肾癌组织标本中有较高的表达量,显然我们的研究结果与前期西班牙学者报道是具有差异的。我们猜测可能与以下因素有关。首先,是否与肿瘤样本的选择有关:我们选取的肾癌肿瘤组织包括了透明细胞癌的低、中、高病理分级标本,而西班牙学者文章中无肿瘤的分期分级相关数据;其次,CB1受体表达是否存在人种的差异,类似的情况在乳腺癌中也有报道。由于乳腺癌,尤其是三阴性乳腺癌(雌激素受体、孕激素受体、HER均不表达)的病理亚型及预后在不同种族之间存在明显差异。WILLIAMS等[17]研究表明:与美国人乳腺癌(三阴性乳腺癌)患者相比,越南人乳腺癌(三阴性)组织中EGFR和P-cadherin表达明显下降,其表达存在明显的差异。同样,我们所收集的组织标本均来自中国人的肾癌组织,而西班牙学者的文章中未注明标本的来源。这些问题需要进一步研究。此外,在此基础上,我们进一步利用CB1受体拮抗剂AM251作用于肾癌细胞株786-O,发现AM251能不同程度的抑制肾癌细胞的增值活力和迁移能力,这进一步说明了CB1受体可能参与肾癌的发生发展及转移。MCKALLIP等[18]研究用大麻素(Δ-9-tetrahydrocannabinol,THC)作用于乳腺癌小鼠模型,结果显示大麻素能够显著增加小鼠肺中转移结节的数量,从而说明大麻素具有促进乳腺癌转移的作用。CARPI等[19]研究者报道了AM251对皮肤黑色素瘤细胞A375的抗肿瘤作用,结果发现AM251能显著的抑制黑色素瘤细胞增殖并促进肿瘤细胞的凋亡发生,进一步的Westernblot说明AM251能够下调抗凋亡蛋白Bcl-2和survivin,上调促凋亡蛋白BAX;而且发现其也可以造成A375的G2/M期阻滞。同样,我们的研究也证明了CB1受体拮抗剂AM251能够抑制肾癌细胞786-O的增殖和迁移,而有关CB1在肾癌发生发展的分子机制仍需要进一步的探索。
综上所述,本研究通过大麻素受体拮抗剂AM251作用于肾癌细胞株786-O,揭示了大麻素受体1在肾癌增殖、迁移等发生发展中的作用,为寻找新的肾癌抗肿瘤靶点提供新的认知。当然,本研究只是浅显的探讨了大麻素受体1在肾癌细胞株786-O中的作用,其具体的作用机制及体内的作用效果仍需要进一步研究和探索。
[1]HOWLETTAC,BIDAUT-RUSSELLM,DEVANEWA,etal.Thecannabinoidreceptor:biochemical,anatomicalandbehavioralcharacterization[J].TrendsNeurosci, 1990, 13(10): 420-423.
[2]BLZQUEZC,SALAZARM,CARRACEDOA,etal.Cannabinoidsinhibitgliomacellinvasionbydown-regulatingmatrixmetalloproteinase-2expression[J].CancRes, 2008, 68(6): 1945-1952.
[3]MICHALSKICW,OTIFE,ERKANM,etal.Cannabinoidsinpancreaticcancer:correlationwithsurvivalandpain[J].InteJCan, 2008, 122(4): 742-750.
[4]SIEGELRL,MILLERKD,JEMALA.Cancerstatistics, 2015[J].CA-ACancerJClin, 2015, 65(1): 5-29.
[5]GUOJun,MAJianhui,SUNYan,etal.Chineseguidelinesonthemanagementofrenalcellcarcinoma(2015edition)[J].AnnalsofTranslMed, 2015, 3(19): 279.
[6]LJUNGBERGB,BENSALAHK,CANFIELDS,etal.EAUguidelinesonrenalcellcarcinoma: 2014update[J].EurUrol, 2015, 67(5): 913-924.
[7]XIEH,SUNX,PIAOY,etal.SilencingoramplificationofendocannabinoidsignalinginblastocystsviaCB1compromisestrophoblastcellmigration[J].JBiolChem, 2012, 287(38): 32288-32297.
[8]MATSUDALA,LOLAITSJ,BROWNSTEINMJ,etal.StructureofacannabinoidreceptorandfunctionalexpressionoftheclonedcDNA[J].Nature, 1990, 346(6284): 561-564.
[9]KANOMasanobu,OHNO-SHOSAKUT,HASHIMOTODANIY,etal.Endocannabinoid-mediatedcontrolofsynaptictransmission[J].PhysiolRev, 2009, 89(1): 309-380.
[10]XIANSusan,PARAYATHNN,NEHOFFH,etal.TheuseofstyrenemaleicacidnanomicellesencapsulatingthesyntheticcannabinoidanalogWIN55,212-2forthetreatmentofcancer[J].AnticancRes, 2015, 35(9): 4707-4712.
[11]CRIDGEBJ,ROSENGRENRJ.Criticalappraisalofthepotentialuseofcannabinoidsincanmanagement[J].CancManagemRes, 2013, 5: 301-313.
[12]QAMRIZ,PREETA,NASSERMW,etal.Syntheticcannabinoidreceptoragonistsinhibittumorgrowthandmetastasisofbreastcancer[J].MolecCancTherap, 2009, 8(11): 3117-3129.
[13]SARFARAZS,AFAQF,ADHAMIVM,etal.Cannabinoidreceptorasanoveltargetforthetreatmentofprostatecancer[J].CancRes, 2005, 65(5): 1635-1641.
[14]CHUNGSC,HAMMARSTENP,JOSEFSSONA,etal.AhighcannabinoidCB(1)receptorimmunoreactivityisassociatedwithdiseaseseverityandoutcomeinprostatecancer[J].EurJCan, 2009, 45(1): 174-182.
[15]XUXundi,LIUYi,HUANGShengfu,etal.OverexpressionofcannabinoidreceptorsCB1andCB2correlateswithimprovedprognosisofpatientswithhepatocellularcarcinoma[J].CancGenetCytogenet, 2006, 171(1): 31-38.
[16]LARRINAGAG,SANZB,PÉREZI,etal.CannabinoidCB1receptorisdownregulatedinclearcellrenalcellcarcinoma[J].JHistochemCytochem, 2010, 58(12): 1129-1134.
[17]WILLIAMSDJ,COHENC,TOTV,etal.Triple-negativebreastcarcinomainwomenfromVietnamandtheUnitedStates:characterizationofdifferentialmarkerexpressionbytissuemicroarray[J].HumPathol, 2009, 40(8): 1176-1181.
[18]MCKALLIPRJ,NAGARKATTIM,NAGARKATTIPS.Delta-9-tetrahydrocannabinolenhancesbreastcancergrowthandmetastasisbysuppressionoftheantitumorimmuneresponse[J].JImmunol, 2005, 174(6): 3281-3289.
[19]CARPIS,FOGLIS,ROMANINIA,etal.AM251inducesapoptosisandG2/McellcyclearrestinA375humanmelanomacells[J].Anti-CancerDrugs, 2015, 26(7): 754-762.
(编辑王玮)
Effects of cannabinoid receptor 1 on the proliferation and migration of 786-O cell of renal carcinoma
WANG Jian-feng, XU Yun-ze, HUANG Yi-ran, ZHANG Jin
(DepartmentofUrology,RenjiHospital,MedicalSchoolofShanghaiJiaotongUniversity,Shanghai200127,China)
ObjectiveToexplorertheexpressionofcannabinoidreceptor1 (CB1)onrenalcarcinomaanditseffectsonrenalcarcinomacellline786-O.MethodsTheCB1expressioninrenalcarcinomawasdetectedwithimmunohistochemicalmethod.The786-OcelllinewastreatedwithCB1antagonistAM251.Thechangesofcellproliferationandmigrationwereobserved.ResultsImmunohistochemicalresultsshowedthatCB1washighlyexpressedinrenalcarcinoma.AftertreatmentofCB1antagonistsAM251,theproliferationof786-Ocelllinewasinhibited.Theinhibitionrateof25μmol/Lgroupat48hand72hwas28.09±2.99and32.83±1.53,thatofthe50μmol/Lgroupat48hand72hwas78.59±5.69and88.02±5.34,respectively.TheIC50at48hand72hwas(38.20±4.75)μmol/Land(35.30±4.80)μmol/L.AftertreatmentofCB1antagonistsAM251,thecellmigrationabilitysignificantlydeclined.Comparedwiththecontrolgroup(184.33±11.06),the20μmol/Lgroup(114±9.64, P=0.001 7)and30μmol/Lgroup(41.67±3.51, P=0.001 5)hadgreatlydecreasednumberofmigrationcells.Withtheincreaseofdrugconcentration,thenumberofmigrationcellswasfewer.ConclusionCB1mayparticipateinthedevelopmentofrenalcarcinoma.Thismayprovidesomeinformationforthedevelopmentofpotentialnewtherapeutictargets.
cancer;renalcellcarcinoma;786-O;cannabinoidreceptor1;AM251
2016-01-27
2016-03-28
上海市卫生系统先进适宜技术推广项目(No.2013SY024);上海市自然科学基金(No.13ZR1425100)
张进,副教授,硕士生导师.
E-mail:med-zhangjin@vip.sina.com
王建丰(1991-),男(汉族),硕士在读.研究方向:肾癌的临床与基础研究.E-mail:wjf_0509@sina.com
R737
A
10.3969/j.issn.1009-8291.2016.08.014
