六神曲炮制过程中微生物的分离与鉴定△
2016-09-25贾丹丹黄春敏刘英胡海峰
贾丹丹,黄春敏,刘英,胡海峰*
(1.国药集团健康产业研究院有限公司,上海 200437;2.上海医药工业研究院,上海 200040)
六神曲炮制过程中微生物的分离与鉴定△
贾丹丹1,2,黄春敏1,刘英1,2,胡海峰1,2*
(1.国药集团健康产业研究院有限公司,上海 200437;2.上海医药工业研究院,上海 200040)
目的:揭示中药饮片六神曲传统发酵炮制工艺中有益微生物种群。方法:应用经典的微生物分离纯化方法,结合形态学考察和16S rRNA或18S rRNA基因序列分析,对六神曲发酵炮制过程中样品进行微生物的分离及初步菌种分类鉴定。结果:共分离获得细菌8株、酵母菌3株、丝状真菌4株。8种细菌分别为成团泛菌、溶血葡萄球菌、阿氏肠杆菌、大肠杆菌、枯草芽孢杆菌、蜡样芽孢杆菌、阪崎肠杆菌、戊糖片球菌;3种酵母菌分别为伯顿生丝毕赤酵母、汉氏德巴利氏酵母、库德里阿兹威氏毕赤酵母;4种丝状真菌分别为卷枝毛霉、总状毛霉、尔青霉、亮白曲霉。结论:六神曲传统发酵炮制工艺涉及多种微生物共同参与发酵过程,为后续建立六神曲现代发酵炮制工艺奠定了菌种基础。
六神曲;发酵;微生物;分离;鉴定
六神曲最早收载于《药性论》[1],是由面粉、赤小豆、苦杏仁、鲜青蒿、鲜苍耳、鲜辣蓼按一定比例混匀后经过微生物发酵而制成的曲剂,具有消食健胃、和中止泻的功能[2]。传统六神曲发酵是利用天然条件下的微生物进行发酵,由于发酵环境中的菌种不同,造成不同产地或相同产地不同批次的产品质量差异较大。而且某些真菌会产生有毒的代谢产物,如黄曲霉素。这些因素使六神曲的应用受到影响[3]。以纯种发酵代替传统发酵,菌种比较固定,保证发酵生产的稳定性,利于中药现代化。本实验采集传统发酵六神曲的多个样品,对其进行微生物种群的分离及鉴定,为后续实现六神曲的纯种发酵奠定了菌种基础。
1 材料
1.1 试剂
传统发酵六神曲样品(中国中药公司提供);LB培养基、孟加拉红培养基、MRS培养基、高氏一号培养基(国药集团化学试剂有限公司);Fx KOD Buffer、脱氧核糖核苷三 磷酸/dNTP、Fx KOD酶、Easy Taq Buffer、Easy Taq酶(TaKaRa公司);自带引物(上海生工生物科技有限公司合成)。
1.2 仪器
电子天平(上海精科天平);精密数显示酸度计(Sartorius);压力蒸汽灭菌锅(上海划线医用核子仪器有限公司);超净工作台(上海智城分析仪器制造有限公司);生化培养箱(上海一恒科学仪器有限公司);恒温培养振荡器(上海智城分析仪器制造有限公司);PCR扩增仪(德国Eppendorf公司)
2 方法
2.1 分离培养基的配制
2.1.1 LB培养基(适合培养细菌) 酵母浸粉5.0 g·L-1、蛋白胨10.0 g·L-1、氯化钠5.0 g·L-1、琼脂20.0 g·L-1,pH 7.0~7.2。高压蒸汽灭菌后加入过滤除菌的制霉菌素(终质量浓度为50 μg·mL-1)。
2.1.2 MRS培养基(适合培养乳酸菌) 蛋白胨10.0 g·L-1、牛肉膏10.0 g·L-1、酵母浸粉5.0 g·L-1、柠檬酸氢二铵2.0 g·L-1、葡萄糖20.0 g·L-1、吐温-80 1.0 mL·L-1、乙酸钠5.0 g·L-1、磷酸氢二钾2.0 g·L-1、硫酸镁0.6 g·L-1、硫酸锰0.25 g·L-1、琼脂20.0 g·L-1,pH 6.8。高压蒸汽灭菌后加入过滤除菌的溴甲酚绿指示剂(终质量浓度为100 μg·mL-1)。
2.1.3 孟加拉红培养基(适合培养真菌) 蛋白胨5.0 g·L-1、葡萄糖10.0 g·L-1、磷酸二氢钾1.0 g·L-1、硫酸镁0.5 g·L-1、琼脂 20 g·L-1、1/3000孟加拉红溶液100 mL·L-1,pH自然。高压蒸汽灭菌后加入过滤除菌的链霉素(终质量浓度为50 μg·mL-1)。
2.1.4 高氏一号培养基(适合培养放线菌) 可溶性淀粉20.0 g·L-1、硝酸钾1.0 g·L-1、磷酸氢二钾0.5 g·L-1、硫酸镁0.5 g·L-1、氯化钠0.5 g·L-1、硫酸亚铁0.01 g·L-1、琼脂20.0 g·L-1,pH 7.4~7.6。高压蒸汽灭菌后加入过滤除菌的重铬酸钾(终质量浓度为100 μg·mL-1)。
2.2 微生物的分离纯化
2.2.1 制备六神曲稀释液 取样品粉末0.5 g,在无菌条件下将其加至装有49.5 mL无菌0.9%氯化钠溶液,含玻璃小珠的250 mL锥形瓶中,振摇约20 min,使菌分散,得10-2稀释度的菌悬液。从中吸取0.5 mL菌悬液,加至盛有4.5 mL无菌水的试管中,充分混匀。如上操作,依次制成10-3、10-4、10-5、10-6等稀释度的菌悬液。
2.2.2 涂布 用无菌吸管分别吸取10-4、10-5、10-6稀释度的菌悬液0.2 mL,滴入制好的平板中,用无菌涂布棒在培养基表面轻轻涂布均匀。
2.2.3 培养 将LB培养基、MRS培养基置于37 ℃恒温培养箱中培养;将孟加拉红培养基、高氏一号培养基置于28 ℃培养箱中培养。
2.2.4 菌株纯化 将培养基表面长出的菌落进行平板划线,直到分出纯的单菌落为止。
2.3 菌株鉴定
2.3.1形态学鉴定 菌落形态:用接种针取单菌落,细菌接种于LB培养基,置37 ℃恒温培养箱中培养;真菌接种于孟加拉红培养基,置28 ℃恒温培养箱中培养,观察菌体在培养基中的菌落形态与生长情况。
显微观察:细菌用结晶紫染色,置于显微镜下观察细菌结构,同时进行革兰氏染色;酵母菌用美蓝染色,置于显微镜下观察;丝状真菌用插片法进行培养,待菌丝长过插片的位置后,取出玻片进行显微镜观察。
2.3.2 分子生物学鉴定 细菌以菌落为模板,上游引物27F:5′GAGAGTTTGATCCTGGCTCAG3′,下游引物1495R:5′CTACGGCTACCTTGTTACGA3′,完成PCR扩增。PCR体系为Fx KOD Buffer 12.5 μL、dNTP 0.4 μL、引物各0.3 μL、FX KOD酶0.4 μL、DMSO 1.25 μL、ddH2O 10μL。PCR程序为94 ℃预热5 min,94 ℃变性1 min,57 ℃退火90 s,72 ℃延伸40 s,循环30次,72 ℃保持10 min,16 ℃保温。用1%琼脂糖凝胶电泳对PCR结果进行验证,将扩增产物进行测序并对结果进行序列分析。
真菌以提取的基因组DNA为模板,上游引物NS1:5′GTAGTCATATGCTTGTCTC3′,下游引物NS2:5′GGCTGCTGGCACCAGACTTGC3′,完成PCR扩增。
基因组提取:取培养的真菌一管,装入细砂,用FastPrep仪器进行操作(5 M·S-1,10 s,2次)。然后加入500 μL DES溶液和5 μLβ-巯基乙醇,混匀,65 ℃水浴30 min。加入500 μL水饱和苯酚∶三氯甲烷∶异戊醇(25∶24∶1),12 000 r·min-1离心5 min。将上清液转移至1.5 mL离心管中,再加500 μL水饱和苯酚∶三氯甲烷∶异戊醇(25∶24∶1),沉淀一次。12 000 r·min-1离心5 min后,将上清液转移至1.5 mL离心管中,加入冷的70%乙醇混匀,-20 ℃沉淀2 h。12 000 r·min-1离心5 min,挥干残余的乙醇,加入TER溶液溶解。
PCR体系为Easy Taq Buffer 2.5 μL、dNTP 1.0 μL、引物各1.0 μL、Easy Taq酶0.1 μL、DMSO 1.25 μL、模板0.5 μL、ddH2O 21 μL。PCR程序为94 ℃预热5 min,94 ℃变性1 min,57 ℃退火90 s,72 ℃延伸40 s,循环30次,72 ℃保持10 min,16 ℃保温。用1%琼脂糖凝胶电泳对PCR结果进行验证,将扩增产物进行测序并对结果进行序列分析。
3 结果与分析
通过对六神曲炮制过程中不同时间点的样品进行分离,总共得到细菌8种,酵母菌3种,丝状真菌4种,结合形态学和分子生物学对所分菌株进行综合鉴定。
3.1 细菌
3.1.1 形态鉴定 各株细菌在LB平板上的菌落形态、显微观察及革兰氏染色结果见表1。
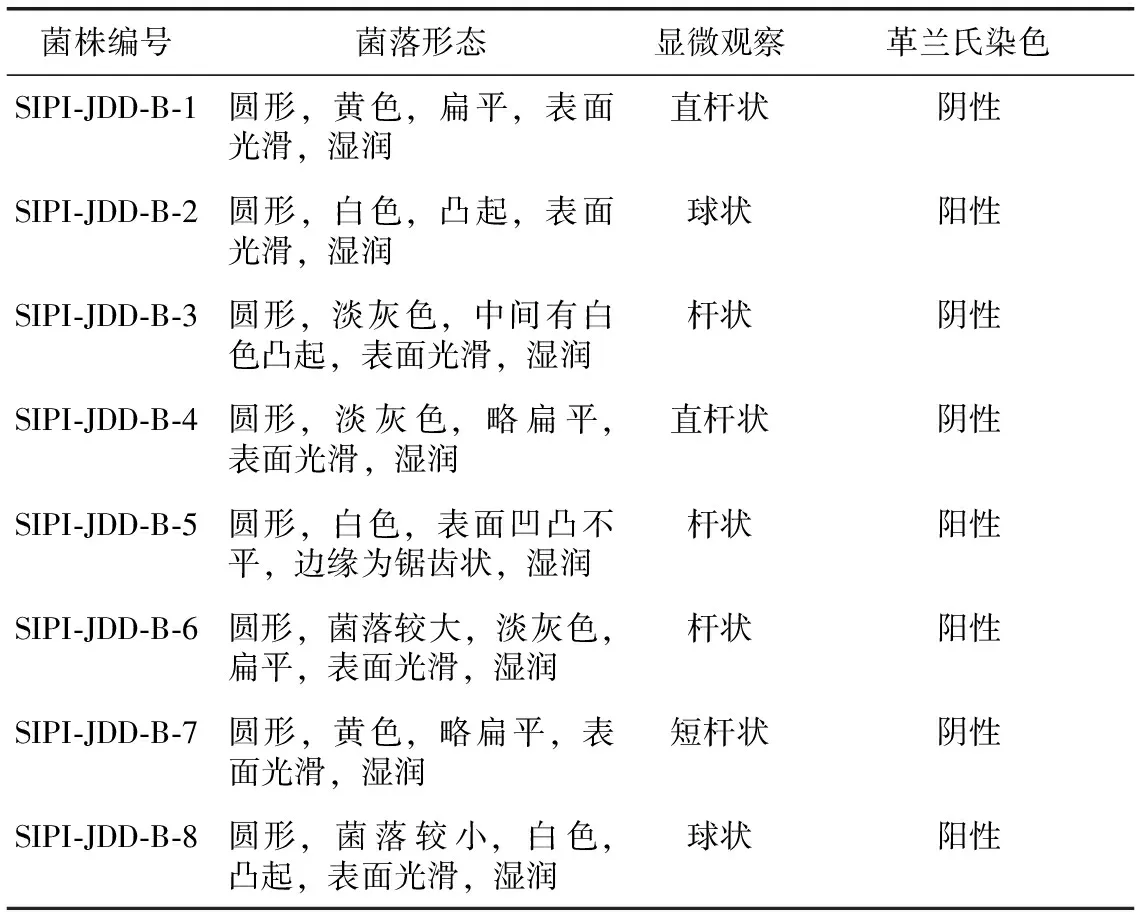
表1 细菌形态描述
3.1.2 细菌种属初步鉴定 将PCR测序结果提交至NCBI,与Gene Bank数据库中已知基因序列进行Blast对比,分析待测菌株与模式菌株的同源性。根据细菌菌株的16S rRNA序列比对分析结果及其形态学特征,并结合《细菌鉴定手册》和《微生物分类学》等有关资料,对所分细菌进行初步鉴定,鉴定结果见表2。
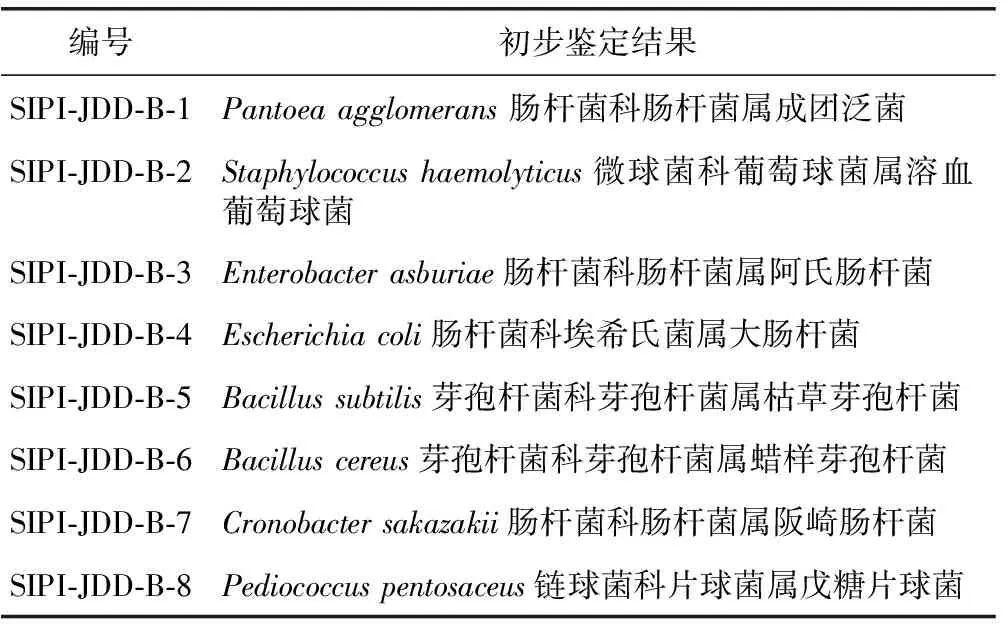
表2 细菌种属初步鉴定
3.2 酵母菌
3.2.1 形态学鉴定 各酵母菌在孟加拉红平板上的菌落形态及显微观察情况见表3。

表3 酵母菌形态描述
3.2.2 酵母菌种属初步鉴定 将PCR测序结果提交至NCBI,与Gene Bank数据库中已知基因序列进行blast对比,分析待测菌株与模式菌株的同源性。根据真菌菌株的18s rDNA序列比对分析结果及其形态学特征,并结合《真菌鉴定手册》和《微生物分类学》等有关资料,对所分酵母菌进行初步鉴定,鉴定结果见表4。

表4 酵母菌种属初步鉴定
3.3 丝状真菌
3.3.1 形态学鉴定 各丝状真菌在孟加拉红平板上的菌落形态及显微观察见表5。

表5 丝状真菌形态描述

图1 SIPI-JDD-F-1的显微图谱

图2 SIPI-JDD-F-2的显微图谱

图3 SIPI-JDD-F-3的显微图谱

图4 SIPI-JDD-F-4的显微图谱
3.3.2 丝状真菌种属初步鉴定 将PCR测序结果提交至NCBI,与Gene Bank数据库中已知基因序列进行blast对比,分析待测菌株与模式菌株的同源性。根据真菌菌株的18s rDNA序列比对分析结果及其形态学特征,并结合《真菌鉴定手册》和《微生物分类学》等有关资料,对所分丝状真菌进行初步鉴定,鉴定结果见表6。

表6 丝状真菌种属初步鉴定
4 结论与讨论
以传统发酵六神曲样品为研究对象,从不同发酵过程样品中分离得到8种细菌,3种酵母菌和4种丝状真菌,并结合形态学及分子生物学对其进行初步鉴定。目前从传统发酵六神曲样品中已分离并初步鉴定的微生物有丝状真菌和酵母菌,其中丝状真菌包括黄曲霉菌、产黄青霉菌、枝孢霉菌[1]、杂色曲霉、肉色曲霉、伞枝犁头霉[3],酵母菌包括浅白隐球酵母、酿酒酵母、库德里阿兹威毕赤酵母、扣囊拟内孢酵母[2]。本文首次对分离得到的细菌进行了初步鉴定,并分离得到4种其他文献中尚未见报道的丝状真菌和2种酵母菌,为后续进行六神曲纯种发酵奠定了菌种基础。其中,阪崎肠杆菌为致病菌,可能为六神曲发酵过程中的杂菌。此外,枯草芽孢杆菌、蜡样芽孢杆菌、尔青霉、亮白曲霉具有淀粉酶和蛋白酶活力,伯顿生丝毕赤酵母具有淀粉酶活力,为后续研究六神曲代谢产物提供了物质基础。以10%六神曲原料和2%琼脂为斜面培养基对分离得到的菌株进行培养,上述菌株在六神曲原料中均能够正常生长,且生长速度与状态与其在LB培养基和孟加拉红培养基中无异。说明上述分离得到的菌株在六神曲原料中生长良好,可用于六神曲的纯种发酵。将纯种发酵六神曲代替传统的自然发酵,菌种固定,质量可控,是六神曲实现中药现代化的必然。
[1] 王秋红,苏阳,王荔慧,等.六神曲中真菌的分离与鉴定[J].中国实验方剂学杂志,2014,20(07):122-126.
[2] 张丽霞,高文远,王海洋,等.六神曲中酵母菌的鉴定[J].中国中药杂志,2012,37(13):1928-1931.
[3] 邬吉野,李莹,王德馨,等.六神曲的发酵菌种分离及纯种发酵考察[J].中国实验方剂学杂志,2013,19(16):12-14.
[4] 杜连祥,路福平.微生物学实验技术[M].北京:中国轻工业出版社,2005.
[5] 胡静,杨旭东,夏清平,等.中药“神曲”中微生物的研究[J].牡丹江医学院学报,2004,25(02):19-20.
[6] 高慧,贾天柱.六神曲的发酵菌种分离及纯种发酵考察[J].中国中药杂志,2008,33(20):2323-2325.
[7] 莫小林,伍小燕,韦振源.10种中药制剂微生物限度检查方法学的验证[J].中国实验方剂学杂志,2012,18(13):56.
[8] 周德庆,张文治,强义国.生物学教学[M].北京:中国学术期刊电子出版社,1981.
IdentificationandIsolationofMicroorganismsfromMedicatedLeavenduringItsProduction
JIA Dandan1,2,HUANGChunmin1,LIUying1,2,HUHaifeng1,2*
(1.SinopharmHealthIndustryInstitiuteCo,Ltd,Shanghai200437,China;2.ShanghaiInstituteofPharmaceuticalIndustry,Shanghai200040,China)
Objective:In order to elucidate the beneficial microorganisms in Medicated Leaven made by traditional fermented methods.Methods:Using classical microbial isolation and purification methods,the strains in Medicated Leaven samples were isolated and purified.The preliminary taxonomy of the strains isolated was carried out by investigating the morphological properties and analyzing and comparing their 16SrRNA or 18SrRNA gene sequence.Results:Eight species of bacteria,three species of yeasts and four species of filamentous fungi were isolated and identified in Medicated Leaven samples.The bacteria werePantoeaagglomerans,Staphylococcushaemolyticus,Enterobacterasburiae,Escherichiacoli,Bacillussubtilis,Bacilluscereu,Cronobactersakazakii,Pediococcuspentosaceus;the yeasts wereHyphopichiaburtonii,Debaryomyceshansenii,Pichiakudriavzevii;the filamentous fungi wereMucorcircinelloides,Mucorracemosus,Penicilliumcamemberti,Aspergilluscandidus.Conclusion:Many species of microorganisms exist in Medicated Leaven samples,which help to reconstruct modern fermentation technology of Medicated Leaven.
Medicated Leaven;fermentation;microorganism;isolation;identification
2015-12-31)
国家中医药管理局中医药行业专项(201507004)
*
胡海峰,研究员,研究方向:微生物药物研究与开发;Tel:(021)62892873,E-mail:haifenghu88@163.com
10.13313/j.issn.1673-4890.2016.3.023
