组织培养条件下甘草种子休眠解除方法的优化△
2016-09-25梁晓薇梅凌锋张春荣唐晓敏程轩轩杨全
梁晓薇,梅凌锋,张春荣*,唐晓敏,程轩轩,杨全
(1.广东药科大学 中药学院,广东 广州 510006;2.国家中医药管理局岭南药材生产与开发重点研究室,广东 广州 510006;3.道地药材国家重点实验室培训基地 中国中医科学院 中药资源中心,北京 100700)
组织培养条件下甘草种子休眠解除方法的优化△
梁晓薇1,2,梅凌锋1,2,张春荣1,2*,唐晓敏1,2,程轩轩1,2,杨全1,2,3*
(1.广东药科大学 中药学院,广东 广州 510006;2.国家中医药管理局岭南药材生产与开发重点研究室,广东 广州 510006;3.道地药材国家重点实验室培训基地 中国中医科学院 中药资源中心,北京 100700)
目的:甘草种子硬实,表面蜡质包被是影响组织培养条件下甘草种子萌发的主要因素。通过对甘草种子进行处理,得到组织培养条件下提高甘草种子萌发率和消毒效果的方法。方法:将甘草种子用98%硫酸处理、灭菌热水处理、各浓度次氯酸钠溶液处理后在MS培养基上培养,考察种子萌发及消毒效果。结果:组织培养条件下,常温水浸泡24 h的甘草种子吸胀率为36.67%,发芽率为10%,经过浓硫酸浸泡80 min、60 ℃热水浸泡24 h(自然冷却至室温)和3%次氯酸钠溶液浸泡15 min的甘草种子吸胀率分别达到100%、42.16%和46.7%;发芽率分别为77.79%、36.67%和24.44%。浓硫酸和次氯酸钠溶液处理的甘草种子消毒效果较好。结论98%硫酸浸泡80 min或者60 ℃热水浸泡24 h(自然冷却)后再用3%次氯酸钠溶液浸泡15 min,均能使甘草种子达到良好的消毒效果和较高的萌发率。
甘草;种子萌发;组织培养
甘草GlycyrrhizauralensisFisch.为豆科多年生草本植物,其根和根茎为常用中药,具有补脾益气、清热解毒、祛痰止咳、缓急止痛、调和诸药的功效[1],是我国大宗药材和食品甜味剂。野生甘草资源少且禁止采挖,人工栽培资源成为药材的主要商品来源,但是产量和质量参次不齐。植物组织培养是实现甘草快速繁殖、优良品种培育和有效成分生物技术生产的主要途径。甘草的组织培养一般以种子萌发获得的无菌苗为外植体[2-3],但甘草种子硬实度高、表面有蜡质包裹,导致自然萌发率低,活力弱[4]。浓硫酸处理[5]、热水烫种[6]、机械摩擦破坏种皮等方法均可促进硬实种子的萌发[7]。机械摩擦不利于种子的表面灭菌。因此,本文采用浓硫酸处理和热水浸泡结合消毒液处理,研究组织培养条件下提高甘草种子萌发和消毒效果的方法。
1 材料
甘草种子采自内蒙古杭锦旗人工栽培基地4年生甘草,经北京中医药大学中药学院魏胜利副教授鉴定为甘草GlycyrrhizauralensisFisch.的种子。
2 方法
2.1 硬实种子的处理
2.1.1 对照将甘草种子在常温下用水浸泡24 h,置于湿润的滤纸上,25 ℃恒温培养。
2.1.2 浓硫酸处理用98%浓硫酸分别浸泡甘草种子20、40、60、80、100、120 min,取出后用水冲洗至pH为中性,在水中24 h,置于湿润的滤纸上,25 ℃恒温培养。
2.1.3 热水处理将种子分别置于100、80、60 ℃热水中至自然冷却并浸泡24 h,置于湿润的滤纸上,25 ℃恒温培养。
2.2 组织培养种子的无菌萌发试验
2.2.1 对照无菌条件下,将甘草种子用无菌水浸泡24 h,置MS培养基中,25 ℃恒温培养。
2.2.2 浓硫酸处理无菌条件下,以2.1.2得到的浓硫酸处理最佳时间浸泡种子,用无菌水冲洗至pH为中性后,浸泡于无菌水中24 h,置MS培养基中25 ℃恒温培养。
2.2.3 热水处理无菌条件下,用2.1.3得到的最佳温度的无菌水浸泡种子至自然冷却并持续24 h。将种子置MS培养基中,25℃恒温培养。
2.2.4 次氯酸钠溶液消毒无菌条件,将种子用75%乙醇浸泡30 s,常温无菌水清洗3次后置3%或5%次氯酸钠溶液中各浸泡10、15、25 min,无菌水冲洗3次后浸泡24 h。将种子置MS培养基中,25℃恒温培养。
2.3 数据统计分析
种子萌发试验的检测指标参照《农作物种子检验规程》[8]和《International Rules for Seed Testing》[9]进行。
2.3.1 发芽试验种子浸泡24 h后,凡体积达到原体积2倍者记为吸胀种子。胚根突出种皮的长度为种子长度的一半时即为发芽的种子。甘草种子培养的第4天统计发芽势,第10天统计发芽率。
发芽势(GP)=(前4天正常发芽种子数/ 供试种子数)×100%
发芽率(GR)=(规定时间内种子发芽数/ 供试种子数)×100%
萌发指数(GI)=Σ(Gt/Dt),Gt:时间t内发芽数;Dt:相应发芽天数。
2.3.2 数据处理数据利用SPSS20.0统计进行统计和单因素方差分析。
3 结果与分析
3.1 硬实种子的处理
3.1.1 浓硫酸处理对种子萌发的影响如图1所示,甘草种子经浓硫酸浸泡不同时间处理后培养至第4 d发芽率都趋于稳定,培养10 d时发芽率都达到最高。其中,经过浓硫酸浸泡80 min的种子发芽率最高,达到77.78%。其次为浸泡60 min的种子,发芽率达到70%,浸泡120 min的种子发芽率低至50%,而未经浓硫酸浸泡的对照种子发芽率最高仅为10%。此外,与对照相比,硫酸浸泡80 min种子的发芽势和发芽指数均有显著提高。
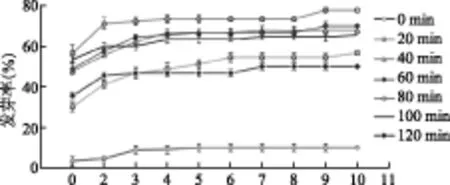
图1 甘草种子的发芽率曲线及浓硫酸处理时间的影响
3.1.2 热水浸泡对种子萌发的影响将甘草种子置初始温度分别为室温(25 ℃)和60 ℃、80 ℃、100 ℃的水(均自然冷却至室温)浸泡24 h后培养,吸胀率、发芽率、发芽势、萌发指数存在差异显著。水的温度与种子吸胀率呈正相关,用100 ℃热水处理的甘草种子吸胀率最高,达到87.78%。但是,水温较高时,发芽率、发芽势和发芽指数呈下降的趋势。水温为60 ℃时,甘草种子的发芽率、发芽势及萌发指数最高。因此,用60 ℃热水浸泡种子的萌发效果最佳。
3.2 组织培养种子的萌发
3.2.1 组织培养种子的预处理以2.1.2、2.1.3得到的最佳萌发条件进行无菌苗的培养(表3)。与无菌水浸泡的对照种子相比,浓硫酸处理80 min、60 ℃无菌水处理的甘草种子的吸胀率、发芽势、发芽率,均有显著提高,且以浓硫酸处理80 min的甘草种子萌发情况最佳,得到的苗无污染。60 ℃无菌水处理的种子和对照种子萌发的苗均存在染菌情况。
3.2.2 次氯酸钠溶液处理将组织培养种子用不同浓度的次氯酸钠溶液浸泡不同时间,以无菌水浸泡种子作为对照。如表4所示,3%和5%次氯酸钠溶液浸泡处理对甘草的吸胀率、发芽势的影响与对照组相比没有显著性差异,都能获得无菌苗。其中3%次氯酸钠溶液浸泡15 min的种子发芽率显著高于对照组,因此可选取3%次氯酸钠溶液浸泡15 min达到消毒灭菌的效果。

表1 浓硫酸处理时间对甘草种子萌发的影响
注:表中小写英文字母表示5%显著水平,大写英文字母表示1%显著水平。

表2 水温对甘草种子萌发的影响
注:表中小写英文字母表示5%显著水平,大写英文字母表示1%显著水平。

表3 浓硫酸和热水处理对组织培养甘草种子萌发情况的影响
注:表中小写英文字母表示5%显著水平,大写英文字母表示1%显著水平。

表4 不同浓度、处理时间次氯酸钠对组织培养甘草种子萌发情况的影响
注:表中小写英文字母表示5%显著水平,大写英文字母表示1%显著水平。
4 结论与讨论
种子硬实是许多豆科植物的特征[10]。甘草种子的种皮坚硬,属于硬实种子,需要经物理和化学方法处理才能改善种皮的通透性、促进水分进入,从而促进萌发。本文采用浓硫酸浸蚀、热水浸泡等方法处理乌拉尔甘草种子,目的在于破除种子的硬实、对种子进行消毒灭菌、提高发芽率和缩短萌发时间。浓硫酸处理和热水浸泡甘草种子都有非常明显的效果,浓硫酸处理甘草种子80 min后,种子的吸胀率、发芽势、发芽率均比对照组和其他处理组有显著性提高,而且幼苗子叶无灼伤,这与王秀英等[11]研究表明浓硫酸浸泡种子70 min后幼苗叶子出现灼伤的结果有所差别。浓硫酸处理可以腐蚀局部种皮、打破栅栏组织的屏障,使种壳变薄从而增大种皮的透水性,因此经过浓硫酸处理的种子吸胀率极显著提高。当硬实种子种皮对胚生长的机械限制被打破后,种子就从休眠期转变为萌发期。但浓硫酸浸泡120 min后的种子由于胚受到伤害,导致发芽率的降低。而且对于虫害较严重但仍有萌发能力的种子,硫酸容易通过伤口进入胚使这些种子丧失发芽能力。热水处理的甘草种子吸胀率、发芽率、发芽势、萌发指数与对照组差异显著,随着水温升高,种子吸胀率升高。然而,种子发芽率、发芽势、萌发指数均逐渐下降。高温烫种可以软化种皮,除去种皮表层的油脂和蜡质,提高种皮的透性和浸出种子内发芽抑制物。但是100 ℃水可能会损伤胚及植物细胞,导致种子失去活力、发芽率相对较低。采用60 ℃热水浸泡种子虽然种皮软化效果不及其他处理效果好,但是对种子的伤害少,因而发芽率、发芽势显著高于其他热水处理组与对照组。这与王彦芹[12]等研究的温汤甘草种子发芽率为零存在差异。
60 ℃热水处理与浓硫酸处理80 min的种子萌发效果比较,后者在组织培养条件下解除甘草种子休眠并获得无菌苗效果更好,浓硫酸处理不仅能促进种子萌发,也能达到良好的消毒效果。但由于浓硫酸处理种子需严格把控时间、处理后冲洗不够彻底易造成酸害且操作相对危险,因此也可选用60℃热水浸泡配合3%次氯酸钠溶液消毒15 min进行组织培养种子的无菌萌发实验。
[1] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2015:86.
[2] Yamamoto Y,Majima T,Saiki I.Pharmaceutical evaluation ofGlycyrrhizauralensisroots cultivated in eastern Nei-Meng-Gu of China[J].Biological & pharmaceutical bulletin,2003,26(8):1144-1149.
[3] Wongwicha W,Tanaka H,Shoyama Y,et al.Production of glycyrrhizin in callus cultures of licorice[J].Zeitschrift für Naturforschung.C,Journal of biosciences,2008,63(5-6):413-417.
[4] 田娟,孙群,王建华等.不同硬实程度乌拉尔甘草种子的活力差异[J].植物生理学通讯,2007,43(2):235-240.
[5] 司马义·巴拉提,卡德尔·阿布都热西提.光果甘草和苦豆子硬实种子处理方法研究[J].种子,2011,30(3):57-60.
[6] 张鹏,孙旭东,刘洋.几种预处理措施对胡枝子种子萌发的影响[J].种子.2014,33(1):1-4.
[7] 杨瑞,王礼强,刘颖.甘草组织培养的研究进展[J].中草药,2014,45(12):1796-1802.
[8] 全国农作物种子标准化技术委员会,全国农业技术推广服务中心.GB/T3453.1-3453.7《农作物种子检验规程》实施指南[S].北京:国家技术监督局中国标准出版社,1995.
[9] International Seed Testing Association.International Rules for Seed Testing[M].Bassersdorf:International Seed Testing Association,2015.
[10] 杨期和,尹小娟,叶万辉.硬实种子休眠的机制和解除方法[J].植物学通报,2006,23(1):108-118.
[11] 王秀英,张大惠.甘草种子不同处理对其萌发和出苗率影响的研究[J].安徽农业科学,2009,37(3):959-960.
[12] 王彦芹,焦培培,张莉等.利用组织培养技术提取甘草黄酮[J].基因组学与应用生物学,2010,29(6):1111-1117.
StudiesonSeedDormancyBreakingofGlycyrrhizauralensisinTissueCultureConditions
LIANG Xiaowei1,2,MeiLingfeng1,2,ZHANGChunrong1,2*,TANGXiaomin1,2,CHENGXuanxuan1,2,YANGQuan1,2,3*
(1.SchoolofTraditionalChineseMedicines,GuangdongPharmaceuticalUniversity,Guangzhou510006,China;2.KeyLaboratoryofStateAdministrationofTraditionalChineseMedicineforProduction&DevelopmentofCantoneseMedicinalMaterials,Guangzhou510006,China;3.StateKeyLaboratoryofDao-diHerbs,NationalResourceCenterofChineseMateriaMedica,ChinaAcademyofChineseMedicalSciences,Beijing100700,China)
Objective:TheGlycyrrhizauralensisseeds are difficult to germinate in tissue culture conditions for its hardness and waxiness.Many methods were used to improve the germination rate and disinfection effect ofG.uralensisseeds in tissue culture.Methods:TheG.uralensisseeds were treated by 98% H2SO4,hot sterile distilled water or sodium hypochlorite solutions,and then cultured on MS medium to investigate the germination rates and disinfection effects.Results:The water absorption rate was 40% and the germination rate was 10% when theG.uralensisseeds were soaked in water at room temperature before cultured on MS medium.However,the water absorption rates reached to 100%,42.16% and 46.7%,and the germination rate reached to 77.79%,36.67% and 24.44%,respectively,when theG.uralensisseeds were treated by 98% H2SO4for 80 min,60 ℃ water for 24 h(naturally cooled down to room temperature)and 3% sodium hypochlorite.TheG.uralensisseeds could be disinfected by 98% H2SO4and sodium hypochlorite solutions.Conclusion:To improve the germination ratesofG.uralensisseeds in tissue culture,the seeds could be treated by 98% H2SO4for 80 min or by 60 ℃ water for 24 h(naturally cooled down to room temperature)followed by 3% sodium hypochlorite surface-sterilization for 15 min.
GlycyrrhizauralensisFisch.;seed germination;tissue culture
2015-12-02)
国家自然科学基金项目(811173488);中医药行业科研专项(201207002);中国中医科学院中药研究所项目(2011ZDXK-01);中国中医科学院中药资源中心项目(KFKT20123005);广东省中医药局建设中医药强省科研项目(20142090)
*
张春荣,讲师,研究方向:分子生药学;Tel:(020)39352176,Email:zhangchunr@21cn.com; 杨全,教授,研究方向:中药资源开发;Tel:(020)39352353,Email:yangquan7208@vip.163.com
10.13313/j.issn.1673-4890.2016.3.019
