NiFe2O4-石墨烯纳米复合材料的制备及其电化学性能
2016-09-23罗驹华
李 涛,罗驹华,颜 祝,,申 盼,3
(1 江苏大学材料科学与工程学院,江苏镇江 212000;2 盐城工学院材料工程学院,江苏盐城 224051;3 常州大学材料科学与工程学院,江苏常州 213164)
NiFe2O4-石墨烯纳米复合材料的制备及其电化学性能
李涛1,罗驹华2,颜祝1,2,申盼2,3
(1 江苏大学材料科学与工程学院,江苏镇江 212000;2 盐城工学院材料工程学院,江苏盐城 224051;3 常州大学材料科学与工程学院,江苏常州 213164)
通过溶剂热的方法合成了石墨烯-镍铁氧体纳米复合材料(NFR)。采用X射线衍射仪(XRD)、拉曼光谱仪(Raman)、傅立叶红外光谱仪(FT-IR)以及透射电镜(TEM)等仪器对样品的形貌和结构进行了表征,并将其作为锂离子电池负极材料组装成模拟电池,考察其电化学性能。测试结果表明:NFR纳米复合材料在100mA·g-1电流密度首圈放电比容量高达1223mAh·g-1,首次可逆比容量为830mAh·g-1,100圈充放电后,容量几乎无衰减,保持较好的循环稳定性。这种优异的性能归功于复合材料中镍铁氧体和石墨烯之间的协同作用。
石墨烯,复合材料,电化学性能,比容量
随着化石燃料资源的日渐枯竭以及其燃烧后带来的环境污染问题,越来越多的国家将目光放到了开发新能源和再生绿色能源上[1-2]。这其中锂离子电池因其具有能量密度高、开路电压高、安全性能好、环境友好、自放电小等优点,而被认为是现代材料和新能源科学的经典能源[3-4]。比容量高、优异的循环稳定和倍率性能的高性能锂离子电池阳极和阴极材料成为了研究的热点。与传统的碳基类负极材料相比,过渡金属氧化物(TMOs)因为其更大的理论比容量而被认为是极有前途的下一代负极材料[5]。所以,资源丰富、环境友好、价格低廉的磁性尖晶石型铁氧体成为下一代商业化应用电极材料的有力争夺者[6]。在众多铁氧体之中,NiFe2O4因为其极高的比容量(915mAh·g-1)而受到了广泛关注[2]。但是受限于其较低的导电性和充放电循环中粒子体积会发生严重变化而致使其容量衰退过快,不能在实际生活中得到应用[7-8]。目前利用纳米材料改性[9-10]或与碳材料[11]进行复合成为了改进NiFe2O4的电化学性能的主要方法。石墨烯作为一种新型碳基材料,受益于其优良的导电性、超薄厚度、极大的比表面积和柔性结构[12],作为铁氧体的复合基底时可以很好地改善上述缺点。但是,疏水性强的石墨烯在溶剂中极难被分散开,相比之下,氧化石墨烯(石墨烯前体)在水中或一些极性溶剂中可充分被剥离为单层氧化石墨烯或层次化的氧化石墨烯[13]。杨光[8]等采用水热法制备了NiFe2O4-石墨烯二元纳米复合材料,粒径为50nm~100nm的粒子分布在石墨烯片层表面。将其制备成锂电池负极材料以100mA·g-1的电流密度充放电时,首次放电容量高达970mAh·g-1,但是受限于晶粒尺寸和粒子间团聚等问题,该电极的循环性能受到了影响,20圈充放电后比容量衰退至668mAh·g-1。
本文通过溶剂热法将NiFe2O4纳米粒子负载在石墨烯片层上。采用氮气气氛下的热处理方法去除铁氧体颗粒间应力,使NiFe2O4纳米粒子在石墨烯表面均匀分散。只需两步就可得到NiFe2O4-石墨烯二元纳米复合材料,并对其结构形貌和电化学性能进行了研究。
1 实验部分
1.1样品的制备
采用改进型Hummers法制备氧化石墨烯(GO),具体方法参见文献[14]。取80mg GO溶于40mL乙醇溶液,室温下磁力搅拌1h,随后超声分散30min最终形成均匀的墨绿色分散液A。称取0.808g Fe(NO)3·6H2O、0.2907g Ni(NO)3·6H2O溶于10mL乙醇溶液中并用相同的分散方法形成均匀的棕色溶液B。然后将溶液A缓慢地滴加到溶液B中。随后,整个混合溶液再搅拌1h。最后逐滴滴入8M NaOH溶液,直至整个混合溶液的pH值在10~11之间。将该混合溶液移至以聚四氟乙烯为衬里的高压反应釜中,置于烘箱中于220℃温度条件下反应24h。然后离心分离,用去离子水和无水乙醇分别洗涤3次后置于40℃下真空干燥12h,取出研磨后得到黑色物体。将该黑色物体置于管式炉中,用高纯氮气作为保护气体在600℃温度条件下煅烧2h,降至室温后收集黑色产物记作NFR-1。整个制备过程如图1所示。

图1 NFR纳米复合材料制备流程图
通过控制变量法制备出其他组分的复合材料,不改变GO的量,等摩尔比例的调控铁源和镍源的投入量,调节NiFe2O4在复合体系中的负载量。按表1中反应物量,重复上述实验制备NF0(不加GO)、NFR-0.5、NFR-2样品。

表1 各组分NFR复合材料配方
1.2样品表征
样品的晶相结构由粉末X射线衍射仪(XRD)(日本理学,D/MAX-2500)测定;采用傅里叶变换红外光谱仪(FT-IR)(NICOLET,Nexus-670)对样品进行物相组成、结构分析;透射电子显微镜(TEM)(JEOL,JLM-2100)研究样品的形貌和结构。
1.3电极材料的制备及电化学性能测试
将活性物质(NFR,NF0)、导电剂(乙炔黑)和粘结剂(聚偏二氟乙烯PVDF)以m(活性物质)∶m(导电剂)∶m(粘结剂)=8∶1∶1比例混合,使用N-甲基吡咯烷酮(NMP)作为分散剂,磁力搅拌2h后制成电极浆。将电极浆料均匀涂敷在铜片上作为工作电极,铜片上涂敷的浆料为1mg左右。电池组件前,将铜片置于120℃以下的真空中干燥12h。以金属锂为箔电极,1.0mol/L的LiPF6/EC+DEC[V(EC)∶V(DEC)=1∶1]为电解液,聚丙烯膜(Celgard 2300)为隔膜在氩气氛围下的真空手套箱内组装成模拟电池。在室温下,使用新威电池测试系统(型号 BTS-5V3A)进行充放电测试,测试电压为0.001V~3.0V(vs.Li/Li+),电流密度100mA·g-1。
2 结果与讨论
2.1NFR纳米复合材料的结构表征
图2(a)为纯镍铁氧体(NF0)的XRD谱,2θ=30.29°、35.70°、43.36°、53.80°、57.36°、62.92°处出现非常明显的特征衍射峰,分别对应NiFe2O4的(220)、(311)、(222)、(400)、(422)、(511)和(440)晶面,与立方晶系NiFe2O4标准PDF图谱(no.74-2801)完美匹配。图2(e)是氧化石墨烯(GO)的XRD谱,位于2θ=10.96°处出现的强烈而尖锐的衍射峰对应于GO的(001)晶面[15]。图2(b~d)为不同石墨烯含量的NFR材料的XRD谱,可以明显地观察到所有样品中特征衍射峰均十分明显且尖锐,表明了样品纯度很高;衍射峰宽度明显宽于NF0,说明了石墨烯的引入降低了晶体颗粒度[2];三组复合材料样品中GO特征峰的消失表明了氧化石墨烯在溶剂热法复合过程中还原成了石墨烯[15]。且三组样品中对应的NF0的特征峰依旧存在,峰位略有偏移,这说明了NFR材料中存在NF0相,且NF0与RGO之间有良好的界面作用。
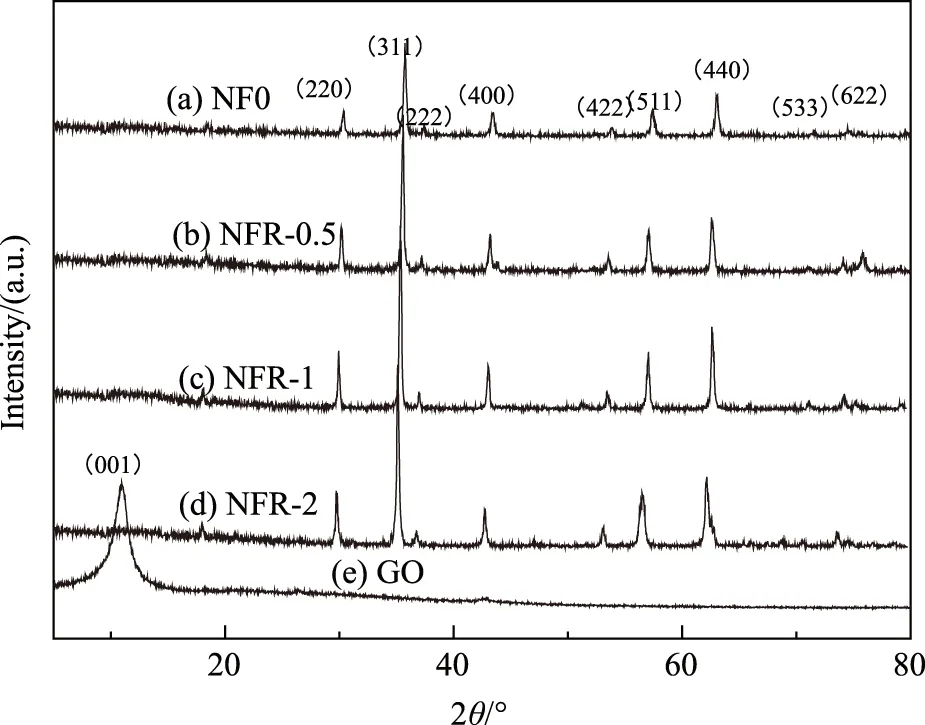
图2 (a)NF0、(b)NFR-0.5、(c)NFR-1、(d)NFR-2、(e)GO的XRD图
图3(a)为GO的傅里叶红外光谱图,图中可以清楚地观察到各个含氧官能团对应的特征吸收峰的位置:羰基或羧基中C=O(1733cm-1)、羧基中C-O(1046cm-1)、叔醇中C-OH(1370cm-1)的伸缩振动峰[16];出现在1623cm-1处的特征峰对应了石墨氧化物中没有被破坏的共轭C=C骨架的伸缩振动[14]。图3(b)是NF0的傅里叶红外光谱图,在547cm-1和439cm-1处的吸收峰分别是由NF0中Fe-O伸缩振动和Ni-O伸缩振动引起的,位于3430cm-1和1630cm-1处的吸收峰是样品吸附微量水的O-H振动吸收峰。图3(c~e)为NFR纳米复合材料的的傅里叶红外光谱图,图中GO中含氧官能团的特征峰都消失了,表明了GO在溶剂热过程中被还原。同时,对比NF0的红外图谱,各组分复合材料在低波数下的吸收峰一致,证明了复合材料中镍铁氧体的存在。
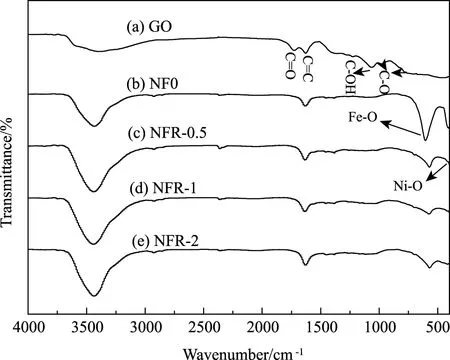
图3 (a)GO、(b)NF0、(c)NFR-0.5、(d)NFR-1、(e)NFR-2的红外光谱图
图4(a)为GO的拉曼光谱图,可以观察到GO有两个主峰,分别是位于1325cm-1的处D峰和1590cm-1处的G峰[13]。图4(b)为NFR纳米复合材料的拉曼光谱,与GO的拉曼光谱相比,NFR的G峰向低频方向发生了位移,这是因为GO在溶剂过程中被还原成了RGO[6]。此外,相比GO,NFR纳米复合物的D/G峰强度的比值有所增大,进一步表明了GO还原成了RGO[15]。
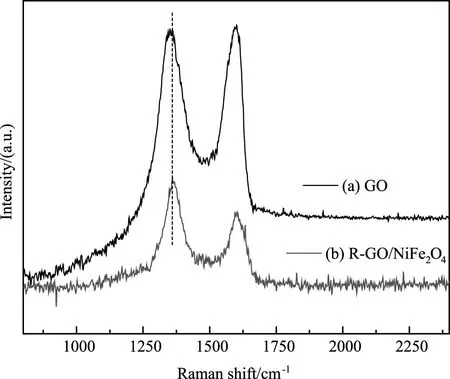
图4 (a)GO和(b)NFR复合材料的拉曼光谱
图5(a)为石墨烯透射电镜照片。可以观察到RGO呈透明片状,RGO单片层碎片与其他单片层在RGO表面产生无规律的交叠、卷曲。图5(b)、(c)分别为热处理前与热处理后的NFR材料,图5(b)中可以观察到浅色薄膜即为RGO,粒径在20nm~30nm的球状颗粒被吸附在石墨烯上,但在热处理前粒子存在较为严重的堆聚现象,从图5(c)可观察到,材料历热处理后NF0粒子均匀地分布在RGO片层表面。

图5 (a)RGO和(b)、(c)热处理前后的NFR纳米复合材料的TEM图
图6为NF0和纳米复合材料NFR-1的比表面积和孔径分布图。通过计算可得,图6(a)中纯NF0样品的比表面积为19.5m2·g-1,而图6(b)中NFR-1样品的比表面积为105.7m2·g-1。加入石墨烯后NF0比表面积的增加了5倍之多,氧化石墨烯只有29m2·g-1的低比表面积[2],所以比表面积的增加主要来源于复合结构的形成。随着石墨烯的引入,比表面积增大,在Li+嵌入/脱嵌的过程时电极材料界面反应位置增多,因此NFR复合材料比NF0材料具有更高的容量。

图6 (a)NF0和(b)NFR-1的比表面积和孔径分布图
2.2NFR纳米复合材料的电化学性能测试
图7(a~d)为NF0、NFR-0.5、NFR-1、NFR-2纳米材料在0.001V~3.0V电压范围、100mA·g-1电流密度的条件下进行恒流充放电的第1、2、3、10次充放电曲线图,首次放电比容量分别为1063mAh·g-1、1153mAh·g-1、1233mAh·g-1、1281mAh·g-1,首次可逆容量分别为680mAh·g-1、738mAh·g-1、830mAh·g-1、844mAh·g-1,库伦效率为63%、64%、67.3%、65.8%,容量的损失主要来源于在第一圈放电过程中电解液和负极材料在固液相间层面上发生反应形成SEI膜[2]。复合材料的首圈容量明显增大是因为石墨烯的引入提供了更多的嵌锂位置,从而提高了初始放电容量。而复合材料中初始容量随着石墨烯在复合体系中所占比例的减小而增大,这是因为石墨烯的理论比容量小于铁氧体所导致的。首次可逆比容量的大小随着石墨烯含量的增多呈现递减的趋势,且NFR-1与NFR-2首次可逆比容量相近,NFR-0.5首次可逆比容量对比前两周明显降低,分析其原因是纳米颗粒在石墨烯表面分布不均导致了可逆容量大幅下降[17]。
为了比较电极材料的循环稳定性能,将各组分材料在电流密度100mA·g-1的条件下进行100次循环。图8中结果显示石墨烯的引入大大提高了电极材料的循环稳定性能。这是因为:首先,还原氧化石墨烯能紧紧固定微小的活性基团;其次,复合材料上的自由空间和RGO可以缓解体积变化的影响。而在复合材料体系中,在经历25次左右循环的容量衰减后容量开始增加。这是因为在循环中NF0粒子粉碎成更加微小的颗粒,如果这些微粒仍然固定在还原氧化石墨烯上,使得活性基团的利用率普遍提高所以电荷容量得到提高。其中性能最好的NFR-1样品,首次可逆比容量为846mAh·g-1,100圈循环后比容量高达842mAh·g-1,比容量几乎无衰减,获得的纳米复合物电极的容量比商业上使用的石墨阳极的理论容量高出近两倍多,显示出了极优越的循环性能。与文献[8]的结论对比后发现循环性能得到明显增强,这是由于更小的晶粒尺寸造成了更多的嵌锂位置和更稳定的晶体结构。
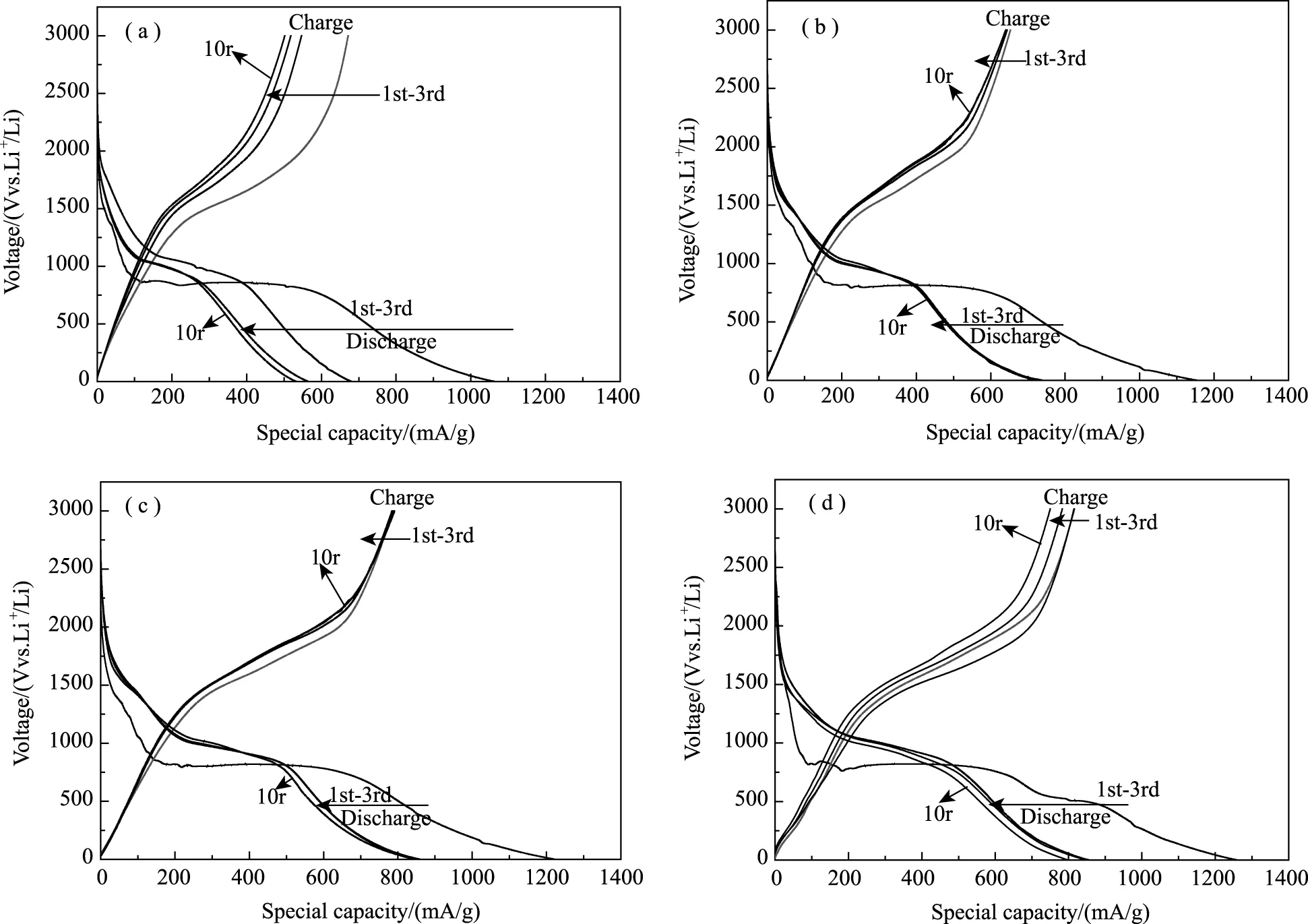
图7 NFR纳米复合材料的充放电曲线图:(a)NF0;(b)NFR-0.5;(c)NFR-1;(d)NFR-2

图8 不同石墨烯含量的NFR的循环性能图
为了进一步测试复合材料在大电流密度条件下的充放电能力,对电极材料进行了倍率性能的测试,不同石墨烯含量的电极材料分别连续在100mA·g-1、200mA·g-1、400mA·g-1、800mA·g-1、1600mA·g-1、100mA·g-1的电流密度下进行充放电十次。从图9中可以明显看出,与RGO形成复合物后NiFe2O4的倍率性能明显提高。在1600mA·g-1电流密度时,NFR-1电极仍然可以提供692mAh·g-1的比容量;相比之下,NF0的比容量只有291mAh·g-1。倍率性能的提升一方面与复合材料独特的微观结构有密切关系,另一方面是因为石墨烯的引入很好地起到了缓冲作用,缓解了纳米粒子在充放电过程中的团聚以及体积膨胀的现象,同时一些层次化的RGO还给锂离子提供扩散通道[18]。
对比三组复合材料的各项性能,发现NFR-1样品的电化学性能最优:当石墨烯含量较少时(NFR-0.5),虽然可以使铁氧体的均匀地分在石墨烯表面,但是复合材料的电子导电性提高并不大,并且也无法完全地起到对铁氧体颗粒的分散以及缓冲体积的膨胀缓冲作用;而当石墨烯含量过多的时候(NFR-1),导电性和缓冲效果提升的同时,使得整个复合材料体系容量变小。
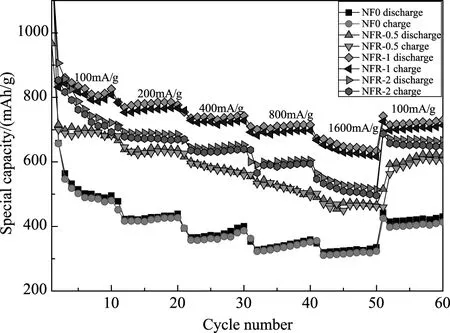
图9 不同石墨烯含量的NFR纳米材料在变电流密度下循环性能曲线
3 结论
以Fe(NO)3·6H2O和Ni(NO)3·6H2O为原料,以NaOH为沉淀剂,使用了一种简易溶剂热法合成出了RGO-NiFe2O4复合材料,简单热处理之后,直径为20nm~30nm左右的球状颗粒NiFe2O4均匀分布在RGO表面片层上。对电极材料进行电化学测试,结果显示NFR-1样品的复合材料具有最佳的电化学性能:100mA·g-1电流密度条件下,首圈放电比容量达到1233mAh·g-1,首次可逆容量高达830mAh·g-1,在经历100次冲放电后比容量几乎无衰减,同时表现出优异的倍率性能。极有可能被应用于实际的商品化电池的生产。
[1] Liang C,Huang S,Zhao W,et al. Polyhedral Fe3O4nanoparticles for lithium ion storage[J]. New Journal of Chemistry,2015,39(4):2651-2656.
[2] Zhu P,Liu S,Xie J,et al. Facile synthesis of NiFe2O4/reduced graphene oxide hybrid with enhanced electrochemical lithium storage performance[J]. Journal of Materials Science & Technology,2014,30(11):1078-1083.
[3] Fotouhi A,Auger D J,Propp K,et al. A review on electric vehicle battery modelling:from lithium-ion toward lithium-sulphur[J]. Renewable and Sustainable Energy Reviews,2016,56:1008-1021.
[4] 李涛. Fe-Mn-Ti-C 锂离子电池负极材料的制备及其电化学性能研究[D]. 山东:山东大学,2015.
[5] 张加艳,沈建兴,魏长宝. 锂离子电池负极材料研究进展[J]. 山东陶瓷,2015(1):7-10.
[6] Fu Y,Wan Y,Xia H,et al. Nickel ferrite-graphene heteroarchitectures:Toward high-performance anode materials for lithium-ion batteries[J]. Journal of power Sources,2012,213:338-342.
[7] Fu M,Jiao Q,Zhao Y. Preparation of NiFe2O4nanorod-graphene composites via an ionic liquid assisted one-step hydrothermal approach and their microwave absorbing properties[J]. Journal of Materials Chemistry A,2013,1(18):5577-5586.
[8] 杨光,陈野川,薛卫东,等. 锂离子负极材料 NiFe2O4/Graphene 复合材料的制备和电化学性能[J]. 化工科技,2014,22(5):16-19.
[9] Wang N,Xu H,Chen L,et al. A general approach for MFe2O4(M=Zn,Co,Ni) nanorods and their high performance as anode materials for lithium ion batteries[J]. Journal of Power Sources,2014,247:163-169.
[10] Lavela P,Kyeremateng N A,Tirado J L. NiMn2-xFexO4prepared by a reverse micelles method as conversion anode materials for Li-ion batteries[J]. Materials Chemistry and Physics,2010,124(1):102-108.
[11] Liu H,Zhu H,Yang H. A low temperature synthesis of nanocrystalline spinel NiFe2O4and its electrochemical performance as anode of lithium-ion batteries[J]. Materials Research Bulletin,2013,48(4):1587-1592.
[12] Ma Z,Zhao T. Reduced graphene oxide anchored with MnO2nanorods as anode for high rate and long cycle Lithium ion batteries[J]. Electrochimica Acta,2016,201:165-171.
[13] 汤慕尧,贺春华,张海燕,等. 有无液晶性的氧化石墨烯之间的差异[J]. 材料科学与工程学报,2015,33(2):203-206.
[14] Xu Y,Luo J,Yao W,et al. Preparation of reduced graphene oxide/flake carbonyl iron powders/polyaniline composites and their enhanced microwave absorption properties[J]. Journal of Alloys and Compounds,2015,636:310-316.
[15] 邹鹏,石文荣,杨书华,等. 石墨烯的化学气相沉积法制备及其表征[J]. 材料科学与工程学报,2014,32(2):264-268.
[16] Singh K,Ohlan A,Pham V H,et al. Nanostructured graphene/Fe3O4incorporated polyaniline as a high performance shield against electromagnetic pollution[J]. Nanoscale,2013,5:2411-2420.
[17] Chen X,Cheng B,Xu H,et al. Porous ZnFe2O4nanospheres grown on graphene nanosheets as a superior anode material for lithium ion batteries[J]. Chemistry Letters,2012,41(6):639-641.
[18] Nethravathi C,Nisha T,Ravishankar N,et al. Graphene-nanocrystalline metal sulphide composites produced by a one-pot reaction starting from graphite oxide[J]. Carbon,2009,47(8):2054-2059.
Fabrication and Electrochemical Performance of NiFe2O4/Granphene Nanocomposites
LI Tao1,LUO Ju-hua2,YAN Zhu1,2,SHEN Pan2,3
(1 Jiangsu University,Zhenjiang 212000,Jiangsu,China;2 Yancheng Institute of Technology,Yancheng 224051,Jiangsu,China;3 Changzhou University,Changzhou 213164,Jiangsu,China )
The nanocomposites of RGO-NiFe2O4(NFR) were synthesized via solvothermal method. Crystal structure and surface morphology of NFR were characterized by X-ray diffraction(XRD),Raman spectroscopy,Fourier transform infrared spectrum(FT-IR) and transmission electron microscopy(TEM). As an anode material of lithium-ion batteries,the electrochemical performance of NFR nanocomposites was studied. The results showed that NFR delivered a high initial discharge capacity of 1223mAh·g-1,reversible capacity of 830mAh·g-1and almost no capacity attenuation after 100 cycles at current densities of 100mA·g-1.
graphene,composites,electrochemical performance,specific capacity
TM 911
