辽宁绒山羊母羔体外胚胎生产技术研究
2016-09-23豆兴堂宋先忱李万波王家明张兴会
豆兴堂,宋先忱,高 月,李万波,王家明,张兴会
(辽宁省畜牧科学研究院,辽宁 辽阳 111000)
辽宁绒山羊母羔体外胚胎生产技术研究
豆兴堂,宋先忱,高月,李万波,王家明,张兴会
(辽宁省畜牧科学研究院,辽宁 辽阳 111000)
以辽宁绒山羊母羔为研究对象,通过超排母羔、卵母细胞体外成熟、体外受精、胚胎移植技术等试验研究,建立了绒山羊母羔体外胚胎生产技术体系。结果表明:PMSG+FHS组与FSH+PMSG组超排方法获得的卵母细胞数无显著差异(P>0.05),但PMSG+FHS组卵裂率和囊胚率均极显著高于FSH+PMSG组(P<0.01)。成熟液添加EGF组PBⅠ率、卵裂率均显著高于对照组(P<0.05);20 ng/mL EGF组PBⅠ率显著高于10 ng/mL组(P<0.05),卵裂率差异不显著(P>0.05)。卵母细胞成熟培养24~27 h组第一极体率与卵裂率均显著高于21~24 h组(P<0.05);SOF受精体系卵裂率显著高于TALP(P<0.05),囊胚率极显著高于TALP受精系(P<0.01)。秋季胚胎移植受体母羊16只,产羔3只。
绒山羊;卵母细胞;体外受精;胚胎
优良种畜高效扩繁一直是制约畜牧产业发展的主要因素之一。JIVET技术近年来已成为配子与胚胎生物技术研究热点之一,JIVET技术即幼畜胚胎体外生产技术,集幼畜超排、活体采卵、卵母细胞体外成熟、体外受精、胚胎体外培养、胚胎移植等技术为一体的胚胎生物技术体系。该技术在国内已成功应用于小尾寒羊[1]、奶山羊[2]等。本实验研究以4~8周龄辽宁绒山羊母羔为对象,通过母羔超排、活体采卵、体外受精与胚胎移植等技术方法,成功获得了“试管绒山羊”,建立了绒山羊母羔体外胚胎生产技术体系。
1 材料与方法
1.1实验材料
选择4~8周龄、体质健壮、性情活泼、健康的辽宁绒山羊母羔。冷冻精液为实验室自制。
1.2主要实验设备
CO2培养箱:HERA Cell 150,美国;立体显微镜:Minitube,德国;电子天平:北京赛多利斯天平公司;超纯水:由Mini-Q纯水仪制;电热恒温水浴锅:DK-S22,上海精宏实验设备有限公司;移卵管、手术保定车:实验室自制。
1.3主要试剂
Medium 199(with Earle’s salts):M3769,Sigma;Mineral oil:M5904,规格:500mL,Sigma分装;BSA:A4919,Sigma分装;FSH:R9D19A,加拿大;宁波第二激素厂,批号:080127;LH:R8K03VB,加拿大;PMSG:1 000 IU/支,宁波市三生药业有限公司,批号:090111;肝素:H01923,Bioszune分装;17β-雌二醇:E8875,Sigma分装;发情羊血清(EGS):绒山羊发情当天用常规血清制备法自制,56 ℃灭活处理30 min;其他试剂除特殊说明外均购自sigma公司。
1.4实验方法1.4.1诱导母羔卵泡发育方法
母羔超排用FSH、PMSG激素,即先肌肉注射PMSG 400IU,以后每间隔12 h分别肌肉(可在颈部肌肉或后肢内侧肌肉)注射FSH 40 mg 3次。
1.4.2卵母细胞活体采集
母羔在最后一次超排注射后12~16 h,手术活体采集卵母细胞。母羔保定于手术车上,常规手术打开腹腔,将一侧卵巢牵引至切口外,固定。10 mL注射器抽取2~3 mL采卵液,先逐一刺破卵巢表面卵泡抽取卵泡液和COCs,直至表面卵泡全部采集完。然后手触碰卵巢内卵泡,采集卵巢内部卵母细胞,直至触碰不到卵泡,卵巢恢复原形。采集时间应越短越好,控制在10 min左右。注意注射器内采卵液温度应保持30 ℃以上。抽取力量不应过大,避免卵丘颗粒细胞脱落形成裸卵。采卵液:TCM-HCO3+10 μg/mL Heparin+5%EGS+2.2 mg/mLNa-pyrunate+2.383mg/mL HEPES+2.603 mg/mL HEPES-Na+10 μL/mL青链霉素。
1.4.3卵母细胞体外成熟培养
用四孔板培养体系。在38.5 ℃、40×体视显微镜下,迅速捡取卵母细胞转移到洗涤液中,并将COCs进行分级(A级:卵丘细胞3层以上,胞质均匀;B级:1~2层卵丘细胞,胞质均匀;C级:卵丘细胞不完整、裸卵或退化的卵母细胞),A、B级卵母细胞洗涤2~3遍,转移到四孔板成熟培养液(每孔600 μL成熟液、上覆矿物油,预先在CO2培养箱中平衡4h)中,每孔25~30枚卵母细胞,38.5 ℃、5%CO2、饱和湿度下成熟培养24 h以上。卵母细胞成熟培养液为:TCM-HCO3+10 μg/mL FSH+10 μg/mL LH+1 μg/mL E2+10%EGS+2.2mg/mL Na-pyrunate+0.012mg/mL cystein-e+10 μL/mL青链霉素。
1.4.4体外受精
取解冻后的精液150~200 μL,轻轻加入到含有800 μL获能液的圆底玻璃试管(预先38.5 ℃、5%CO2、饱和湿度下平衡4 h)的底部,竖直轻轻放入CO2培养箱,使精子获能上游20~30 min,受精备用。将成熟培养后的卵母细胞转移到受精液中,受精液洗涤2~3遍;将卵母细胞转移到含受精液的四孔板(每孔400 μL受精液,上覆矿物油,预先38.5 ℃、5%CO2、饱和湿度下平衡4h)中,每孔25~30枚卵母细胞。取微量圆底玻璃试管中的上清液,显微镜下检查精子活力,判定精子合格后,受精。根据精子密度取100~150 μL上清液,轻轻加入到有卵母细胞的四孔板中,避免产生气泡。四孔板放入CO2培养箱,38.5 ℃、5%CO2、饱和湿度下精卵受精作用22~24 h。精子获能液:SOF(或TALP)基础液+10%EGS+25 μg/mL肝素+10 μL/mL青链霉素。受精液:SOF(或TALP)基础液+6 mg/mL BSA+1 μg/mL亚牛磺酸钠+10 μL/mL青链霉素。
1.4.5早期胚胎体外发育培养
精卵受精作用22~24 h后,将假定合子转移到胚胎发育洗涤液中,巴氏捡卵管轻轻吹打假定合子周围的卵丘细胞与粘附的精子,使之脱落。体视镜下配合捡卵管拨动假定合子,观察PBⅡ。将假定合子在胚胎发育液中洗涤2~3遍,转移到含胚胎发育液的四孔板(每孔600 μL发育液,上覆矿物油,预先38.5 ℃、5%CO2、饱和湿度下平衡4 h)中,38.5 ℃、5%CO2、5%O2、90%N2发育培养。培养24 h观察卵裂情况,并统计卵裂率,挑出单细胞,卵裂胚胎继续发育培养。卵裂胚胎用添加BSA的SOF培养液培养48 h,再换液用添加FBS的SOF液培养至囊胚,培养中每24 h半量置换培养液。
1.5统计分析
实验数据用SPSS13.0软件分析,差异显著性用one-way ANOVA检验,P>0.05认为差异不显著,P<0.05认为具有显著性差异,P<0.01认为差异极显著。
2 结果与分析
2.1不同超排方法对超排效果、体外受精卵裂率和囊胚率的影响
表1不同超排方法对超排效果、卵裂及胚胎发育的影响

组别羔羊/只卵泡/个平均卵数/个卵裂率/%囊胚率/%PMSG+FSH636661.00±13.93a42.43(143/337)A47.59(69/145)AFSH+PMSG651585.83±18.35a22.80(101/443)B25.74(26/101)B
从表1可以看出,两种超排方法获得的平均卵母细胞数无显著差异(P>0.05),但PMSG+FHS组卵裂率和囊胚率均极显著高于FSH+PMSG组(P<0.01)。表明超排方法不仅影响超排效果且对体外受精后卵裂及胚胎发育有很大影响。

图1 母羔超排卵巢
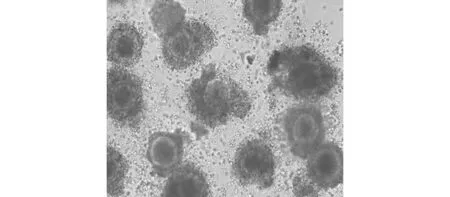
图2 成熟卵母细胞100×

图3 成熟卵母细胞(PbⅠ)400×
2.2成熟液添加EGF对卵母细胞成熟与卵裂的影响
表2成熟液添加EGF对卵母细胞成熟与卵裂的影响
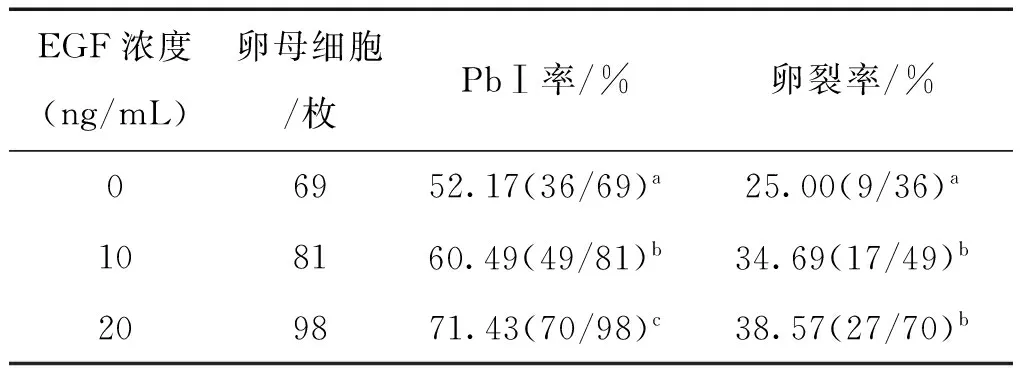
EGF浓度(ng/mL)卵母细胞/枚PbⅠ率/%卵裂率/%06952.17(36/69)a25.00(9/36)a108160.49(49/81)b34.69(17/49)b209871.43(70/98)c38.57(27/70)b
表2表明,成熟液添加EGF对卵母细胞成熟与卵裂有很大影响。添加EGF组PBⅠ率、卵裂率均显著高于对照组(P<0.05);20 ng/mL EGF组PBⅠ率显著高于10 ng/mL组(P<0.05),卵裂率差异不显著(P>0.05)。
2.3卵母细胞IVM时间对成熟及卵裂的影响
表3卵母细胞IVM时间对成熟及卵裂的影响

IVM时间/h卵母细胞/个PbⅠ率/%卵裂率/%21~245856.89(33/58)a24.24(8/33)a24~277268.06(49/72)b40.82(20/49)b27~304971.43(35/49)b34.29(12/35)b
从表3可以看出,卵母细胞成熟培养24~27 h组PbⅠ率显著高于21~24 h组(P<0.05),与27~30 h组差异不显著(P>0.05);卵裂率方面,卵母细胞成熟培养24~27 h组卵裂率显著高于21~24 h组(P<0.05),与27~30 h组差异不显著(P>0.05)。
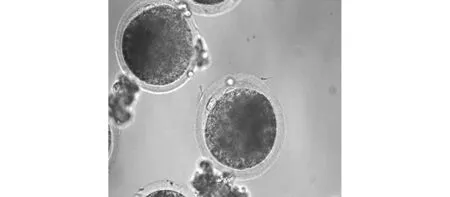
图4 受精(PbⅡ)

图5 早期囊胚

图6 出生的羔羊
2.4不同受精体系对卵裂及胚胎发育能力的影响
从表4可以看出,SOF受精体系卵裂率显著高于TALP(P<0.05),囊胚率极显著高于TALP受精系(P<0.01)。
表4受精体系对胚胎发育的影响

受精体系卵母细胞/个卵裂率/%囊胚率/%TALP7826.92(21/78)a19.05(4/21)ASOF8340.96(34/83)b41.18(14/34)B
2.5母羔体外胚胎移植情况
2011年11月通过超排母羔、采集卵母细胞、体外受精,生产母羔体外胚胎,2~4细胞期体外胚胎移植受体母羊16只,2012年4月开始3只受体母羊产羔3只,其中难产死亡1只,体外胚胎移植产羔率为18.75%。
3 讨论
3.1超排方法不仅影响超排效果且对体外受精后卵裂及胚胎发育有很大影响。目前幼羔超排方法以FSH+PMSG联合使用较多[1~3]。本试验比较了FSH+PMSG和PMSG+FSH超排方法,结果表明两种超排方法超排效果没有差异,但PMSG+FSH法对体外受精卵裂和胚胎发育有较大促进作用。可能与PMSG作用时间稍长,能促进卵泡卵母细胞充分生长发育有关。PMSG是糖蛋白激素中唯一独特的促性腺激素,同一分子中具有黄体生成素和促卵泡生成素两种促性腺激素的活性,由于PMSG在动物体内的半衰期较长,同一分子又具有FSH和LH的双重活性,在动物体内,其生理作用是对卵巢和睾丸的靶细胞受体,特异性极强。
3.2表皮生长因子(EGF)是人体内的一种活性物质,由53个氨基组成的活细胞,藉由刺激表皮细胞生长因子受体之酪氨酸磷酸化,达到修补增生肌肤表层细胞,其最大特点是能够促进细胞的增殖分化,从而以新生的细胞代替衰老和死亡的细胞。王艾平[4]等在卵母细胞成熟液中添加EGF,结果含50 ng/mL EGF组COCs成熟率 (75.45%~75.8%)和卵裂率 (72.4%~74.1%)均显著高于其它组。表明EGF对COCs体外成熟和卵裂发育具有明显的促进作用。刘丑生[5]等在绵羊卵母细胞成熟液中添加EGF,结果为50 ng/mL的EGF的成熟率和卵裂率分别为71.2%和45.5%,显著高于对照组和10、20、30、40 ng/mL组(P<0.05)。本试验结果表明,EGF对卵母细胞成熟、体外受精卵裂有很大促进作用。
3.3卵母细胞IVM时间对其成熟及体外受精都有很大影响。张勇等[6]认为,成熟培养20 h,24 h的卵母细胞成熟率显著高于培养16 h,核成熟后培养3~4 h有利于卵母细胞质成熟,对其后的受精、卵裂及胚胎的进一步发育有重大影响。本实验结果表明,卵母细胞成熟培养24~27 h组成熟率、卵裂率均显著高于21~24 h组,27~30 h组成熟率(71.43%)高于24~27 h组(68.06%),差异不显著;24~27 h组卵裂率(40.82%)高于27~30 h组(34.29%),差异不显著。刘泽隆[7]研究表明,山羊卵母细胞体外成熟培养18~24 h,15~25 h,成熟率逐渐提高,而在30~35 h时则退化程度严重。但母羔卵母细胞体外成熟可能需要稍长的时间,具体成熟时间对卵裂及胚胎发育的影响,值得进一步试验研究。
3.4受精培养液对卵母细胞受精和卵裂有很多影响。国外较多采用TALP液研究性成熟前山羊卵母细胞的体外受精,用添加了50 μg/mL肝素的mDM液获能,用添加1 μg/mL亚牛磺酸的TALP液受精[8]。张锁链[9]等采集种公羊新鲜精液,以0.5 μM A-23187处理1min或在培养液中添加50 μg/mL肝素获能,用2 mM咖啡因、20 μg/mL BSA的BO液做受精液,2~4细胞胚的卵裂率分别为28.6%和41.9%。赵宏远[2]采集超排母山羊羔卵母细胞,成熟培养后用SOF液受精,受精培养23~26 h组,平均卵裂率为48.33%。武建朝[10]研究结果表明,TALP受精液(卵裂率42.11%)比BO更适合母羔体外受精及卵裂。本试验结果显示,SOF受精体系更适合绒山羊母羔卵母细胞体外受精。
3.5羔羊体外生产胚胎在母体子宫内附植后的发育力弱,产羔率低,是羔羊体外胚胎移植存在的主要问题。可能与幼羔卵母细胞成熟程度有很大关系,尤其在与成年羊卵母细胞在卵母细胞直径、能量、蛋白合成、胞质成熟和分子生物学的差异[11],也可能是妊娠过程中由于流产和木乃伊影响了正常胎儿的发育,胚胎发育失败和附植前后胚胎丢失等等。总之,羔羊体外胚胎移植产羔受很多因素影响,效果不稳定。提高羔羊卵母细胞的体外胚胎生产效率和移植妊娠率,是今后应着力研究解决的问题。
[1]陈晓勇,田树军,桑润滋,等.诱导幼羔卵泡发育及体外胚胎生产[J].农业生物技术学报,2008,(16)3:456-460.
[2]赵宏远.影响山羊幼羔卵泡发育及体外受精效果主要因素研究[D]:[硕士学位论文].河北保定:河北农业大学动物科学技术学院,2009.
[3]邵庆勇,成文敏,杨红远,等.羔山羊卵泡诱导发育及活体采卵研究[J].中国农业大学学报,2008,13(5):75-80.
[4]王艾平,魏 泓,孙新民,等.表皮生长因子、巯基乙醇和亚硫磺酸对山羊体外胚胎生产的影响研究[J].中国草食动物,2005,25(1):3-6.
[5]刘丑生,陆会宁,张利平,等.EGF和IGF-I对绵羊卵母细胞体外成熟和卵裂的影响[J].畜牧兽医学报,2008,39(5):588-593.
[6]张勇,刘泽隆,李裕强.山羊卵泡卵母细胞体外成熟的研究[J].西北农业大学学报,1999,27(1):14-18.
[7]刘泽隆.牛和山羊卵泡卵母细胞体外受精及其体外受精胚早期发育的研究[D].杨陵:西北农林科技大学硕士学位论文,1997.
[8]Begofia A,Ana R,Jimenez-Macedo,et al.Effect of oocyte diameter on meiotic competence,embryo development,P34(cdc2) expression and MPF activity in prepubertal goat oocytes[J].Theriogenology,2007,67:526-536.
[9]张锁链,刘东军,度洪式,等.羔山羊的超数排卵及体外受精[J].内蒙古大学学报(自然科学版),1994,25(2):205-208.
[10]武建朝.利用性成熟前山羊卵泡卵母细胞体外生产胚胎的研究[D]:[南京农业大学硕士学位论文].南京:南京农业大学,2007.
[11]张艳普,孙树春.幼畜与成年畜超排卵发育潜能的研究进展[J].畜牧与兽医,2010,42(8):100-102.
Study on Technology of Embryo ProductioninvitroLiaoning Cashmere lamb
DOU Xing-tang,SONG Xian-chen,GAO Yue,LI Wang-bo,WANG Jia-ming,ZHANG Xing-hui
(Institute of Animal Husbandry Science of Liaoning Province,Liaoyang 111000,China)
This dissertation taked the Liaoning Cashmere Goat female lambs as the research object.it has been created that in vitro embryo producton system of Liaoning Cashmere goat female lambs by studied on superovulation,IVM,IVF,ET.The results were showed that the number of oocytes collected by PMSG+FHS and FSH+PMSG superovulation was no significant difference,but Cleavage rate and blastula rate of PMSG+FHS group were both very significant higher than that of FSH+PMSG group(P<0.01);Secondly,PBⅠrate and cleavage rate of oocytes maturation culture solution with EGF were both significant higher than that of control group (P<0.05),PBⅠrate of culture solution with 20ng/mL EGF group was significant higher than 10ng/mL group (P<0.05),but cleavage rate was no significant difference (P>0.05).PBⅠrate and cleavage rate of oocytes maturation 24-27h group were both significant higher than that of 21-24h group (P<0.05);Cleavage rate of SOF IVF system was significant higher than that of TALP(P<0.05),blastula rate of SOF IVF system was very significant higher than that of TALP(P<0.01).And then,in autumn in vitro embryos of Liaoning Cashmere goat female lambs were transferred to oviduct of 16 recipient of female Liaoning Cashmere goat,3 lambs were born next year.
Cashmere goat;Oocyte;In vitro fertilization;Embryo
2016-06-29
豆兴堂(1978-),男,农业推广硕士,高级畜牧师。
E-mail:dou791120@sina.com
S826.3
A
1005-2739(2016)05-0009-05
