缺血性脑血管病患者脂蛋白a与颈动脉内膜增厚及斑块形成相关性研究
2016-09-19赵岩闫福岭
赵岩,闫福岭
缺血性脑血管病患者脂蛋白a与颈动脉内膜增厚及斑块形成相关性研究
赵岩1,闫福岭2
目的:探讨缺血性脑血管病患者脂蛋白a[Lp(a)]与颈动脉内膜增厚及斑块形成相关性。方法回顾性分析缺血性脑血管病患者临床资料,按颈动脉彩超结果,将患者分为内膜正常组,内膜增厚组及斑块形成组;同时测定患者血脂组分(LDL,HDL,TG,Lp(a))及其他血管性危险因素。结果:缺血性脑血管病患者Lp(a),LDL,TG水平高于常规体检者,HDL水平较之降低,差异有统计学意义(P<0.05);内膜增厚组及斑块形成组LDL,Lp(a),HDL水平高于内膜正常组,差异有统计学意义(P<0.05);斑块形成组LDL,TG水平高于内膜增厚组及内膜正常组,差异均有统计学意义(P<0.05);内膜增厚组与斑块形成组组间Lp(a),HDL水平比较,差异无统计学意义(P>0.05)。经多因素logistic回归分析,Lp(a)是颈动脉硬化的独立危险因素。结论:血脂不同组分在颈动脉内膜增厚及斑块形成的不同阶段可能发挥不同作用;LP(a)在增厚期作用相对更显著。
缺血性脑血管病; 颈动脉斑块; 脂蛋白(a);危险因素
为探讨缺血性脑血管病患者脂蛋白a[Lp(a)]与颈动脉内膜增厚及斑块形成相关性,本文回顾性分析了471例缺血性脑血管病患者临床资料,现报告如下。
1 资料与方法
1.1资料本资料471例均为我院2012年6月-2015年3月神经内科住院的缺血性脑血管病患者(患者组),符合以下标准:(1)急诊CT/MRI检查明确诊断为缺血性脑血管病,符合1995年全国第四届脑血管学术会议修订的诊断标准[1]。(2)意识清楚,签署知情同意书。排除标准:(1)治疗前急诊CT/MRI等检查发现有可疑脑出血,蛛网膜下腔出血,出血性梗死,肿瘤,动静脉畸形,心源性栓塞。(2)严重心肝肾功能不全。(3)有血液系统疾病。(4)既往有脑梗死后遗症,影响神经功能缺损评分者。(5)未服用影响血脂水平药物。(6)记录资料不全者。根据颈动脉超声检查结果将患者分成颈动脉正常组98例(IMT<1.0 mm)、颈动脉内膜增厚组211例(1.0 mm≤IMT<1.2mm)和斑块形成组162例(IMT≥1.2 mm,或比邻近部位厚0.5mm,或达邻近部位IMT值1.5倍,或充盈缺损处面积≥10 mm2)。体检组采用我院体检中心同期同年龄段数据。2组人群基本情况。见表1。
1.2方法血脂测定;患者于入院次日清晨7时左右抽取空腹静脉血5 ml,用OLYMPUS AU2700全自动生化仪进行血脂测定包括脂蛋白(a)[Lp(a)],甘油三酯(TG),高密度脂蛋自胆固醇(HDL-C),低密度脂蛋白胆固醇(LDL-C)等。颈动脉超声检查:采用ATL5000型彩色多普勒超声诊断,探头频率为5~12 Hz。检查方法:取平卧位,从颈动脉起始处开始,沿血管走向依次检测双侧颈总动脉,分叉处,颈外动脉及颈内动脉颅外段,测量所有部位内膜-中膜厚度(IMT)。
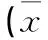
表1 2组人群血压及血液生化指标比较 ±s)

2 结果
2.1不同组别患者血脂水平比较缺血性脑血管病患者内膜增厚组及斑块形成组LDL,Lp(a)水平高于内膜正常组,HDL水平低于正常组,差异有统计学意义(P<0.05);内膜增厚组TG水平较内膜正常组差异无统计学意义(P>0.05);斑块形成组LDL,TG水平高于内膜增厚组及内膜正常组,差异均有统计学意义(P<0.05);内膜增厚组与斑块形成组组间Lp(a),HDL水平比较,差异无统计学意义(P>0.05)。见表2。

表2 不同组别患者血脂水平比较 ±s)
注:与内膜正常组比较,*P<0.05;与内膜增厚组比较,#P<0.05。
2.2各血脂组分之间及与颈动脉硬化相关性比较Lp(a)与颈动脉硬化程度成低度正相关,与LDL,TG成微弱相关,与HDL无显著相关性。见表3。
2.3各血脂组分多因素logistic回归分析以颈动脉硬化为因变量,以LP(a),LDL,HDL,TG四个因素为自变量,所有研究对象进入回归分析(复相关系数R=0.333,方差分析F=14.483,P<0.05)。结果显示,在排除其他血脂组分影响下,Lp(a)对颈动脉硬化的影响依然是存在的,是其独立的危险因素(偏回归系数β=0.359,P<0.05)。见表4。

表3 各血脂组分间及与颈动脉硬化相关性分析
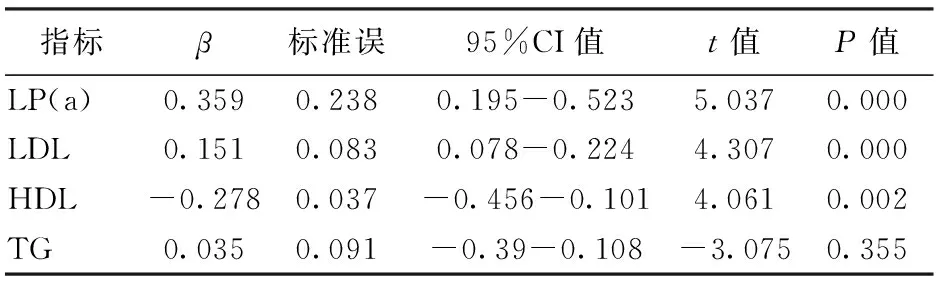
表4 影响颈动脉硬化的血脂成份logistic回归分析
3 讨论
缺血性脑血管病发病率及致残致死率均相对较高,是国内外研究的热点,颈动脉内膜病变的严重程度与缺血性脑血管疾病的发生密切相关[2]。近期大量的基础和临床研究均表明Lp(a)与AS的形成和发展密切相关,2009年ERQOU等在JAMA发表文章认为:脂蛋白(a)异常是动脉粥样硬化继发冠心病,中风等持续稳定的,独立的,有适中价值的指标[3]。在血脂组分中,LDL通常被认为是引起动脉粥状硬化(AS)的重要危险因素,其通过血管内皮进入内膜下层,被修饰成氧化型LDL(0X-LDL),巨噬细胞吞噬OX-LDL后形成泡沫细胞并不断增多融合,构成了AS的脂质核心[4]。但流行病学显示部分AS患者血清LDL-C并不升高,高水平LDL-C人群的AS发病率也有很大差异,这提示LDL-C在动脉内膜增厚及斑块形成的过程中不是单独作用,可能有其他因素参与。
1963年挪威科学家Berg首先发现Lp(a)。1975年Dalhen研究认为Lp(a)是AS的危险因子。1987年Mclean等研究发现Lp(a)中的Apo(a)与纤溶酶原(PLG)具有高度同源性,都有一个与纤维蛋白结合的kingle区,从而认为Lp(a)不仅是AS的危险因素,而且可能与纤溶系统有关。Lp(a)呈圆球形,是由与LDL类似的脂质核心和ApoB与独特的Apo(a)以S-S链的形式结合而成的大分子复合物,是一类独立的脂蛋白。Apo(a)是Lp(a)的特异性抗原,主要在肝脏合成,在很大程度上影响着脂蛋白(a)的代谢和理化性质[5]。人类Lp(a)呈高度偏态分布,个体差异可达1 000倍(0~1 000 mg/L),目前一般认为300 mg/L为临界水平,>300 mg/L为病理水平。但同一个体Lp(a)水平的变化则相对稳定。血清Lp(a)浓度受遗传基因控制[6],基本不受年龄、性别、饮食营养、药物及其他环境因素的影响。
Lp(a)的糖蛋白Apo(a)结构非常相似于PLG,可竞争性抑制PLG与纤维蛋白及纤维蛋白原结合,阻止组织型纤溶酶原激活物(t-PA)与纤维蛋白结合,干扰血栓栓子表面PLG的活化,抑制纤溶酶的形成,同时抑制依赖t-PA而形成的纤溶酶对纤维蛋白的降解过程,促进血栓形成。并可抑制PLG与单核巨噬细胞细胞和血小板的PLG受体的结合及其在内皮细胞表面的激活,增加PLG激活抑制物Ⅰ(PAI-Ⅰ)的分泌,阻止血栓溶解。血管舒张药物可使不完全闭塞的血管重新开放,但血管一旦开放,血浆Lp(a)就会进入血管壁并与破裂的斑块和血栓栓子结合,而Apo(a)的蛋白酶区域并无酶活性,故不能象PLG那样形成纤溶酶水解纤维蛋白,结果形成Lp(a)-纤维蛋白复合物沉积于动脉壁破坏纤溶作用,结果导致血管重新闭塞,因此高浓度Lp(a)的患者较低浓度Lp(a)患者更易形成闭塞性凝血块,导致血管堵塞,形成心脑血管血栓性疾病[7]。Sawabe等对1062例尸检分析显示:随脂蛋白a水平增高,严重冠状动脉狭窄发生率呈线性增长[8]。另外,国内张丽霞等人发现在体外无PLG实验中Lp(a)亦可以直接作用于血小板,激活PKC,诱导并加强其磷酸化反应,有利于发挥血小板的粘附、聚集、释放等生理功能,促进早期血小板血栓的形成[9]。
国内外亦开展了Lp(a)氧化修饰方面的工作。日本Ichikawa等研究表明,Lp(a)与LDL一样,在动脉壁的三种主要细胞(内皮细胞、平滑肌细胞和巨噬细胞)处发生氧化修饰,OX-Lp(a)通过清道夫受体及巨噬细胞的摄取和降解,导致细胞内胆固醇酯的蓄积和泡沫细胞的形成。Lp(a)氧化修饰后,与PLG受体位点的结合增强,更易干扰纤溶系统,参与了AS过程及栓塞的发生[10]。日本YAMADA等人从AS斑块中提取出氧化型脂蛋白(a),进一步证实Lp(a)在AS形成过程中的作用[11]。中南湘雅二院赵水平教授研究认为Ox-Lp(a)能诱导内皮细胞表达P选择素增强,支持Ox-Lp(a)比Ox-LDL可能具有更强的致动脉粥样硬化作用的观点[12]。TAKAMI等认为Lp(a)增强了细胞内黏附分子-1表达,促进白细胞特别是单核细胞对血管内皮的粘附性及向血管内皮的转移,在AS的早期和炎性心血管疾病两方面均起重要作用[13]。
高Lp(a)水平是缺血性脑血管病的独立危险因素,可一定程度预测其发病风险,支持了香港Woo等研究结论[14]。Lp(a)与LDL,TG成微弱相关,与HDL无显著相关性,与相关文献研究基本一致[15-16]。通过对颈动脉病变程度分级,我们发现颈动脉内膜病变组(包括增厚组及斑块形成组)其LDL,Lp(a)水平均高于内膜正常组,HDL水平低于正常组,差异有统计学意义(P<0.05);内膜增厚组TG水平较内膜正常组,差异无统计学意义(P>0.05);斑块形成组LDL,TG水平高于内膜增厚组及内膜正常组,差异有统计学意义(P<0.05);内膜增厚组与斑块形成组组间比较,Lp(a),HDL水平差异无统计学意义(P>0.05)。这提示我们:高Lp(a)水平及低HDL水平可能对颈动脉内膜的增厚有一定启动作用,TG的影响则在内膜斑块形成期参与进来。而在颈动脉内膜正常组,增厚组及斑块形成组组间对比中,LDL水平依次升高,提示其可能参与了颈动脉病变的全阶段。推测其不同阶段所受因素的影响,有利于诊疗的个体化干预。
[1]中华神经科学会中华神经外科学会.各类脑血管疾病诊断要点[J].中华神经科杂志,1996,29(6):379-380.
[2]O′LEARY DH,POLKA JF,KRONMAI RA,et al.Carotid-Artery Intina and media thickness as a risk factor for myocardial infarction and stroke in older adults,Cardiovascular Health Study Collaborative Research Group[J].N Engl J Med,1999,340(1):14-22.
[3]ERQOU S,KAPTOGE S,PERRY PL,et a1.Lipoprotein(a) concentration and the risk of coronary heart disease,stroke,and nonvascular mortality[J].JAMA,2009,302(4):412-423.
[4]LIBBY P.Changing Concepts of Atherogenesis[J].J Intern Med,2000,247(3):349-358.
[5]ZLATOHLAVEK L,ZIDKOVA K,VRABLIK M,et a1.Lipoprotein(a) and its position among other risk factors of atherosderosis[J].Physiol Res,2008,57(5):777-783.
[6]BOERWINKLE E,LEFFERT CC,LIN J,et al.Apolipoprotein(a) gene accounts for greater than 90% of the variation in plasma lipoprotein(a) concentrations[J].J Clin Invest,1992,90(1):52-60.
[7]SCANU AM,EDELSTEIN C.Kringle-Dependent Structual and Functional Polymorphism of Apolipoprotein(a)[J].Acta Biochimica et Biophysica Sinica,1995,1256(1):1-12.
[8]SAWABE M,TANAKA N.NAKAHARA K,et al.High lipoprotein(a) level promotes both coronary atherosclerosis and myocardial infarction: a path analysis using a large number of autopsy cases[J].Heart,2009,95(24):1997-2002.
[9]张丽霞,孙艳虹,孙勤敏,等.血小板血栓形成过程中脂蛋白(a)作用的实验研究[J].中华检验医学杂志,2001,24(1):8-11.
[10]ICHIKAWA T,UNOKI H,SHIMOYAMADA H,et al.Lipoprotein(a) promotes smooth muscle cell proliferation and dedifferention in atherosclrotic lesions of human apo(a) transgenic rabbits[J].Am J Pathol,2002,160(3):227-236.
[11]YAMADA S,MORISHITA R,NAKAMURA S,et al.Development of antibody against epitope of Lipoprotein(a) modified by oxidation:evaluation of new enzyme-linked immumosorbent assay for oxidized Lipoprotein(a)[J].Circulation,2000,102(14):1639-1644.
[12]ZHAO SP,XU DY.Oxidized lp(a) enchanced the expression of psemection in cultured human umbilical cells[J].Thromb Res,2000,100(6):501-510.
[13]TAKAMI S,YAMASHITA S.Lipoprotein(a) Enhances the Expression of Intercellular Adhesion Molecule-1 in Cultured Human Umbilical Vein Endothelial Cells[J].Circulation,1998,97(8):721-728.
[14]WOO J,LAU E,LAM CKW,et al.Hypertension,lpoprotein(a) and apolipoproternA-I as risk factors for stroke in the Chinese[J].Stroke,1991,22(2):203-208.
[15]谢旭芳,王卫珍,冯莉莉,等.血清脂蛋白(a)和颈动脉粥样硬化与脑梗死的相关分析[J].中华脑血管病杂志,2010,8(4):262-266.
[16]郝洪军,金海强,刘冉,等.急性缺血性脑血管病患者TXB2,6-keto-PGF1α,oxLDL和Lp(a)水平分析[J].临床检验杂志,2015,33(1):29-32.
Correlation between lipoprotein(a) and carotid intimal thickening and plaque formation in patients with ischemic cerebrovascular disease
ZHAOYan,YANFu-ling.
(SoutheastUniversityMedicalCollege,Nanjing,Jiangsu211500,China)
Objective:To explore the correlation between lipoprotein(a) and carotid intimal thickening and plaque formation in patients with ischemic cerebrovascular disease.Methods:Clinical data of patients with ischemic cerebrovascular disease were collected and analyzed retrospectively.According to color Doppler ultrasound examination results,the patients were divided into a normal group,an intimal thickening group and a plaque formation group.LDL,HDL,TG,Lp(a) and other vascular risk factors were tested in the patients.Results:Lp (a),LDL,and TG levels in the patients with ischemic cerebrovascular disease were higher than those in the healthy subjects,and the HDL level was lower.LDL,Lp(a),and HDL levels were higher in the carotid intimal thickening and plaque formation groups than in the normal group.LDL and TG levels in the plaque formation group were higher than those in the intimal thickening and normal groups.The difference was statistically significant.Lp(a) and HDL levels were different between the carotid intimal thickening and plaque formation groups,but there was no significant difference.LP(a) was an independent risk factor for carotid atherosclerosis by logistic regression analysis.Conclusion:Different components of lipids may play a different role in different stages of carotid intimal thickening and plaque formation.Lp(a) is more significant in the early stage.
Ischemic cerebrovascular diseases; Carotid artery plaque; lipoprotein (a); Risk factors
单位] 1.东南大学医学院;2.东南大学附属中大医院 神经内科,江苏 南京 211500
[作者简介] 赵岩(1981-),男,主治医师,在读研究生。
闫福岭,男,主任医师,E-mail:yanfuling218@163.com
10.14126/j.cnki.1008-7044.2016.05.008
R 743.31
A
1008-7044(2016)05-0520-04
2016-03-21)
