基于光热效应的沙门氏菌试纸条检测方法研究
2016-09-18邴欣刘静静高卢翔张震刘兆臣贾敏山东省产品质量检验研究院山东济南500山东师范大学生命科学学院山东济南5004
邴欣,刘静静,高卢翔,张震,刘兆臣,贾敏,*(.山东省产品质量检验研究院,山东济南500;.山东师范大学生命科学学院,山东济南5004)
基于光热效应的沙门氏菌试纸条检测方法研究
邴欣1,刘静静2,高卢翔2,张震2,刘兆臣2,贾敏2,*
(1.山东省产品质量检验研究院,山东济南250012;2.山东师范大学生命科学学院,山东济南250014)
建立一种基于氧化石墨烯-金复合物的光热效应沙门氏菌渗滤试纸条的检测方法。制备了石墨烯-金纳米复合物,并将其与抗体偶联,在传统渗滤试纸条方法的基础上,优化了渗滤试纸条的各项试验条件以及激光照射时长。采用目测法及光热效应温差法检测沙门氏菌的最低检测限分别为2.4×104CFU/mL及2.4×103CFU/mL。绘制了石墨烯-金纳米复合物光热效应渗滤试纸条方法检测沙门氏菌的标准曲线,并得到线性回归方程:y=0.754x-2.09,R2=0.971。
试纸条;石墨烯纳米复合物;光热效应;沙门氏菌
沙门氏菌是引起食物中毒的食源性致病菌之一,由沙门氏菌引起的食物中毒在各国的细菌性食物中毒中位居首位[1],在我国细菌性食物中毒病例中,沙门氏菌引起的食物中毒病例约占40%[2]。沙门氏菌是我国众多食品标准中的检测项目,且要求不得检出[3-5]。
传统沙门氏菌检测方法需经增菌、分离培养、生化反应和血清学鉴定等繁琐检验程序,需4 d~7d才能得到明确诊断结果,耗时费力[6]。分子生物学检测方法需要精密仪器及昂贵试剂,不适宜大范围推广使用[7]。沙门氏菌免疫学检测方法有酶联免疫吸附测定法(ELISA)、荧光免疫分析法(FIA)、免疫磁性分离法(IMS)等,但ELISA法检测结果易出现假阳性,FIA法灵敏度低且成本较高,IMS法灵敏度低[8]。因此,价格低廉、操作简单、检测快速的沙门氏菌检测方法的研究迫在眉睫。
近年来,免疫胶体金试纸条因其简便、快速、灵敏度高等优点得到广泛的应用,但此类检测方法通常采用目测或者读卡器区分颜色深浅来判断检测结果[9-11],其灵敏度与其他分子检测方法仍然偏低,且无法实现准确的定量检测。因此如何提高试纸条检测方法的灵敏度,实现定量或半定量检测已成为试纸条检测方法的主要发展方向。近年来,研究者从诸多方面致力于提高试纸条检测方法的灵敏度,例如将其与荧光技术[12-13]、电化学技术[14-15]相结合来实现精确的定量检测。
Qin等[16]利用纳米金(AuNPs)的光热效应显著提高了层析式试纸条的检测灵敏度,AuNPs与待测物偶联后用激光照射,AuNPs可产生热量并引起温度变化,且AuNPs的温度变化与待测物浓度成线性关系,待测物浓度可通过标准曲线计算得到。已有文献报道通过AuNPs与氧化石墨烯(GO)的偶联可增强光热效应的转化[17]。本研究用氧化石墨烯-纳米金复合物替代传统免疫胶体金试纸条上的纳米金,并利用氧化石墨烯-纳米金复合物的光热效应来进行沙门氏菌的检测以提高灵敏度。
1 材料与方法
1.1材料与试剂
LB培养基、牛肉膏蛋白胨培养基:北京奥博星生物技术有限公司;氯金酸:国药集团化学试剂有限公司;碳酸钾(K2CO3)、柠檬酸三钠、甲醇、吐温20:天津市华特化研科技有限公司;牛血清白蛋白(BSA):Sigma,Roche738328;氧化石墨烯:南京先丰纳米材料科技有限公司;PBS:赛默飞世尔生物化学制品(北京)有限公司;抗鼠伤寒沙门氏菌抗体:博奥森生物有限公司;鼠伤寒沙门氏菌(ATCC14028):中国医学菌种保藏中心。
1.2仪器与设备
MOV-112电热鼓风恒温干燥箱:三洋电机国际贸易有限公司;HZQ-X100摇床培养箱:哈尔滨市东联电子技术开发有限公司;IRS红外热像仪:上海热像机电科技股份有限公司;OX-R301-1近红外灯:OXLASERS。
1.3方法
1.3.1石墨烯-金纳米复合物的制备与电镜表征
采用柠檬酸钠还原法[18]制备胶体金:取1 mL 0.1%的氯金酸(HAuCl4)水溶液,用双蒸水稀释定容至100mL后转移到250 mL圆底烧瓶中。将圆底烧瓶置于电热套上加热直至溶液沸腾。保持煮沸1 min后,剧烈搅拌下一次性迅速加入3.5 mL 1%的柠檬酸三钠,持续搅拌,溶液由最初的浅黄色逐渐变为黑色再变为蓝色最后变为红色,待颜色保持不变后继续煮沸并搅拌10min~15 min,关闭电热套停止加热,使溶液自然冷却,所得溶液即为胶体金溶液,4℃冰箱储存待用。
在制备胶体金溶液的基础上,对比并结合多项研究[19-20],最终采用如下方法合成石墨烯-金纳米复合物:当胶体金溶液在持续的搅拌下变为红褐色时,一次性迅速加入3.5 mL的氧化石墨烯溶液,继续搅拌至溶液颜色保持不变后,继续煮沸并搅拌10 min~15 min,停止加热,使溶液自然冷却。8 000 r/min离心10 min除去多余的石墨烯,沉淀物用双蒸水复溶即得石墨烯-金纳米复合物。
将制备好的石墨烯-金纳米复合物进行电镜扫描,在电镜下观察胶体金颗粒的形态及其在石墨烯表面的分布情况,验证复合物是否合成成功。
1.3.2石墨烯-金纳米复合物标记抗沙门氏菌抗体的制备
0.1 mol/L K2CO3调节石墨烯-金纳米复合物pH至9.0,取1 mL石墨烯-金纳米复合物置于2 mL的EP管中,加入1 mL 0.6 μg/mL的沙门氏菌抗体,室温振摇反应4 h~8 h,4℃过夜保存。将上述石墨烯-金-抗沙门氏菌抗体复合物分装到EP管中,4℃10 000 r/min离心30 min,弃上清,二次水复溶沉淀,即得石墨烯-金-抗沙门氏菌抗体复合物。
1.3.3沙门氏菌的培养及样品前处理
1.3.3.1沙门氏菌的培养
鼠伤寒沙门氏菌ATCC 14028置于LB液体培养基中,37℃摇床培养,待细菌生长至对数生长期(OD600=0.3)时收集待用。
1.3.3.2沙门氏菌的前处理
沙门氏菌ATCC 14028在使用之前需要处理,以去除多余的培养基及细菌代谢物对试验结果的干扰。待细菌生长至对数生长期时,收集一定量的菌液,4℃,3 000 r/min离心5 min,弃上清,二次水复溶后再离心。重复上述离心操作,弃上清,0.01 mol/L PBS缓冲液将离心沉淀溶解后待用。
1.3.4包被液的优化
将1 μg抗鼠伤寒沙门氏菌的抗体分别溶于含有0%、2%、4%、6%、8%、10%甲醇的0.01 mol/LPBS溶液,滴加到Whatman AE 99硝酸纤维素膜上的加样区内,37℃干燥箱中包被1 h。滴加10 μL 3%的BSA封闭液于37℃干燥箱中封闭30 min。然后用0.4%PBST冲洗液冲洗1 min,晾干后滴加10 μL石墨烯-胶体金-抗体复合物,渗入后于0.4%PBST溶液中冲洗1 min,晾干后观察背景颜色较低的为最佳包被液。
1.3.5封闭液的优化
1.3.5.1封闭液中BSA浓度的优化
将1 μg抗鼠伤寒沙门氏菌抗体用甲醇含量为6%的包被液包被,滴加到Whatman AE 99硝酸纤维素膜上的加样区内,于37℃干燥箱中包被1 h。然后分别滴加10 μL 0%、1%、2%、3%、4%、5%封闭液于37℃干燥箱中封闭30 min,于0.4%PBST冲洗液中冲洗1 min。晾干后滴加10 μL石墨烯-胶体金-抗体复合物,渗入后于0.4%PBST冲洗液中冲洗1 min,晾干后观察背景较低的为封闭液中最佳BSA浓度。
通过设置微课程上传至教学平台,教师课上可将重点微课程加入教学中,学生课下根据自身情况反复观看微课,便于课前预习、课后复习[2][3]。
1.3.5.2封闭液中Tween-20的优化
将1 μg抗鼠伤寒沙门氏菌的抗体用甲醇含量为6%的包被液包被,滴加到Whatman AE 99硝酸纤维素膜上的加样区内,37℃干燥箱中包被1 h。滴加10 μL含有0%、0.2%、0.4%、0.6%、0.8%、1.0%Tween-20的封闭液于37℃干燥箱中封闭30 min,于0.4%PBST冲洗液中冲洗1 min。晾干后滴加10 μL石墨烯-胶体金-抗体复合物,渗入后于0.4%PBST冲洗液中冲洗1 min,晾干后观察背景较低的为封闭液中最佳Tween-20的量。
1.3.6冲洗液优化
将1 μg抗鼠伤寒沙门氏菌抗体用甲醇含量为6%的包被液包被,包被结束后滴加10 μL 4%BSA+0.6% Tween-20的封闭液于37℃干燥箱中封闭30 min,于0.4%PBST冲洗液中冲洗1 min。晾干后滴加10 μL石墨烯-胶体金-抗体复合物,渗入后,分别用含有0%、0.2%、0.4%、0.6%、0.8%、1.0%Tween-20的冲洗液冲洗1 min,晾干后观察背景较低的为最佳冲洗液。
1.3.7照射时长的优化
制作完成石墨烯-胶体金-抗体复合物试纸条后,用甲醇含量为6%的包被液将1 μg抗鼠伤寒沙门氏菌的抗体包被到Whatman AE 99硝酸纤维素膜上的加样区内,37℃包被1 h,滴加10 μL 4%BSA+0.6% Tween-20的封闭液于37℃干燥箱内封闭30 min,于最佳冲洗液中冲洗1 min,晾干后分别滴加10 μL石墨烯-胶体金-抗体复合物与相同数量的鼠伤寒沙门氏菌沉淀的混合物,渗入后,于0.4%Tween-20冲液洗中冲洗1 min,晾干后,808 nm红外光照射加样区1 min,热像仪测量并记录加样区不同时间点(0、10、20、30、40、50、60 s)的温度并计算温差,观察温差情况选择最佳的照射时长。
1.3.8石墨烯-胶体金复合物光热效应渗滤试纸条的灵敏度测试
用甲醇含量为6%的包被液将1 μg抗鼠伤寒沙门氏菌的抗体滴加到Whatman AE 99硝酸纤维素膜上的加样区内,37℃包被1 h,滴加10 μL 4%BSA+0.6% Tween-20的封闭液于37℃干燥箱内封闭30 min,于0.4%Tween-20冲液洗中冲洗1 min,晾干后,分别加入10 μL石墨烯-胶体金-抗体复合物与不同细菌数鼠伤寒沙门氏菌沉淀的混合物,渗入后,于0.4%Tween-20冲洗液中冲洗1 min,晾干后,808 nm红外光照射加样区最优时长,热像仪测量并记录加样区的温度并计算温差。多次试验确定最低检测限,绘制标准曲线。
2 结果与分析
2.1石墨烯—金纳米复合物的制备与电镜表征石墨烯—金纳米复合物的电镜表征见图1。

图1 石墨烯-金纳米复合物透射电镜图片Fig.1 The TEM image of GO-Au nanocomposite
综合试验条件、制备的难易程度及所需时间、制备的复合物的稳定性等多方面因素,本试验将目前多种石墨烯-金纳米复合物制备法的优点进行融合,得到了如下所述的制备方法。首先利用柠檬酸三钠还原法制备胶体金,在此基础上加入氧化石墨烯溶液并通过加热进行原位还原。该方法用时短,制备的石墨烯-金纳米复合物稳定性高。利用透射电镜(TEM)对制备的石墨烯-金纳米复合物进行表征,电镜结果显示,本研究所制备的复合物,金颗粒呈现球形,平均粒径约20 nm且大小均一,较好地结合在石墨烯片层上,证明本试验所用方法可应用于合成石墨烯-金纳米复合物。
2.2最佳包被液的选择
包被液通过静电力可以将抗体牢固的包被到Whatman AE 99硝酸纤维素膜上,本试验探究了0.01 mol/L的PBS缓冲液中不同甲醇含量对抗体固定的影响,结果见图2。如图2所示,结果表明:甲醇含量为6%时背景明显比不加甲醇及其它浓度甲醇的背景颜色浅。由于背景颜色深浅直接影响试纸条的升温情况,因此选择甲醇含量为6%的PBS缓冲液。

图2 不同包被液对渗滤试纸条方法的影响Fig.2 Dot immune-graphene-gold filtration assay with different coating buffers
2.3最佳封闭液的选择
2.3.1封闭液中BSA浓度的选择
封闭液可以占据Whatman AE 99硝酸纤维素膜上的非特异性位点,降低非特异性结合,增强信噪比,常见的封闭液主要有BSA和脱脂牛奶两种,脱脂牛奶相对BSA成分复杂,因此本试验选择BSA作为封闭液,结果见图3。如图3所示,BSA含量为4%时背景明显较其它BSA含量的背景颜色浅,因此本试验选择BSA含量为4%的封闭液。

图3 封闭液中不同BSA含量对渗滤试纸条方法的影响Fig.5 Dot immune-graphene-gold filtration assay with different concentration BSA blocking buffers
2.3.2封闭液中Tween-20的选择
Tween-20有复性抗原的作用,可提高特异性的识别能力,因此本试验优化了封闭液中Tween-20的量,结果见图4。如图4所示,结果表明:Tween-20含量为0.6%时背景较低。因为背景颜色深浅直接影响试纸条的升温情况,因此本试验选择添加0.6%Tween-20的封闭液。

图4 添加不同Tween-20的封闭液对渗滤试纸条方法的影响Fig.4 Dot immune-graphene-gold filtration assay with different concentration Tween-20 blocking buffers
2.4最佳冲洗液的选择
过量的封闭液除结合非特异性位点外还有可能结合特异性位点,过量的待检测鼠伤寒沙门氏菌及未结合的石墨烯-胶体金-抗体复合物也会对渗滤试纸条的灵敏度产生影响,Tween-20为表面活性剂,可以减少背景和非特异性条带,故优化冲洗液中Tween-20的量。本试验用0.01 mol/L PBS添加Tween-20作为冲洗液结果见图5。如图5所示,结果表明:Tween-20含量为0.4%时背景较低,因此选用0.01 mol/L PBS+ 0.4%Tween-20作为冲洗液。

图5 不同冲洗液对渗滤试纸条方法的影响Fig.7 Dot immune-graphene-gold filtration assay with different washing buffers
2.5最佳照射时长的选择
石墨烯-胶体金复合物在808 nm红外光照射下产热产生温差,适宜的照射时长可以节约试验时间同时提高测试稳定性。试验结果如图6所示。结果表明:随着照射时间的增加,温差不断增加,但10 s之后增加趋势不明显,为节约试验时间并减小试验误差,本试验选择20 s为最佳照射时间。
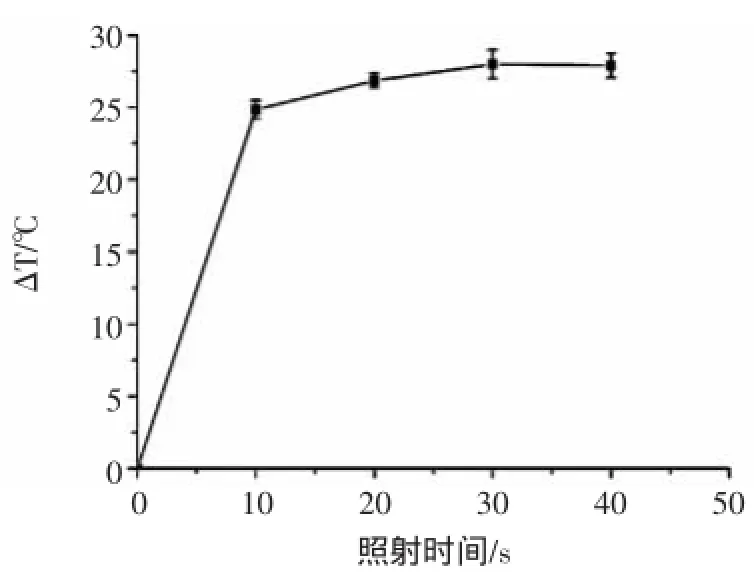
图6 照射时长的优化Fig.6 Optimization of the irradiation time
2.6石墨烯-胶体金复合物光热效应渗滤试纸条灵敏度测试
光热效应渗滤试纸条方法在传统渗滤试纸条方法定性检测的基础上根据石墨烯-胶体金的良好热效应建立,通过808 nm红外光照射加样区得出温差定量测定鼠伤寒沙门氏菌。激光照射前对照组的温度为T01,808 nm激光照射20 s后热像仪测得的温度为T02,滴加沙门氏菌的试验组激光照射前的温度为T1,808 nm激光照射20 s后热像仪测得的温度为T2,温差ΔT=T2-T1-(T02-T01)。
以鼠伤寒沙门氏菌的个数(CFU/mL)为横坐标,温差(ΔT)为纵坐标绘制标准曲线,得出鼠伤寒沙门氏菌的个数与温差的线性关系。结果如图7所示。结果表明:随着鼠伤寒沙门氏菌的个数的增加,温差不断增加。该试验所得标准曲线线性公式为:y=0.754x-2.09,R2=0.971,说明鼠伤寒沙门氏菌的个数与温差呈良好的线性相关。当信噪比=3∶1时,鼠伤寒沙门氏菌的个数为2 400 CFU/mL,鼠伤寒沙门氏菌的最低检测限为2 400 CFU/mL。
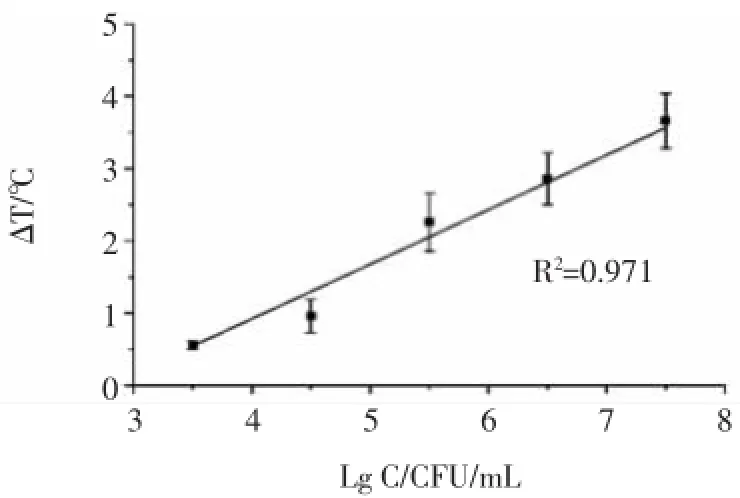
图7 沙门氏菌数目与温差的线性标准曲线Fig.7 The linear relation of the number of Salmonella and ΔT
3 结论
本研究利用柠檬酸三钠还原制备胶体金,在此基础上加入氧化石墨烯溶液,通过加热法进行原位还原,确定了石墨烯-金纳米复合物的制备方法与条件。利用该方法制备的石墨烯-金纳米复合物对抗沙门氏菌抗体进行标记,制备了石墨烯-金-抗沙门氏菌抗体复合物。采用双抗夹心法,建立了检测沙门氏菌的基于石墨烯-金纳米复合物光热效应的渗滤试纸条方法。该渗滤试纸条方法采用目测法检测沙门氏菌时,在沙门氏菌数目为2.4×104CFU/mL时出现可与空白区分开的红斑,而采用温差法检测时,可以将检测限降低到2.4×103CFU/mL。相比基于胶体金光热效应的渗滤试纸条方法,该方法对沙门氏菌检测的灵敏度提高了10倍。本研究通过大量试验数据计算绘制出沙门氏菌数目与温度差的标准曲线,得到线性回归方程:y=0.754x-2.09,R2=0.971。试验结果证明,基于光热效应的渗滤试纸条方法较传统渗滤试纸条方法灵敏度更高,该方法可应用于鼠伤寒沙门氏菌的检测。
[1]王毳,闫磊,曾庆祝.沙门氏菌的检测技术与方法[J].现代食品科技,2007,23(5):82-85
[2] Yang B,Qu D,Zhang X,et al.Prevalence and characterization of Salmonella serovars in retail meats of marketplace in Shaanxi,China [J].International journal of food microbiology,2010,141(1):63-72
[3]中华人民共和国卫生部,中国国家标准化管理委员会.GB 2726—2005熟肉制品卫生标准[S].北京:中国标准出版社,2005
[4]中华人民共和国卫生部,中国国家标准化管理委员会.GB 7099—2003糕点、面包卫生标准[S].北京:中国标准出版社,2003
[5]中华人民共和国卫生部,中国国家标准化管理委员会.GB 9678.1—2003糖果卫生标准[S].北京:中国标准出版社,2003
[6]孙园园,赵鹏,刘骏,等.沙门氏菌检测方法研究进展[J].中国畜牧兽医,2011,38(1):218-221
[7]李小玲,刘斌,但现龙,等.沙门氏菌内标PCR快速检测试剂盒的研制与应用[J].中国农业科学,2011,44(16):3395-3402
[8]刘喆,张书萧,王少辉,等.沙门氏菌的检测技术进展[J].中国动物传染病学报,2012,20(2):81-86
[9]Liu C,Jia Q,Yang C,et al.Lateral flow immunochromatographic assay for sensitive pesticide detection by using Fe3O4nanoparticle aggregates as color reagents[J].Anal Chem,2011,83(17):6778-6784
[10]Kim Y A,Lee E H,Kim K O,et al.Competitive immunochromatographic assay for the detection of the organophosphorus pesticide chlorpyrifos[J].Anal chimacta,2011,693(1):106-113
[11]Zhou Y,Pan F G,Li Y S,et al.Colloidal gold probe-based immunochromatographic assay for the rapid detection of brevetoxins in fishery product samples[J].BiosensBioelectron,2009,24(8):2744-2747
[12]Xu W,Chen X,Huang X,et al.Ru(phen)3 2+doped silica nanoparticle based immunochromatographic strip for rapid quantitative detection of β-agonist residues in swine urine[J].Talanta,2013,114:160-166
[13]Li Z,Wang Y,Wang J,et al.Rapid and sensitive detection of protein biomarker using a portable fluorescence biosensor based on quantum dots and a lateral flow test strip[J].Anal Chem,2010,82(16):7008-7014
[14]Wang L,Lu D,Wang J,et al.A novel immunochromatographic electrochemical biosensor for highly sensitive and selective detection of trichloropyridinol,a biomarker of exposure to chlorpyrifos[J]. BiosensBioelectron,2011,26(6):2835-2840
[15]Nian H,Wang J,Wu H,et al.Electrochemical immunoassay of cotinine in serum based on nanoparticle probe and immunochromatographic strip[J].Anal ChimActa,2012,713:50-55
[16]Qin Z,Chan W C W,Boulware D R,et al.Significantly improved analytical sensitivity of lateral flow immunoassays by using thermal contrast[J].AngewChemInt Ed,2012,124(18):4434-4437
[17]Zedan A F,Moussa S,Terner J,et al.Ultrasmall gold nanoparticles anchored to graphene and enhanced photothermal effects by laser irradiation of gold nanostructures in graphene oxide solutions[J].ACS nano,2012,7(1):627-636
[18]Frens G.Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions[J].Nature,1972(241):20-22
[19]冯晓苗,闫真真.石墨烯-金纳米复合材料:水热合成及在生物传感器中的应用[J].无机化学学报,2013,29(5):1051-1056
[20]Hu J,Li F,Wang K,et al.One-step synthesis of graphene-AuNPs by HMTA and the electrocatalytical application for O2and H2O2[J].Talanta,2012,93:345-349
A Paper-based Detection Method of Salmonella Using the Photo-thermal Effect
BING Xin1,LIU Jing-jing2,GAO Lu-xiang2,ZHANG Zhen2,LIU Zhao-chen2,JIA Min2,*
(1.Shandong Product Quality Inspection Research Institute,Jinan 250012,Shandong,China;2.College of Life Science,Shandong Normal University,Jinan 250014,Shandong,China)
A novel paper-based dot immune-graphene-gold filtration assay for the detection of Salmonella was developed based on the photothermal effect of graphene oxide(GO)-Au nanocomposite.First of all,the GO-Au nanocomposite and anti-Salmonella antibody modified GO-Au nanocomposite were synthesized.Based on the traditional strip test method,experimental conditions such as the buffer solutions and the irradiation time were optimized.The limit of naked eye detection was as low as 2.4×104CFU/mL and could be increased to 2.4×103CFU/mL by the use of temperature contrast.The standard curve of dot immune-graphene-gold filtration assay for detecting Salmonella was established,and the linear regression equation:y=0.754x-2.09,R2=0.971.
strip;graphene nanocomposites;photo-thermal effect;Salmonella
2016-05-06
国家质量监督检验检疫总局科技计划项目(2014QK122)作者简介:邴欣(1977—),男(汉),高级工程师,博士,研究方向:产品质量安全。
