超声波辅助酶法优选花生芽中白藜芦醇提取工艺
2016-09-15谭属琼谢勇武
谭属琼,谢勇武
(福建师范大学 闽南科技学院,福建 泉州 362332)
超声波辅助酶法优选花生芽中白藜芦醇提取工艺
谭属琼,谢勇武
(福建师范大学 闽南科技学院,福建 泉州362332)
以花生芽为原料,采用纤维素酶-超声波复合处理从花生芽中提取白藜芦醇,结合单因素试验研究了酶的酶解温度、酶添加量、pH值、酶解时间和超声波对样品的处理温度、处理时间、乙醇浓度(体积分数)、料液比等8个因素对花生芽中白藜芦醇提取量的影响,并且通过正交试验确定最佳提取工艺。结果表明:花生芽中白藜芦醇最优提取工艺为花生芽粉为1.000g,酶解温度为60℃,酶添加量为0.2g,pH值为4.8,酶解时间为2.0h,超声波处理温度为60℃,乙醇浓度为70%,料液比为1∶40,超声波处理时间为50min,在此条件下花生芽中白藜芦醇的最大提取量为7.39mg/g,比传统的乙醇回流法提高了大约4.6倍。
花生芽;白藜芦醇;纤维素酶酶解;超声波处理
0 引言
花生种子发芽后可以作为芽菜食用,称为花生芽,又称长寿芽。花生芽里的白藜芦醇含量比花生的各个部位所含有量都多,花生发芽后,其蛋白质已分解为氨基酸,由于其脂肪含量低,维生素含量则全面提高,各种营养成分更易被人体吸收[1]。花生芽较好生长,大概1~2周就可以长到10cm左右,芽菜是我国2000年前就已流行的一种保健蔬菜,具有营养丰富等特点;芽菜中还含有较多的维生素B1和B2,矿质元素,特别是磷,在芽苗菜中也较丰富,而且种子中富含磷,在萌芽及芽苗生长时,其以无机态转移到芽苗当中,便于人体吸收、消化[2]。
白藜芦醇俗称芪三酚,化学名称为3,4,5-三羟基二苯乙烯(3,4,5-trihy-drolystilbence),化学式为C14H12O3,分子量228.25,是含芪类结构的二苯乙烯芪类、非黄酮类多酚物质[3]。于1924年首次发现,主要存在于葡萄、虎杖、花生、桑椹、松树、买麻藤等12科、31个属72种植物中[4],白藜芦醇是生物或非生物对植物本身刺激(如阳光照射)所产生的一种植物抗毒素,研究表明,白藜芦醇对乳腺癌[5,6]、结肠癌[7]等多种肿瘤细胞均有显著抑制作用,还具有抗炎,抗氧化[8]等多种对人体有好处的生理功能,国外已有白藜芦醇相关的保健品上市,有胶囊、片剂和口服液等类型[9],近几年,白藜芦醇被国内外广泛的提取出来并应用到各个领域[10],因此对其提取研究有着重要意义。研究以福建龙岩花生仁为原料,花生仁中营养丰富,花生芽中白藜芦醇含量很多,因此使用超声波辅助酶法优选提取白藜芦醇,为样品前萃取提供一种经济可靠实用的提取方法,且进一步拓展超声波辅助酶法的具体应用范围。
1 材料与方法
1.1材料
原料:花生,购于龙岩,新鲜,市售;纤维素酶,购于上海源叶生物科技有限公司。
主要试剂:白藜芦醇标准样品,上海源叶生物科技有限公司;盐酸、无水乙醇、甲醇均为分析纯,甲醇含量≥99.9%,乙醇含量≥99.7%。
1.2试验方法
1.2.1主要工艺流程
1)纤维素酶酶解:花生→发芽(发芽机,50h可长10~15cm,每天换水)→洗净→沥干→烘干(50℃烘24h)→粉碎→过筛(过40目筛,贮于干燥器中备用)→纤维素酶酶解提取→减压过滤→乙醇定容→测定吸光度值→分析计算;
2)超声波处理:花生→发芽→洗净→沥干→烘干(50℃烘24h)→粉碎→过筛(过40目筛,贮于干燥器中备用)→超声波提取→减压过滤→乙醇定容→测定吸光度值→分析计算;
3)酶解-超声波复合强化处理:花生→发芽→洗净→沥干→烘干(50℃烘24h)→粉碎→过筛(过40目筛,贮于干燥器中备用)→纤维素酶酶解提取→超声波提取→减压过滤→乙醇定容→测定吸光度值→分析计算。
1.2.2白藜芦醇含量计算
准确将抽滤后的样品转移到50mL容量瓶中,用乙醇稀释到刻度线,摇匀,作为样品液,于306nm处测定吸光度,由回归线性方程得出白藜芦醇含量及提取量[11]。根据以下公式计算白藜芦醇的提取量:
白藜芦醇提取量(mg/g)=(C×V)÷M×1 000
称取粉碎过筛的花生芽粉,记为M,单位为g;试验后提取液稀释后的体积,记为V,单位为mL;根据方程得出的白藜芦醇的质量浓度,记为C,单位为g/mL。
2 结果与分析
2.1白藜芦醇标准曲线的绘制
精确称取白藜芦醇标准品5.0mg,用甲醇稀释于50mL容量瓶中,摇匀,所得浓度为0.10mg/mL的标准品溶液。分别吸取对照液1、2、3、4、5、6、7mL,分别置于25mL容量瓶中,用甲醇定容后,然后分别测其在306nm处的吸光值,平行测定3次,求平均值,绘制标准曲线,即A=0.145C+0.011 4,R2=0.999 9。
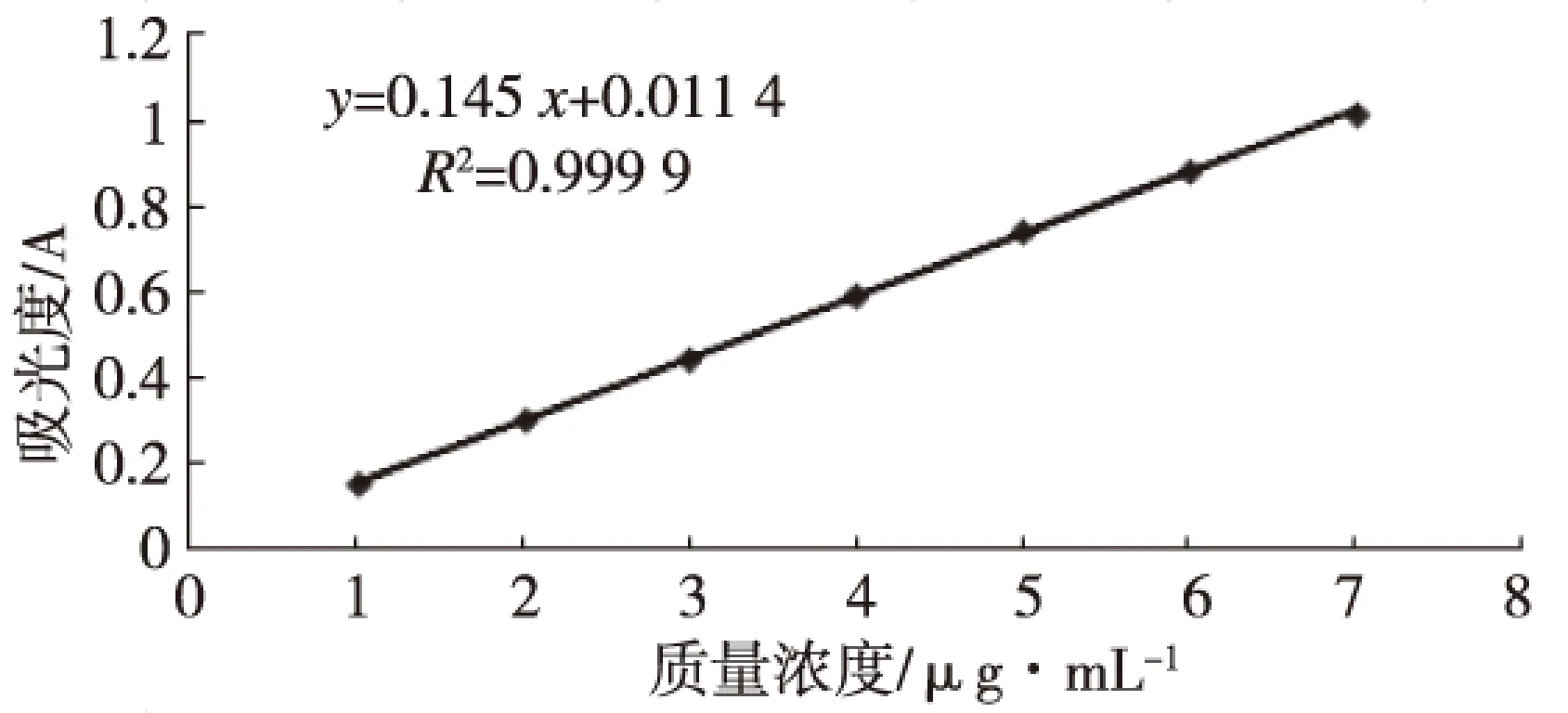
图1 白藜芦醇含量的标准曲线Fig.1 Standard curve of resveratrol content
2.2纤维素酶酶解试验结果分析
2.2.1不同酶解温度对花生芽中白藜芦醇提取量的影响
准确称取1.000g花生芽粉5份,酶的添加量为0.1g、在料液比1∶20(g/mL)、加入60%乙醇,酶解pH5.0(用0.1moL/L盐酸溶液调pH值)、酶解时间2.0h的条件下,分别对30℃、40℃、50℃、60℃、70℃酶解温度进行提取,并测其吸光度根据回归线性方程并计算提取量,其结果见图2A。

图2 不同酶解温度(A)、酶添加量(B)、pH值(C)和酶解时间(D)对花生芽中白藜芦醇提取量的影响Fig.2 The effect of reaction temperature (A), add the amount (B), pH (C) and enzymolysis time (D) on extraction of resveratrol in the peanut bud
由图2A可知,在酶解过程中,随着酶解的温度不断升高,白藜芦醇提取量先升高后降低,在50℃时,白藜芦醇的含量最高,可达到2.20mg/g。在酶解反应中,反应速度因温度的变化而变化的同时,同时也因为温度高于酶的最佳温度而使酶的活性丧失和改变酶的稳定性,当温度达到60~70℃,会因为温度过高而使酶的活性部分丧失,影响酶与原料的反应,从而导致提取量降低。因此,提取白藜芦醇的酶解温度以50℃左右为宜。
2.2.2不同酶添加量对花生芽中白藜芦醇提取量的影响
准确称取1.000g花生芽粉5份,在料液比1∶20(g/mL)、加入60%乙醇,调节pH值为5.0的条件下,在酶解时间2.0h条件下,酶解温度50℃,分别添加酶的量为0.05、0.10、0.15、0.20、0.25g的酶进行提取,其他条件与2.1.1相同,其结果见图2B。由图2B可知,白藜芦醇的提取量在酶添加量为0.05~0.20g范围内随着酶添加量的升高而升高,但在酶添加量为0.25g时,白藜芦醇的含量反而下降,可能是由于花生芽在大量纤维素酶的作用下被酶过分分解,导致提取花生芽中白藜芦醇的提取量下降。因此,提取白藜芦醇的酶添加量以0.2g左右为宜。
2.2.3不同pH值对花生芽中白藜芦醇提取量的影响
准确称取1.000g花生芽粉5份,在料液比1∶20(g/mL)、酶解温度50℃、酶添加量0.2g、在酶解时间2.0h条件下,在pH分别为4.4、4.6、4.8、5.0、5.2下提取,其它与2.1.1相同,其结果见图2C。由图2C可知,白藜芦醇在pH为5.0时,提取量最高,表明酶在5.0时活力最好,但是在pH5.0之后白藜芦醇的提取量随着pH值的增加呈显著的下降趋势。此试验所用的纤维素酶最适的pH值为4.8,当溶液的pH超过最适pH值范围(大多数酶的最适pH值在4.0~8.0范围内),可能导致酶丧失活性,从而影响试验的影响。因此,提取白藜芦醇的pH值为5.0左右为宜。
2.2.4不同酶解时间对花生芽中白藜芦醇提取量的影响
准确称取1.000g花生芽粉5份,在料液比1∶20(g/mL),酶解温度50℃、酶添加量0.2g,调节pH值为5.0的条件下,分别对1.5、2.0、2.5、3.0、3.5h的酶解时间进行提取,其他条件与2.1.1相同,其结果见图2D。由图2D可知,酶解时间从1.0~1.5h,白藜芦醇的提取量呈直线上升,当酶解时间在1.5h时,白藜芦醇最提取量最高,但是当时间超过1.5h,提取量下降,可能由于长时间在50℃下,纤维素酶发生变性而丧失部分活性,并且对于白藜芦醇本身不够稳定的性质造成影响,导致酶解时间在1.5h之后,提取量降低的。因此,提取白藜芦醇的酶解时间以1.5h左右为宜。
2.2.5纤维素酶酶解的正交试验结果分析
研究通过单因素法试验,确定了酶解温度(A)、酶添加量(B)、pH(C)、酶解时间(D)这4个因素对提取试验的影响,然后对试验结果进行分析,最终确定了正交试验的各因素水平,见表1。采用L9(34)正交试验表安排了各试验的因素水平,进行试验并且测定花生芽中白藜芦醇提取量,试验方案及结果见表2。
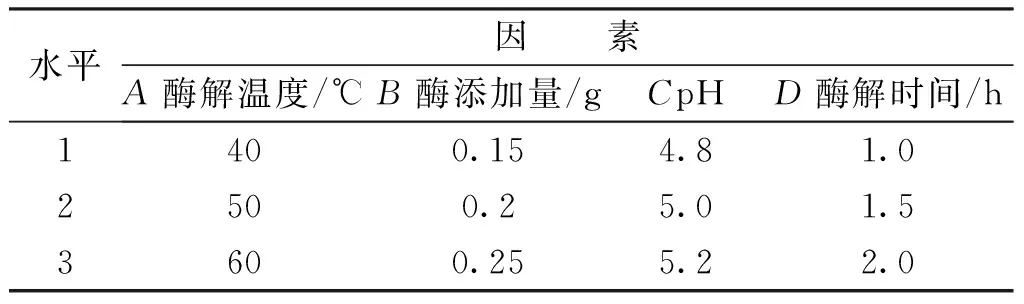
表1 酶解法提取白藜芦醇正交试验因素水平表Tab.1 Enzymatic hydrolysis to extract resveratrol factors orthogonal test level
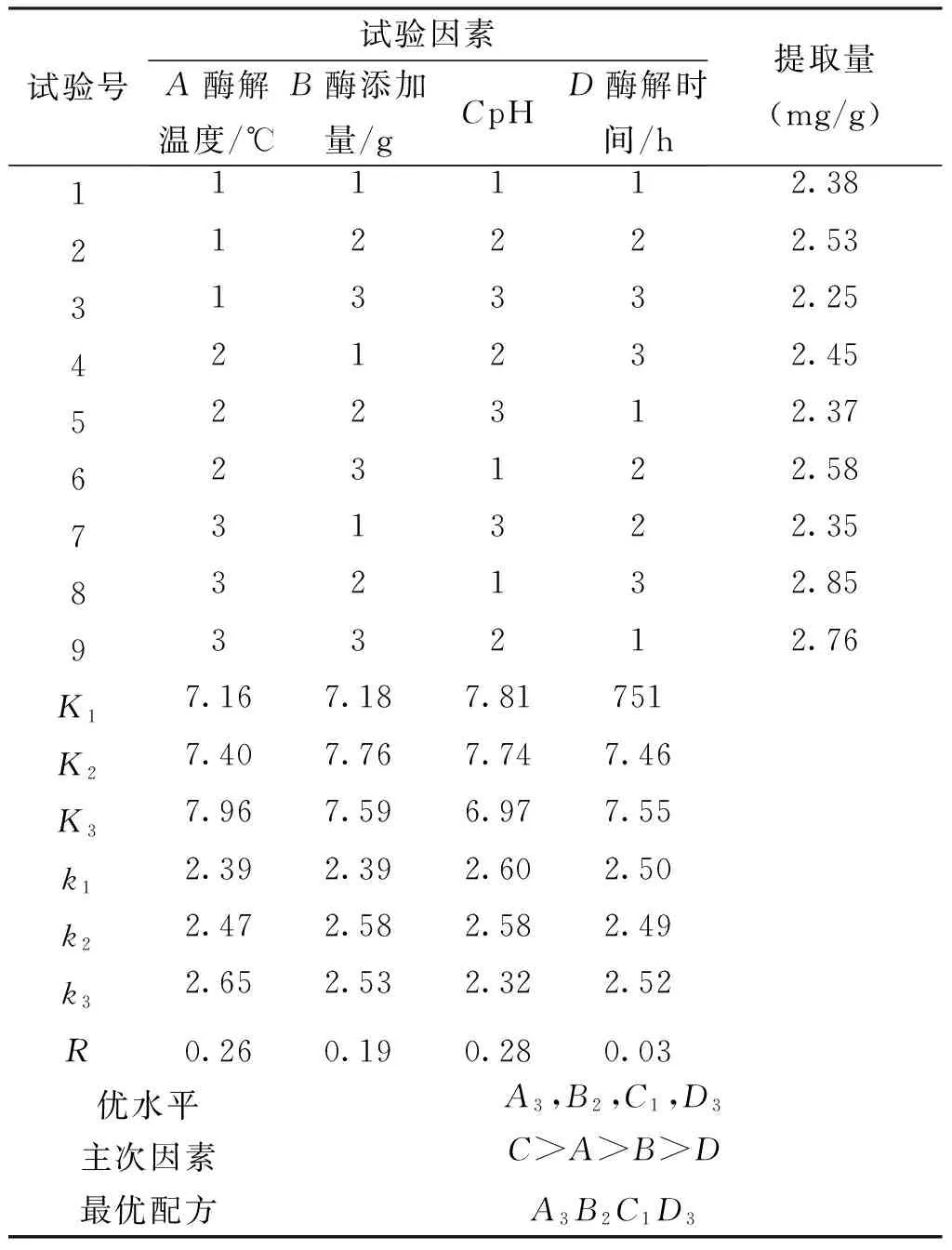
表2 酶解法提取白藜芦醇正交试验结果与分析Tab.2 Enzymatic hydrolysis to extract resveratrol orthogonal experimental results and analysis
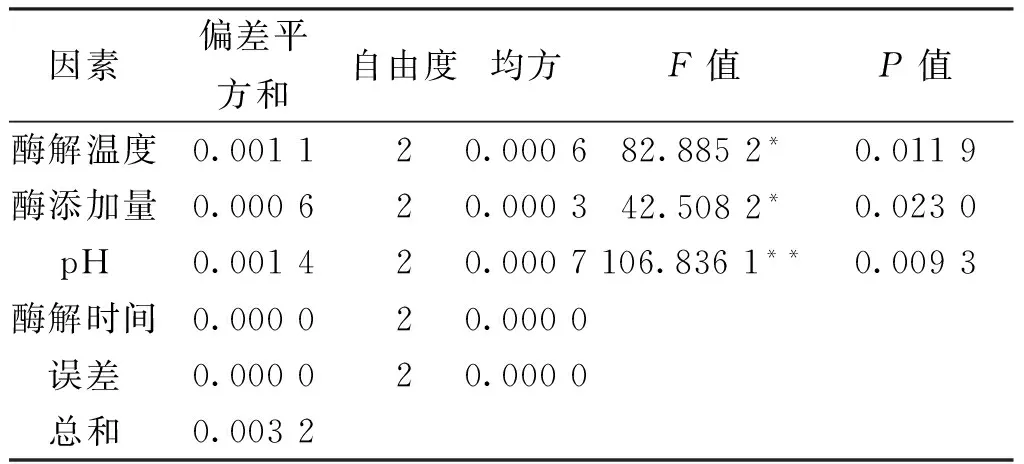
表3 酶解法提取白藜芦醇试验结果方差分析表Tab.3 Enzymatic hydrolysis to extract resveratrol test results of anova table
注:F0.01(2,2)=99,F0.05(2,2)=19,“*”表示显著(0.01
通过L9(34)正交试验,由表2极差R分析可知,对提取白藜芦醇的影响大小主次顺序为:C最大,其次分别是A、B、D,即pH值>酶解温度>酶添加量>酶解时间,与表3方差分析结果一致。说明pH值是影响白藜芦醇提取量的主要因素,酸度或者碱度在提取白藜芦醇的过程中有很大的影响,在相同的提取条件下可改变白藜芦醇的提取量,提取过程适宜的pH值为4.8。酶解温度和酶添加量是改变白藜芦醇提取量的次要的2个因素,当pH值为4.8,酶解温度低于60℃时,随着酶解温度的升高,提取出的白藜芦醇含量也跟之越高,然而超过60℃时,提取出的含量缓慢下降。酶解时间,是酶解法提取白藜芦醇中影响最小的因素,酶解可基本上把脂肪和蛋白质去除掉,得到白藜芦醇。因此,确定最佳提取工艺为:A3B2C1D3,即酶解温度为60℃,酶添加量为0.2g,pH值为4.8,酶解时间为2.0h,其提取量为2.85mg/g。
2.3超声波处理试验结果分析
2.3.1不同乙醇浓度对花生芽中白藜芦醇提取量的影响
准确称取1.000g花生芽粉5份,在料液比1∶20(g/mL),分别加入40%、50%、60%、70%、80%乙醇浓度,在50℃,频率为40kHz超声波水浴中提取30min,其它条件与2.1.1相同,其结果见图3A。
由图3A可知,乙醇浓度从40%到70%时,白藜芦醇的提取量缓慢上升,当乙醇浓度达到70%,白藜芦醇的提取量最高,但是当浓度超过70%之后,提取量迅速下降,可能是乙醇浓度太高,且花生芽本身含有一些醇溶性和亲脂性成分,该成分影响着对白藜芦醇的提取,而且白藜芦醇本身是多羟基结构,容易和乙醇中所含有的水结合将白藜芦醇从花生芽中溶解出来。因此,提取白藜芦醇的乙醇浓度以70%左右为宜。2.3.2超声时间对花生芽中白藜芦醇提效果的影响
准确称取1.000g花生芽粉5份,在料液比1∶20(g/mL),加入70%乙醇,温度50℃下,频率为40kHz超声波水浴中分别提取10min、20min、30min、40min、50min,其他条件与2.1.1相同,其结果见图3B。

图3 不同乙醇浓度(A)、超声波时间(B)、超声波温度(C)、料液比(D)对花生芽中白藜芦醇提取量的影响Fig.3 The effect of alcohol concentration (A), ultrasonic time(B), ultrasonic temperature (C) and solid-liquid ratio (D) on extraction of resveratrol in the peanut bud
由图3B可知,随着提取时间的延长,白藜芦醇提取量先升高后降低,提取40min时,白藜芦醇提取量达到最高;但是在40min以后时,提取量下降,其可能是超声波处理温度不稳定导致的;白藜芦醇本身的稳定性较差,所以超声时间的越长提取出的白藜芦醇含量较少。因此,提取白藜芦醇的超声波处理时间以40min左右为宜。
2.3.3不同超声波处理温度对花生芽中白藜芦醇提取量的影响
准确称取1.000g花生芽粉5份,在料液比1∶20(g/mL),加入70%乙醇,在频率为40kHz超声波清洗机中超声30min,分别在温度30℃、40℃、50℃、60℃、70℃下提取,其他与2.1.1相同,其结果见图3C。
由图3C可知,当温度在50℃下时,白藜芦醇提取量最高,但是当温度高于50℃时,随着温度达到最高点之后提取量开始降低,这个结果由于白藜芦醇本身的不稳定性,在温度过高的条件下对提取量存在很大的影响,并且试验中产生的试验误差,都会导致提取量降低。因此,提取白藜芦醇的超声波处理温度以50℃左右为宜。
2.3.4不同料液比(粉:乙醇)对花生芽中白藜芦醇提取量的影响
准确称取1.000g花生芽粉5份,以料液比1∶20、1∶30、1∶40、1∶50、1∶60分别加入70%乙醇,在50℃下,频率为40kHz超声波水浴中提取30min,其他条件与2.1.1相同,其结果见图3D。
由图3D可知,当料液比从1∶20增加到1∶50,提取量逐渐升高,料液比在1∶50的情况下,白藜芦醇的提取量最高,但是当料液比增加到1∶60之后,提取出的白藜芦醇含量略微降低,变化不大,此结果可能在料液比低于1∶50时,超声波并没有将白藜芦醇从花生芽中完全提取出来,当料液比在1∶50时,白藜芦醇基本提取完全,在试验过程中,有部分白藜芦醇残留在水相中而导致的损失,当料液比超过1∶60,反应体系中的原料浓度降低,导致提取量下降。因此,提取白藜芦醇的料液比以1∶50左右为宜。
2.3.5超声波处理正交试验
通过以单因素试验为研究方法,确定了超声温度(A)、超声时间(B)、乙醇体积分数(C)、料液比(D)这4个因素对提取试验的影响,然后对试验结果进行分析,最终确定了正交试验的各因素水平,见表4。采用L9(34)正交试验表安排了各试验的因素水平,进行试验并且测定花生芽中白藜芦醇提取量,试验方案及结果见表5。
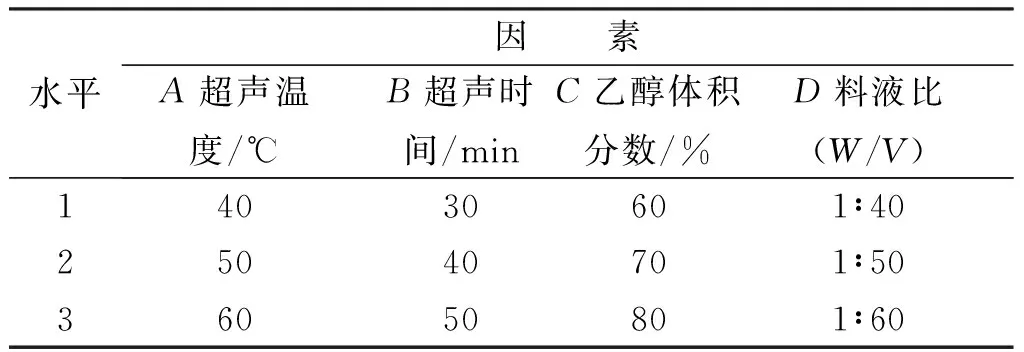
表4 超声波处理提取白藜芦醇正交试验因素水平表Tab.4 Ultrasonication to extract resveratrol factors orthogonal test level
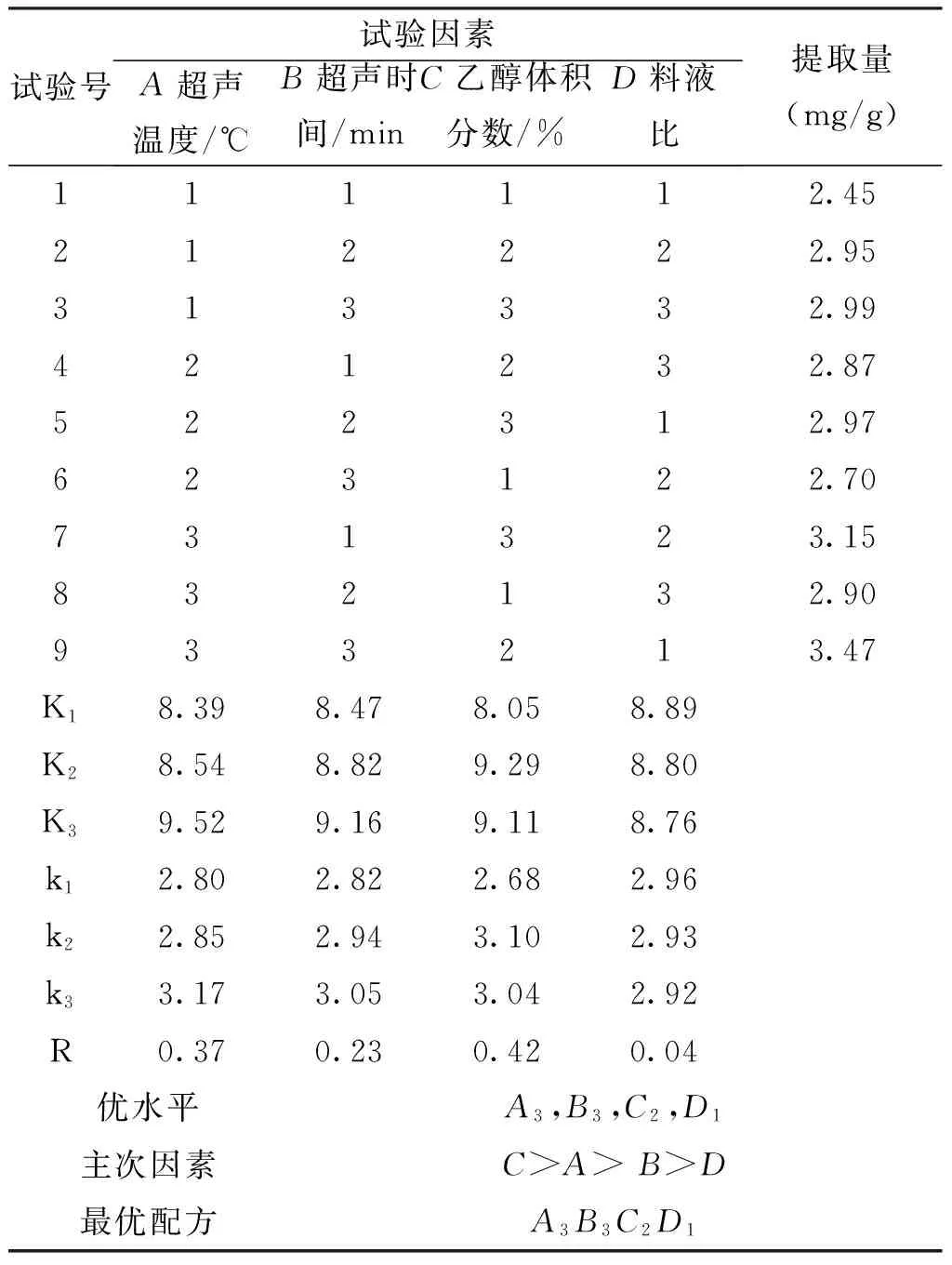
表5 超声波处理提取白藜芦醇正交试验结果与分析Tab.5 Ultrasonication to extract resveratrol orthogonal experimental results and analysis
由表5可知,各因素影响提取白藜芦醇含量的大小顺序为C>A>B>D,即乙醇浓度>超声波处理温度>超声波处理时间>料液比,与表6方差分析结果一致。说明乙醇浓度是影响白藜芦醇提取量的主要因素,根据相似相溶的原理,乙醇浓度为70%时,白藜芦醇的提取效果最好,但是当浓度继续增加,提取量逐渐下降,部分杂质的溶出影响着对白藜芦醇的
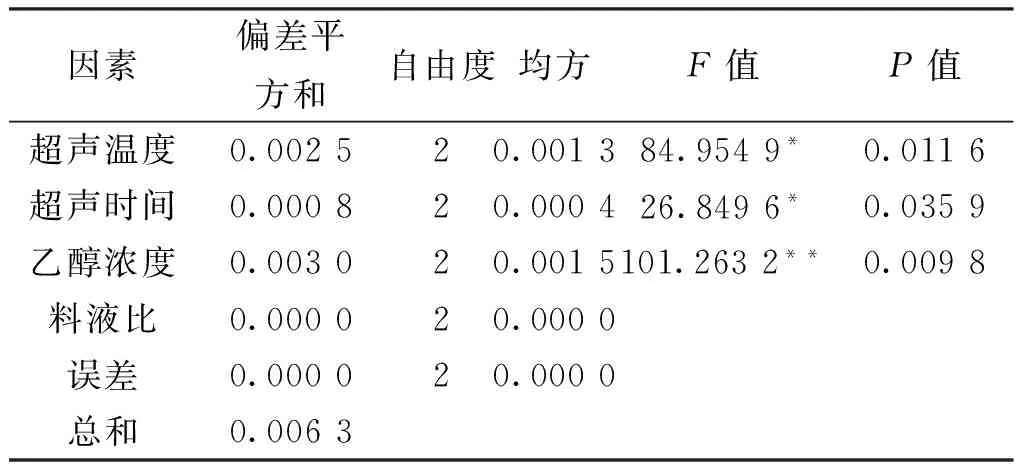
表6 超声波处理提取白藜芦醇试验结果方差分析表Tab.6 Ultrasonication to extract resveratrol test results of anova table
注:F0.01(2,2)=99,F0.05(2,2)=19,“*”表示显著(0.01
提取;超声波处理温度和时间是改变白藜芦醇提取量的第二重要的2个因素,温度太低、时间太短则不能将白藜芦醇完全提取出来,而温度太高或时间太长则白藜芦醇提纯度较低,综合所述,确定最佳提取工艺为:A3B3C2D1,即超声波处理温度为60℃,乙醇浓度为70%,料液比为1∶40,超声波处理时间为50min,其提取量为3.47mg/g。
2.4验证比较试验
3种不同提取方法的提取量比较见表7。由表7可知,酶解-乙醇提取法、超声波-乙醇提取法、酶解-超声波提取法比乙醇回流法分别提高约1.7、2.1、4.6倍。

表7 3种不同提取方法的提取量比较Tab.7 To compare the three different extraction methods of extraction yield
3 结论
利用超声波法结合酶解法提取花生芽中白藜芦醇,最佳提取工艺条件为:超声波处理温度为60℃,乙醇浓度为70%,料液比为1∶40,超声波处理时间为50min,酶解温度为60℃,酶添加量为0.2g,pH值为4.8,酶解时间为2.0h,在此条件下白藜芦醇的最大提取量可达7.39mg/g。该试验表明,花生芽中白藜芦醇含量丰富,而且白藜芦醇品质也较好,是提取白藜芦醇的良好原料,科学家建议每人每日食入适量的白藜芦醇对身体有益,我国人口众多,因此我国对于食用白藜芦醇的市场需求量是巨大的。因而从花生芽中提取白藜芦醇具有较大的经济应用价值。
[1] 任志.花生芽菜生产技术与食用方法[J].科学种养,2013(6):58.
[2] 谷建田,张德纯,王德槟,等.芽苗菜的种类、作用与前景[J].现代农业,1998(10):8-9.
[3] 赵克森.白藜芦醇的一般生物学作用[J].国外医学:卫生学分册,2002,29(6):374-376.
[4] 田浩,刘玉,夏禄华,等.匀浆法提取花生植株中白藜芦醇[J].东北林业大学学报,2008,36(3):81-83.
[5] ALKHALAF M.Resveratrol-induced growth inhibition in MDA-MB-231 breast cancer cells is associated with mitogen activated protein kinase signaling and protein translation[J].Eur J Cancer Prev,2007,16(4):334-341.
[6] LEVI F,PASCHE C,LUCCHINI F,et al.Resveratrol and breast cancer risk[J].Eur J Cancer Prev,2005,14(2):139-142.
[7] TRINCHERI N F,NICOTRA G,FOLLO C,et al.Resveratrol induces cell death in colorectal cancer cells by a novel pathway involvingly sosomal cathepsin D[J].Carcinogenesis,2007,28(5):922-931.
[8] NDIAYE M,PHILIPPE C,MUKHTAR H,et al.The grape antioxidant resveratrol for skin disorders: Promise,prospects,and challenges[J].Archives of Biochemistry and Biophysics,2011,508(2):164-170.
[9] 任彦荣,吴洪斌.白藜芦醇的检测手段及药理作用[J].安徽农业科学,2012,40(2):788-790.
[10]姜燕,鲍慧娟,张海悦.花生红衣白藜芦醇的研究进展[J].食品研究与开发,2013(18):129-132.
[11]钱时权,石亚中,伍亚华,等.纤维素酶-超声波辅助有机溶剂提取山葡萄渣中白藜芦醇的研究[J].食品工业科技,2012,33(3):210-213.
Optimization on extracting technology of resveratrol from peanut bud by ultrasonic-assisted enzymatic
TAN Shuqiong,XIE Yongwu
(Minnan Science and Technology Institute, Fujian Normal University, Quanzhou, Fujian 362332, China)
Peanut sprout was used as raw material. Using compound treated with cellulose and ultrasonic, resveratrol extraction from peanut sprout. Moreover, observing the effects on resveratrol extraction rate of reaction, quantity, pH, enzymolysis time and ultrasonic of the factors such as temperature, time, alcohol concentration and solid-liquid ratio for the sample were studied by single. Factor and orthogonal tests, the optimum condition of extraction was obtained. The results show that the optimum extraction process was peanut sprout powder 1.000g, reaction temperature 60℃, enzyme added 0.2g, pH 4.8, enzymolysis time 2.0h, ultrasonic temperature 60℃, alcohol concentration 70%, solid-liquid ratio 1∶40, ultrasonic time 50 min. Under these conditions, best extractive ratio achieved 7.39mg/g. The extractive ratio increases by about 4.6 times than refluent ethanol extraction.
peanut bud; resveratrol; cellulase enzymatic hydrolysis; ultrasonication
1004—5570(2016)04-0068-07
2016-05-08
谭属琼(1985-),女,讲师,研究方向:农产品加工及贮藏工程,E-mail:xt102545@163.com.
TQ463
A
