缺血性心功能不全家兔心肌ACE2/Ang-(1-9)/Ang-(1-7)轴的变化及培哚普利的治疗作用
2016-09-15郝潇李树仁孟田田高青党懿荀丽颖苑可心张倩辉郝清卿齐晓勇
郝潇 李树仁 孟田田 高青 党懿 荀丽颖 苑可心 张倩辉 郝清卿 齐晓勇
基础研究
缺血性心功能不全家兔心肌ACE2/Ang-(1-9)/Ang-(1-7)轴的变化及培哚普利的治疗作用
郝潇 李树仁 孟田田 高青 党懿 荀丽颖 苑可心 张倩辉 郝清卿 齐晓勇
目的 探讨培哚普利对缺血性心功能不全家兔新型RAAS系统的影响。方法 利用随机数字表法将30只家兔随机分为培哚普利组、心功能不全组和假手术组。培哚普利组及心功能不全组通过结扎冠状动脉前降支的方法制作缺血性心功能不全家兔模型,假手术组仅开胸不结扎冠状动脉。模型制作成功后培哚普利组给予培哚普利生理盐水溶液2 ml·kg-1·d-1灌胃(浓度为1 mg/ml),心功能不全组及假手术组给予等量生理盐水灌胃。4周后心脏彩超测定心功能;Real-Time PCR检测血管紧张素转换酶2(ACE2)mRNA表达,ELISA检测家兔血清Ang-(1-9)和Ang-(1-7)水平。结果 与心功能不全组相比,培哚普利可显著改善心功能[(50.61±3.21)%比(46.44±1.66)%,P<0.01];与假手术组相比,心功能不全家兔血清 Ang-(1-9)[(3.86±0.49)ng/ml比 (3.03±0.29)ng/ml,P<0.01]和 Ang-(1-7)[(3.82±0.59)ng/ml比 (2.76±0.22)ng/ml,P<0.01]水平均增高,心肌 ACE2 mRNA 表达显著增高(0.41±0.14 比 0.25±0.08,P<0.01);心功能不全家兔应用培哚普利后,血清 Ang-(1-9)[(4.71±0.31)ng/ml比(3.86±0.49)ng/ml,P=0.001]和 Ang-(1-7)[(4.42±0.50)ng/ml比(3.82±0.59)ng/ml,P=0.039]水平均增高,ACE2 mRNA 表达增加(0.98±0.14 比 0.41±0.14,P<0.01)。相关性分析显示,缺血性心功能不全家兔心功能与心肌ACE2 mRNA表达呈正性相关关系,相关系数为0.770(P=0.003)。结论 心功能不全家兔RAAS系统激活的同时还伴有新型RAAS系统的抑制,而培哚普利可以通过ACE2/Ang-(1-9)/Ang-(1-7)这一新型RAAS通路发挥心脏保护性作用。
缺血性心功能不全; 肾素-血管紧张素-醛固酮系统; 血管紧张素转换酶2; 血管紧张素转换酶抑制剂
心肌梗死(myocardial infarction,MI)是目前临床最常见的危害人类健康的心血管病之一。MI后由于容量负荷和压力负荷而导致心室重构,最终导致心功能不全的发生[1]。血管紧张素转换酶抑制剂(angiotensin-converting enzyme inhibitor,ACEI)在心力衰竭的治疗中起着基石的作用,受到各个心力衰竭管理指南的推荐[2-4]。然而ACEI类药物在心力衰竭治疗中的机制尚不完全明确。除了目前已知的抑制血管紧张素转换酶(angiotensin-converting enzyme,ACE)降低血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)的水平、减少缓激肽的降解或直接刺激激肽受体及其抑制交感神经激活等作用,目前仍有其他机制可能影响心功能不全的进程。2000年,Tipnis等[5]发现了血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE2),其催化产物为血管紧张素-(1-9)和血管紧张素-(1-7)。后续研究显示,Ang-(1-9) 和 Ang-(1-7) 均具有拮抗 AngⅡ的作用。但两者在ACEI作用机制是否起作用尚不明确。本研究通过给予心肌梗死后心功能不全家兔ACEI类药物培哚普利,观察家兔心肌ACE2表达、血清 Ang-(1-9)及 Ang-(1-7)水平和心功能的变化,探讨在ACEI类药物治疗心功能不全中对新型RAAS系统的作用。
1 材料与方法
1.1 实验动物 本实验选用健康3个月龄新西兰雄性家兔共 30 只,体重(2.69±0.17)kg,由河北医科大学实验动物中心提供。
1.2 主要实验试剂及仪器 培哚普利片(雅施达制药有限公司);注射用青霉素钠(华北制药);反转录试剂盒(Promega);荧光定量 PCR 试剂盒(BBI);随即引物(Promega);PCR引物(上海生工生物工程有限公司);Ang-(1-9)试剂盒(上海蓝基生物科技有限公司);Ang-(1-7)试剂盒(上海蓝基生物科技有限公司)。
心脏超声仪(TOSHIBA);7300实时定量PCR仪(ABI);紫外可见分光光度仪(北京普析通用仪器有限责任公司)。
1.3 方法
1.3.1 动物分组及处理 将30只健康新西兰雄性家兔按照随机数字表法随机分为培哚普利组、心功能不全组及假手术组。家兔心肌梗死后2周通过心脏彩超检测家兔心功能,左室射血分数(left ventricular ejection fraction,LVEF)低于50%即为心功能不全。心功能不全模型制作成功后,培哚普利组以培哚普利生理盐水溶液2 ml·kg-1·d-1灌胃(浓度为1 mg/ml),心功能不全组及假手术组给予等量生理盐水灌胃。
1.3.2 实验动物模型制备 采用开胸结扎冠状动脉前降支的方法制作急性心肌梗死后心功能不全模型。将家兔麻醉后仰卧位固定于兔台,记录术前心电图。消毒铺巾后沿胸骨左缘逐层切开皮肤及皮下组织,剪断第4、5肋软骨,打开心包,暴露左冠状动脉前降支,于肺动脉圆锥与左心耳交点下方3 mm处用0号丝线结扎前降支(模型制备成功标准为心尖部及部分左室前壁心肌由红色变为暗紫色,局部心肌收缩减弱或异常运动,心电图示胸前导联ST段持续弓背向上抬高[6]),后逐层关胸。术后3 d每天给予青霉素80万U肌注。假手术组开胸后将丝线穿过前降支下方,但不结扎。
1.3.3 超声心动图检测心功能 采用Toshiba超声仪在术前、术后2周及给药后4周由同一专科医生行超声心动图检查,测量各组左室舒张末期容积(end-diastolic volume,EDV) 左室射血分数(left ventricle ejection fraction,LVEF)及左室短轴缩短率(left ventricle fractional shortening,LVFS)。所有测量值均取3次测量的平均值。
1.3.4 Real-time PCR法检测心肌组织ACE2基因mRNA的表达 给药4周后,取50 mg心肌梗死区域心肌组织进行研磨,提取总RNA,琼脂糖凝胶电泳检测其完整性;按照反转录试剂盒说明书进行反转录。反应条件为:42℃ 50 min,95℃ 5 min。引物序列:GAPDH的上游引物为 5′-CGCCTGGAGAAAGCTGCTAA-3′,下游引物为 5′-CGACCTGGTCCTCGGTGTAG-3′, 扩 增 产 物 为 103 bp[6];ACE2 上游引物为 5′-CAACACTTGAACCCCCTTATGA-3′, 下 游 引 物 为 5′-TGCTTTTGCTTCCTTCGGTC-3′,扩增产物为 133 bp。将获得的cDNA按照荧光定量PCR试剂盒操作说明书方法扩增目的基因,PCR热循环参数为96℃ 4 min,然后 3步反应,即 94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,40个循环。以GAPDH为内参照,将目的基因表达的相对定量值用于统计学分析。Real-time PCR采用 2-ΔΔCt(ΔCt=目的基因 Ct值-GAPDH Ct值,ΔΔCt=目的基因ΔCt值-内参照基因ΔCt值)统计分析结果[7]。将所得的AT2R mRNA的表达量与LVEF进行相关性分析。
1.3.5 Elisa法检测血清中 Ang-(1-9)和 Ang-(1-7)的含量 用药4周后,将三组家兔麻醉后经腹主动脉取血,抗凝后离心,3000 r/min,15 min后取上清,超低温冰箱存放。
以标准品次序加入标准品,再在空白孔中加入等量样品和PBS;各孔中加入酶标记溶液,封板后37℃孵育1 h;清洗后拍干;各孔按顺序加入显色剂A和B;37℃避光反应10~15 min后加入终止液;于紫外可见分光光度仪测量各孔OD值;依据标准品浓度及其OD值计算相应公式,依据公式和样品OD值计算样品 Ang-(1-9)和Ang-(1-7)的浓度。
1.4 统计学方法 使用SPSS 13.0软件包进行数据处理。正态性数据以±s表示,非正态数据以中位数(四分位数)表示,采用完全随机设计单因素方差分析(one-way ANOVA),多个样本间两两比较采用SNK-q检验,相关变量间采用直线相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 心肌梗死后心功能不全模型结果 30只新西兰雄性家兔接受模型手术,术后共有25只存活,其中培哚普利组9只,死亡1只;HF组8只,死亡2只;假手术组8只,死亡2只。共死亡5只,2只于手术过程中大量出血死亡,1只于结扎前降支过程中诱发室颤死亡,1只开胸后气胸死亡,1只于给药灌胃时误入气管窒息死亡。
2.2 心脏超声检查结果 造模前将各组新西兰雄性家兔行心脏彩超检查,各组家兔心功能指标均正常,并于造模后2周(即给药前)及给药4周后再次行超声检查。
经统计学处理发现,心肌梗死后2周心脏彩超显示,三组EF、FS及EDV无明显区别(P=0.693,P=0.664,P=0.493)。给药4周后,培哚普利组及心功能不全组LVEF及LVFS较假手术组均显著降低(P均<0.01),EDV 显著增大(P<0.01);培哚普利组心功能与心功能不全组相比,LVEF及LVFS均明显改善(P=0.041,P=0.047),EDV 显著缩小(P<0.01)。见表 1。
表1 各组间给药4周后心功能的比较(±s)
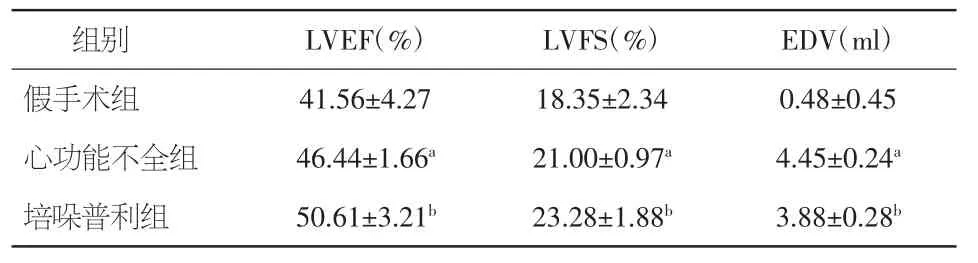
表1 各组间给药4周后心功能的比较(±s)
注:LVEF:左室射血分数;LVFS:左室短轴缩短率;EDV:左室舒张末期容积。与假手术组比较,aP<0.05;与心功能不全组比较,bP<0.05
组别 LVEF(%) LVFS(%) EDV(ml)假手术组 41.56±4.27 18.35±2.34 0.48±0.45心功能不全组 46.44±1.66a21.00±0.97a4.45±0.24a培哚普利组 50.61±3.21b23.28±1.88b3.88±0.28b
2.3 心肌梗死区域组织ACE2 mRNA表达及其与心功能的相关关系 给药4周后,三组间通过Real-Time PCR检测ACE2 mRNA表达水平有显著差异(P<0.01);与假手术组相比,心功能不全组ACE2 mRNA表达明显增高(P=0.036);与心功能不全组相比,培哚普利组ACE2 mRNA表达明显增高(P<0.01)。相关性分析显示,缺血性心功能不全家兔心肌ACE2 mRNA表达水平与心功能呈正相关(P=0.003),相关系数为0.770。见表2。
表2 各组间给药4周后ACE2 mRNA表达水平比较(±s)

表2 各组间给药4周后ACE2 mRNA表达水平比较(±s)
注:与假手术组比较,aP<0.05;与心功能不全组比较,bP<0.05
组别 ACE2 mRNA假手术组 0.25±0.08心功能不全组 0.41±0.14a培哚普利组 0.98±0.14b
2.4 血清Ang-(1-9)与 Ang-(1-7)水平 标准品计算公式为,Ang-(1-9):OD值和浓度分别取10的对数记为 x和 y,y=0.12190-1.41505x;Ang-(1-7):OD值和浓度分别取10的对数记为x和y,y=0.17799-1.53809x。通过公式及样品OD值计算样品浓度。见表3。
给药4周后,三组间通过ELISA检测血清Ang-(1-9)水平有显著差异(P<0.01);与假手术组相比,心功能不全组血清Ang-(1-9)水平明显增高(P=0.002);与心功能不全组相比,培哚普利组血清Ang-(1-9)水平明显增高(P=0.001)。
表3 各组间给药4周后Ang-(1-9)及Ang-(1-7)的比较(±s)
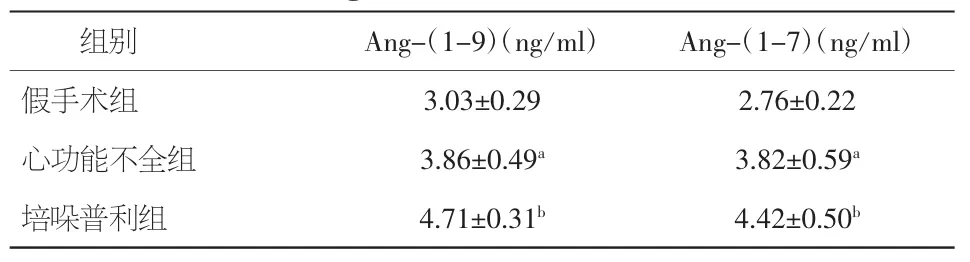
表3 各组间给药4周后Ang-(1-9)及Ang-(1-7)的比较(±s)
注:与假手术组比较,aP<0.05;与心功能不全组比较,bP<0.05
组别 Ang-(1-9)(ng/ml) Ang-(1-7)(ng/ml)假手术组 3.03±0.29 2.76±0.22心功能不全组 3.86±0.49a3.82±0.59a培哚普利组 4.71±0.31b4.42±0.50b
给药4周后,三组血清Ang-(1-7)水平有显著差异(P<0.01);与假手术组相比,心功能不全组血清 Ang-(1-7)水平明显增高(P=0.001);与心功能不全组相比,培哚普利组血清Ang-(1-7)水平明显增高(P=0.039)。
3 讨论
心肌梗死后,由于压力负荷和容量负荷的变化,导致肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS) 激活,AngⅡ及醛固酮水平增高,作用于相应受体,导致血管收缩、钠水潴留、细胞增殖,以及促炎症的作用,最终导致心功能不全的发生和进展。Tipnis等[5]发现了ACE2,这种酶可以催化生成 Ang-(1-9)和 Ang-(1-7)。随着 ACE2/Ang-(1-9)/Ang-(1-7) 的发现,新型的RAAS系统也逐渐被人们所认知。在这一新型RAAS发现后,关于Ang-(1-7)的研究发现Ang-(1-7)具有抗增殖和扩血管作用[8],并有研究显示其生理作用与AngⅡ相拮抗[9]。近年来Ang-(1-9)相关研究也逐渐增多,显示Ang-(1-9)在高血压或心力衰竭进程中通过拮抗传统的RAAS系统发挥降血压及心脏、血管和肾脏的保护作用[10]。
作为心功能不全治疗的基石药物,ACEI类药物的作用机制尚不完全明确。ACEI类药物可以抑制AngⅡ的形成,从而减少醛固酮的合成和释放以及抑制交感神经的激活,并使AngⅡ刺激心肌细胞增生、促进心肌肥厚等作用受到抑制[11]。另外,作为ACE的抑制剂,还可以抑制缓激肽的降解,使缓激肽蓄积,从而发挥扩血管作用[12]。
研究发现,ACE2 催化 AngⅠ形成 Ang-(1-9),而后者通过ACE、脯氨酰内肽酶(POP)、中性肽链内切酶(NEP)以及巯基和金属依赖性寡肽酶(TOP)催化形成 Ang-(1-7)[13]。因此可以推测,ACEI类药物可以通过新型RAAS系统发挥心脏保护作用。
本研究通过制作心肌梗死后心功能不全模型,并给予ACEI类代表药物培哚普利灌胃,探讨该药物对新型RAAS系统三种重要因子的影响。研究发现,心肌梗死后心功能不全家兔心肌内ACE2、血清Ang-(1-9)及 Ang-(1-7)均明显增高。应用培哚普利后ACE2 mRNA表达明显增高,血清Ang-(1-9)及Ang-(1-7)明显增高,心功能不全家兔心功能显著改善。提示培哚普利可能在新型RAAS系统中主要通过增加ACE2表达增加Ang-(1-9)及Ang-(1-7)水平发挥心脏保护作用。ACE2的表达与家兔心功能的改善呈正相关关系,提示在新型RAAS系统中,ACE2可以发挥核心作用。Ang-(1-9)及Ang-(1-7)作为新型RAAS系统的作用因子发挥心脏保护作用。
心肌梗死后RAAS系统激活,ACE表达明显增高,导致血和组织中AngⅡ水平显著增高,促进心脏重构,最终导致心功能不全的发生和进展。另外,由于 RAAS 系统激活,Ang-(1-9) 及 Ang-(1-7)随着其底物AngⅠ和AngⅡ水平增高而增高;这两种因子可能具有拮抗AngⅠ和AngⅡ的作用。这一结论与本研究结果相符。
在培哚普利组ACE2 mRNA表达以及血清Ang-(1-9)和 Ang-(1-7)水平较心功能不全及假手术组均显著增高,提示培哚普利在拮抗传统RAAS系统的同时,还可以通过提高新型RAAS系统的水平发挥心脏保护作用。有研究发现Ang-(1-9)的水解较 AngⅠ速度慢 18 倍,较 Ang-(1-7)慢30%[14]。由此可见,在应用培哚普利抑制ACE后由于Ang-(1-9)代谢较慢也是引起其蓄积的因素之一,并且由此可以推测,在应用ACEI类药物的情况下,主要通过 Ang-(1-9)而不是 Ang-(1-7)发挥其心脏保护作用。
有研究发现,心肌梗死的大鼠以及假手术组的大鼠在应用了依那普利8周后,其血清Ang-(1-9)水平明显升高,但循环血中Ang-(1-7)的水平则不受依那普利影响[15]。这与我们的发现是不同的。我们的研究发现,应用了培哚普利组较心功能不全组血清Ang-(1-7)水平明显升高。这可能由于尚有其他酶可以催化这一反应,同时底物Ang-(1-9)增加,因此Ang-(1-7)水平仍可以升高。不论血清Ang-(1-7)水平是否受到影响,都说明在拮抗AngⅡ的作用方面主要是Ang-(1-9)在发挥作用。
有研究通过受体阻断的方法发现,Ang-(1-7)和Ang-(1-9)分别通过激活Mas受体和血管紧张素 2 型受体(angiotensin type 2 receptor,AT2R)发挥各自的保护性作用,并且上游的Ang-(1-9)并不完全通过降解为Ang-(1-7)才发挥保护作用[16]。心功能不全家兔血清 Ang-(1-9)和 Ang-(1-7)均明显高于假手术组,但仍出现心功能不全的进展,可能是由于AngⅡ对AT2R的结合能力较Ang-(1-9)高100倍[17]。因此,在心功能不全RAAS过度激活的情况下,尽管Ang-(1-9)水平会升高,这可能会有一定的改善作用,但仍不能拮抗传统RAAS激活引起的心功能不全的进展和恶化。在心功能不全家兔应用了培哚普利后血清Ang-(1-9)水平明显升高,同时由于竞争物质AngⅡ的降低,使Ang-(1-9)对AT2R激活增强,从而发挥心脏保护作用。
本研究通过给予心肌梗死后心功能不全家兔培哚普利药物治疗,改善心功能不全家兔的心功能,验证了培哚普利在心功能不全治疗中的肯定作用,同时为RAAS系统的完整描述提供了一定的依据。但由于受体拮抗剂研究Ang-(1-9)相关受体的研究中[16],应用的受体阻滞剂不能特异性阻断AT2R,因此关于Ang-(1-9)下游的作用机制尚不能完全确定,仍需要更多的分子水平的研究。
(本文图片第670页)
[1]王亚静,吴新华.心肌梗死后心力衰竭发生机制的研究进展.疑难病杂志,2012,11:726.
[2]McMurray JJ,Adamopoulos S,Anker SD,et al.ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012:The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology.Developed in collaboration with the Heart Failure Association(HFA)of the ESC.Eur Heart J,2012,33:1787-1847.
[3]Yancy CW,Jessup M,Bozkurt B,et al.2013 ACCF/AHA Guideline for the Management of Heart Failure:A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation,2013,128:1810-1852.
[4]中华医学会心血管病分会,中华心血管病杂志编辑委员会.中国心力衰竭诊断和治疗指南2014.中华心血管病杂志,2012,42:449-461.
[5]Tipnis SR,Hooper NM,Hyde R,et al.A human homolog of angiotensin-converting enzyme cloning and functional expression captoprilin sensitive earboxypeptidase.J Biol Chem,2000,275:33238-33243.
[6]高青,李树仁,荀丽颖,等.经bcl-2基因修饰的骨髓间充质干细胞移植对缺血性心功能不全兔心功能及血管新生的影响.中国病理生理杂志,2015,31:640-646.
[7]Schmittgen TD,Livak KJ.Analyzing real-time PCT data by the comparative C(T)meathod.Nat Protoc,2008,3:1101-1108.
[8]Zhong J,Jin H,Oudit G,et al.Loss of ACE2 augments angiotensinⅡ-induced myocardial hypertrophy and remodeling with increased Profilin-1 expression.Heart,2011,97:A31-32.
[9]Grobe JL,Mecca AP,Lingis M,et al.Prevention of angiotensinⅡ -induced cardiac remodeling by angiotensin-(1-7).Am J Physiol Heart Circ Physiol,2007,292:H736-742.
[10]Ocaranza MP,Mova J,Barrientos V,et al.Angiotensin-(1-9)reverses experimental hypertension and cardiovascular damage by inhibition of the ACE/AngⅡ Axis.J Hypertens,2014,32:771-783.
[11]朱明燕,柳景景,石雷.血管紧张素转换酶抑制剂研究进展与临床应用.中国医药导报,2011,8:9-10.
[12]Manning J,Vehaskari VM.Postnatal modulation of prenatally programmed hypertension by dietary Na and ACE inhibition.Am J Physiol Regul Integr Comp Physiol,2005,288:R80.
[13]Ocaranza MP,Michea L,Chiong M,et al.Recent insights and therapeutic perspectives of angiotensin-(1-9) in the cardiovascular system.Clinical Science,2014,127:549-557.
[14]McKinney CA,Fattah C,Loughrey CM,et al.Angiotensin-(1-7) and angiotensin-(1-9) function in cardiac and vascular remodeling.Clin Sci(Lond),2014,126:815-827.
[15]Ocaranza MP,Godoy I,Jalil JE,et al.Enalapril attenuates downregulation of angiotensin-converting enzyme 2 in the late phase of ventricular dysfunction in myocardial infarcted rat.Hypertension,2006,48:572-578.
[16]Ocaranza MP,Lavandero S,Jalil JE,et al.Angiotensin-(1-9)regulates cardiac hypertrophy in vivo and in vitro.J Hypertens,2010,28:1054-1064.
[17]Flores-Munoz M,Work LM,Douglas K,et al.Angiotensin-(1-9) attenuates cardiac fibrosis in the stroke-prone spontaneously hypertensive ratvia the angiotensin type 2 receptor.Hypertension,2012,59:300-307.
Changes of ACE2/Ang-(1-9)/Ang-(1-7)axis in ischemic cardiac dysfunction rabbits and the theraputic effects of Perindopril
HAO Xiao,LI Shu-ren,MENG Tian-tian,et al.Cardiology Department,Hebei General Hospital,Shijiazhuang 050051,China
Objective To investigate effects of Perindopril on ACE2/Ang-(1-9)/Ang-(1-7)axis in ischemic cardiac dysfunction rabbits.Methods 30 male rabbits were selected.The rabbits were randomly divided into 3 groups(n=10):Perindopril group,cardiac dysfunction group and control group.The left anterior descending coronary arteries of the rabbits were ligatured for model preparation.In the Perindopril group,rabbits were treated with Perindopril split normal saline solution 2 ml·kg-1·d-1(1 mg/ml).In cardiac dysfunction group and control group,rabbits were treated with normal saline solution 2 ml·kg-1·d-1(0.33 mg/ml).4 weeks after treatment,cardiac function was measured via echocardiography,angiotensin-converting enzyme 2 mRNA expression was analyzed by real-time PCR,serum Ang-(1-9)and Ang-(1-7)level ware detected by enzyme linked immunosorbent assay.Results Compared with control group,the cardiac function of the other two groups were significantly reduced[(50.61±3.21)%vs(46.44±1.66)%,P<0.01],but the serum Ang-(1-9)[(3.86±0.49)ng/ml vs (3.03±0.29)ng/ml,P<0.01]and Ang-(1-7)[(3.82±0.59)ng/ml vs (2.76±0.22)ng/ml,P<0.01]level and the ACE2(0.41±0.14 vs 0.25±0.08,P<0.01)mRNA expression of the other two groups were significantly improved.Compared with cardiac dysfunction group,Perindopril group got significant improvement in ACE2(0.41±0.14 vs 0.25±0.08,P<0.01)mRNA expression and the serum level of Ang-(1-9)[(4.71±0.31)ng/ml vs(3.86±0.49)ng/ml,P=0.001]and Ang-(1-7)[(4.42±0.50)ng/ml vs (3.82±0.59)ng/ml,P=0.039].Correlation analysis revealed that the improvement of the cardiac function was associated with ACE2 mRNA expression(R=0.770,P=0.003).Conclusion Accompanied by RAAS activated in ischemic cardiac dysfunction rabbits,the ACE2/Ang-(1-9)/Ang-(1-7)was also activated.Perindopril can improve cardiac function via ACE2/Ang-(1-9)/Ang-(1-7)axis.
Ischemic cardiac dysfunction; Renin-angiotensin-aldosterone system; Angiotensin converting enzyme 2;Angiotensin converting enzyme inhibitor
LI Shu-ren,E-mail:lsr64@126.com
050051 河北省石家庄市,河北医科大学附属河北省人民医院心脏一科
李树仁,E-mail:lsr64@126.com
10.3969/j.issn.1672-5301.2016.07.022
Q95-33;R542.2
A
1672-5301(2016)07-0658-05
2015-12-24)
