Bmp24缺失对家蚕核型多角体病毒基因组的复制、转录及病毒组装的影响
2016-09-15史利利巩成见童富淡
陈 琛,于 威,b,史利利,b,巩成见,b,蒋 磊,b,童富淡,b
(浙江理工大学,a.生物化学研究所; b.浙江省家蚕生物反应器和生物医药重点实验室,杭州 310018)
Bmp24缺失对家蚕核型多角体病毒基因组的复制、转录及病毒组装的影响
陈琛a,于威a,b,史利利a,b,巩成见a,b,蒋磊a,b,童富淡a,b
(浙江理工大学,a.生物化学研究所; b.浙江省家蚕生物反应器和生物医药重点实验室,杭州 310018)
研究Bmp24基因的生物学功能,利用Red重组技术和Bac-to-Bac系统构建Bmp24缺失型病毒(Bmp24-ko-Bacmid)和Bmp24修复型病毒(Bmp24-re-Bacmid)。然后将Bmp24-ko-Bacmid、Bmp24-re-Bacmid以及野生型病毒(wtBacmid)分别转染BmN细胞,病毒滴度测定发现3种病毒都能产生有活力的子代病毒并使细胞发病,但Bmp24-ko-Bacmid在各个时相的滴度值显著低于其他两种病毒(P<0.05)。电镜观察结果发现Bmp24-ko-Bacmid感染的细胞中只有少量细长的杆状结构,而其他两种病毒感染细胞后能够产生大量具有囊膜包裹的成熟病毒粒子。qPCR实验结果显示,Bmp24缺失不会影响病毒基因组的复制,同时qRT-PCR结果显示Bmp24缺失使早期、晚期基因和极晚期基因的转录水平显著低于野生型病毒(P<0.05)。
家蚕核型多角体病毒;Bmp24基因;Red重组系统;Bac-to-Bac系统
0 引 言
杆状病毒(baculovirus)是一类具有囊膜包裹的双链DNA大型病毒,感染的宿主种类达到600多种,是已知昆虫病毒中最大的类群。杆状病毒属于杆状病毒科,这一病毒家族分为4大类[1]:α-杆状病毒属Alphabaculovirus (lepidopteran-specific nucleo-polyhedrovirus NPV)、β-杆状病毒属Betabaculovirus(lepidopteran-specific gran-uloviruses)、γ-杆状病毒属Gammabaculovirus (hymenopteran-specific NPV)、δ-杆状病毒属Deltabaculovirus (dipteran-specific NPV)。
家蚕核型多角体病毒(Bombyxmorinucleopolyhedrovirus, BmNPV)(T3株)是Alphabaculovirus的成员之一,自从该病毒基因组测序完成之后[2],对其分子生物学上的研究非常多,尤其是对基因组中保守基因的功能研究颇多。至今为止,大约有65%的基因被报道,例如调控基因lef-3[3]、lef-1[4]、lef-11[5]等;结构基因Ac143[6]、ODV-E56[7]、Bm60[8]、38K[9]、Bm67[10]、和Bm91[11]等。
p24基因在苜蓿夜蛾核型多角体病毒(Autographcalifornicamultiple nuclear polyhedrosis virus,AcMNPV)和黄衫毒蛾核型多角体病毒(Orgyiapseudotsugatamulticapsid nucleopolyhedrovirus,OpMNPV)[12]中都是位于多角体膜蛋白基因区域连续表达的5个晚期开放阅读框(open reading frame ORF)中的第一个,预期蛋白分子量大小为21.2KDa。在OpMNPV中p24基因编码了一种核衣壳相关蛋白[13];在舞毒蛾核型多角体病毒 (Lymantriadisparmultiple embedded nucleopolyhedrovirus,LdMNPV)中p24的同源序列缺失N-端,编码蛋白预期分子量为11KDa[14]。表达时相研究发现p24在AcMNPV和OpMNPV中为晚期表达基因,而在LdMNPV中该基因为早期表达基因[15],即p24基因具有结构多样性和表达的多样性,但该基因在病毒繁殖和感染过程中究竟具有何种影响以及在细胞感染中有何种调控功能,研究甚少。
Bmp24位于BmNPV基因组的101,563-102,150 nt,预测蛋白分子量为21.8 KDa。本实验以Bmp24基因为研究对象,探究该基因对BmNPV病毒复制、转录及组装的影响,为优化家蚕杆状病毒表达系统提供基础资料。
1 材料与方法
1.1材料与试剂
家蚕细胞BmN,DH10Bac(含Helper plasmid,含pKD46质粒,可表达phage λRed重组酶系统);大肠杆菌菌株TG1;质粒pKD3(含氯霉素抗性基因cat)和质粒pFastBacHTB均由本实验室保存。
T4连接酶(TaKaRa公司)、限制性内切酶BamHⅠ和EcoRⅠ(TaKaRa公司);DpnⅠ(Promega公司);PCR反应有关的酶与试剂(TOYOBO公司);胎牛血清和 sf-900TMII SFM(1×)(Life technologies 公司);脂质体转染试剂和SYBR Green实时荧光定量PCR试剂盒(Roche 公司);其余试剂均为国产分析纯。
1.2方法
1.2.1Bmp24缺失型和修复型病毒的构建及鉴定
以pKD3质粒为模板,Bmp24-C1/C2为引物,PCR扩增获得含有Bmp24同源臂和氯霉素(cat)基因的线性片段,为了避免模板自身对后续实验的污染、减少假阳性提高打靶效率,本实验用PCR产物为模板进行了二次PCR,获得的片段命名为Bmp24-C。将Bmp24-C利用CaCl2热激法转化到制备好的DH10Bac(含pKD46质粒)感受态细胞中,在Red重组酶的作用下使得Bmp24-C与Bmp24发生同源重组,最后经LB固体平板(含Kan和Cm抗性)筛选,挑斑进行PCR鉴定。鉴定引物组合为Bmp24-up和Bmp24-down、cat-F和Bmp24-down、Bmp24-up和cat-R(表1)。获得的Bmp24缺失型病毒命名为Bmp24-ko-Bacmid 。
以wtBacmid基因组为模板, pFastBacHTB-p24 F/R为引物,PCR扩增含Bmp24基因及其上游60 bp左右(含启动子)序列的线性片段,连接到转移载体pFastBacHTB上,并命名为pFastBacHTB-p24。然后将pFastBacHTB-p24转化到已制备的Bmp24-ko-Bacmid感受态细胞中,通过含有Kan、Gen、Tet抗性及IPTG、X-gal的LB固体平板进行蓝白斑筛选培养,挑取白斑进行PCR鉴定。鉴定引物组合为M13F和M13R、M13F和pFastBacHTB-p24R、pFastBacHTB-p24F和M13R(表1)。获得的Bmp24修复型病毒命名为Bmp24-re-Bacmid。

表1 Bmp24缺失型和修复型病毒构建及鉴定
Bmp24缺失型病毒构建策略(图1-a)和修复型病毒(图1-b)的构建策略。

图1 Bmp24缺失型和修复型病毒的构建策略注:(a)Bmp24缺失型病毒的构建策略:扩增带有Bmp24基因同源臂的cat片段,同wtBacmid的病毒基因组中Bmp24基因发生同源重组,替换p24基因;(b)修复型病毒的构建策略:扩增完整的Bmp24基因通过转移载体定点补回到Bmp24-ko-Bacmid的病毒基因组中polh基因上游位点。
1.2.2TCID50分析Bmp24缺失对子代病毒增殖的影响
分别将1μg的wtBacmid、Bmp24-ko-Bacmid和Bmp24-re-Bacmid DNA经脂质体法(V转染试剂∶VDNA=3∶1)转染到处于对数生长期的BmN[16-17],收集转染后12、24、48、72 h和96 h的细胞上清。然后将状态良好的BmN均匀地铺于96孔板(1×104个/孔),27 ℃静置培养24 h。当细胞密度达到70%~80%后,将收集的病毒上清按梯度稀释(10-1~10-9)后接种到铺有细胞的96孔板中(100 μL/孔),每个稀释度要设置8个重复,并且将未接病毒液的细胞孔作为阴性对照组。27 ℃静置培养5 d,观察细胞状况,记录各个稀释度阳性和阴性感染的孔数。3次重复实验后用TCID50终端稀释法计算病毒滴度并制备曲线。
1.2.3电镜分析Bmp24缺失对子代病毒组装的影响
以3种病毒上清(MOI=10)分别感染处于对数增长期的BmN,48 h后离心(1000 r/min,5 min)收集细胞。参照相关文献[18]的方法固定、包埋、切片和染色,以HitachiH-7650型透射镜观察分析。
1.2.4qPCR分析Bmp24缺失对病毒基因组复制的影响
首先以未转染的wtBacmid为标准品,按103~109的梯度依次稀释,各取1 μL为模板进行qPCR,绘制标准曲线。然后分别将1 μg的wtBacmid、Bmp24-ko-Bacmid和Bmp24-re-Bacmid的基因组DNA转染(V转染试剂∶VDNA=3∶1)BmN(1×106/培养皿),收集转染后12、24、48 h和72 h的细胞,提取胞内总DNA,以DpnⅠ酶[19]在37 ℃条件下消化12 h。将消化后的基因组DNA作为模板进行qPCR[20]分析。以gp41(gp41是BmNPV ODV的囊膜蛋白基因,gp41基因突变感染昆虫细胞后不能产生二代病毒)作为基因组复制水平的标记基因,根据gp41基因序列设计引物gp41 F和gp41 R(表2)。为了确保上样量的统一,实验中引入内参β-Actin,β-Actin的扩增引物为β-actin F/β-actin R(表2)。

表2 qPCR反应中所用扩增引物
1.2.5qRT-PCR分析Bmp24缺失对病毒基因组转录的影响
收集3种病毒转染12、24、48 h和72 h后的细胞,提取胞内总RNA,以不同时相的总RNA为模板,按照逆转录试剂盒逆转录合成cDNA的第一条链。再以cDNA为模板进行qPCR,每个样品设置3个实验重复,研究Bmp24基因缺失对早期基因lef-3、晚期基因vp39和极晚期基因p10转录的影响。同样,为了消除上样量产生的误差,引入内参β-Actin。根据lef-3、vp39、p10基因[21]序列分别设计引物lef-3 F和lef-3 R、vp39 F和vp39 R、p10 F和p10 R(表3)。

表3 qRT-PCR反应中所用扩增引物
1.2.5数据处理
利用SPSS17.0软件对实验数据进行统计学分析,通过T检验比较各实验组之间是否存在显著差异,P<0.05表示各组数据存在显著差异,P<0.01表示存在极显著差异。
2 结果与分析
2.1Bmp24缺失型和修复型病毒的鉴定
缺失型病毒理论上PCR扩增条带大小为:以cat-F和Bmp24-down为引物扩增条带为1023 bp;以cat-R和Bmp24-up为引物扩增条带为399 bp;以Bmp24-up和Bmp24-down为引物扩增条带为1424 bp。PCR结果显示扩增产物大小均与理论值相符(图2-a),表明Bmp24缺失型病毒构建成功,将该病毒命名为Bmp24-ko-Bacmid 。
修复型病毒理论上PCR扩增产物大小:以M13F和M13R为引物扩增条带为3000 bp;以M13F和pFastBacHTB-p24R为引物扩增条带为2350 bp;以pFastBacHTB-p24F和M13R为引物扩增条带为1390 bp。PCR结果表明扩增产物大小均与理论值相符(图2-b),表明Bmp24修复型病毒构建成功,将该病毒命名为Bmp24-re-Bacmid 。
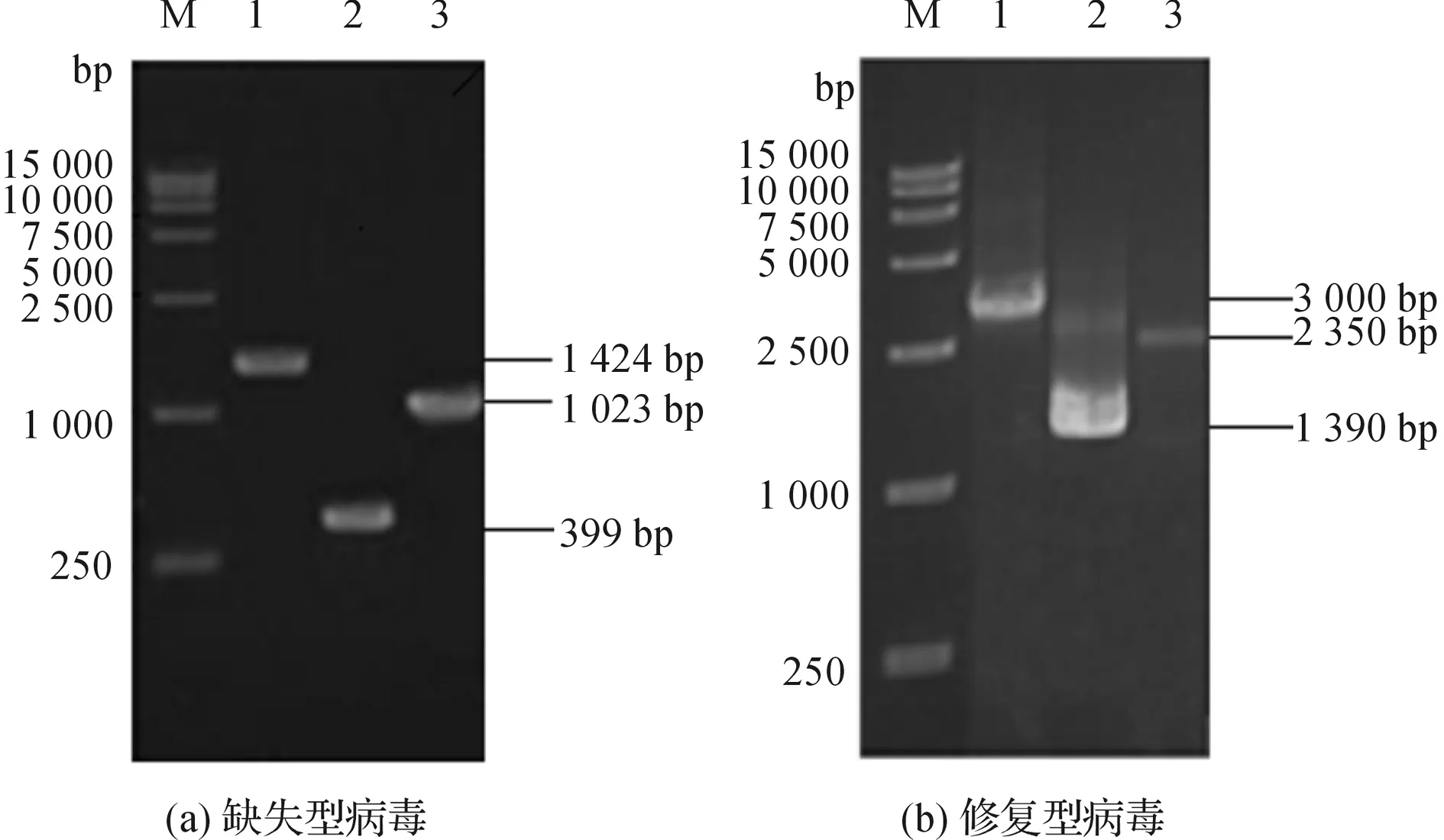
图2 Bmp24基因缺失型和修复型病毒的PCR鉴定注:(a)Bmp24基因缺失型病毒的PCR鉴定;M:DL-15000;1:以Bmp24-up& Bmp24-down为引物的PCR产物;2:以Bmp24-up& cat-R为引物的PCR产物;3:以cat-F & Bmp24-down为引物的PCR产物;(b)Bmp24基因修复型病毒的PCR鉴定;1:以M13F和M13R为引物的PCR产物;2:以M13F和pFastBacHTB-p24R为引物的PCR产物;3:以pFastBacHTB-p24F和M13R为引物的PCR产物。
2.2Bmp24缺失对病毒滴度的影响
收集3种病毒转染后特定时间点的病毒上清,感染BmN细胞,以TCID50法测定滴度。
结果显示3种病毒都可以产生有效的子代病毒并使细胞发病,且随着病毒转染时间的延长子代病毒滴度值增加;但Bmp24缺失型病毒的滴度显著低于野生型病毒(P<0.05),而修复型病毒与野生型病毒相比差异不显著(P>0.05)(图3)。
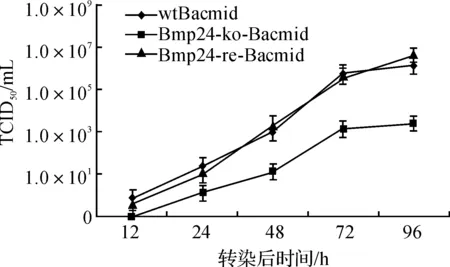
图3 3种病毒转染BmN细胞后的病毒滴度测定曲线
2.3Bmp24缺失对病毒粒子组装的影响
将MOI为10的3种病毒上清感染BmN细胞,48 h后收集的细胞经固定、包埋、切片和染色,透射电镜观察。10000×电镜结果显示:Bmp24-ko-Bacmid病毒感染的细胞中(图4-b1)病毒颗粒量与wtBacmid(图4-a1)及Bmp24-re-Bacmid(图4-c1)两种病毒相比明显降低;30000×电镜结果显示:Bmp24-ko-Bacmid病毒感染的细胞中只出现少量细小的杆状结构(图4-b2),而wtBacmid病毒感染的细胞(图4-a2)存在大量包装成熟的杆状病毒颗粒,而这种变化在Bmp24基因修复后得到弥补(图4-c2)。

图4 电子显微镜观察3种病毒转染BmN48h后的增殖情况注:a1. 野生型病毒感染的BmN(10000×);b1. 缺失型病毒感染的BmN(10000×);c1.修复型病毒感染的BmN(10000×);a2. 野生型病毒感染的BmN(30000×);b2. 缺失型病毒感染的BmN(30000×);c2.修复型病毒感染的BmN(30000×)。
2.4Bmp24缺失对BmNPV基因组复制的影响
收集3种病毒转染特定时间后的细胞,提取总DNA进行qPCR分析。结果表明随着转染时间的延长,3种病毒的gp41的拷贝数都随之增高,但Bmp24-ko-Bacmid和wtBacmid相比无显著差异(P>0.05),证实Bmp24不是病毒基因组复制的必需基因(图5)。

图5 3种病毒转染BmN后病毒拷贝数随时间变化的qPCR分析
2.5Bmp24缺失对早期、晚期基因和极晚期基因转录的影响
收集3种病毒转染特定时间后的细胞,提取总RNA进行qRT-PCR分析。qRT-PCR实验得出转染后不同时间点收集的细胞中lef-3、vp39和p10的ct值,按照ΔCt=ΔCt目的基因-ΔCt内参基因;ΔΔCt=ΔCt-ΔCt最大值,计算出所有ΔΔCt。然后以-ΔΔCt为纵坐标,转染后时相为横坐标做柱状图,显示3种病毒在各个时间点上的转录水平(这里图表显示的不是绝对值差异,而是相对值差异)。结果表明缺失型病毒转染细胞后产生的子代病毒的早期基因lef-3(图6-a)、晚期基因vp39(图6-b)和极晚期基因p10(图6-c)在各个时期的转录水平都低于野生型病毒,差异显著(P<0.05),而修复型与野生型无显著差异(P>0.05),Bmp24基因的补回弥补了这一缺陷。
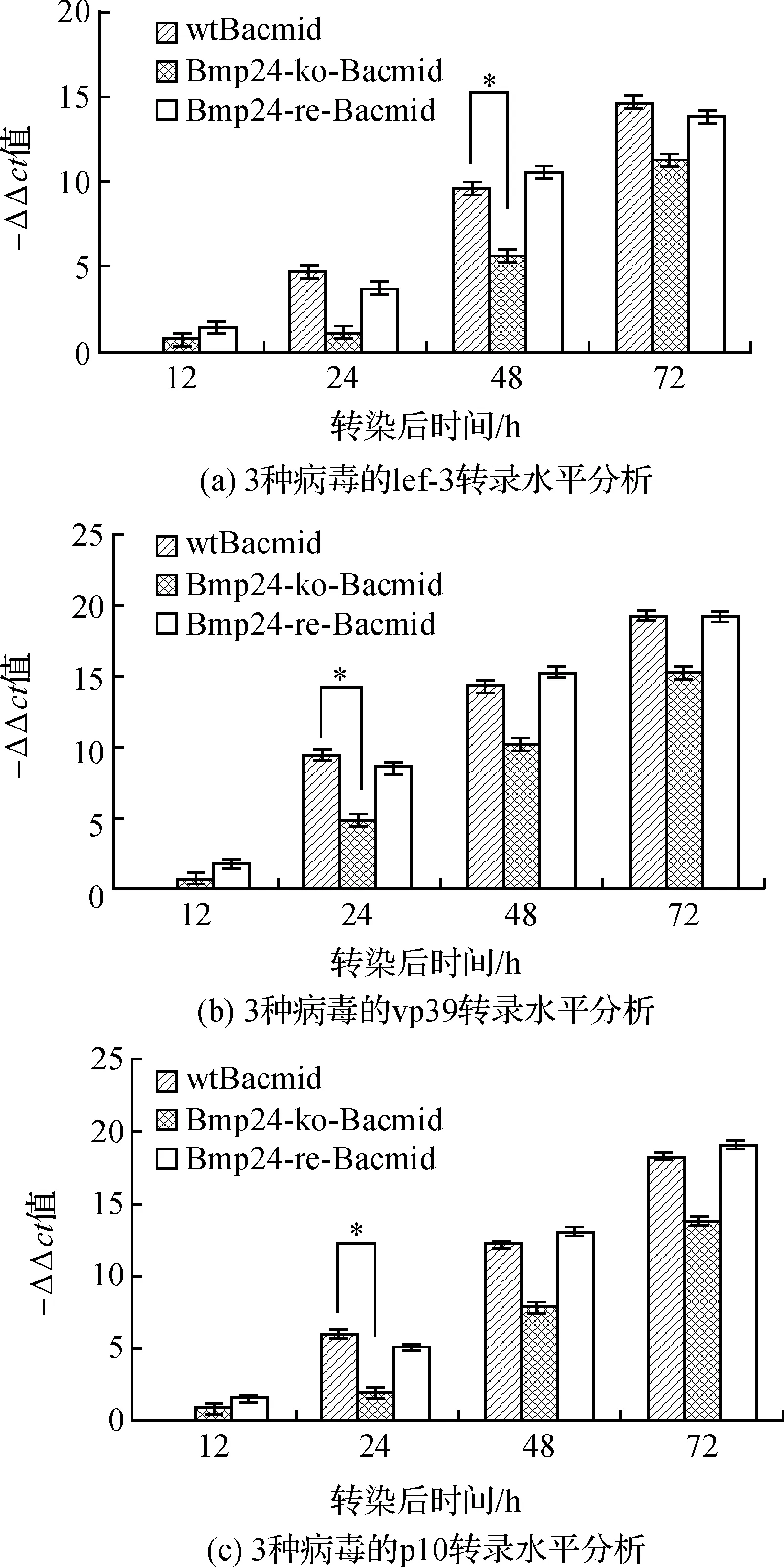
图6 3种病毒对病毒基因组转录水平的影响
3 讨 论
前期实验研究发现p24基因表达的蛋白是重要的核衣壳相关蛋白,但该基因在病毒繁殖和感染中具体的功能仍未知,因此本实验利用Red重组的方法及Bac-to-Bac系统对其在细胞感染中的调控功能进行深入研究。
近年对BmNPV的保守基因研究颇多,而基因敲除是研究基因功能的有效方法之一。Red重组技术构建Bm61基因缺失型和修复型病毒[22],病毒滴度的测定发现转染后12~96h,Bm61的缺失并不会影响子代病毒的滴度,而本研究发现Bmp24基因缺失病毒的滴度值显著低于野生型(P<0.05);同时电镜实验进一步发现Bmp24基因的缺失影响子代病毒粒子的包装,而其对子代病毒的增殖和包装的影响机理有待深入研究。
在AcMNPV基因组中插入转座子使p24基因失活,发现该基因的失活对基因组复制没有显著影响[23];本实验发现Bmp24的缺失对BmNPV的gp41基因复制无显著影响,p24对BmNPV和AcMNPV病毒基因复制具有相似的功能。qRT-PCR实验结果显示Bmp24缺失虽然对基因复制没有显著影响,但Bmp24的缺失会显著降低BmNPV的早期基因lef-3、晚期基因vp39和极晚期基因p10的转录水平,其作用机制有待深入研究。
另外,Bm56同Bmp24一样,也是家蚕核型多角体病毒中重要的结构基因[24],以往研究通过qPCR实验发现Bm56缺失对BmNPV病毒基因组复制和转录都没有显著影响,而本研究发现Bmp24缺失对于BmNPV病毒基因组复制水平没有显著影响,但它的缺失却显著降低病毒的转录水平。然而Bmp24和Bm56对BmNPV病毒基因组复制的作用机理是否相同,有待进一步研究;而两者对病毒基因组转录作用的差异及其机制,也有待深入研究。
本实验研究发现Bmp24基因具有一定的调控功能,影响子代病毒增殖和组装,抑制BmNPV病毒基因组的转录。
[1] JEHLE J, BLISSARD G, BONNING B, et al. On the classification and nomenclature of baculoviruses: a proposal for revision[J]. Arch Virol, 2006, 151: 1257-1266.
[2] PENG K, VAN OERS M M, Hu Z, et al. Baculovirus per os infectivity factors form a complex on the surface of occlusion-derived virus[J]. J Virol, 2010, 84(18): 9497-9504.
[3] GOMI S, MAJIMA K, MAEDA S. Sequence analysis of the genome ofBombyxmorinucleopolyhedrovirus[J]. J Gen Virol, 1999, 80(5): 1323-1337.
[4] YU M, CARSTENS E B. Identification of a domain of the baculovirusAutographacalifornicamultiple nucleopolyhedrovirus single-strand DNA-binding protein LEF-3 essential for viral DNA replication[J]. J Virol, 2010 , 84(12): 6153-6162.
[5] MIKHAILOV V, ROHRMANN G. The baculovirus replication factor LEF-1 is a DNA Primase[J]. J Virol, 2002, 76: 2287-2297.
[6] ZHANG J, DONG Z Q, ZHANG C D, et al. Identification of a novel nuclear localization signal of baculovirus late expression factor 11[J]. Virus Res, 2014 , 184: 111-119.
[7] MCCARTHY C B, THEILMANN D A. AcMNPV ac143 (odv-e18) is essential for mediating budded virus production and is the 30 th baculovirus core gene[J]. Virology, 2008, 375 (1): 277-291.
[8] SPARKS W O, HARRISON R L, BONNING B C.Autographacalifornicamultiple nucleopolyhedrovirus ODV-E56 is a per os infectivity factor, but is not essential for binding and fusion of occlusion-derived virus to the host midgut[J]. Virolggy, 2011, 409(1): 69-76.
[9] GUO Z J, QIU L H, AN S H, et al. Open reading frame 60 of theBombyxmorinucleopolyhedrovirus plays a role in budded virus production[J]. Virus Research, 2010, 151: 185-191.
[10] WU W, LIANG H, KAN J, et al.Autographacalifornicamultiple nucleopolyhedrovirus 38K is a novel nucleocapsid protein that interacts with VP1054, VP39, VP80, and itself[J]. J Virol, 2008, 82(1): 12356-12364.
[11] GE J Q, YANG Z N, TANG X D, et al. Characterization of a nucle-opolyhedrovirus with a deletion of the baculovirus core gene Bm67[J]. J Gen Virol, 2008, 89: 766-774.
[12] TANG Q, LI G H, YAO Q, et al. Bm91 is an envelope component of ODV but is dispensable for the propagation ofBombyxmorinucleopolyhedrovirus[J]. Journal of Invertebrate Pathology, 2013, 113(1): 70-77.
[13] GOMBART A F, BLISSARD G W , ROHRMANN G F. Characterization of the genetic organization of the HindIII M region of the multicapsid nuclear polyhedrosis virus ofOrgyiapseudotsugatapserdotsugatareveals major differences among baculoviruses[J]. Journal of General Virology, 1989, 70(a): 1815-1828.
[14] WOLGAMOT G M, GROSS C H, RUSSELL R L Q, et al. Immunocytochemical characterization of p24, a baculovirus capsid-associated protein[J]. Journal of General Virology , 1993, 74: 103 -107.
[15] BJORNSON R M , ROHRMANN G F. Nucleotide sequence of the polyhedron envelope protein gene region of the Lyrnantria dispar nuclear polyhedrosis virus[J]. Journal of General Virology, 1992, 73(a): 1499-1504.
[16] LIN G, BLISSARD G W. Analysis of anAutographacalifornicanucleopolyhedroviruslef-11 knockout: LEF-11 is essential for viral DNA replication[J]. J Virol, 2002a , 76 (6): 2770-2779.
[17] LIN G, BLISSARD G W. Analysis of anAutographacalifornicamulticapsid nucleopolyhedroviruslef-6-null virus: LEF-6 is not essential for viral replication but appears to accelerate late gene transcription[J]. J Virol, 2002b, 76 (11): 5503-5514.
[18] LI Y, WANG J, DENG R, et al. Vlf-1 deletion brought AcMNPV to defect in nucleocapsid formation[J]. Virus Genes , 2005, 31: 275-284.
[19] VANARSDALL A L, OKANO K, ROHRMANN G F. Characterization of the replication of a baculovirus mutant lacking the DNA polymerase gene[J]. Virology, 2005, Jan 5;331(1): 175-180.
[20] VANARSDALL A L, OKANO K, ROHRMANN G F. Characterization of the role of very late expression factor 1 in baculovirus capsid structure and DNA processing[J] J Virol, 2006, 80(4): 1724-1733.
[21] YU W, DU C Y, QUAN Y P, et al. Characterization of late gene expression factor LEF-10 fromBombyxmorinucleopolyhedrovirus[J]. Virus Res, 2013, 175(1): 45-51.
[22] SHEN H X, CHEN K P. BM61 ofBombyxmorinucleopolyhedrovirus: Its involvement in the egress of nucleocapsids from the nucleus[J]. FEBS Letters, 2012, 586(1): 990-995.
[23] GOMART A F, PEARSON M N, ROHRMANN G F, et a1. A baculovirus polyhedral envelope-associated Protein: genetic location, nucleotide sequence, and iramtmocytochemical characterization [J]. Virology, 1989, 169(1): 182-193.[24] 石扬辉, 朱丽萍, 张臣,等, 家蚕核型多角体病毒(BmNPV)Bm56缺失对病毒复制和转录的影响[J]. 浙江理工大学学报:自然科学版, 2014, 31(6): 734-739.
(责任编辑: 许惠儿)
Effect ofBmp24 Deficiency on Replication, Transcription and Virus Assembly of BmNPV
CHENChena,YUWeia,b,SHILilia,b,GONGChengjiana,b,JIANGLeia,b,TONGFudana,b
(a. Institute of Biochemistry; b.Zhejiang Provincial Key Laboratory of Silkworm Bioreactor and Biomedicine, Zhejiang Sci-Tech University, Hangzhou 310018, China)
This research intends to study the biological function of Bmp24. We constructed Bmp24-ko-Bacmid Red recombination technology and Bac-to-Bac system. Then, Bmp24-ko-Bacmid, Bmp24-re-Bacmid and wtBacmid transfected BmN cells. It was found through virus titer that the three viruses could generate viable progeny virus and induce cell pathogenesis, but the titerring values of Bmp24-ko-Bacmid was markedly lower than the other two types of viruses in various phases (P<0.05). Transmission electron microscopy result shows that among the cells infected by Bmp24-ko-Bacmid, there is only a small amount of long slender rod-shaped structures, while the other two virus-infected cells can produce large amounts of mature virus particles with capsule package. The qPCR result shows that lack of Bmp24 will not affect the replication of the viral genome. And the qRT-PCR result shows that lack of Bmp24 will reduce the transcription levels of early gene, late gene and very late gene which are significantly lower than that of the wild-type virus (P<0.05).
bmnpv;Bmp24 gene; Red recombination system; Bac-to-Bac system;
10.3969/j.issn.1673-3851.2016.01.018
2015-02-11
国家高技术研究发展计划“863”项目(2011AA100603)
陈琛(1988-),女,安徽淮南人,硕士研究生,主要从事生物反应器与蛋白质组学方面的研究。
童富淡,E-mail:fdtong@zstu.edu.cn
Q812
A
1673- 3851 (2016) 01- 0109- 07 引用页码: 010704
