几种经典有机反应的分子轨道描述
2016-09-14许家喜北京化工大学理学院有机化学系北京100029
许 薇 许家喜(北京化工大学理学院有机化学系,北京100029)
·知识介绍·
几种经典有机反应的分子轨道描述
许薇许家喜*
(北京化工大学理学院有机化学系,北京100029)
用分子轨道来描述有机反应的过程对于正确理解有机反应的机理非常重要,分子轨道可以清楚地描述出反应的选择性和立体化学等信息。本文讨论了脂肪和芳香亲核取代、芳香亲电取代、加成和消除等几种经典有机化学反应过程的分子轨道描述。
有机反应;分子轨道;亲核取代;加成;消除
www.dxhx.pku.edu.cn
在有机化学的学习中,用分子轨道来描述有机反应的过程对于正确理解有机反应机理非常重要,分子轨道不仅可以清楚地描述有机反应的过程,还可以帮助说明和解释反应的选择性和立体化学等信息。但是,分子轨道理论相对比较抽象,不论是教师讲授,还是学生学习,都感到比较困难。甚至目前广泛应用的有机化学教科书中对于非常重要和典型的脂肪双分子亲核取代反应SN2反应过程的分子轨道描述都是错误的。因此,我们认为有必要讨论一下有机化学中经典反应过程的分子轨道描述。我们在这里不再赘述分子轨道理论,只讨论基础有机化学中经典反应过程的分子轨道描述。希望本文能够对教师授课和学生的学习和理解提供有益的帮助。
1 有机化学中化学键形成和断裂的分子轨道描述
分子轨道对称性守恒原理是基本化学理论之一。这个原理说明了分子轨道的对称性对化学反应进行的难易程度及产物构型起决定性作用,使人们对反应动力学和反应机理的认识深入到了物质微观结构层次。当反应物和产物的分子轨道对称特征一致时,反应就容易发生;而不一致时,反应就不容易进行。即在基元反应中分子轨道的对称性保持不变[1,2]。
正确理解化学键形成和断裂的分子轨道描述是用分子轨道准确描述有机反应过程的基础。所以,这里先介绍一下基础有机化学中涉及的典型化学键形成和断裂的分子轨道描述[3,4]。只有波相相同的2个原子轨道或分子轨道之间才能够形成化学键,波相相反则形成反键。有机化学中常见的化学键包括σ键和π键。由2个波相相同的s轨道可以形成氢分子的σ键、由波相相同的s和p轨道形成σ键(如由氢原子和卤素原子形成卤化氢分子)、由2个波相相同的p轨道形成σ键(如由2个卤素原子形成卤素分子)、由波相相同的s轨道和spn(n=1,2,3)杂化轨道形成σ键(如由氢原子和碳原子的sp,sp2或sp3杂化轨道形成C-H键)、由波相相同的p轨道和spn(n=1,2,3)杂化轨道形成σ键(如由卤素原子和碳原子的sp,sp2或sp3杂化轨道形成C-X键)、由波相相同的2个spn(n=1,2,3)杂化轨道形成σ键(如由2个碳原子形成C-C键)、由2个波相相同的p轨道形成π键(如由2个碳原子形成C=C键或1个碳原子和1个氮原子或氧原子形成的C=N或C=O双键等)、及由n个p轨道形成共轭体系(如由n个碳原子形成的p-π和π-π键)等。化学键的断裂过程就是其形成的逆过程。
2 经典有机反应过程的分子轨道描述
单分子的电环化和电开环,以及σ迁移反应等周环反应的分子轨道描述在很多教材中都讲述得非常清楚[5,6],在此不再赘述。本文主要讨论对双分子反应的分子轨道描述[7]。分子轨道理论认为,双分子反应应该满足下列3个基本条件:
(1)起决定性作用的轨道是两个反应物分子中一个分子的最高已占轨道(HOMO)和另一分子的最低空轨道(LUMO),当两分子接近时,电子便从一个分子的HOMO流入另一分子的LUMO。
(2)当两个分子互相接近时,一个分子的HOMO与另一分子的LUMO拟形成化学键重叠部分的波相必须相同。即这两个起决定性作用的轨道必须具有相同的对称性,应属于点群中的同一对称类型。而且,如有可能,还要两个轨道之间轨道系数大的一段彼此重叠,轨道系数小的一段相互重叠,这样重叠最有效,从而显示出反应的选择性[8],如Diels-Alder反应的区域选择性。
(3)互相起作用的HOMO和LUMO轨道能量必须接近(约在6 eV范围内)。对一个基元反应,如果找不到一对轨道满足上述所有条件,则该反应就很难按这种方式进行,称为对称禁阻的反应。
首先来看目前一些有机化学教科书中关于脂肪SN2反应过程的分子轨道描述[3,9-11],在该描述中,亲核试剂都是从一端进攻C-X键的σ成键轨道,具体来说就是进攻碳原子形成C-X键的sp3轨道中较小的一瓣(图1)。这就相当于是亲核试剂(Nu:)的HOMO轨道与卤代烷C-X键的HOMO轨道反应,这肯定是不正确的。可是,现行的有机化学教科书中却都是这样来描述的。我们都知道:两个物质之间的反应,一定是一个物质的HOMO轨道与另一个物质的LUMO轨道反应。只有这样,HOMO轨道中的一对电子填充在新形成的能量较低的成键轨道中,而新形成的能量较高的反键轨道是空的,反应后体系能量较低,反应才可以发生。如果是两个物质的HOMO轨道发生反应,这两个HOMO轨道中的两对电子将分别填充在新形成的成键和反键轨道中,反应将无法发生。两个物质的LUMO轨道也无法反应,因为两个LUMO轨道中都没有电子,没有电子可以填充在新形成的成键轨道中,成键轨道中没有共享的电子对,该化学键也就没有形成。脂肪SN2反应过程的正确描述应该是:亲核试剂的HOMO轨道进攻卤代烷C-X键的反键轨道,即卤代烷的LUMO轨道,从而在亲核试剂与碳原子间形成新的化学键,原来的C-X键则发生断裂。即该亲核取代反应过程涉及2个化学键,亲核试剂带有孤电子对的HOMO轨道从卤代烷C-X键空的反键轨道σ*C-X的外端进攻,才能实现轨道系数大的轨道有效重叠,在亲核试剂与碳原子间形成新化学键[4];同时,原来的σC-X键拉长发生断裂(图1)。同时也说明了亲核试剂之所以从背面进攻,是由于轨道的有效重叠。
卤代烷双分子消除反应(E2)的分子轨道描述如下:碱OH-进攻C-X键邻位碳原子的C-H键的反键轨道σ*C-H,接近形成O-H键,同时C-H键和C-X键拉长。此时,相邻2个碳原子的p轨道已经接近形成π键。由于这两个p轨道要形成C=C键的π键,因此它们必须在一个平面内,才有利于π键的形成。这就是为什么E2消除要求消除的氢原子和卤素原子要反式共平面的原因(图2)。
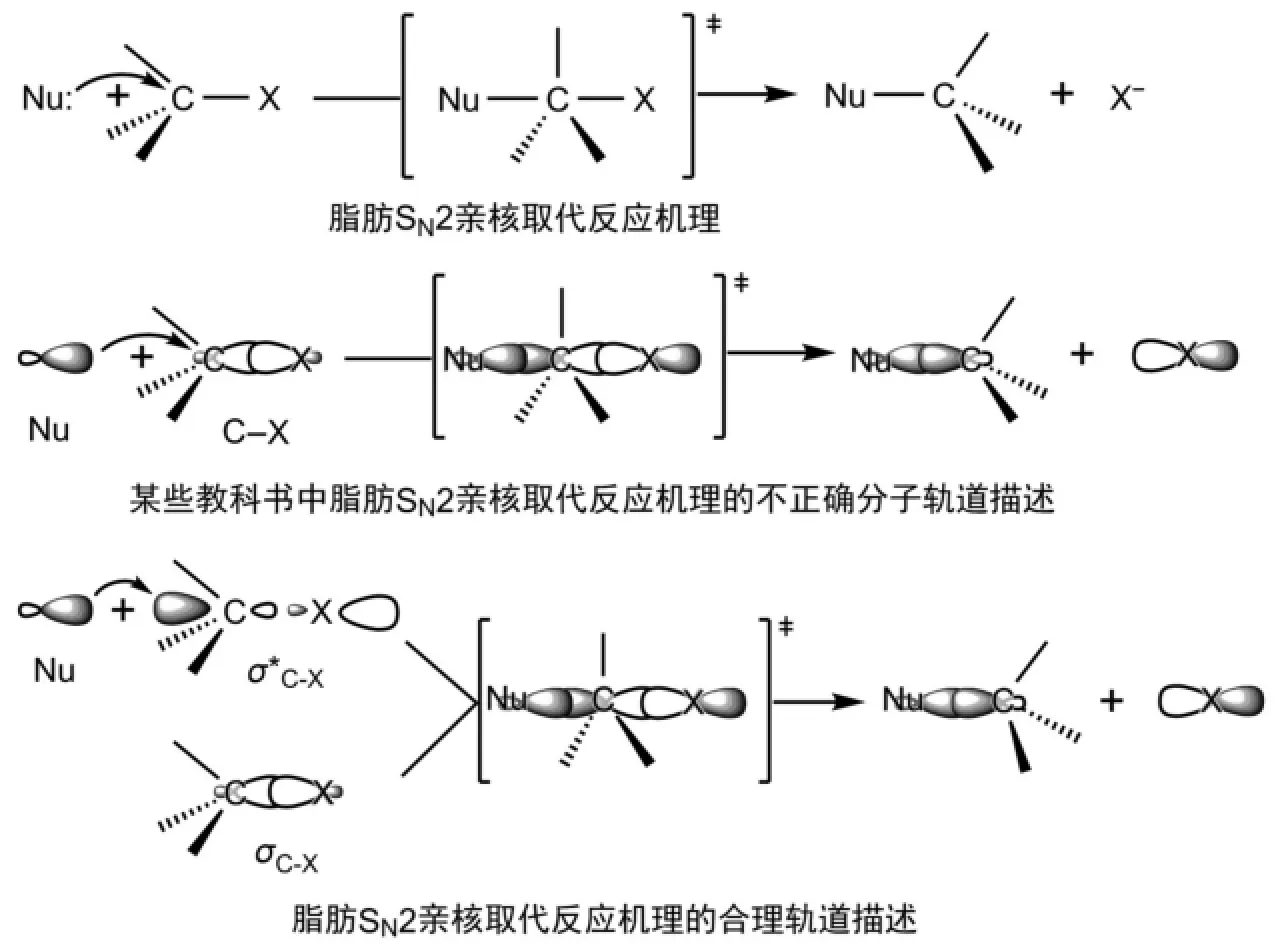
图1 脂肪SN2反应过程的分子轨道描述
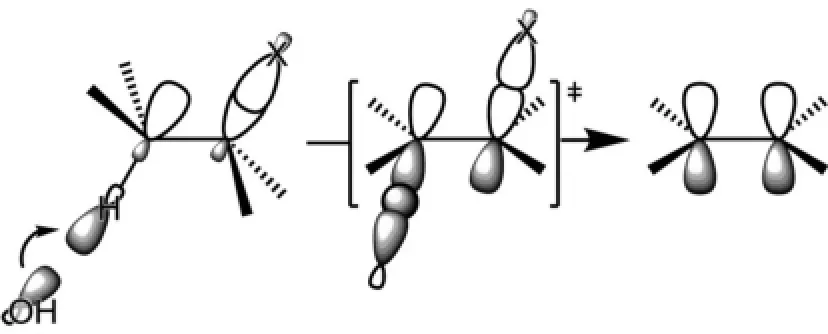
图2 双分子消除反应的分子轨道描述
溴对烯烃的亲电加成是由溴分子异裂生成的溴正离子的LUMO轨道与C=C键的π键HOMO轨道相互作用,该相互作用由于溴原子比较大有利于形成三元环状的环丙溴正离子中间体。然后,溴负离子作为亲核试剂进攻C-Br键的反键轨道σ*C-Br,在亲核试剂Br-与碳原子间形成新化学键,同时,被进攻的σC-Br键拉长发生断裂,从而三元环打开,实现溴对烯烃的加成。从反应过程就可以看出,生成的邻-二溴产物一定是反式加成产物(图3)。
卤化氢对烯烃的亲电加成就是氢离子先与C=C键的π键HOMO轨道相互作用形成三元环状中间体,由于氢离子太小,形成的三元环不稳定,很容易开环形成碳正离子。卤素负离子对三元环开环得到反式-加成产物,而卤素负离子对碳正离子的亲核加成可以从p轨道的上下两面进行,可以分别得到顺式-和反式-加成产物,所以,该反应的反式选择性并不好(图4)。
在中性条件下,亲核试剂(:NuH)对醛酮羰基的亲核加成是亲核试剂的HOMO轨道对羰基的LUMO轨道的加成,然后通过溶剂(通常是亲核试剂本身)参与的质子化来实现的(图5)。因为氢质子的[1,3]-迁移是轨道对称性禁阻的。
酸催化的亲核试剂(:NuH)对醛酮羰基的亲核加成是质子首先与醛酮羰基的HOMO轨道发生亲电加成,得到质子化的羰基,其会互变异构化成碳正离子(实质是以质子化的羰基和羟基碳正离子的杂化体形式存在),亲核试剂再进攻碳正离子的LUMO轨道,得到质子化的加成产物,然后去掉氢质子得到产物(图6)。
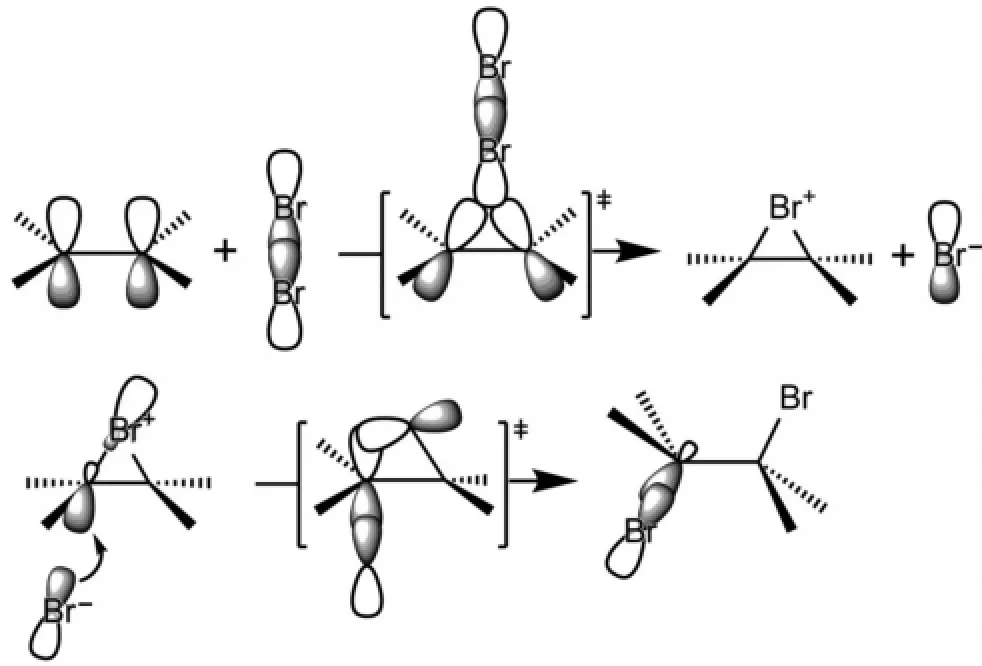
图3 溴对烯烃亲电加成反应机理的分子轨道描述
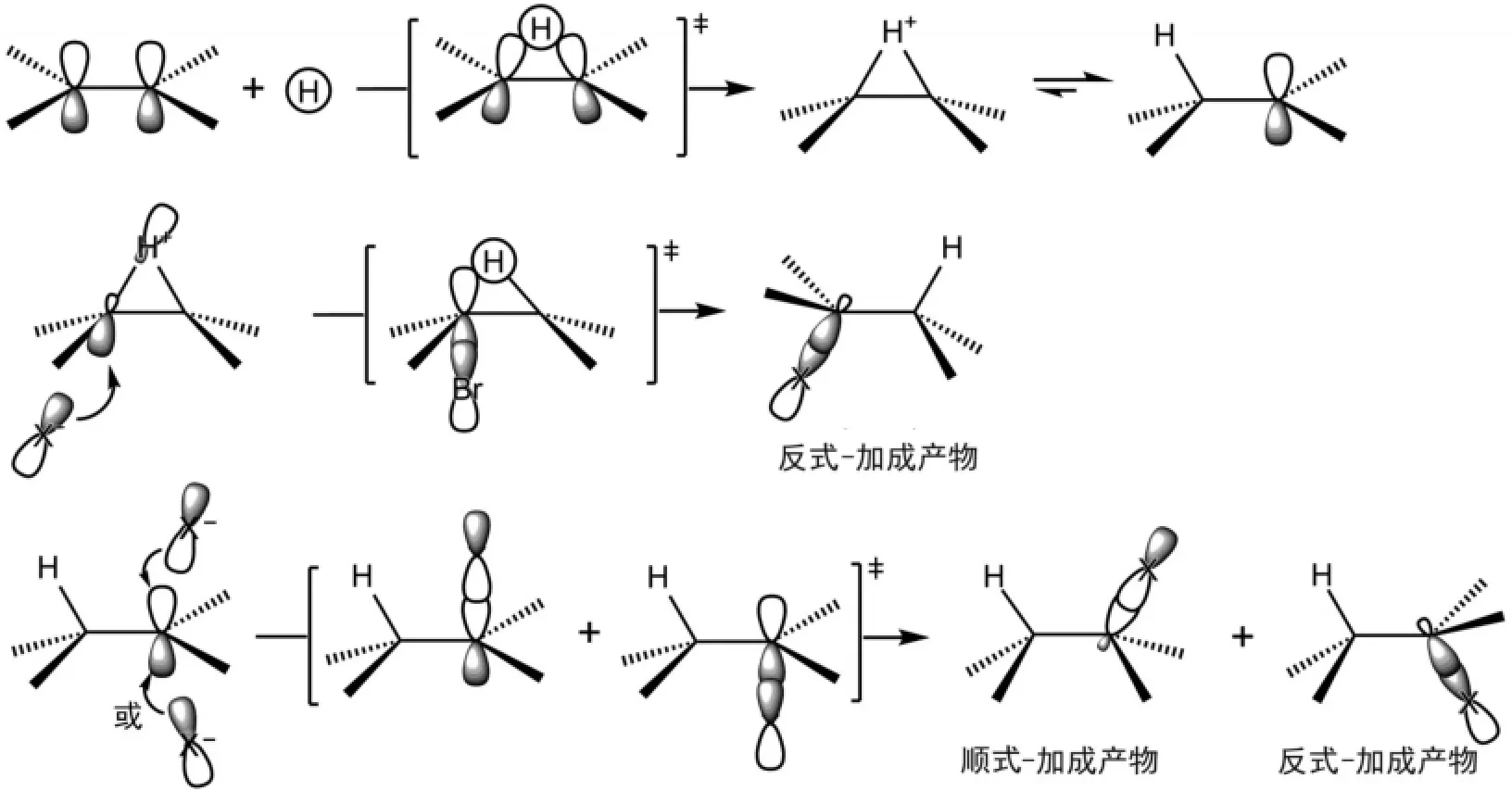
图4 卤化氢对烯烃亲电加成反应机理的分子轨道描述
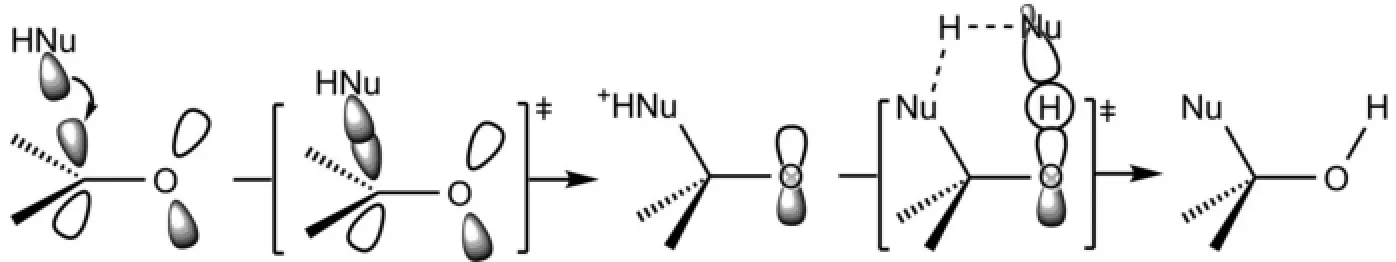
图5 亲核试剂对醛酮羰基亲核加成反应机理的分子轨道描述
羧酸衍生物的相互转化都是通过亲核试剂(:Nu-)对羧酸衍生物羰基的亲核加成-消除过程来实现的。亲核试剂的HOMO轨道首先对羰基的LUMO轨道进行加成,得到四面体负离子中间体,该四面体中间体的C-O键发生旋转,使容易离去的L基团与氧原子的p轨道处于同一平面上,然后发生消除反应,C-L键断裂得到新的羧酸衍生物。对中性亲核试剂参与的和酸催化的羧酸衍生物的转化反应的分子轨道描述在此不再赘述(图7)。
芳香亲电取代反应的分子轨道描述是,亲电试剂E+的LUMO轨道首先与苯环的HOMO轨道反应,形成环己二烯碳正离子中间体,苯环存在两个轨道能量相同的简并HOMO轨道,这里只选取其中的一个来讨论,该中间体再发生C-H断裂,得到芳香亲电取代反应产物(图8)。
芳香亲核取代反应的分子轨道描述是,亲核试剂Nu-的HOMO轨道首先与苯环的LUMO轨道反应,形成环己二烯碳负离子中间体,苯环存在两个轨道能量相同的简并LUMO轨道,这里只选取其中的一个来讨论(苯环上的取代基对其不同碳原子的轨道系数是有影响的,这里只是定性描述,忽略了取代基对轨道大小的影响),该中间体再发生C-L断裂,得到芳香亲核取代反应产物(图9)。
自由基取代和加成反应[3,12]、周环反应中的电环化和电开环、环加成反应以及σ迁移反应的分子轨道描述在很多教材和文章中都讲述得非常清楚[5,13],在此不再赘述。本文讨论了基础有机化学中经典反应过程的分子轨道描述,希望能够对教师授课和学生的学习和理解提供有益的帮助,为今后更好地利用分子轨道理论来解释复杂有机化学反应奠定基础。分子轨道理论不仅在解释和预测许多化学反应上表现出了强大优势,而且在指导有机合成等方面也显示出很好的实用价值,因而其在有机化学中的应用具有非常重要的意义。
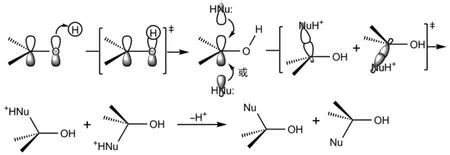
图6 酸催化亲核试剂对醛酮羰基亲核加成反应机理的分子轨道描述
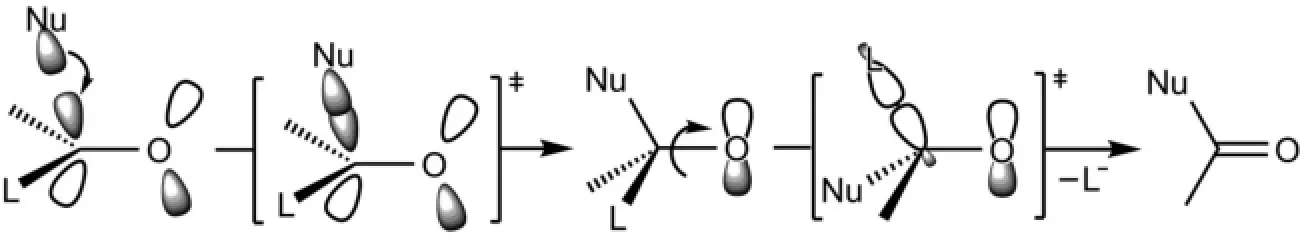
图7 羧酸衍生物转化的亲核加成-消除反应机理的分子轨道描述
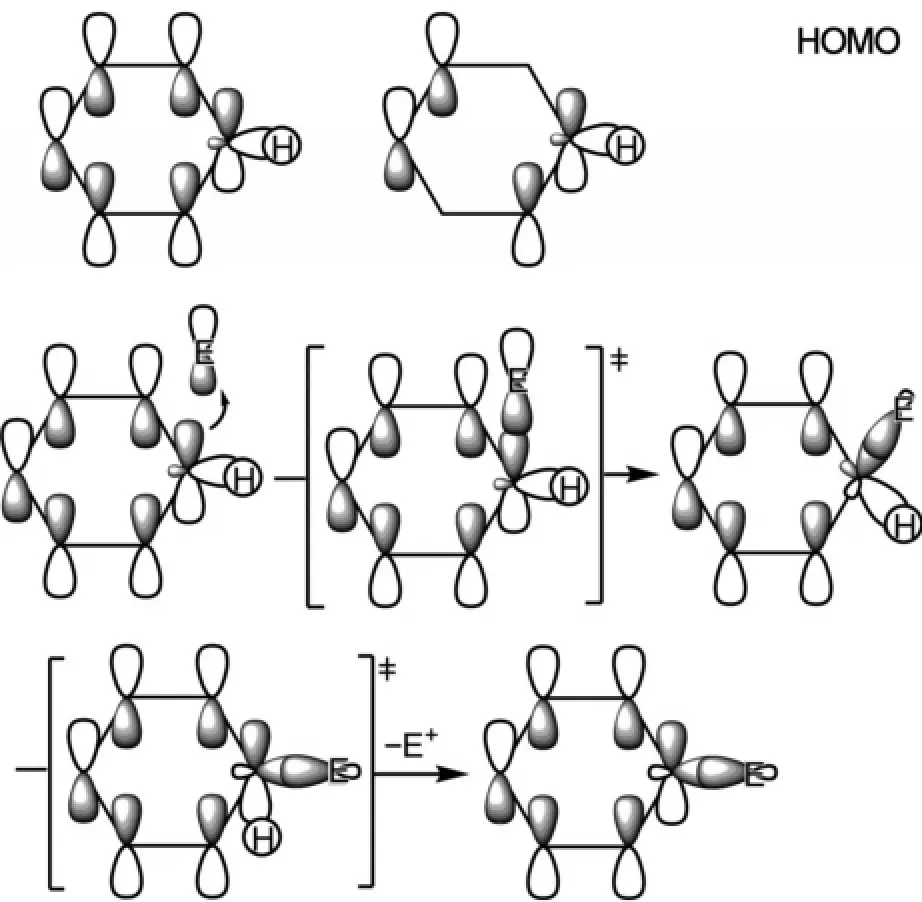
图8 芳香亲电取代反应机理的分子轨道描述
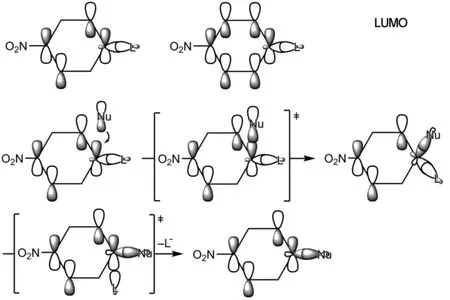
图9 芳香亲核取代反应机理的分子轨道描述
[1]Fukui,K.;Shing,H.J.Chem.Phys.1952,20,722.
[2] Fukui,K.;Yonezawa,T.;Shing,H.J.Chem.Phys.1954,22,1433.
[3]Volhardt,K.P.C.;Schore,N.E.Organic Chemistry,6th ed.;W.H.Freeman and Company:New York,2011;pp 228.
[4]McMurry.J.Organic Chemistry,8th ed.;Thomson Brooks Cole:New York,2011;pp 377.
[5]邢其毅,徐瑞秋,周政,裴伟伟.基础有机化学.第2版.北京:高等教育出版社,2005:833-860.
[6]郭文生,刘凤澡,袁履冰.大学化学,1992,7(1),17.
[7] 李笃.化学通报,1977,No.1,53.
[8]尚振海.有机反应中的电子效应.北京:高等教育出版社,1992:146.
[9]Wade,L.G.,Jr.Organic Chemistry,2nd ed.;Prentice Hall,Inc.:New York,1991;pp 178.
[10]李艳梅,赵圣印,王兰英,罗自萍,李兆陇,黄志敏,麻远.有机化学.北京:科学出版社,2011:142.
[11]伍越寰,李伟昶,沈晓明.有机化学.合肥:中国科技大学出版社,2002:246.
[12]Streitwieser,A.ACS Sym.Ser.2013,1122(Pioneers of Quantum Chemistry),275.
[13]虞忠衡.有机化学,1996,16,97.
Molecular Orbital Description on Several Classical Organic Reactions
XU WeiXU Jia-Xi*
(Department of Organic Chemistry,Faculty of Science,Beijing University of Chemical Technology,Beijing 100029,P.R.China)
It is very important to describe organic reaction processes with molecular orbitals,especially frontier orbitals,for correct and completely understanding of organic reaction mechanisms.Molecular orbital description can provide useful information on selectivity and stereochemistry of organic reactions.Molecular orbital descriptions on several classic organic reactions,including aliphatic and aromatic nucleophilic substitutions,electrophilic aromatic substitution,addition and elimination,are discussed.
Organic reaction;Molecular orbital;Nucleophilic substitution;Addition;Elimination
O621.1;G64
10.3866/PKU.DXHX201510006
,Email:jxxu@buct.edu.cn
