黄瓜绿斑驳花叶病毒安徽分离物全基因组序列测定及分析
2016-09-14严丹侃张海珊郑红英章东方
严丹侃, 张海珊, 郑红英, 燕 飞, 章东方*
(1. 安徽省农业科学院植物保护与农产品质量安全研究所, 合肥 230031;2. 浙江省农业科学院病毒学与生物技术研究所, 杭州 310021)
黄瓜绿斑驳花叶病毒安徽分离物全基因组序列测定及分析
严丹侃1,张海珊1,郑红英2,燕飞2,章东方1*
(1. 安徽省农业科学院植物保护与农产品质量安全研究所, 合肥230031;2. 浙江省农业科学院病毒学与生物技术研究所, 杭州310021)
通过胶体金免疫层析试纸条和RT-PCR等手段对采自安徽和县的西瓜病株进行检测,确定其病原为黄瓜绿斑驳花叶病毒(Cucumbergreenmottlemosaicvirus, CGMMV)。为明确CGMMV安徽分离物CGMMV-Anhui的分类地位,进一步克隆了该病毒的全基因组序列,分析了其基因组结构特征。结果表明,CGMMV-Anhui基因组全长为6 423 bp (GenBank登录号 KT236095),与已报道的CGMMV的编码区的基因结构一致,仅5′和3′端非编码区核苷酸数目略有差异。将CGMMV-Anhui与已报道的分离物的全基因组序列和外壳蛋白基因序列进行系统发育分析,显示CGMMV 不同分离物可分为亚洲和欧洲两个组,安徽分离物CGMMV-Anhui与亚洲分离物亲缘关系较近,可能具有共同的侵染源。
黄瓜绿斑驳病毒;安徽分离物;基因组;序列分析
黄瓜绿斑驳花叶病毒(Cucumbergreenmottlemosaicvirus,CGMMV),为烟草花叶病毒属(Tobamovirus)成员,主要侵染葫芦科作物,致使植株生长缓慢、矮化,叶片出现色斑、水疱及变形;结果延迟,甚至不育。西瓜感染该病毒后,种子周围的果肉呈紫红色或暗红色的水渍状,西瓜成熟后,变为暗褐色且出现空洞,失去经济价值,给农民带来巨大的经济损失。常温下,该病毒的侵染力可保持数月,极易通过汁液传播。种子带毒是其远距离传播的主要方式[1-2]。该病毒自Ainsworth首次在黄瓜上发现并报道以来[3],在世界上许多国家被相继发现。在我国,该病毒于1986年在台湾首次被报道[4],随后,2004年从日本进口的南瓜种子中被截获,之后2005年在广西某农业展示中心的观赏南瓜叶片上分离得到[5]。根据我国农业部公布的《全国农业植物检疫性有害生物分布行政区名录(2014)》,辽宁、上海、江苏、浙江、安徽、山东、湖北、湖南、广东、广西、海南等11个省区市74个县市区均有CGMMV分布。
CGMMV是一种正单链RNA病毒,直杆状,大小为300 nm×18 nm。该病毒基因组大小约6 423 bp,编码至少4个蛋白,2个复制酶蛋白 (186 kD和 129 kD)、运动蛋白 (30 kD)和外壳蛋白 (17.5 kD)[6]。目前,日本[7]、西班牙[8]、印度[9]、以色列[1]、韩国[10]和加拿大[11]等国家已报道了该病毒多个分离物的基因组信息。在我国,辽宁分离物[12]、北京分离物、山东分离物[13-14]、河北分离物[15]和海南分离物[16]等的全基因组或近全基因组序列都已测定并报道。
2015年笔者在安徽和县发现个别西瓜种植大棚出现疫情,病株叶片出现浅绿色的斑纹,上端叶片皱缩,植株矮小、生长缓慢。运用胶体金免疫层析试纸条检测,发现阳性样本后,将病样采回,运用分子生物学的方法,进一步检测和鉴定,确定为CGMMV侵染。本文克隆了该病毒分离物的全基因组序列并分析了其基因组结构特征,与已报道分离物进行系统进化相关性分析,以期揭示CGMMV安徽分离物(CGMMV-Anhui)的基因组信息及系统进化情况,为研究该病毒的传播途径提供依据。
1 材料与方法
1.1材料
病毒病样: 2015年5月10日采集于安徽和县历阳镇西瓜大棚中,干燥保存于-70℃冰箱中备用。
主要试剂:MiniBEST Plant RNA Extraction Kit和PrimeScriptTMOne Step RT-PCR Kit购自TaKaRa公司,克隆载体pUCm-T和琼脂糖凝胶DNA回收试剂盒等购自上海生工生物工程有限公司,黄瓜绿斑驳花叶病毒胶体金免疫层析试纸条购自美国Agdia公司。
引物:CGMMV鉴定所用引物CGMMV-F和CGMMV-R由浙江大学生物技术研究所谢艳老师提供,扩增片段大小约850 bp;4对用于CGMMV-Anhui全基因组序列扩增的引物参考钟敏等[15]的报道。引物序列见表1,所有引物均由生工生物工程 (上海) 股份有限公司合成。
病毒RNA:称取100 mg西瓜病株叶片,在液氮中磨碎,使用MiniBEST Plant RNA Extraction Kit提取叶片总RNA,溶解于经DEPC处理的灭菌超纯水中,-80℃保存备用。

表1 CGMMV-Anhui 基因组序列扩增引物
1.2方法
1.2.1黄瓜绿斑驳花叶病毒胶体金免疫层析试纸条检测
参照说明书进行。
1.2.2CGMMV-Anhui 全基因组序列测定与分析
以CGMMV-Anhui侵染发病的西瓜叶片组织总RNA为模板,按照PrimeScriptTMOne Step RT-PCR Kit 说明书,以RT-PCR特异性引物和覆盖CGMMV全基因组序列的4对引物进行PCR扩增,PCR产物在1×TAE电泳缓冲液中,经1%琼脂糖凝胶电泳分离。PCR产物使用UNIQ-10 柱式DNA凝胶回收试剂盒[生工生物工程 (上海) 股份有限公司]回收纯化后,分别与pUCm-T载体连接并转化大肠杆菌DH5α,每个片段选取多个鉴定为阳性的克隆委托生工生物工程(上海) 股份有限公司测序,通过比对选择3个测序结果相同的序列作为最终测序结果,拼接序列获得CGMMV-Anhui全基因组序列,从GenBank中获得20个CGMMV分离物全基因组序列,根据全基因组序列及外壳蛋白(coat protein,CP) 基因序列,分析CGMMV-Anhui与其他分离物的系统进化关系,以KGMMV(NC_003610)为外群。使用DNAstar软件中的MegAlign进行开放阅读框及非编码区序列比对分析。针对全基因组序列和外壳蛋白基因序列,采用Mega 6.0软件进行系统发育树分析,采用邻位相接聚类分析法构建系统发育树,用1 000次重复的自展检验评价系统发育树拓扑结构的可靠性[15]。
2 结果与分析
2.1CGMMV的胶体金免疫层析试纸条和RT-PCR检测
使用黄瓜绿斑驳花叶病毒胶体金免疫层析试纸条对安徽和县西瓜病株和健康叶片进行检测,病株叶片在质控线和测试线均出现紫红色条带,结果为阳性,表明该病株中含有黄瓜绿斑驳花叶病毒;而健康叶片在质控线呈紫红色而测试线未显色,结果为阴性,表明不含黄瓜绿斑驳花叶病毒。使用CGMMV特异性引物(CGMMV-F/CGMMV-R)对检测结果进行验证,结果显示病株叶片可扩增出约850 bp条带,而健康叶片未扩增出条带,对条带进行克隆后测序,结果显示为黄瓜绿斑驳花叶病毒。
2.2CGMMV-Anhui 的全基因组RT-PCR扩增与序列测定
通过4对引物扩增CGMMV-Anhui全基因组序列,获得4段DNA片段,大小与预期一致,分别为1 944、 1 564、1 618和1 466 bp (图1)。将得到的CGMMV基因组各DNA片段进行拼接,得到CGMMV-Anhui全基因组序列,全长6 423 bp,将该序列提交GenBank,登录号为KT236095。
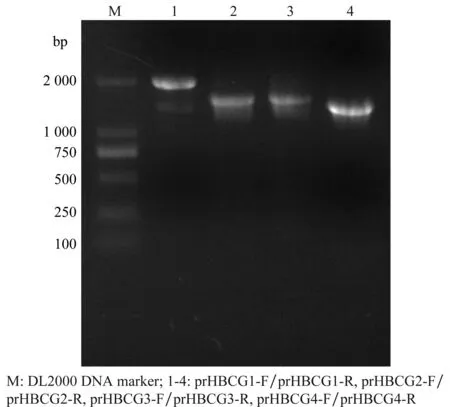
图1 CGMMV-Anhui全基因组序列4 个片段的扩增Fig.1 Amplification of four fragments of CGMMV-Anhui genomic sequence
2.3CGMMV-Anhui基因组序列分析
对CGMMV-Anhui的全基因组序列进行分析表明,其包含5′非编码区(60 bp)、复制酶蛋白(3 435 bp和4 947 bp)、运动蛋白(795 bp)、外壳蛋白(486 bp)和3′非编码区(175 bp)。将CGMMV-Anhui各部分序列与已报道的其他20个CGMMV分离物进行核苷酸比对(表2),基因组核苷酸相似性在90.1%~99.8%,其中与4株欧洲分离物差异最大,与亚洲分离物和北美分离物相似性较高,而与以色列的4个分离物的相似性在94.1%~98.3%,各分离物间的差异较大。将CGMMV-Anhui非编码区序列与其他地区分离物比对发现,5′非编码区的相似性在95.0%~100%,而3′ 非编码区的相似性在93.3%~99.4%。相对而言,4个蛋白质编码区的核苷酸序列变化较大,其中复制酶蛋白编码区与4株欧洲分离物的相似性小于90%。
将CGMMV-Anhui的4个蛋白质的氨基酸序列与其他20个CGMMV分离物进行比对,结果表明,2个复制酶蛋白的氨基酸相似性分别为97.6%~100% 和 97.7%~100%,运动蛋白的相似性为97.7%~99.6%,外壳蛋白的相似性为95.7%~100%。其中与西班牙分离物差异较大,4个蛋白质的氨基酸序列相似性为95.7%~97.8%。
2.4CGMMV-Anhui与其他分离物系统进化分析
基于CGMMV基因组序列构建系统发育树,结果(图2)表明21个CGMMV分离物可分为两个亚组,其中欧洲4个分离物与以色列分离物CGMMV-Ec在同一亚组中。CGMMV-Anhui分离物与其他以色列分离物、亚洲分离物和北美分离物在一个亚组中,其中CGMMV-Anhui与中国河南郑州CGMMV-hn、浙江海宁分离物CGMMV-ZJ、河北分离物CGMMV-chb在同一分支上,而中国山东泰安分离物CGMMV-CCMV-TANG和韩国分离物CGMMV-KW处于同一分支中,辽宁分离物CGMMV-Liaoning与台湾台中分离物CGMMV11单独形成分支。日本、韩国、印度和中国分离物处于同一较大分支中,而北美分离物和以色列CGMMV-Rd和CGMMV-TY分离物处于同一分支中(图2)。相对而言,安徽分离物CGMMV-Anhui与亚洲分离物亲缘关系较近,与欧洲分离物的亲缘关系较远,这与基于外壳蛋白基因序列的系统进化关系分析结果基本一致,但是在各分支上存在差异(图3)。
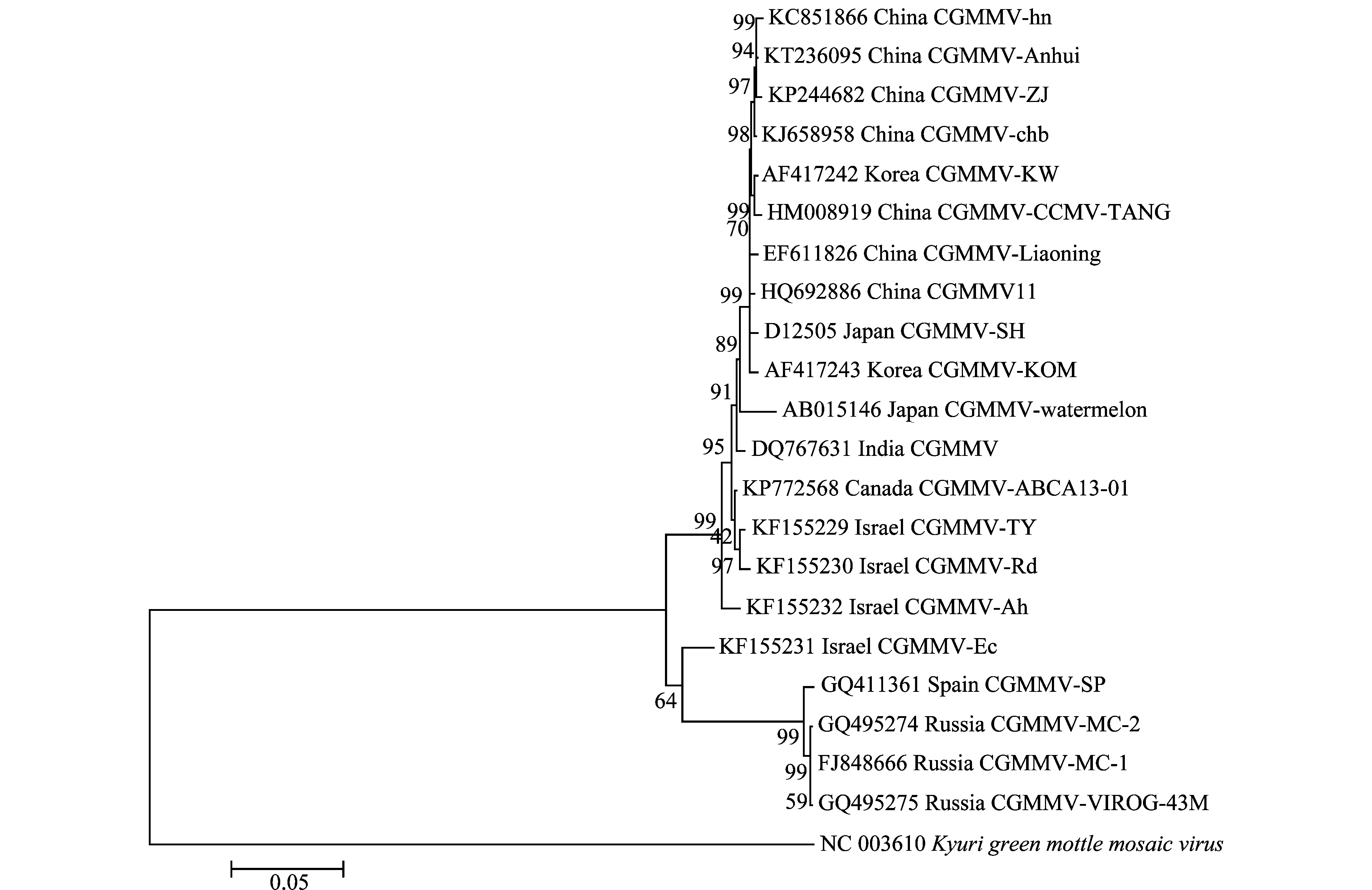
图2 基于CGMMV-Anhui全长基因组序列的CGMMV分离物系统进化关系Fig.2 Phylogenetic relationships of CGMMV-Anhui with other reported isolates based on genomic sequences

图3 基于外壳蛋白基因序列的CGMMV-Anhui 与其他分离物的系统进化关系Fig.3 Phylogenetic relationships of CGMMV-Anhui with other reported isolates based on the gene sequences of coat protein
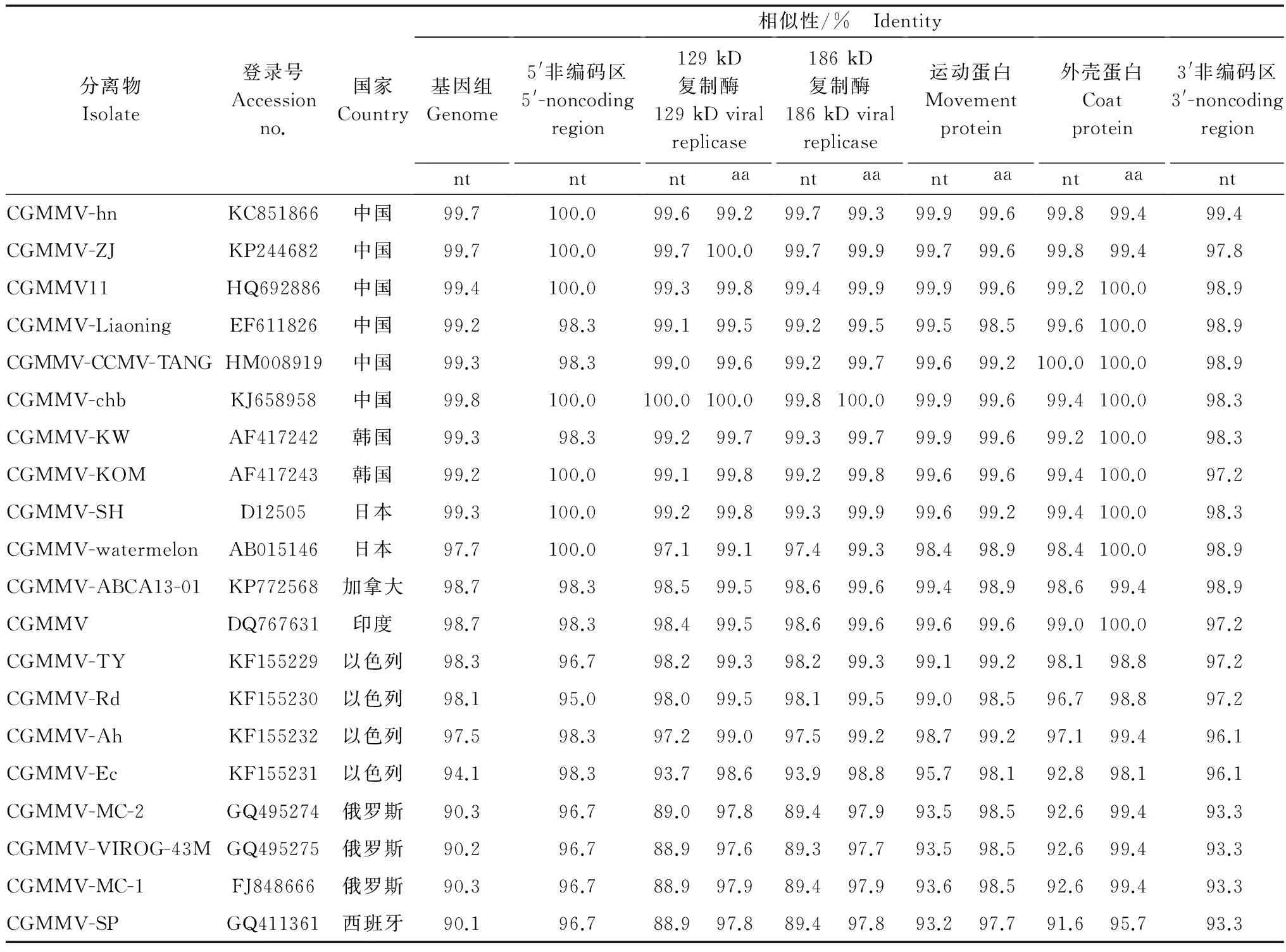
分离物Isolate登录号Accessionno.国家Country相似性/% Identity基因组Genoment5'非编码区5'-noncodingregionnt129kD复制酶129kDviralreplicasentaa186kD复制酶186kDviralreplicasentaa运动蛋白Movementproteinntaa外壳蛋白Coatproteinntaa3'非编码区3'-noncodingregionntCGMMV-hnKC851866中国99.7100.099.699.299.799.399.999.699.899.499.4CGMMV-ZJKP244682中国99.7100.099.7100.099.799.999.799.699.899.497.8CGMMV11HQ692886中国99.4100.099.399.899.499.999.999.699.2100.098.9CGMMV-LiaoningEF611826中国99.298.399.199.599.299.599.598.599.6100.098.9CGMMV-CCMV-TANGHM008919中国99.398.399.099.699.299.799.699.2100.0100.098.9CGMMV-chbKJ658958中国99.8100.0100.0100.099.8100.099.999.699.4100.098.3CGMMV-KWAF417242韩国99.398.399.299.799.399.799.999.699.2100.098.3CGMMV-KOMAF417243韩国99.2100.099.199.899.299.899.699.699.4100.097.2CGMMV-SHD12505日本99.3100.099.299.899.399.999.699.299.4100.098.3CGMMV-watermelonAB015146日本97.7100.097.199.197.499.398.498.998.4100.098.9CGMMV-ABCA13-01KP772568加拿大98.798.398.599.598.699.699.498.998.699.498.9CGMMVDQ767631印度98.798.398.499.598.699.699.699.699.0100.097.2CGMMV-TYKF155229以色列98.396.798.299.398.299.399.199.298.198.897.2CGMMV-RdKF155230以色列98.195.098.099.598.199.599.098.596.798.897.2CGMMV-AhKF155232以色列97.598.397.299.097.599.298.799.297.199.496.1CGMMV-EcKF155231以色列94.198.393.798.693.998.895.798.192.898.196.1CGMMV-MC-2GQ495274俄罗斯90.396.789.097.889.497.993.598.592.699.493.3CGMMV-VIROG-43MGQ495275俄罗斯90.296.788.997.689.397.793.598.592.699.493.3CGMMV-MC-1FJ848666俄罗斯90.396.788.997.989.497.993.698.592.699.493.3CGMMV-SPGQ411361西班牙90.196.788.997.889.497.893.297.791.695.793.3
3 讨论
黄瓜绿斑驳花叶病毒病是我国葫芦科作物上的主要病毒病之一,严重危害西瓜、葫芦等作物[17]。本研究利用胶体金免疫层析试纸条技术在安徽和县西瓜大棚中检测到黄瓜绿斑驳花叶病毒,并利用黄瓜绿斑驳花叶病毒特异性引物对病样进行RT-PCR检测,确定为黄瓜绿斑驳花叶病毒。本研究首次克隆了CGMMV安徽分离物全基因组序列,分析了其基因组结构特征以及与其他分离物的系统发育关系,为揭示我国CGMMV分类地位及该病毒的传播途径奠定了基础。
目前,我国已报道了浙江、河北、山东、辽宁、台湾和海南等多个地区的CGMMV分离物全基因组序列。本研究将获得的安徽分离物CGMMV-Anhui全基因组序列和20个已知CGMMV分离物进行系统发育分析,结果表明CGMMV分离物可以大致分为两组,第Ⅰ组为亚洲组,主要包括中国、日本、韩国、印度分离物,此外还包括1个北美分离物和3个以色列分离物;第Ⅱ组为欧洲分离物,主要包括西班牙和俄罗斯分离物,以及1个以色列分离物。CGMMV-Anhui与我国内陆地区(河北、浙江、河南)的分离物同源性最高,同时与亚洲国家(韩国、日本)分离物同源性也较高,而与欧洲的4个分离物存在非常明显的进化差异。由此可知,CGMMV-Anhui与CGMMV日本和韩国分离物有共同的流行学侵染源,但是西瓜病株采集地未从日本或韩国引种,这说明在我国多地发生CGMMV的情况下,该病毒已在我国定殖,并逐步扩散,新发生的病毒毒源可能来自于国内[16, 18-19]。此外,基于CGMMV全基因组分析发现,相比于我国其他地区,山东的分离物与韩国分离物更为接近,而基于外壳蛋白基因序列分析发现,河北、辽宁分离物与日韩分离物同处于1个分支中,这可能与CGMMV基因组不同位置的进化速度,寄主和地域差异等因素有关,但结果仍需进一步验证。
[1]Antignus Y, Pearlsman M, Ben-Yoseph R, et al. Occurrence of a variant ofCucumbergreenmottlemosaicvirusin Israel[J].Phytoparasitica, 1990, 18(1): 50-56.
[2]Antignus Y, Wang Y, Pearlsman M, et al. Biological and molecular characterization of a new cucurbit-infectingTobamovirus[J].Phytopathology, 2001, 91(6): 565-571.
[3]Ainsworth G C. Mosaic diseases of the cucumber [J].Annals of Applied Biology, 1935, 22(1): 55-67.
[4]Hseu S H, Huang C H, Chang C A, et al. The occurrence of five viruses in six cucurbits in Taiwan [J].Plant Protection Bulletin, Taiwan, 1987, 29(3): 233-244.
[5]秦碧霞, 蔡健和, 刘志明, 等. 侵染观赏南瓜的黄瓜绿斑驳花叶病毒的初步鉴定[J].植物检疫, 2005,19(4):198-200.
[6]Kim O K, Mizutani T, Natsuaki K T, et al. First report and the genetic variability ofCucumbergreenmottlemosaicvirusoccurring on bottle gourd in Myanmar [J].Journal of Phytopathology, 2010, 158(7/8): 572-575.
[7]Ugaki M, Tomiyama M, Kakutani T, et al. The complete nucleotide sequence ofCucumbergreenmottlemosaicvirus(SH strain) genomic RNA [J].Journal of General Virology, 1991, 72(7):1487-1495.
[8]Célix A, Luis-Arteaga M, Rodríguez-Cerezo E. First report of cucumber green mottle mosaic tobamovirus infecting greenhouse-grown cucumber in Spain [J].Plant Disease, 1996, 80(11):1303.
[9]Vani S, Varma A. Properties ofCucumbergreenmottlemosaicvirusisolated from water of river Jamuna [J].Indian Phytopathology, 1993, 46(2):118-122.
[10]Kim K H, Lee J M, Kim S M, et al. Nucleotide sequences of two Korean isolates ofCucumbergreenmottlemosaicvirus[J].Molecules and Cells, 2003, 16(3): 407-412.
[11]Li Rugang, Zheng Yi, Fei Zhangjun, et al. First complete genome sequence of an emergingCucumbergreenmottlemosaicvirusisolate in North America[J].Genome Announcements, 2015, 3(3): e00452-e004515.
[12]陈红运, 林石明, 陈青, 等. 黄瓜绿斑驳花叶病毒辽宁分离物全基因组序列测定[J].病毒学报, 2009, 25(1): 68-72.
[13]Liu Yan, Wang Yanan, Wang Xifeng, et al. Molecular characterization and distribution ofCucumbergreenmottlemosaicvirusin China [J].Journal of Phytopathology, 2009, 157(7/8): 393-399.
[14]田永蕾, 刘冬梅, 张永江, 等. 黄瓜绿斑驳花叶病毒北京和山东分离物的生物学测定及其基因组比较[J].植物检疫, 2009, 23(6):1-6.
[15]钟敏, 赵绪生, 胡同乐, 等. 黄瓜绿斑驳病毒河北分离物基因组克隆及序列分析[J].植物保护学报, 2015, 42(2):182-187.
[16]王峰, 任春梅, 季英华, 等. 黄瓜绿斑驳花叶病毒海南分离物基因组测定与毒源分析[J].植物保护, 2014, 40(6): 75-81.
[17]周玲玲, 吴元华, 赵秀香, 等. 黄瓜绿斑驳花叶病毒生物学特性及对西瓜生长的影响[J].沈阳农业大学学报,2008,39(4):417-422.
[18]李小妮,任小平,王琳, 等. 广东省黄瓜绿斑驳花叶病毒分子检测及防疫[J].植物保护学报, 2009, 36(3): 283-284.
[19]赵慧茹, 林振亚, 朱俊子, 等. 湖南首次检测到黄瓜绿斑驳花叶病毒[J].植物病理学报, 2013, 43(2): 219-221.
(责任编辑:杨明丽)
Cloning and sequence analysis of the genome of CucumbergreenmottlemosaicvirusAnhui isolate
Yan Dankan1,Zhang Haishan1,Zheng Hongying2,Yan Fei2,Zhang Dongfang1
(1. Institute of Plant Protection and Agro-Products Safety, Anhui Academy of Agricultural Sciences, Hefei230031,China; 2. Institute of Virology and Biotechnology,Zhejiang Academy of Agricultural Sciences,Hangzhou310021,China)
Based on gold immunochromatographic assay and RT-PCR methods, the pathogen infecting watermelon in He County of Anhui Province was identified asCucumbergreenmottlemosaicvirus(CGMMV). In order to clarify the genome characteristics ofCucumbergreenmottlemosaicvirusisolate from Anhui (CGMMV-Anhui), the complete genomic sequence of CGMMV-Anhui was determined by molecular cloning. The results showed that the genome of CGMMV-Anhui contained 6 423 nucleotides (GenBank accession no. KT236095) and its genomic structure was the same as that of the CGMMV isolates previously reported, except for the nucleotide numbers of 5′-noncoding region (NCR) and 3′-NCR. The phylogenetic relationship of CGMMV-Anhui with other reported isolates was analyzed based on the genomic sequence and coat protein gene sequence.The analysis of phylogenetic tree showed that CGMMV could be separated into Asian isolates and European isolates. CGMMV-Anhui showed the closest relationship with Asian isolates and they might share the same infection source.
Cucumbergreenmottlemosaicvirus;Anhui isolate;genome;sequence analysis
2015-08-05
2015-10-08
公益性行业(农业)科研专项(201303028);安徽省蔬菜产业技术体系
E-mail:dfzhang2002@163.com
S 436.5
A
10.3969/j.issn.0529-1542.2016.04.025
