白桦BpMADS12基因启动子的克隆及表达分析
2016-09-13王子佳李慧玉张瑞萍
杨 洋 王子佳 李慧玉 张瑞萍
(1.林木遗传育种国家重点实验室(东北林业大学),黑龙江 哈尔滨 150040 2.黑龙江省农业科学院大豆研究所,黑龙江 哈尔滨 150086)
白桦BpMADS12基因启动子的克隆及表达分析
杨洋1王子佳1李慧玉1张瑞萍2
(1.林木遗传育种国家重点实验室(东北林业大学),黑龙江 哈尔滨 150040 2.黑龙江省农业科学院大豆研究所,黑龙江 哈尔滨 150086)
为探究白桦BpMADS12基因的功能,克隆了BpMADS12基因上游1 750 bp启动子序列,通过生物信息学对顺式作用元件进行分析,并利用农杆菌花序浸染法将其遗传转化入拟南芥,然后通过β-葡萄糖苷酸酶(GUS)组织化学染色检测BpMADS12启动子的组织表达特性及干旱胁迫应答。结果表明:BpMADS12启动子序列中含有与开花、激素及干旱响应等相关的顺式作用元件;该启动子在拟南芥中的表达模式呈现为在营养生长阶段不表达,而进入生殖生长阶段后,在根、花叶、花瓣、雄蕊、雌蕊及种子等各个组织部位中均表达;PEG胁迫后处理组拟南芥中GUS表达量低于未处理组。研究显示BpMADS12基因参与白桦的开花调节、激素应答、胁迫响应(干旱)等生物学过程,对生殖生长阶段各组织器官的发育有一定的调控作用,且负调控干旱响应途径。
白桦;BpMADS12启动子;顺式作用元件;克隆;表达分析
MADS-box转录因子是生物界普遍存在的一类转录因子家族,该家族分为2大类,第1类包含动物和真菌中的ARG80/SRF-like基因及植物中的M型MADS-box基因,第2类包含动物和真菌中的MEF2-like基因及植物中的MIKC-type基因。植物中典型的由MADS-box基因编码的转录因子含有高度保守的MADS结构域,它包括1个半保守的I-结构域、1个相对保守的K-结构域和1个C-结构域[1]。MADS-box基因在花器官形成、控制花期及成花转变方面发挥着重要作用[2-3]。然而,随着研究的不断深入,发现一些MADS-box基因在表皮毛、茎、叶、根等营养器官中表达并发挥着多样的功能[4-9]。桉树的ETL基因,属于SOC1/TM3支系,有研究显示该基因在营养器官和生殖器官中均有表达,尤其在根、茎、器官原基及雌雄花中[10]。在拟南芥(Arabidopsisthaliana)中,AGL11和AGL13在种子中有明显的表达。在拟南芥的根中至少有50个MADS-box基因有表达[11-12],在其发育过程中AGL14通过PIN的转录调控来控制生长素的极性运输[13],GhMADS11在纤维中特异表达,在酵母中过表达GhMADS11可以促使细胞伸长[14]。这些结果显示,MADS-box基因在植物的营养器官中有多种表达模式,可能与植物器官的生长发育过程有一定的调控作用[15]。
本研究克隆的白桦(Betulaplatyphylla)BpMADS12基因(GenBank Accession number: JF721399)属于MADS-box基因家族SOC1/TM3亚族。通过PCR扩增技术从白桦中得到BpMADS12启动子序列,并对BpMADS12基因启动子元件进行分析。将克隆到的启动子构建到植物表达载体上,并用农杆菌介导的花序浸染法转化拟南芥,对转BpMADS12启动子拟南芥及干旱胁迫后的转BpMADS12启动子拟南芥进行GUS染色分析,研究BpMADS12启动子的表达模式。
1 材料与方法
1.1 试验材料
BpMADS12启动子克隆材料取自东北林业大学林木遗传育种试验基地10年生已开花结实的白桦,拟南芥为哥伦比亚野生型。
DNA提取试剂盒和纯化试剂盒购于天根生物技术公司;ExTaq聚合酶、T4连接酶、BamHI 内切酶、SalI 内切酶购于宝生物工程(大连)有限公司;农杆菌EHA105 和pBI101载体均为本实验室保存。
1.2试验方法1.2.1BpMADS12基因启动子克隆根据白桦基因组信息(已完成测序及拼接工作,尚未网上公布),设计引物扩增BpMADS12基因上游1 750 bp的基因组序列,引物由上海生工公司合成,上下游引物序列分别为: 5‘-GTACGTCGACAGAGAGGAGAGAGGAGAGAGG-3’(下划线为SalI酶切位点);5‘- GTACGGATCCTACCTTCACAACAAGGTGAGG-3’(下划线为BamHI酶切位点)。以白桦总DNA为模板,20 μL PCR扩增体系进行PCR扩增,克隆BpMADS12基因启动子,反应体系如下:1×Ex Taq PCR Buffer,2.5 mmol/L dNTPs,DNA模板1 μL,上下游引物各为20 mmol/L,Ex Taq DNA 聚合酶2 U/μL,无菌水补足20 μL。PCR扩增程序:94 ℃预变性4 min;94 ℃变性45 s,58 ℃退火45 s,72 ℃延伸2 min,30个循环;72 ℃延伸10 min。PCR产物经1.0 %琼脂糖凝胶电泳检测。并进行胶回收纯化后备用。1.2.2BpMADS12基因启动子顺式作用元件预测为了研究BpMADS12基因的可能功能,使用在线顺式作用元件预测软件PLACE(http://www.dna.affrc.go.jp/PLACE/)和PlantCARE(http://bioinformatics. psb. ugent. be/webtools/plantcare/html/)对该基因的启动子序列进行了分析[16-17]。
1.2.3植物表达载体构建分别对BpMADS12启动子胶回收产物和植物表达载体pBI101质粒进行BamHI和SalI双酶切。酶切产物经1.0 %琼脂糖凝胶电泳检测。使用OMEGA纯化试剂盒对得到的启动子和载体的酶切产物进行纯化,纯化后产物用T4 DNA连接酶16 ℃过夜连接,连接反应完成后,通过热击法将连接产物转化到大肠杆菌Trans5α感受态细胞中。PCR检测条带位置正确的阳性克隆送往上海英俊生物公司测序。保存经测序比对正确的重组质粒,通过电击法将构建好的植物表达载体转入农杆菌EHA105中,转化子经PCR验证后保存备用。1.2.4转化拟南芥及筛选根据Steven等[18]的花序浸染法转化拟南芥,培养农杆菌菌液至OD600=1.0~1.2,室温4 000 r/min离心10 min收集菌体,用转化介质(10 mmol/L 氯化镁,5%蔗糖,200 μL/L Silwet-77)重悬菌体,侵染拟南芥花序30 s,避光24 h后将其置于正常光下培养,3 ~ 4周后可收获种子。
收取浸花法转化后的拟南芥种子在含50 mg/mL卡那霉素的选择培养基选择阳性克隆,并分单株移栽到基质中,待其成熟后进行PCR检测,并收取种子,作为亲本进行自交并使用相同培养基筛选直至获得纯合子。播种,作为胁迫处理的材料。
1.2.5BpMADS12基因启动子表达模式分析将纯合的转BpMADS12基因启动子拟南芥种子播种,并从种子春化后1 、3 、5 、7 、15 、30 d进行融合基因GUS染色,染色方法参见Li等[19]的研究,观察BpMADS12基因启动子的表达部位,拍照。
1.2.6转BpMADS12基因拟南芥胁迫干旱处理分别选用3株野生型和转BpMADS12 启动子拟南芥,使用15 %的PEG处理进行模拟干旱胁迫。处理3 d后取拟南芥各组织部位进行GUS染色,染色方法同上。
2 结果与分析
2.1BpMADS12基因启动子克隆
根据白桦基因组信息,以白桦总DNA为模板,采用PCR技术扩增BpMADS12基因启动子区。通过琼脂糖凝胶电泳结果显示在1 750 bp扩增出特异条带(图1),与目的基因长度一致。通过测序进一步证实为BpMADS12基因的启动子。
2.2BpMADS12基因启动子顺式作用元件预测
通过PlantCARE及PLACE数据库对白桦基因组DNA为模板克隆的1 750 bp启动子序列进行分析(图2和表1),该序列中除了含有启动子的基本转录元件TATA-box、CAAT-box,还含有2个开花相关元件(POLLEN1LELAT52和GTGANTG10),多个激素相关元件(ARR1AT,WRKY71OS,CGCGBOXAT,TCA-motif),5个干旱响应元件(MYB1AT,MYBCORE,MYCATRD22,MYB2CONSENSUSAT,MBS),多个光响应元件等。由此可以推测该基因可能参与到了白桦的开花调节,激素应答,胁迫响应(干旱),光响应等生物学过程中。
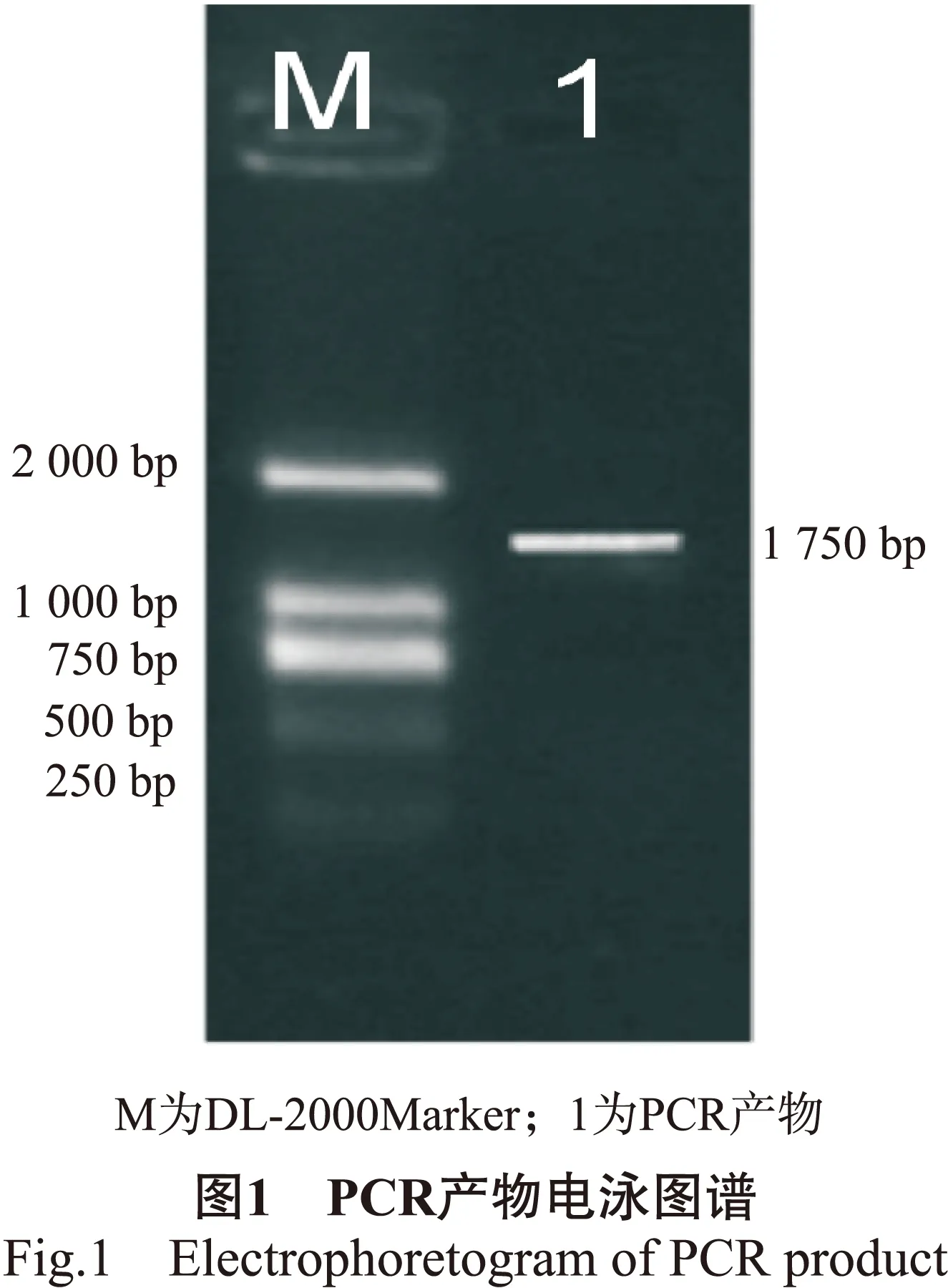
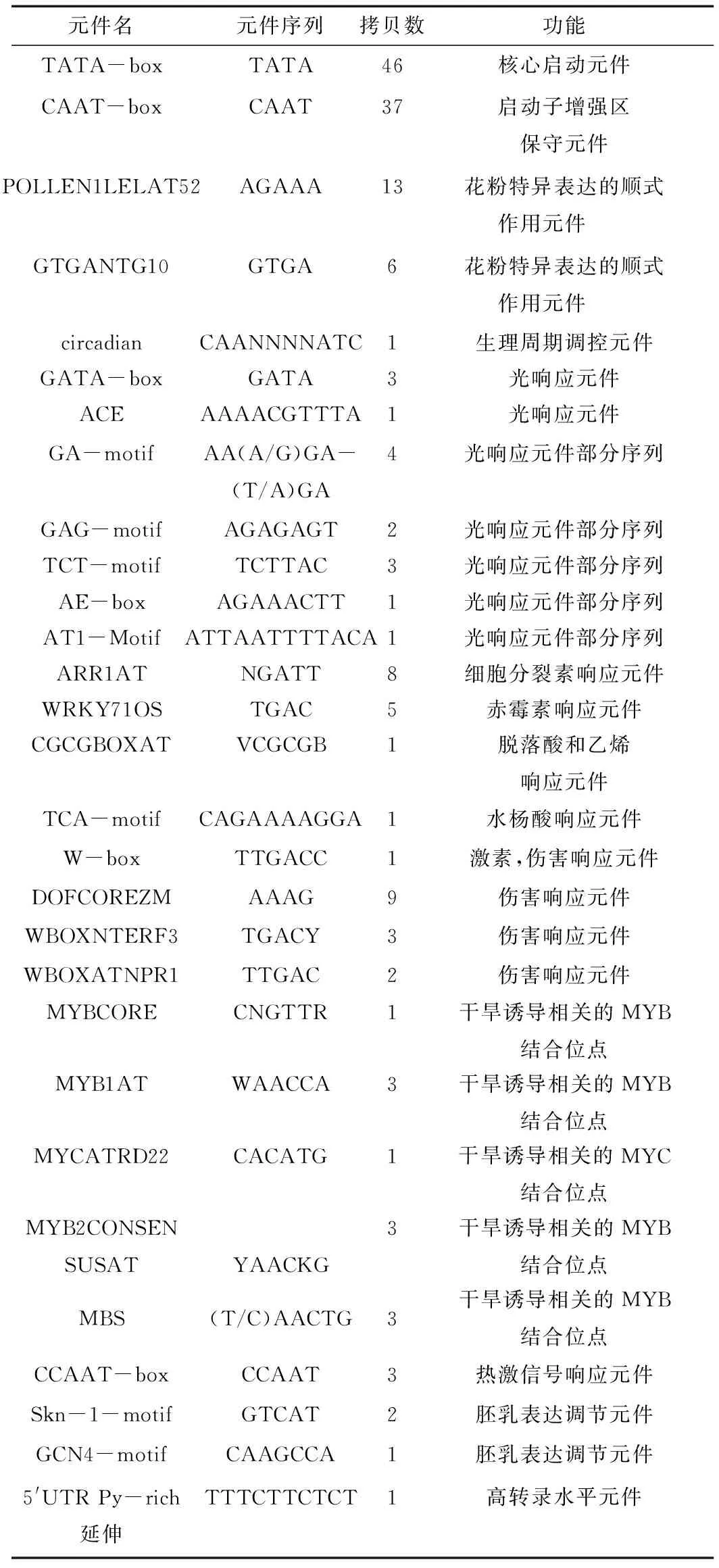
元件名元件序列拷贝数功能TATA-boxTATA46核心启动元件CAAT-boxCAAT37启动子增强区保守元件POLLEN1LELAT52AGAAA13花粉特异表达的顺式作用元件 GTGANTG10GTGA6花粉特异表达的顺式作用元件 circadianCAANNNNATC1生理周期调控元件GATA-boxGATA3光响应元件ACEAAAACGTTTA1光响应元件GA-motifAA(A/G)GA-(T/A)GA4光响应元件部分序列GAG-motifAGAGAGT2光响应元件部分序列TCT-motifTCTTAC3光响应元件部分序列AE-boxAGAAACTT1光响应元件部分序列AT1-MotifATTAATTTTACA1光响应元件部分序列ARR1ATNGATT8细胞分裂素响应元件WRKY71OSTGAC5赤霉素响应元件CGCGBOXATVCGCGB1脱落酸和乙烯响应元件TCA-motifCAGAAAAGGA1水杨酸响应元件W-boxTTGACC1激素,伤害响应元件DOFCOREZMAAAG9伤害响应元件WBOXNTERF3TGACY3伤害响应元件WBOXATNPR1TTGAC2伤害响应元件MYBCORECNGTTR1干旱诱导相关的MYB结合位点MYB1ATWAACCA3干旱诱导相关的MYB结合位点MYCATRD22CACATG1干旱诱导相关的MYC结合位点MYB2CONSENSUSATYAACKG3干旱诱导相关的MYB结合位点MBS(T/C)AACTG3干旱诱导相关的MYB结合位点CCAAT-boxCCAAT3热激信号响应元件Skn-1-motifGTCAT2胚乳表达调节元件GCN4-motifCAAGCCA1胚乳表达调节元件5'UTRPy-rich延伸TTTCTTCTCT1高转录水平元件
2.3植物表达载体构建
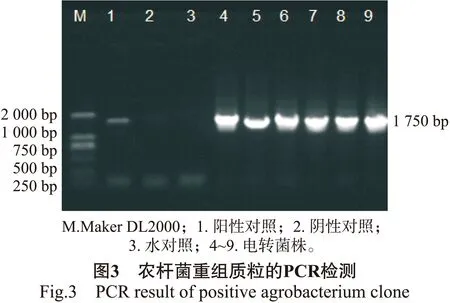
通过启动子顺式作用元件分析预测得知,获得的BpMADS12启动子片段既具有启动子的核心元件又含有与开花、干旱、激素、光响应相关的元件。为研究BpMADS12在植物体内的表达模式,构建BpMADS12启动子与GUS报告基因融合的植物表达载体,PCR检测结果见图3。
2.4转化拟南芥及筛选
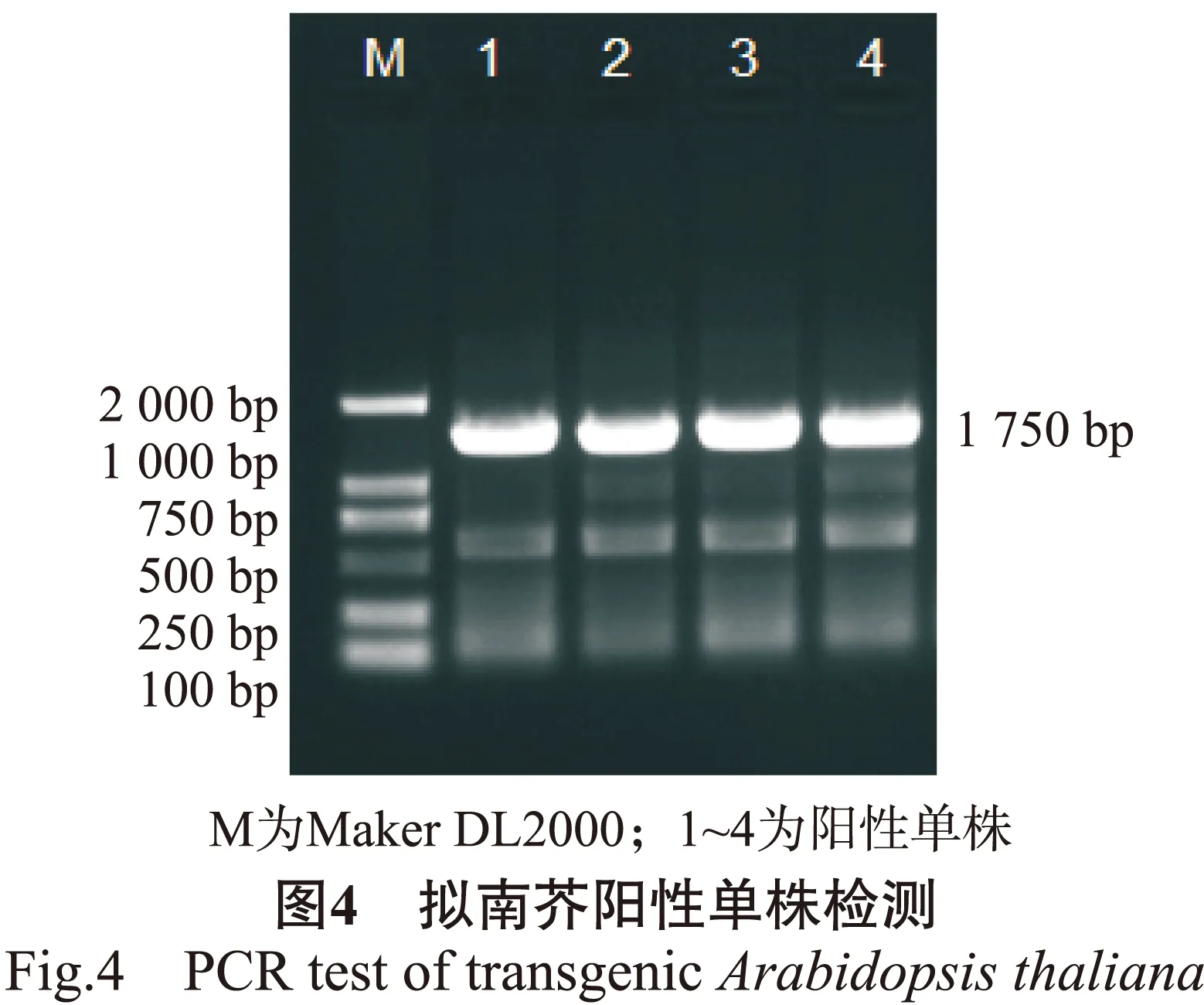
通过浸花法转化拟南芥,暗处理24 h后,移到长日照(16 h光照,8 h黑暗)培养室培养,待成熟后收取种子,在选择培养基上筛选获得阳性单株,播种后,待其长出8 ~ 10片真叶时撕取1 ~ 2片叶子提取DNA作为模板,使用BpMADS12基因启动子特异性引物进行PCR检测。结果显示,所获得的4个阳性单株总DNA为模板的PCR产物于1.0 %的琼脂糖凝胶上电泳,均在1 750 bp左右出现特异条带(图4),这与BpMADS12基因启动子片段大小一致。证明BpMADS12基因启动子成功整合到了拟南芥基因组中并能稳定表达,可以作为后续研究的材料。
2.5BpMADS12基因启动子表达模式
将纯合的转BpMADS12基因启动子拟南芥种子播种,并从种子春化后开始分阶段进行融合基因GUS染色,从而了解该基因的表达模式,见图5。从图5中可以看出,BpMADS12基因在拟南芥中的表达模式呈现为在营养生长阶段不表达(1、3、5、7、15 d),而进入生殖生长阶段后,花瓣,雄蕊、雌蕊及种子等生殖器官及根、花叶等营养器官中均表达(30 d)。

2.6转BpMADS12基因启动子拟南芥的耐旱性
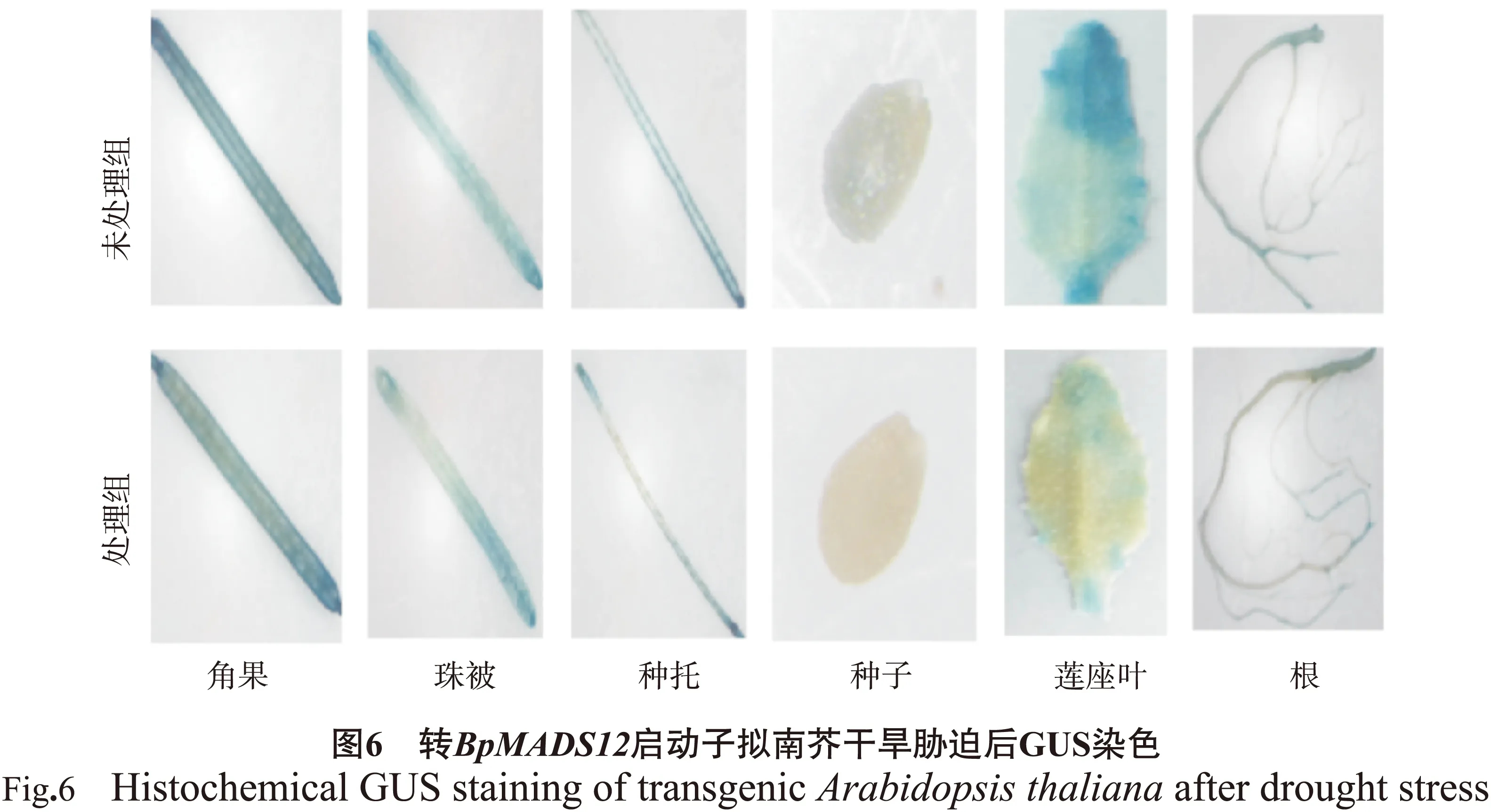
通过预测发现BpMADS12基因启动子序列中含有5个与干旱诱导相关的MYB(MYC)结合位点元件,所以对转BpMADS12基因启动子拟南芥进行了干旱胁迫处理。根据BpMADS12基因启动子的表达模式,选取开花结实期进行干旱处理。用15 %的PEG处理3 d后取转BpMADS12拟南芥各组织部位进行GUS染色,结果见图6。结果显示,胁迫后未处理组拟南芥中GUS表达量高于15 %PEG处理拟南芥,可能是该基因在干旱响应途径中起着负调控作用,有待进一步研究。
3 结论与讨论
BpMADS12是MADS-box基因家族SOC1/TM3亚族的一员[20]。SOC1/TM3亚族基因在植物各营养组织器官中均发挥着作用。SOC1亚族基因AGL19在茎中表达,通过春化作用途径促进植物开花[21]。桉树(Eucalyptusspp.)ETL基因(AGL14/AGL19同源基因)主要在幼根维管及根分生组织中表达,在器官原基、茎分生组织和生殖器官中也有表达[10,22]。杨树(Populusspp.)的MADS-box5(PTM5)在正分化的初生、次生木质部及韧皮部有表达[15]。现在已知的转SOC1基因的拟南芥(Arabidopsisthaliana)、水稻(Oryza.sativa)、玉米(Zeamays)、小麦(Triticumaestivum)、大豆(Glycinemax)、榛子(Corylus heterophylla)等与非转基因植株相比花期提前[23-30]。但杂种山杨(Populusdavidiana)中FPF1对花期没有任何影响,却在木材形成过程中发挥了重要作用。以上研究说明SOC1/TM3亚族基因在不同物种中存在功能分歧。在本研究中,通过组织化学染色分析得知BpMADS12启动子在拟南芥中的表达模式呈现为在营养生长阶段不表达,而在生殖生长阶段的各个组织部位中均表达,说明BpMADS12基因对生殖生长阶段各组织器官的生长发育有一定的调控作用。
通过启动子顺式作用元件分析预测得知,获得的BpMADS12启动子序列除了含有启动子的核心元件外,还含有一些激素响应元件,如细胞分裂素调节相关元件ARR1AT[31];核心序列为TGAC的WRKY710S元件,响应赤霉素信号途径[32];水杨酸响应元件TCA-motif。转录组数据分析发现过表达BpMADS12白桦中激素合成及信号转导途径差异基因显著富集(under review),在其他物种中也发现MADS-box家族基因参与激素信号调控;OsMADS29通过影响细胞分裂素合成途径调控种子发育[33]。OsMADS1敲除后的水稻,其生长素合成、极性分布和一些信号因子都受到影响[34-35]。这些结果均说明,MADS-box蛋白通过激素信号影响植物的生长发育。
BpMADS12启动子序列中含有5个干旱诱导相关元件,通过PEG胁迫后处理组拟南芥中表达量低于未处理组,说明该基因在干旱响应途径中起着负调控作用。在拟南芥中研究发现SOC1基因参与逆境过程。微阵列分析寻找下游拟南芥SOC1的靶基因鉴定了的多条冷诱导基因,例如COR基因,在它的启动子区域和CRT/DRE连接因子(CBFs)区域。CHIP试验证实了SOC1能够直接作用于CBF基因的启动子,这意味着SOC1参与冷应答途径[36]。
启动子顺式作用元件分析为揭示白桦BpMADS12基因的功能提供了方向,对于该基因功能的深入研究需要实验进一步揭示。
[1]Podila G K,Cseke L J,Sen B, et al. Application of aspenMADS-BOXgenes to alter reproduction and development in trees.US 2004/0019933 A1 [P].2015-08-06.
[2]Weigel D, Meyerowitz E M. TheABCsof floral homeotic genes[J]. Cell, 1994,78(2):203-209.
[3]Gutierrez-Cortines M E, Davies B. Beyond theABCs: ternary complex formation in the control of floral organ identity[J]. Trends Plant Sci, 2000,5(11):471-476.
[4]Mao L, Begum D, Chuang H W, et al.JOINTLESSis aMADS-boxgene controlling tomato flower abscission zone development[J]. Nature, 2000,406(6798):910-913.
[5]Alvarez-Buylla E R,Liljegren S J,Pelaz S, et al.MADS-boxgene evolution beyond flowers: expression in pollen, endosperm, guard cells, roots and trichomes[J]. Plant J, 2001,24(4):457-466.
[6]Arora R, Agarwal P, Ray S, et al.MADS-boxgene family in rice: genome-wide identification, organization and expression profiling during reproductive development and stress[J]. BMC Genomics, 2007,8:242.
[7]Burko Y, Shleizer-Burko S,Yanai O, et al. A role forAPETALA1/fruitfull transcription factors in tomato leaf development[J]. Plant Cell, 2013,25(6):2070-2083.
[8]Kimura Y, Aoki S, Ando E, et al. A flowering integrator,SOC1, affects stomatal opening inArabidopsisthaliana[J]. Plant Cell Physiol, 2015,56(4):640-649.
[9]Lovisetto A, Masiero S, Rahim M A, et al. Fleshy seeds form in the basal Angiosperm Magnolia grandiflora and severalMADS-boxgenes are expressed as fleshy seed tissues develop[J]. Evol Dev, 2015,17(1):82-91.
[10]Decroocq V, Zhu X, Kauffman M, et al. ATM3-likeMADS-boxgene fromEucalyptusexpressed in both vegetative and reproductive tissues[J]. Gene, 1999,228(1/2):155-160.
[11]Burgeff C, Liljegren S J, Tapia-Lopez R, et al.MADS-boxgene expression inlateral primordia, meristems and differentiated tissues ofArabidopsisthalianaroots[J]. Planta, 2002,214(3):365-372.[12]Parenicova L,de Folter S,Kieffer M, et al. Molecular and phylogenetic analyses of the completeMADS-boxtranscription factor family inArabidopsis: new openings to the MADS world[J]. Plant Cell, 2003,15(7):1538-1551.
[13]Garay-Arroyo A,Ortiz-Moreno E, de la Paz Sánchez M, et al. The MADS transcription factorXAL2/AGL14 modulates auxin transport duringArabidopsisroot development by regulating PIN expression[J]. EMBO J, 2013,32(21):2884-2895.
[14]Li Y, Ning H, Zhang Z, et al. A cotton gene encoding novelMADS-boxprotein is preferentially expressed in fibers and functions in cell elongation[J]. Acta Biochim Biophys Sin (Shanghai), 2011,43(8):607-617.
[15]Cseke L J, Zheng J, Podila G K. Characterization ofPTM5 in aspen trees: aMADS-boxgene expressed during woody vascular development[J]. Gene, 2003,318:55-67.
[16]Higo K, Ugawa Y,Iwamoto M, et al. Plant cis-acting regulatory DNA elements( PLACE ) database: 1999[J]. Nucleic Acids Research, 1999,27:297-300.
[17]Lescot M, Dehais P, Thijs G, et al. PlantCARE, a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J]. Nucleic Acids Research, 2002,30:325-327.
[18]Steven J,Clough S J,Bent A F. Floral dip: a simplified method forAgrobacterium-mediated transformation ofArabidopsisthaliana[J]. Plant J, 1998,16:735-743.
[19]Chen Li,Jiang Bingjun,Wu Cunxiang, et al. The characterization ofGmTIP, a root-specific gene from soybean,and the expression analysis of its promoter[J]. Plant Cell Tiss Organ Cult, 2015,121:259-274.
[20]刘菲菲,李慧玉,王姗, 等. 白桦BpSOC1基因的克隆及时序表达分析[J]. 东北林业大学学报, 2011,39(4):1-4.
[21]Schǒnrock N,Bouveret R,Leroy O, et al. Polycomb-group proteins repress the floral activatorAGL19 in theFLC-independent vernalization pathway[J]. Genes, 2006,20(12):1667-1678.
[22]De Oliveira Dias B F,Simoes-Araujo J L,Russo C A M, et al. UnravelingMADS-boxgene family inEucalyptusspp.:a starting point to an understanding of their developmental role in trees[J]. Genet Mol Biol, 2005, 28:501-510.
[23]Lee H,Suhs S,Park E, et al. TheAGAMOUS-LIKE20 MADS domain protein integrates floral inductive pathways inArabidopsis[J]. Gene & Develop, 2000,14: 2366-2376.[24]Borner R,Kampmann G,Chandler J, et al. A MADS domain gene involved in the transition to flowering inArabidopsis[J]. Plant J, 2000,24(5):591-599.
[25]Lee S,Kim J,Hanj J, et al. Functional analyses of the flowering time geneOsMADS50, the putative SUPPRESSOR OF OVER-EXPRESSION OF CO1/ AGAMOUS-LIKE 20(SOC1/AGL20) ortholog in rice[J]. Plant J, 2004,38(5):754-764.
[26]Tadege M,Sheldonc C,Helliwellc A, et al. Reciprocal control of flowering time byOsSOC1 in transgenicArabidopsisand byFLCin transgenic rice[J]. Plant Biotechnol J, 2003,1(5):361-369.
[27]Heuer S,Hansen S,Bantin J, et al. The maizeMADS-BoxgeneZmMADS3 affects node number and spikelet development and is co-expressed with ZmMADS1 during flower development, in egg cells, and early embryogenesis[J]. Plant Physiol, 2001, 127(1):33-45.
[28]Shitsukawa N,Ikari C,Mitsuya T, et al. WheatSOC1 functions independently ofWAP1/VRN1, an integrator of vernali-zation and photoperid flowering promotion pathways[J]. Physiol Plant, 2007,130(4):627-636.
[29]Zhong X,Dai X,Xv J, et al. Cloning and expression analysis ofGmGAL1,SOC1 homolog gene in soybean[J]. Mol Biol Rep, 2012,39(6):6967-6974.
[30]孟晓庆. 榛子成花基因的克隆及其表达特性分析[D]. 北京:北京林业大学, 2013.
[31]Ross E J H,Stone J M,Elowsky C G, et al. Activation of theOryzasativanon-symbiotic haemoglobin-2 promoter by the cytokinin-regulated transcription factor,ARR1[J]. Journal of Experimental Botany, 2004,55(403):1721-1731.[32]Xie Z,Zhang Z L,Zou X, et al. Annotations and functional analyses of the riceWRKYgene super family reveal positive and negative regulators of abscisic acid signaling in aleurone cells[J].Plant Physiol, 2005,137(1):176-189.
[33]Nayar S,Sharma R,Tyagi A K, et al. Functional delineation of riceMADS29 reveals its role in embryo and endosperm development by affecting hormone homeostasis[J]. J Exp Bot, 2013,64(14):4239-4253.
[35]Khanday I,Yadav S R,Vijayraghavan U. RiceLHS1/OsMADS1 controls floret meristem specification by coordinated regulation of transcription factors and hormone signaling pathways[J]. Plant Physiol, 2013,161(4):1970-1983.[36]Seo E,Lee H,Jeon J, et al. Crosstalk between cold response and flowering inArabidopsisis mediated through the flowering-time geneSOC1 and its upstream negative regulatorFLC[J]. The Plant Cell, 2009,21:3185-3197.
(责任编辑张坤)
Cloning and Expression Analysis of BpMADS12 Promoter fromBetulaplatyphylla
Yang Yang1, Wang Zijia1, Li Huiyu1,Zhang Ruiping2
(1.State Key Laboratory of Tree Genetics and Breeding (Northeast Forestry University), Harbin Heilongjiang 150040, China 2.Soybean Reasearch Institute,Heilongjiang Academy of Agricaltural Sciences,Harbin Heilongjiang 150086,China)
To characterize the function ofBpMADS12, a 1 750 bp flanking sequence upstream of the translation initiation codon was cloned, and several putative cis-regulatory elements were deciphered from the promoter sequence ofBpMADS12 using PLACE and PlantCARE web tools, and constructed into vector pBI101, and was transferred intoArabidopsisthaliana, then investigated the expression pattern and drought stress response via histechemical GUS staining. The results showed that flowering, multiple hormone-responsive and drought-responsive elements were predicted in the promoter region. Histechemical GUS staining showed that theBpMADS12 promoter expressed in all tissues and organs during reproductive phase, such as roots, floral leaves, petals, stamens, pistils, seeds, and so on, instead of vegetative phase; and the GUS expression was down-regulated in transgeneticArabidopsisthalianaafter PEG stress. In conclusion,BpMADS12 participates in biological processes of flowering, hormone response, drought stress response, and regulates the development of all tissues and organs during the generative growth phase to some extent, and drought responsive pathway negatively.
Betulaplatyphylla;BpMADS12 promoter; cis-elements analysis; clone; expression analysis

2015-08-06
“十二五”农村领域国家科技计划课题(2012BAD21B02)资助;哈尔滨市应用技术研究与开发项目(2013RFXYJ082)资助。
李慧玉(1978—),女,博士,副教授。研究方向:林木遗传育种。Email:lihuiyu0519@aliyun.com。
10.11929/j.issn.2095-1914.2016.01.002
S718.46
A
2095-1914(2016)01-0009-07
第1作者:杨洋(1991—),女,硕士生。研究方向:林木遗传育种。Email:929118066@qq.com。
