急性脑梗死患者血清基质金属蛋白酶-9与颈动脉斑块及血管内皮功能的相关性
2016-09-12姚汉云文芳董新宇
姚汉云,文芳,董新宇
·论著·
急性脑梗死患者血清基质金属蛋白酶-9与颈动脉斑块及血管内皮功能的相关性
姚汉云1,文芳2,董新宇3
目的:探讨血清基质金属蛋白酶-9(MMP-9)表达与急性脑梗死(ACI)颈动脉斑块及血管内皮功能的相关性。方法:ACI患者126例,经颈动脉行彩超诊断分为无斑块(NCP)组40例、稳定斑块(SCP)组44例及不稳定斑块(UCP)组42例,采用ELISA测定血清中MMP-9、基质金属蛋白酶抑制剂-1(TIMP-1)、血管内皮生长因子(VEGF),采用流式细胞仪检测血浆中内皮颗粒,RT-PCR测定MMP-9 mRNA、VEGF mRNA表达,Logistic回归分析MMP-9与血管内皮功能相关性。结果:ACI患者在住院后第2天和第15天的血清中MMP-9、TIMP-1、VEGF均呈现不同程度的升高,其中SCP组、UCP组的MMP-9、TIMP-1、VEGF与NCP组差异有统计学意义(P<0.05);NCP组中CD31+/CD42-阳性率为12.34%,SCP组、UCP组分别为28.22%、43.17%,与NCP组相比差异有统计学意义(P<0.05),SCP组与UCP组差异有统计学意义(P<0.05);UCP组的MMP-9 mRNA、VEGF mRNA均明显高于NCP组、SCP组。结论:脑梗死患者MMP-9的表达与VEGF表达呈现协同关系,其表达量随着脑梗死患者颈动脉斑块的不稳定性增加出现明显的升高趋势,其表达量与内皮细胞受损程度呈现明显的相关性。
血清基质金属蛋白酶-9;急性脑梗死;颈动脉斑块;血管内皮
动脉粥样硬化是引起脑梗死、冠心病的病变发生基础,动脉粥样硬化形成的斑块引起颈动脉狭窄,斑块破裂是引起脑梗死的关键环节[1]。不稳定斑块(unstable carotid plaque,UCP)会随着血液流经心脑血管,引起栓塞,从而引起心肌梗死或者脑梗死。目前,多项研究发现粥样硬化斑块的破裂与基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)的表达增多有密切关系[2],UCP中MMP-9高表达会刺激血管内皮生长因子(vascular endothelial growth factor,VEGF)高表达,进而引起斑块出现纤溶,导致斑块松动、破裂。我院发现动脉粥样硬化导致的脑梗死患者血清中炎性细胞因子表达异常。但是,动脉粥样硬化发展不同阶段与MMP-9表达的相关性,MMP-9在脑梗死患者发展的不同阶段与血管内皮功能的关系目前报道较少。本研究旨在探讨MMP-9在脑梗死患者发展的不同阶段与血管内皮功能的关系,报道如下。
1 资料与方法
1.1一般资料
选择2012年4月至2013年7月在我院神经内科住院的急性脑梗死(acute cerebral infarction,ACI)患者126例,均符合卫生部制定的《中国脑血管病防治指南》诊断标准[3],男71例,女55例;年龄47~78岁,平均(64.2±8.9)岁。所有患者根据颈动脉彩超结果分为3组:①无斑块(no carotid plaque,NCP)组40例,男23例,女17例;平均年龄(64.1±9.1)岁;脑梗死体积(9.23±3.36)cm3;②稳定斑块(stable carotid plaque,SCP)组44例,男25例,女19例;平均年龄(65.4± 8.9)岁;脑梗死体积(9.37±3.41)cm3;③UCP组42例,男23例,女19例;平均年龄(65.9±10.6)岁;脑梗死体积(9.47±3.69)cm3。各组脑梗死体积差异无统计学意义(P>0.05)。另外选取来院经体检合格的患者39例为对照组,男22例,女17例;平均年龄(66.2±10.5)岁,无颈动脉内膜增厚,血液指标检测均正常。受试者入院后均进行空腹血糖、血脂、颈动脉彩超及肝肾功能检测,且签订知情协议书。4组年龄、性别方面差异无统计学意义(P>0.05)。
1.2方法
1.2.1颈动脉超声检查[4]采用GE Ultrasound Vivid 8型彩色多普勒超声仪检查患者颈总动脉双侧、分叉部位以及颈内动脉等,分析判断颈动脉有无斑块以及斑块性质。测量标准:①测量颈动脉内膜中层厚度(intima-media thickness,IMT),IMT<1.0 mm为正常,IMT 为1.0~1.5 mm为增厚,IMT≥1.5 mm为斑块形成;综合考虑残余管径、血流速度、频谱形态、彩色血流情况等评估狭窄率;②根据斑块回声强度及病理学检测分析斑块性质:脂质型软斑块、纤维型斑块、钙化型硬斑块及溃疡型斑块4种,其中纤维型斑块、钙化型硬斑块为SCP,脂质型软斑块与溃疡型斑块为UCP。
1.2.2样本采集和处理 受试者在入院后次日清晨及15 d后清晨空腹取肘静脉血3 mL,在无菌离心管中以2 000 r/min离心30 min,收集血清,保存于-70℃冰箱中待检。
1.2.3血清中相关因子检测 采用ELISA法检测血清中MMP-9、基质金属蛋白酶抑制剂-1(tissue inhibitor of metalloproteinase-1,TIMP-1)及VEGF,操作方法严格按照说明书执行。
1.2.4血浆内皮微颗粒(endothelial microparticles,EMP)检测 受试者在入院后次日清晨及15 d后清晨空腹另取肘静脉血3 mL置于真空EDTA-K2抗凝管中,以1 000r/min离心获取富血小板血浆,然后以1 800r/min离心7 min获取血小板贫瘠血浆。取其中50 μL血小板贫瘠血浆,加入特异性荧光抗体(CD31+/CD42-),在室温下孵育30 min后,加入1 mL及5 μL Flow-CountTM荧光微球即上流式细胞仪待测。收集6 000个颗粒后停止计数,获得EMP的所占百分含量。
1.2.5荧光定量 PCR测定 MMP-9 mRNA、VEGF mRNA ①血浆中总RNA提取:将ACI患者各取200 μL血浆,加入10 μL的Proteinase K消化液进行消化,然后按照Trizol LS试剂盒说明书进行后续操作,使用NanoDrop 1000检测血浆中总RNA的浓度。②MMP-9 mRNA、VEGF mRNA测定:将所提总RNA进行琼脂糖凝胶电泳确定有无降解。采用紫外分光光度计检测吸光度值,以此为RNA含量。RT条件为:37℃孵育1.5 h,95℃进行5 min。将PCR产物进行电泳和拍照,采用光密度扫描仪进行扫描,以GAPDH的光密度值作为参照,计算MMP-9 mRNA、VEGF mRNA光密度值与其对比所得相对值。引物序列:MMP-9正向 引物为 5'-GCGGATCCAGCGCCCAGAGAGACAC-3',MMP-9反向引物为5'-TTAAGTTCCACTCCGGGCAGGATT-3';VEGF正向引物为5'-AAGATCCGCAGACGTGTAAATGTT-3',VEGF反向引物为5'-CGGCTTGTCACATGCAAGTA-3';NAPDH正向引物为5'-CGGAGTCAACGGATTTGGTCGTAT-3',NAPDH反向引物为5'-GCCGATAGTGATGACCTGACCGT-3'。
1.3统计学处理
采用SPSS13.0统计软件包及ImageJ4.2对数据及图片进行处理;对计量资料采用t检验,计量结果以()表示,计数资料采用χ2检验,相关性分析采用Logistic回归分析,P<0.05为差异有统计学意义。
2 结果
2.1病历资料比较
ACI患者与对照组在收缩压、舒张压、年龄及空腹血糖等差异无统计学意义(P>0.05),体质指数及血脂相关指标差异有统计学意义(P<0.05),见表1。
表1 各组临床资料比较()
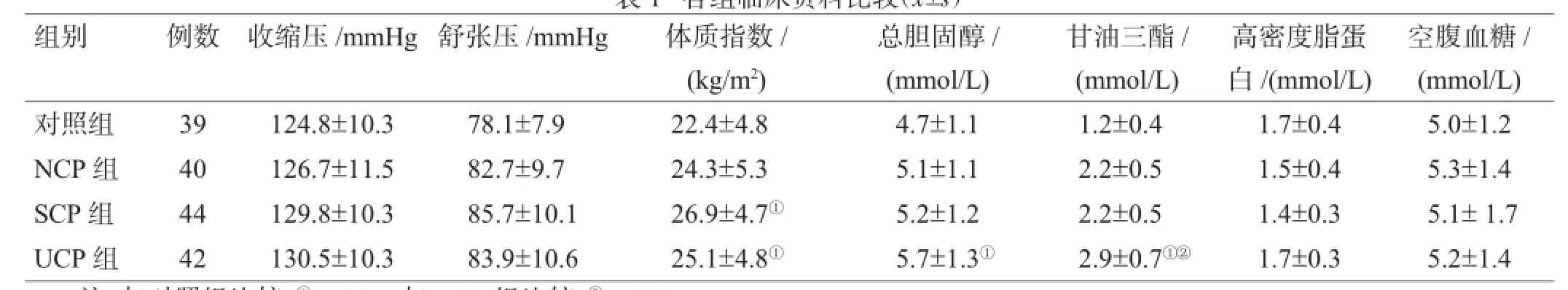
表1 各组临床资料比较()
注:与对照组比较,①P<0.05;与NCP组比较,②P<0.05
组别 例数 收缩压/mmHg舒张压/mmHg 体质指数/ (kg/m2)空腹血糖/ (mmol/L)对照组 39 124.8±10.3 78.1±7.9 22.4±4.8 4.7±1.1 1.2±0.4 1.7±0.4 5.0±1.2 NCP组 40 126.7±11.5 82.7±9.7 24.3±5.3 5.1±1.1 2.2±0.5 1.5±0.4 5.3±1.4 SCP组 44 129.8±10.3 85.7±10.1 26.9±4.7① 5.2±1.2 2.2±0.5 1.4±0.3 5.1±1.7 UCP组 42 130.5±10.3 83.9±10.6 25.1±4.8① 5.7±1.3① 2.9±0.7①② 1.7±0.3 5.2±1.4总胆固醇/ (mmol/L)甘油三酯/ (mmol/L)高密度脂蛋白/(mmol/L)
2.2血清中相关因子检测结果比较
ACI患者在住院后第2天清晨的血清中MMP-9、TIMP-1、VEGF均不同程度升高,其中SCP组、UCP组与对照组差异有统计学意义(P<0.05),UCP组的MMP-9、TIMP-1、VEGF与NCP组相比较,差异有统计学意义(P<0.05);15 d后,上述指标均有所下降,SCP组及UCP组与对照组相比差异有统计学意义(P< 0.05),见表2。
2.3血浆EMP结果分析
NCP组中CD31+/CD42-阳性率为12.34%,SCP组、UCP组分别为28.22%、43.17%,与NCP组比较差异有统计学意义(P<0.05);SCP组与UCP组比较差异有统计学意义(P<0.05),见图1。
2.4血浆中MMP-9 mRNA、VEGF mRNA表达情况
UCP组血浆中VEGF-mRNA水平最高,其次为SCP组,NCP组最低,SCP组、UCP组血浆中VEGF-mRNA高于NCP组,差异有统计学意义(P< 0.05);UCP组患者的MMP-9 mRNA水平最高,其次为NCP组,SCP组最低,SCP组与NCP组之间差异无统计学意义(P>0.05),NCP组与UCP组差异有统计学意义(P<0.05),见图2。
2.5MMP-9与血管内皮功能相关性
ACI患者MMP-9与VEGF呈正相关(SCP组:r= 0.786,P=0.000;UCP组:r=0.986,P=0.000);与TIMP-1呈正相关(SCP组:r=0.751,P=0.000;UCP组:r=0.901,P=0.000);与EMP表达率呈正相关(SCP组:r=0.867,P=0.000;UCP组:r=0.948,P=0.000)。
表2 各组MMP-9、TIMP-1、VEGF比较()

表2 各组MMP-9、TIMP-1、VEGF比较()
注:与对照组比较,①P<0.05;与NCP组比较,②P<0.05;与SCP组比较,③P<0.05

图1 流式细胞术检测ACI患者血浆EMP结果

图2 RT-PCR检测血浆中MMP-9 mRNA、VEGF mRNA(A)和统计结果(B)
3 讨论
心脑血管病的病因病理是目前研究的热点,其中动脉粥样硬化斑块的形成及其稳定性的影响因素越来越受到众多学者的重视[5]。本研究发现,入院的126例ACI患者中有86例(68.5%)出现颈动脉斑块,其中不稳定斑块42例(33.3%),这提示,颈动脉斑块在动脉粥样硬化引起的脑梗死或缺血性脑血管病中起重要作用,因此在临床上检测动脉粥样硬化患者颈动脉斑块的形成及破裂有重要的意义。MMPs是一种锌离子依赖性的蛋白酶超家族,在降解心脑血管系统的细胞外基质中起重要作用,可被体内多种细胞分泌,如单核细胞、巨噬细胞、内皮细胞及平滑肌细胞等[6]。MMP-9也被称为明胶酶B,主要参与血管新生、炎症反应及多种恶性肿瘤的侵袭和转移等[7]。有研究证实,冠脉旋切术斑块中MMP-9呈现高表达状态,尤其在不稳定型心绞痛患者斑块中的表达率更高[8]。本研究采用ELISA测定血清中MMP-9的表达发现,住院后48 h内,对照组中该蛋白的表达量明显低于ACI患者,差异有统计学意义(P<0.05);UCP组其表达量明显高于NCP组及SCP组。患者在入院15 d后,MMP-9的表达量降低,这一结果尚未能做出更好解释,但ACI患者血清中MMP-9的表达仍高于对照组。这提示,MMP-9在随着动脉粥样硬化的发展期表达量呈升高趋势,这也印证了动脉粥样硬化斑块的性质越不稳定,发生脑梗死的可能性将越大。
基质金属蛋白酶组织-抑制因子(tissue inhibitor of metalloproteinases,TIMPs)是MMPs家族中内源性特异性抑制因子,当MMP-TIMP以复合体的形式结合后,将阻断MMPs与底物的结合,从而抑制细胞外基质的降解[9]。TIMP-1是MMP-9、MMP-1特异性结合的糖基化蛋白[10]。本研究显示不稳定颈动脉斑块中MMP-9、TIMP-1及MMP-9/TIMP-1比值明显增加,与既往的报道基本一致。本研究发现UCP组血清中TIMP-1相对于NCP、SCP组高,差异有统计学意义(P<0.05),而NCP组和SCP组差异无统计学意义,这提示TIMP-1的急剧增加是不稳定斑块破裂的原因所在。
VEGF是重要的促血管新生因子,通过与内皮细胞特异性结合,促进内皮细胞的增殖、血管形成等[11]。研究显示,在动脉粥样硬化等多种疾病中,VEGF参与病理性的血管新生,在不稳定颈动脉斑块中VEGF染色阳性细胞数目表达量增多[12],因此,目前有学者认为斑块处新生血管的增多是导致斑块不稳甚至破裂的原因[13,14]。有研究显示缺氧及炎性反应是促进斑块内VEGF表达的主要原因,MMP-9、MMP-1在炎性反应中起重要作用[15,16]。本研究通过RT-PCR分析血浆中MMP-9 mRNA、VEGF mRNA表达情况,发现UCP组血浆中两者的表达量明显高于SCP组,差异有统计学意义(P<0.05)。Logistic分析发现,MMP-9的表达与VEGF的表达呈正相关。这提示,脑梗死患者颈动脉斑块的不稳甚至破裂与MMP-9和VEGF协同作用有关。EMP是直接反映血管内皮受损的标志,其在多种疾病,如动脉粥样硬化、全身炎症反应综合征、糖尿病等表达均明显增高。本研究显示,UCP组EMP CD31+/CD42-表达明显高于SCP组。本研究未采集对照组血浆行流式细胞术和RT-PCR检测,因此有一定欠缺。
[1]邓远琼,柳超平,易小红,等.急性脑梗死病人颈动脉软斑块与血浆中高敏C反应蛋白、基质金属蛋白酶9有关[J].中华高血压杂志,2008,16: 1125-1128.
[2]Phipps JE,Hatami N,Galis ZS,et al.A fluorescence lifetime spectroscopy study of matrix metalloproteinases-2 and-9 in human atherosclerotic plaque[J].J Biophotonics,2011,4:650-658.
[3]Johnson JL,Dwivedi A,Somerville M,et al.Matrix metalloproteinase (MMP)-3 activates MMP-9 mediated vascular smooth muscle cell migration and neointima formation in mice[J].Arterioscler Thromb Vasc Biol, 2011,31:e35-e44.
[4]杜爱玲,赵海港,卢红,等.血清基质金属蛋白酶-9与急性脑梗死颈动脉斑块相关研究[J].现代预防医学,2013,10:71-74.
[5]赵晓晖,周媛,沈健,等.基质金属蛋白酶-9与脑梗死颈动脉粥样斑块相关性及阿托伐他汀干预后的变化 [J].脑与神经疾病杂志,2010,18: 321-324.
[6]Bot PT,Pasterkamp G,Goumans MJ,et al.Hyaluronic acid metabolism is increased in unstable plaques[J].Eur J Clin Invest,2010,40:818-827.
[7]Koh SH,Park CY,Kim MK,et al.Microbleeds and free active MMP-9 are Independent risk factors for neurological deterioration in acute lacunar stroke[J].Eur J Neurol,2011,18:158-164.
[8]Kunte H,Kunte G,Busch MA,et al.Differences in carotid plaque content of macrophages,T cells and MMP-9 between patients with embolic and hemodynamic cerebral ischemia due to symptomatic carotid stenosis[J]. Atherosclerosis,2010,211:456-460.
[9]Wang JM,Huang YJ,Wallg Y,et al.Hicreased circulating CD31+/CD42-mieroParticlesare assoeiated with impaired systemic artery elasticity in healthy subjects[J].Am J Hypertens,2007,20:957-996.
[10]EsPosito K,Ciotola M,Schisano B,et al.Endothelial microparticles correlate with endothelial dysfunction in obese women[J].Clin Endoerinol Metab,2006,91:3676-3679.
[11]董小跃,张胜燕.荧光定量RT-PCR检测宫颈癌患者外周血MMP-9 mRNA表达的临床意义[J].海南医学,2012,23:9-11.
[12]刘庆萍,吴岩峰,王辉.基质金属蛋白酶9及其组织型抑制剂1水平与老年脑梗死患者颈动脉粥样硬化程度的关系 [J].南京医科大学学报(自然科学版),32:1570-1574.
[13]武喆,韩登峰,张小宁.纤维蛋白原和血小板平均体积与急性脑梗死相关性研究[J].神经损伤与功能重建,2014,9:20-24.
[14]关良劲,张文,钟汉林,等.急性冠状动脉综合征患者颈动脉斑块和血浆基质金属蛋白酶-9的关系[J].广州医学院学报,2005,33:32-35.
[15]李薇,杨全玉,李时光.急性脑梗死患者血清白介素-18水平与颈动脉斑块的关系[J].神经损伤与功能重建,2011,6:184-187.
[16]朱贤英,谭来勋.通心络治疗大鼠脑梗死灶周围突触和星形胶质细胞的影响[J].保健医学研究与实践,2011,8:7-11.
(本文编辑:王晶)
Correlation of Serum Matrix Metalloproteinase-9 and Carotid Artery Plaques and Endothelial Function in Acute Cerebral Infarction Patients
YAO Han-yun1,WEN Fang2,DONG Xin-yu3.1.Department of Neurology,Wuhan No.1 Hospital,Wuhan 430022,China;2.Department of Neurology,Renmin Hospital of Wuhan University,Wuhan 430060,China;3.Wuhan University Hospital,Wuhan 430072,China
AbstractObjective:To investigate the correlation of serum matrix metalloproteinase-9(MMP-9)expression with carotid plaques and vascular endothelial function in acute cerebral infarction(ACI)patients.Methods:One hundred and twenty-six ACI patients diagnosed by the carotid artery ultrasound were divided into Groups No-plaque(NCP,n=40),Stable-plaque(SCP,n=44),and Unstable-plaque(UCP,n=42).ELISA was used to detect serum MMP-9,tissue inhibitor of metalloproteinase-1(TIMP-1),and vascular endothelial growth factor(VEGF). Endothelial plasma particles were measured by flow cytometry.And the expressions of MMP-9 mRNA, VEGF-mRNA were detected by RT-PCR.The correlation of MMP-9 with vascular endothelial function was analyzed byLogisticregression.Results:The serum MMP-9,TIMP-1,VEGF expressions were increased in ACI patients on days 2 and 15 after hospitalization.Compared with the NCP group,the levels of MMP-9,TIMP-1,and VEGF in the groups SCP and UCP were significantly different(P<0.05).The positive rate of CD31+/CD42-was 12.34%in the NCP group,while 28.22%in the SCP group,43.17%in the UCP group(P<0.05).with a significant difference between the SCP group and the UCP group(P<0.05).The expressions of MMP-9 mRNA,VEGF mRNA in the UCP group were significantly higher than those in the groups NCP and SCP.Conclusion:The expressions of MMP-9 in the ACI patients correlate with VEGF expression,which are up-regulated with the increased instability of carotid artery plaques in patients with cerebral infarction.The expressions of MMP-9 correlate with the damage of endothelial cells.
serum matrix metalloproteinase-9;acute cerebral infarction;carotid plaque;vascular endothelial
R741;R741.02
A
10.16780/j.cnki.sjssgncj.2016.01.006
1.武汉市第一医院神经内科
武汉430022
2.武汉大学人民医院神经内科
武汉430060
3.武汉大学医院
武汉430072
2014-07-09
姚汉云
hbyan1979@126. com
