替米沙坦对小鼠巨噬细胞M1/M2亚型极化的影响
2016-09-12邢亦明胡泽平王邦宁
邢亦明,胡泽平,王邦宁,周 青,汪 渊
替米沙坦对小鼠巨噬细胞M1/M2亚型极化的影响
邢亦明1,胡泽平1,王邦宁1,周 青2,汪 渊2
目的 探讨替米沙坦对小鼠巨噬细胞M1/M2亚型极化的影响。方法 分别用脂多糖(LPS)联合干扰素-γ(IFN-γ)和白介素-4(IL-4)诱导小鼠巨噬细胞M1/M2型极化,用免疫荧光法检测极化结果。在M1型巨噬细胞中分别加入0.1、1、10 μmol/L替米沙坦,同时设立空白对照组及溶剂对照组,Western blot法检测各组巨噬细胞亚型标志物诱导性一氧化氮合酶(iNOS)和精氨酸酶Ⅰ(ArgⅠ)的表达情况,ELISA法检测各组培养液上清中IL-6、IL-10表达情况。结果 在LPS+IFN-γ诱导的小鼠巨噬细胞中M1型巨噬细胞标志物iNOS、IL-6的表达水平明显升高,替米沙坦干预后,各干预组M1型巨噬细胞标志物iNOS、IL-6的表达水平下降(P<0.05),随着替米沙坦浓度的增加而降低,而代表M2型巨噬细胞标志物的ArgⅠ和IL-10表达水平上升(P<0.05)。结论 替米沙坦可以抑制LPS+IFN-γ诱导的小鼠巨噬细胞M1型极化,促进M1型巨噬细胞向M2型巨噬细胞转化。
替米沙坦;巨噬细胞M1/M2型极化;炎症
网络出版时间:2016-6-6 13:52:32 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160606.1352.030.html
替米沙坦是一种新型血管紧张素Ⅱ受体拮抗剂,广泛应用于临床冠心病、高血压等心血管疾病的治疗,其不仅有拮抗肾素-血管紧张素-醛固酮系统、改善心肌重构、改善血管内皮功能等心血管保护作用,更有抗炎、抗动脉粥样硬化作用[1]。动脉粥样硬化是一种慢性炎症性疾病,巨噬细胞在其中扮演了重要角色[2]。近年来,通过调节巨噬细胞功能影响动脉粥样硬化发生发展的研究受到广泛关注。研究[3]显示,巨噬细胞在不同的微环境下可以分化为M1和M2两种亚型,称为巨噬细胞极化。M1型巨噬细胞高表达诱导性一氧化氮合酶(inducible nitric oxide synthases,iNOS)、白介素-6(interleukin-6,IL-6)等,有促炎、促动脉粥样硬化作用;M2型巨噬细胞高表达精氨酸酶I(arginaseⅠ,ArgⅠ)、白介素-10(interleukin-10,IL-10)等,有抗炎、抗动脉粥样硬化作用。然而,替米沙坦是否能够调节巨噬细胞M1/M2型极化,目前尚不清楚。该研究探讨替米沙坦对小鼠巨噬细胞M1/M2型极化的影响。
1 材料与方法
1.1材料
1.1.1细胞株 小鼠巨噬细胞RAW264.7由中国科学技术大学生命科学院馈赠。
1.1.2主要试剂和仪器 替米沙坦购于上海勃林格殷格翰药业有限公司;胎牛血清(fetal bovine serum,FBS)购于杭州四季青生物工程材料有限公司;DMEM高糖培养基购于美国Gibco公司;脂多糖(lipopolysaccharides,LPS)购于美国Sigma公司;IL-4和干扰素-γ(interferon-γ,IFN-γ)均购于美国Peprotech公司;兔ArgⅠ多抗和β-actin单抗购于美国Santa Cruz公司;兔iNOS多抗购于美国Abcam公司;其余相应二抗及免疫荧光试剂盒购于北京中杉金桥生物技术有限公司;BCA定量试剂盒、ECL显色试剂盒均购于美国Pierce公司;IL-6、IL-10 ELISA试剂盒均购于北京四正柏科技有限公司;免疫荧光照片均使用Leica DM4000B拍摄。
1.2方法
1.2.1细胞培养和传代 用含有10%胎牛血清、100 U/ml链霉素、100 μg/ml青霉素和2 mmol/L谷氨酰胺的高糖DMEM培养基培养细胞,细胞培养瓶置入5%CO2、37℃培养箱中,当细胞密度为90% ~95%并处于对数生长期时,用0.25%胰酶消化传代。
1.2.2免疫荧光法检测巨噬细胞M1/M2亚型极化
将处于对数生长期的RAW264.7细胞接种于 6孔板,设立M1组和M2组,分别在M1组和M2组加入LPS 200 ng/ml+IFN-γ 20 ng/ml和IL-4 15 ng/ml共培养12 h,同时设立空白对照组(Mφ组),取出盖玻片,用预冷的PBS溶液清洗3遍,4%多聚甲醛固定20 min,PBS溶液清洗3遍;后用0.3%聚乙二醇辛基苯基醚(TritonX-100)透化细胞膜10 min,PBS冲洗3遍;用含1%BSA的PBS封闭30 min,弃封闭液,加入iNOS一抗和 ArgⅠ一抗(1∶200,用封闭液配制),4℃过夜,PBS洗3遍;再加入FITC标记的兔抗小鼠IgG二抗(1∶100,PBS配制),室温孵育1 h,弃二抗,PBS冲洗3遍再加入0.5 μg/ml DAPI染核10 min,弃DAPI;PBS冲洗3遍,最后用荧光淬灭剂封片,荧光显微镜观察结果并拍照。
1.2.3Western blot法检测iNOS、ArgⅠ的表达复苏RAW264.7细胞,按照上述方法进行培养及传代,待细胞稳定传代后,加入LPS 200 ng/ml+IFN-γ 20 ng/ml培养12 h,后加入替米沙坦0.1、1、10 μmol/L(替米沙坦用DMSO溶解),并设立空白对照组和溶剂对照组。共培养24 h后,PBS洗涤3次,每瓶加入200 μl RIPA蛋白提取液,冰上放置30 min,刮取细胞,移入1.5 ml预冷EP管中,反复冻融3次,14 000 r/min离心30 min,将上清液移入另一个1.5 ml EP管中。BCA法测定总蛋白浓度并将所有样本调整至相同浓度,加入4×蛋白上样缓冲液,混匀后煮沸变性,-80℃保存备用。配制12.5% SDS-PAGE,加入等量样本后电泳,电泳结束将蛋白转移至PVDF膜上。5%脱脂牛奶室温封闭2 h,一抗(iNOS、ArgⅠ、β-actin)4℃孵育过夜,PBS洗涤,二抗室温孵育2 h,洗涤后在暗室内加ECL,覆盖上X线片、显影、定影。底片扫描后用Quantity One分析灰度值。
1.2.4ELSIA法检测细胞上清液IL-6、IL-10水平
收集各培养瓶细胞培养上清液,根据说明书步骤使用ELISA法检测上清液IL-6、IL-10水平,酶标仪检测吸光度值,标准曲线计算活性。
1.3统计学处理 使用SPSS 19.0软件进行分析,计量资料以±s表示,两组间均值比较采用t检验,多组间均值比较采用单因素方差分析,进一步两两比较采用LSD法,以P<0.05为差异有统计学意义。
2 结果
2.1体外诱导小鼠巨噬细胞M1/M2亚型极化结果 M1组iNOS的表达水平相对于Mφ组和M2组均明显升高(P<0.05)(图1),而M2组ArgⅠ表达水平明显高于Mφ组及M1组(P<0.05)(图2),结果提示体外巨噬细胞极化造模成功。
2.2替米沙坦对M1型巨噬细胞iNOS和ArgⅠ表达的影响 在M1型巨噬细胞中加入不同浓度(0.1、1、10 μmol/L)替米沙坦干预24 h后,与空白对照组比较,替米沙坦干预各组iNOS表达水平明显下降,随着替米沙坦浓度的增加,iNOS表达水平明显降低(F=51.893,P<0.05)。同时,与空白对照组相比,替米沙坦干预各组ArgⅠ表达水平明显上升,随着替米沙坦浓度的增加,ArgⅠ表达水平明显上升(F=10.090,P<0.05)。见图3。
2.3替米沙坦对巨噬细胞培养上清液IL-6水平的影响 与Mφ比较,M1组上清液中IL-6水平明显增加(P<0.01);M1组与M1+DMSO组比较,差异无统计学意义;与M1组比较,替米沙坦干预组IL-6水平明显下降,随着替米沙坦的浓度增加,IL-6水平进一步降低(F=49.871,P<0.05)。见图4。

图1 M1组、Mφ组、M2组iNOS表达情况 免疫荧光×400
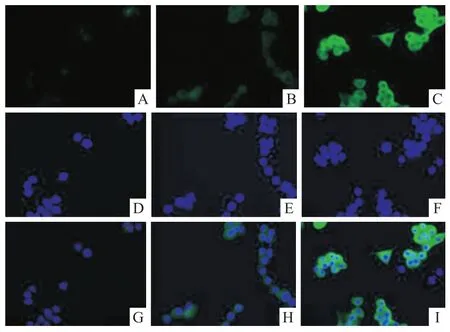
图2 M1组、Mφ组、M2组iNOS表达情况 免疫荧光×400
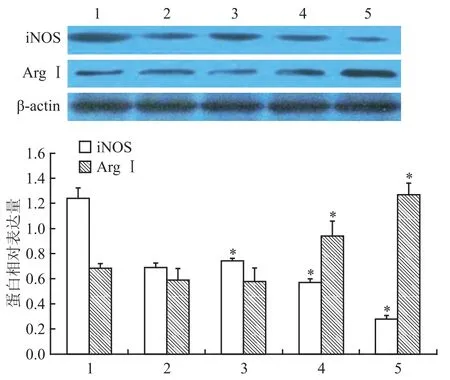
图3 Western blot法检测iNOS、ArgⅠ蛋白表达

图4 细胞培养上清液中IL-6水平
2.4替米沙坦对巨噬细胞培养上清液IL-10水平的影响 Mφ组、M1+DMSO组和M1组细胞培养上清液中IL-10水平差异无统计学意义;与M1组比较,替米沙坦干预组细胞培养上清液中IL-10水平均升高,随着替米沙坦的浓度增加,IL-10水平进一步升高(F=6 652.236,P<0.01)。见图5。
3 讨论
动脉粥样硬化是一种全身性的疾病,是多种心脑血管疾病的病理基础,亦是急性心脑血管事件的罪魁祸首,严重危害人类健康。随着人民生活水平的提高,动脉粥样硬化发病率呈逐年递增趋势且呈现年轻化。在动脉粥样硬化的形成机制中,炎症反应被证实参与了动脉粥样硬化的发生、发展及转归[2]。多种免疫细胞参与了动脉粥样硬化的炎症反应,其中单核细胞募集是动脉粥样硬化炎症反应中的早期事件,进入内皮下的单核细胞转化为巨噬细胞,巨噬细胞吞噬脂质形成泡沫细胞,成为粥样斑块形成的基础[4]。然而,巨噬细胞有异质性的特点,即根据局部微环境的不同起到促炎或抗炎的作用,称之为巨噬细胞极化。最经典的分型为通过经典途径激活的M1型和通过选择性途径激活的M2型,M1型巨噬细胞高表达iNOS、IL-6、IL-1β、IL-23、肿瘤细胞因子-α等,有促炎及促动脉粥样硬化形成的作用;M2型巨噬细胞高表达ArgⅠ、IL-10、转化生长因子-β等,有抗炎和抗动脉粥样硬化的作用[3];两者均存在于粥样斑块中,呈现动态平衡,可以相互转化[5]。研究[6]显示,巨噬细胞亚型与斑块的稳定性相关,在不稳定性斑块中,M1型巨噬细胞占主导地位;而在稳定斑块中,更多表现为M2型巨噬细胞;在易损的斑块肩部,M1型巨噬细胞个数远多于M2型巨噬细胞,而在相对稳定的纤维帽中,M1型巨噬细胞与M2型巨噬细胞数目相似,相对于巨噬细胞的绝对个数而言,亚型所占的比例对斑块的稳定性影响更大[7]。

图5 细胞培养上清液中IL-10水平
本研究就经典的巨噬细胞极化分型为理论基础,采用小鼠巨噬细胞株RAW264.7进行细胞培养,分别给予LPS+IFN-γ、IL-4进行极化造模,在诱导极化的同时加入不同浓度替米沙坦进行干预,研究结果可见替米沙坦对M1型巨噬细胞表面标志物iNOS、IL-6的表达有抑制作用,随着替米沙坦浓度的增加,iNOS、IL-6的表达水平进一步下降,差异有统计学意义。同时检测ArgⅠ、IL-10,与M1组比较,替米沙坦干预组ArgⅠ、IL-10的表达水平明显增加,随着替米沙坦浓度的增加,Arg I、IL-10的表达水平进一步增加,差异有统计学意义。提示,替米沙坦有抑制巨噬细胞向M1型分化的作用,随着浓度的增加,其抑制作用进一步增强,有诱导M1型巨噬细胞向M2型巨噬细胞转化的趋势。
巨噬细胞极化受多种信号通路及转录因子调控[8]。其中,过氧化物酶体增殖物激活受体-γ(peroxisome proliferator-activated receptor-γ,PPAR-γ)是一种在巨噬细胞中高表达的核受体,参与脂质代谢和阻止动脉粥样硬化的进程。PPAR-γ在IL-4诱导的巨噬细胞中通过STAT-6途径高表达,可通过抑制NF-κB途径和AP-1途径表达抗炎物质,是一种影响M2型巨噬细胞极化的重要转录因子[9]。M2型巨噬细胞表面标记物的表达与PPAR-γ呈正相关,PPAR-γ的活化可以促使单核细胞向M2巨噬细胞的分化[10]。替米沙坦有选择性激活PPAR-γ作用。本课题组前期研究[11]表明替米沙坦通过促进PPAR-γ的表达保护血管内皮,抑制动脉粥样硬化进展。推测替米沙坦可能通过促进PPAR-γ表达,促进M1型巨噬细胞向M2型转化。
综上所述,替米沙坦对小鼠巨噬细胞RAW264. 7的M1型极化有着抑制作用,促进M1型巨噬细胞向M2型转化,为替米沙坦的抗动脉粥样硬化作用提供了可能的新机制。
[1]Hu Z P,Wang B N,Qian H Y,et al.Fixed-dose telmisartan/ hydrochlorothiazide in comparison with losartan/hydrochlorothiazide in decreasing serum hepatocyte growth factor and improving endothelial dysfunction in hypertensive patients[J].Int Heart J,2010,51(4):252-8.
[2]Sloop G D.Atherosclerosis-an inflammatory disease[J].N Engl J Med,1999,340(24):1928.
[3]Colin S,Chinetti-Gbaguidi G,Staels B.Macrophage phenotypes in atherosclerosis[J].Immunol Rev,2014,262(1):153-66.
[4]Libby P,Ridker P M,Hansson G K.Inflammation in atherosclerosis:from pathophysiology to practice[J].J Am Coll Cardiol,2009,54(23):2129-38.
[5]van Tits L J,Stienstra R,van Lent P L,et al.Oxidized LDL enhances pro-inflammatory responses of alternatively activated M2 macrophages:a crucial role for Krüppel-like factor 2[J].Atherosclerosis,2011,214(2):345-9.
[6]Lee C W,Hwang I,Park C S,et al.Macrophage heterogeneity of culprit coronary plaques in patients with acute myocardial infarc-tion or stable angina[J].Am J Clin Pathol,2013,139(3):317-22.
[7]Stöger J L,Gijbels M J,van der Velden S,et al.Distribution of macrophage polarizationmarkers in human atherosclerosis[J].Atherosclerosis,2012,225(2):461-8.
[8]Federica D P,Bart S,Giulia C G.Macrophage phenotypes and their modulation in atherosclerosis[J].Circ J,2014,78(8):1775-81.
[9]Babaev V R,Yancey P G,Ryzhov S V,et al.Conditional knockout of macrophage PPARgamma increases atherosclerosis in C57BL/6 and low-density lipoprotein receptor-deficient mice[J].Arterioscler Thromb Vasc Biol,2005,25:1647-53.
[10]El Hadri K,Mahmood D F,Couchie D,et al.Thioredoxin-1 promotes anti-inflammatory macrophages of the M2 phenotype and antagonizes atherosclerosis[J].Arterioscler Thromb Vasc Biol,2012,32(6):1445-52.
[11]Hu Z P,Fang X L,Qian H Y,et al.Telmisartan prevents angiotensin II-induced endothelial dysfunction in rabbit aorta via activating HGF/Met system and PPARγ pathway[J].Fundam Clin Pharmacol,2014,28(5):501-11.
Effect of Telmisartan on mice macrophage M1/M2 polarization
Xing Yiming,Hu Zeping,Wang Bangning,et al
(Dept of Cardiology,The First Affiliated Hospital of Anhui Medical University,Hefei 230022)
Objective To investigate the effect of Telmisartan on the M1/M2 polarization of mice macrophage. Methods Mice macrophage was induced to M1/M2 polarization by LPS+IFN-γ and IL-4 respectively,and tested by immunofluorescence.Meanwhile cells were treated with 0.1,1,10 μmol/L Telmisartan,blank control group and vehicle control group were established at the same time.The biomarkers iNOS and ArgⅠwere tested by Western blot,and the cytokines IL-6 and IL-10 were tested by ELISA assay.Results The biomarker iNOS and IL-6,secreted by M1 macrophage,were apparently increased in the macrophages induced by LPS+IFN-γ.However,after being treated with Telmisartan,the expressions of iNOS and IL-6 were obviously decreased(P<0.05),as the concentration higher the expression lower.While,the expression of Arg I and IL-10,which represented the M2 macrophage,increased(P<0.05).Conclusion Telmisartan can inhibit the M1 polarization of mice macrophage RAW264.7 induced by LPS and IFN-γ and transform M1 macrophage polarization to M2 macrophage polarization.
Telmisartan;macrophage M1/M2 polarization;inflammation
R 392
A
1000-1492(2016)07-0989-05
2016-04-21接收
高等学校博士学科点专项科研基金(编号:20123420120005);安徽高校省级自然科学研究重点项目(编号:KJ2012A147)
1安徽医科大学第一附属医院心血管内科,合肥 2300222安徽医科大学分子生物学实验室,合肥 230032
邢亦明,女,硕士研究生;王邦宁,女,主任医师,教授,博士生导师,责任作者,E-mail:wangbangning@medmail.com.cn;胡泽平,男,副教授,副主任医师,硕士生导师,责任作者,E-mail:1431318679@qq.com
