RTCA实时定量动态监测HCMV在MRC-5细胞上的增殖的研究
2016-09-12张业婷俞海洋张文昌陈敬贤王明丽
张业婷,钟 峰,姚 瑶,赵 俊,俞海洋,张文昌,陈敬贤,王明丽
RTCA实时定量动态监测HCMV在MRC-5细胞上的增殖的研究
张业婷,钟 峰,姚 瑶,赵 俊,俞海洋,张文昌,陈敬贤,王明丽
目的 采用实时细胞分析(RTCA)系统监测人巨细胞病毒(HCMV)在MRC-5细胞株上的复制增殖过程,评价此方法在动态监测病毒增殖中的应用价值。方法 应用RTCA动态观察MRC-5细胞在不同阶段的生长指数(CI),选择合适的细胞浓度进行HCMV增殖的研究,同时采用传统的空斑形成试验和间接免疫荧光实验作为该方法学的比较和结果验证。结果 选择MRC-5最适细胞浓度为0.5× 105个/孔;与空斑试验及免疫荧光结果比较,半数细胞指数CI值对应时间(CIT50)与病毒初始滴度有良好的线性关系;同时CI值与病毒滴度随着时间的持续,显示出明显的负相关性(r=-0.977,P<0.05)。结论 RTCA技术可实时监测记录细胞生长状态,反应细胞贴壁、伸展,同时能实时定量监测HCMV增殖复制状况,数据客观可靠,为今后基础实验研究提供了新的实验技术和方法。
实时细胞检测技术;人巨细胞病毒;增殖
网络出版时间:2016-6-6 13:52:31 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160606.1352.008.html
人巨细胞病毒(human cytomegalovirus,HCMV)属于疱疹病毒β亚科,是疱疹病毒科中最大的一种病毒,结构复杂,基因组全长超过240 000 bp,病毒颗粒的直径约为200 nm。据报道,发达国家HCMV的成人平均感染率为40%~60%,而发展中国家高达到90%以上[1]。目前该病毒还被认为与恶性肿瘤、糖尿病、心血管疾病(动脉粥样硬化)有关[2]。HCMV通常呈潜伏感染,对免疫功能低下的个体,如艾滋病、器官移植、肿瘤及使用免疫抑制剂的患者体内HCMV病毒会被再激活,造成巨细胞病毒性视网膜炎、食管炎、胃炎、结肠炎、肝炎等终末器官综合征。HCMV又是先天性感染最常见的病原体之一,对孕妇和胎儿危害极大,可引起死胎、流产、胎儿畸形和发育迟缓等病理性损害。HCMV活动性感染的孕妇可通过产道感染新生儿,导致新生儿小头畸形、智力低下、黄疸、肝脾肿大、听力或视力丧失等多脏器、多系统不可逆性损害[3]。美国国家科学研究院医学研究所曾于1999年把研制预防先天性HCMV感染疫苗列为优先级研究对象,但至今仍无疫苗获准上市[4]。HCMV在细胞上的增殖复制的研究,能够为抗HCMV病毒药物的作用机制研究等方面提供一定的指导作用,目前仍缺少监测 HCMV增殖复制的可靠、新型、客观、准确和稳定的方法。该研究运用RTCA技术建立了实时动态监测HCMV病毒滴度的方法,建立了运用该仪器动态测算病毒滴度的方法,并与空斑形成实验和间接免疫荧光实验对比得出了一致的实验结果。
1 材料与方法
1.1材料
1.1.1细胞、病毒株 细胞株为人胚肺成纤维细胞(MRC-5),购自ATCC。HCMV AD169株为实验室标准毒株,由复旦大学上海医学院微生物学教研室提供,安徽医科大学微生物教研室保存,实验用毒株的滴度为1.0×105PFU/ml。
1.1.2试剂 DMEM培养基、小牛血清(美国Gibco公司);HCMV pp65抗体(英国Abcam公司);FITC标记羊抗鼠二抗(上海碧云天生物技术有限公司);琼脂糖(美国Promega公司)。
1.1.3仪器 RTCA iCelligence实时细胞功能分析仪(IXL8,美国ACEA公司);CO2培养箱(HF90,上海力申科学仪器有限公司);倒置荧光显微镜(IX53,日本Olypus公司);Countess自动细胞计数仪(C10281,美国Invitrogen公司)。
1.2方法
1.2.1RTCA监测细胞生长周期 使用RTCA实时无标记细胞功能分析仪监测MRC-5细胞生长周期。首先加入100 μl/孔含有10%小牛血清的营养液于8孔电子板内获得背景读数。随后按照300 μl/孔加入MRC-5细胞悬液,细胞终浓度分别为1.0 ×105、0.5×105、0.25×105个/孔。每个稀释度细胞平行设置复孔。室温放置 30 min后放入RTCA分析仪内实时动态检测细胞的黏附伸展及繁殖状态,将仪器设置30 min/次,监测并记录细胞指数值(cell index,CI),于37℃,5%CO2条件下培养,连续观察200 h。
1.2.2RTCA监测HCMV感染MRC-5细胞的致细胞病变效应(cytopathic effect,CPE) MRC-5细胞以5.0×104个/孔的浓度接种于8孔电子板内,培养24 h后弃去营养液,再加入300 μl/孔10倍系列稀释的HCMV AD169株病毒悬液以1.0×105、1.0 ×104、1.0×103、1.0×102PFU/孔到8孔电子板,感染MRC-5细胞,对照组加入300 μl维持液。37℃,5%CO2条件下孵育1.5 h后弃去病毒悬液,加入300 μl/孔含2%小牛血清的DMEM维持液继续培养,每个病毒稀释度做复孔,加入病毒后将8孔电子板放回实时细胞分析仪内,设置每隔30 min监测并记录CI值,共200 h。
1.2.3空斑形成实验检测病毒悬液滴度 将MRC-5细胞以5.0×104个/孔的量加入24孔细胞培养板内,待细胞生长成单层时,病毒以感染复数(multiplicity of infection,MOI)=0.1接种到MRC-5细胞上,37℃、5%CO2培养箱中孵育1 h后弃去病毒液,PBS洗3遍,加入含有2%FBS的培养液于37℃、5%CO2培养箱中培养,分别于孵育后0、12、24、36、48、60、72、84、96、108、120、132、144、156、168、180、192、204 h收集培养液,用维持液将病毒悬液10倍系列稀释后,再以0.2 ml/孔的量加入到细胞培养板中,同时设立细胞对照组,37℃孵育1.5 h,加入含有1%琼脂糖的DMEM培养液0.5 ml,置于37℃、5%CO2培养箱中培养7 d。其间逐日镜下观察细胞生长状况及其CPE,终止观察后加入含10%甲醛的结晶紫染色液,染色5 min后流水冲去琼脂凝块。在倒置显微镜下观察空斑并计数。病毒空斑形成单位(PFU/ml)=蚀斑均数×病毒稀释倍数/病毒接种量。
1.2.4免疫荧光检测HCMV在MRC-5细胞中复制
将MRC-5细胞以5.0×104个/孔的量加入24孔细胞培养板内,待细胞生长成单层时,病毒以MOI= 0.1接种到MRC-5细胞上,37℃、5%CO2培养箱中孵育1 h后弃去病毒液,PBS洗3遍,加入含有2% NBS的培养液于37℃、5%CO2培养箱中培养,分别于孵育后 0、12、24、36、48、60、72、84、96、108、120、132、144、156、168、180、192、204 h收集培养液,用间接免疫荧光实验分别检测不同时间段病毒的滴度,具体操作步骤如下:①将细胞爬片取出后PBS冲洗2次,4%多聚甲醛固定30 min;②加1%Trixon至玻片上,盖满玻片为准,37℃、5 min;③PBS洗涤3次,每次3 min,加入 5%小牛血清封闭液,37℃、1 h;④PBS洗涤3次,每次3 min,加入HCMV pp65单抗于玻片上,以盖满玻片为准,37℃、2 h;⑤PBS洗涤3次,每次3 min,加入FITC标记羊抗鼠IgG,盖满玻片,37℃、1 h;⑥PBS洗涤3次,每次3 min,50%甘油封片,荧光显微镜下观察记录结果。
1.3统计学处理 采用SPSS 17.0软件进行分析,使用了重复测量资料方差分析、线性相关分析等方法处理,数值变量采用χ2进行统计描述。
2 结果
2.1MRC-5细胞最适浓度的确定 本实验使用RTCA技术实时监测细胞增殖CI值,并由此确定接种病毒的最佳时间点。统计结果显示,当MRC-5细胞以0.5×105个/孔加入孔板内时,细胞在生长24 h后形成单层细胞层,无细胞聚集叠加现象,并且细胞平台期时间满足观察HCMV感染细胞CPE时间,与倒置显微镜下观察结果一致(图1)。

图1 RTCA监测MRC-5细胞增殖曲线
2.2RTCA监测HCMV致MRC-5细胞CPE效应 在MRC-5细胞中,当 MOI=2(即 HCMV滴度为2.0×105PFU/ml),半数细胞指数值(half cell index time,CIT50)为77 h,而当MOI=0.2(即 HCMV滴度为2.0×104PFU/ml),细胞CIT50为104 h,水平线与细胞指数曲线相应交点所对应的时间即为CIT50。当病毒以MOI=0.1接种于MRC-5细胞24 h后,显微镜下观察少数细胞出现变圆、肿胀现象,折光性增强,在接种达到96 h时,部分细胞出现脱落、凋亡现象。与镜下观察比较,RTCA细胞分析系统能够准确得反映病毒致细胞CPE效应。见图2。HCMV感染MRC-5细胞后CPE效应随着时间增加而递增,并且在不同HCMV感染剂量下,细胞CI值下降随时间递增(图3)。

图2 HCMV接种MRC-5细胞致CPE效应 ×100

图3 RTCA监测HCMV致MRC-5细胞CPE效应
2.3空斑形成实验检测HCMV病毒滴度 结晶紫染色液染色后,空斑呈无色圆形,散在均匀分布,界限明显(图4)。空斑形成实验统计结果显示,HCMV接种 MRC-5细胞后在40 h以内病毒滴度处于平稳期,这个时间包含了病毒的吸附期及隐蔽期,约在50 h时病毒滴度出现陡升,提示病毒在细胞内数量急剧增加,动力学曲线呈线性函数关系。此时,在显微镜下明显看出CPE。到150 h时病毒增殖速度明显下降,此时镜下观察细胞病变处于“”,部分细胞开始脱落,此时病毒滴度较初始病毒滴度增加约2 000倍(图5)。
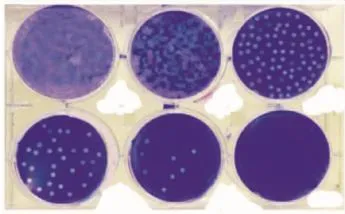
图4 空斑形成实验检测HCMV滴度
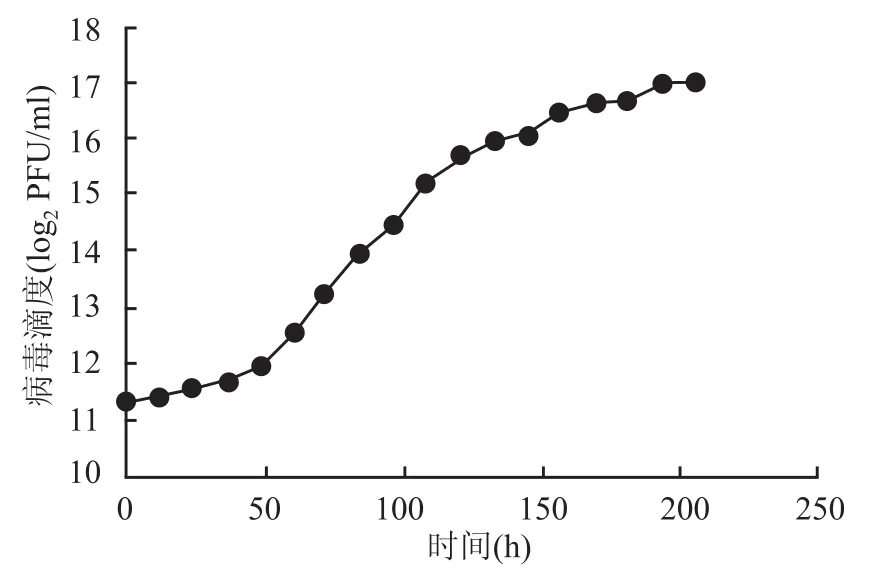
图5 空斑形成实验检测HCMV在MRC-5细胞中复制(±s,n=3)
2.4间接免疫荧光验证HCMV在MRC-5细胞中复制 荧光显微镜下观察,HCMV在细胞中随着时间的增加,pp65蛋白大量复制表达,感染阳性细胞数不断增多(图6)。将不同方法检测病毒滴度结果进行重复测量资料方差分析(表1),间接免疫荧光法和空斑形成实验相比较,差异无统计学意义(F= 0.745,P=0.437)。
2.5HCMV增殖滴度与CIT50及CI值相关分析 病毒在经过10倍系列稀释梯度下接种细胞后,细胞CIT50值随病毒滴度递减而呈递增趋势,分别以CIT50值为Y轴,HCMV滴度为X轴绘制曲线,获得线性图(图7)。CIT50值与HCMV感染剂量的log PFU呈反比,R2值为0.957,提示两者之间有良好的线性回归关系,通过生成的公式Y=-26.800X+211.30,由实验结果得出的CIT50值可以直接计算出初始病毒的滴度。实验结果比较表明,细胞指数与病毒滴度存在相关性,在病毒接种后36 h内,细胞指数相对稳定、贴壁状况良好;而随着感染时间的增加,病毒开始大量复制,细胞CPE效应增加,细胞指数也随之急剧下降,通过散点图显示病毒滴度与细胞指数是非线性趋势。因此对细胞指数进行对数转换(图8),转换后的变量结果为Ln(代表细胞指数),通过散点图可以发现病毒滴度和Ln基本呈线性趋势,对两个变量进行正态性检验,结果表明两个变量都是正态分布。满足线性相关条件。病毒滴度和Ln的相关系数,二者呈负相关性(r=-0.977,P<0.05)。以病毒滴度为因变量,Ln为自变量进行线性回归分析,结果显示自变量对变量的影响差异有统计学意义(P<0.05)。

图6 HCMV在MRC-5中不同时间段荧光显微镜观察结果 ×200
表1 两种方法检测HCMV病毒滴度结果比较(×103,±s)

表1 两种方法检测HCMV病毒滴度结果比较(×103,±s)
方法24 h 48 h 72 h 96 h免疫荧光(GFU/ml)3.16±0.13 3.97±0.32 9.86±0.21 25.2±1.0空斑形成(PFU/ml)3.08±0.16 4.04±0.29 9.74±0.19 23.2±3.3

图7 MRC-5细胞感染HCMV的滴度与CIT50线性关系
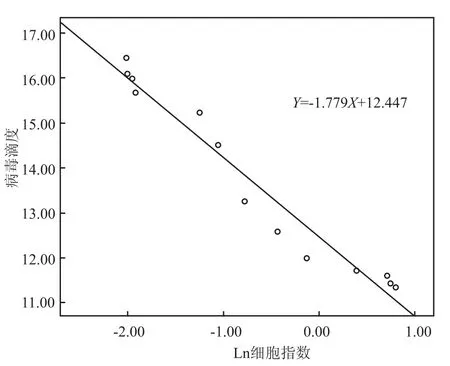
图8 病毒感染过程中病毒滴度与细胞指数的相关分析
3 讨论
目前对于HCMV增殖复制与宿主间复杂的相互作用缺乏深入了解。研究病毒的最常用方法仍是空斑形成实验,但此法费时费力,不宜快速检测,且无法获取病毒复制及其引起的细胞病变的完整信息。各实验室条件和体系不同,数据无法参比,为基础研究带来了困难。另外,此外某些病毒如减毒突变株可能会在细胞内复制成功,但由于其作用微弱,在单层细胞上产生的空斑难以识别,因此空斑试验无法研究此类病毒的CPE。
本研究采用RTCA实时监测HCMV在MRC-5细胞中的增殖状况。在进行MRC-5细胞测试HCMV的CPE检测之前,先使用RTCA对细胞生长繁殖进行定量分析,以确定病毒感染性实验的最佳细胞浓度。判断依据为正常细胞增殖处于对数生长期,并且平台期维持在6 d以上,确保感染病毒后细胞能被持续观察。本次实验结果得出,当细胞浓度为5.0×104个/孔时,最适合病毒的接种,RTCA检测细胞接种HCMV后的CI值与空斑形成实验结果比较,病毒的滴度与CI值呈明显负相关性,提示通过RTCA检测细胞CI值可实时反映病毒的滴度。
RTCA与传统的检测方法相比有明显优势,操作简单、步骤少、人为干扰小;完整细胞效应图谱,提供大量、重要的动态反应信息;实验结果客观、重复性好;降低了操作人员与病毒接触的次数(实验全过程仅需一次),安全系数高,尤其对高致病性病原体;全自动实时监控,全过程动态观察;可以高通量的进行特异性抗体的检测及疫苗的保护性效果评价。RTCA的应用领域非常广泛,涉及新药研发、毒理学、肿瘤学、医学微生物学及病毒学等。Lu et al[5]运用RTCA技术评估了H1N1疫苗接种是否成功,Solly et al[6]运用RTCA做一些以细胞为基础的实验,为新药的研发奠定基础。
本文运用RTCA细胞分析系统实现了对细胞实时全程动态监测,在临床疾病指导治疗等方面的应用也具有很高的价值,为今后抗病毒药物的研制及疫苗的研发提供可靠有力的实验基本技术。
[1]Hoz R E,Stephens G,Sherlock C.Diagnosis and treatment approaches of CMV infections in adult patients[J].Clin Virol,2002,25:S1-12.
[2]Dolcino M,Puccetti A,Barbieri A,et al.Infections and autoimmunity:role of human cytomegalovirus in autoimmune endothelial cell damage[J].Lupus,2015,24(4-5):419-32.
[3]Pillet S,Roblin X,Cornillon J,et al.Quantification of cytomegalovirus viral load[J].Expert Rev Anti Infect Ther,2014,12(2):193-210.
[4]Arvin A M,Fast P,Myers M,et al.National Vaccine Advisory Committee.Vaccine development to Prevent cytomegalovirus disease:report from the National vaccine Advisory Committee[J]. Clin Infect Dis,2004,39(2):233-9.
[5]Lu H Z,Xu X.Label-free real-time cell based assay system for evaluating H1N1 vaccination success[J].Asia Pac Biotech News,2010,14(10):15-7.
[6]Solly K,Wang X,Xu X,et al.Application of real-time cell electronic sensing(RT-CEs)technology to cell-based assays[J].Assay Drug Dev Technol,2004,2(4):363-72.
Monitoring of HCMV replication with real-time cell assay on MRC-5
Zhang Yeting,Zhong Feng,Yao Yao,et al
(Dept of Microbiololgy,Anhui Medical University,Hefei 230032)
Objective To detect the human cytomegalovirus(HCMV)replication in MRC-5 cells by applying realtime cell assay(RTCA)system,and evaluate the applicable value of this method in the dynamic monitoring of viral replication.Methods RTCA was applicated to monitor cell index(CI)in different growth stages.The optimal concentration of cell was selected to study HCMV replication.Additionally,traditional plaque formation assay and immunofluorescence assay were used to compare and validate the result of RTCA system.Results The most suitable cell concentration was 0.5×105cells per plate.Compared with the plaque formation assay and immunofluorescence assay,the value of half cell index(CIT50)had a satisfactory linear correlation with the initial virus titer.The RTCA system showed a significant negative correlation with time continuation for the detection of cell index and the virus titer(r=-0.977,P<0.05).Conclusion RTCA technique is successfully established to monitor the growth status of the cells in real time,which might reflect the cell's adhesion and spreading.The RTCA system could timely monitor HCMV titer with cell index.All the data are solid and reliable.The method would be helpful for future basic experiments on creating new experimental techniques and methods.
real-time cell assay;human cytomegalovirus;proliferation
R 373.9
A
1000-1492(2016)07-0935-05
2016-02-22接收
国家自然科学基金(编号:30872253);安徽高校省级自然科学研究项目(编号:KJ2012ZD08)
安徽医科大学微生物学教研室,合肥 230032
张业婷,女,硕士研究生;王明丽,女,教授,硕士导师,责任作者,E-mail:1952987441 @qq.com
