正加速度适应性训练对大鼠胃黏膜COX-1 mRNA和COX-2 mRNA表达的影响
2016-09-12唐合兰杨春敏王建昌
刘 昊,陈 英,徐 珊,杜 斌,唐合兰,颜 伟,邱 杰,杨春敏,,王建昌
正加速度适应性训练对大鼠胃黏膜COX-1 mRNA和COX-2 mRNA表达的影响
刘 昊1,陈 英2,徐 珊2,杜 斌2,唐合兰2,颜 伟2,邱 杰2,杨春敏1,2,王建昌2
目的 探讨正加速度适应性训练对大鼠胃黏膜环氧合酶1(COX-1)mRNA和环氧合酶2(COX-2)mRNA表达的影响。方法 40只雄性SD大鼠随机分为5组,每组8只,分别标记为A、B、C、D、E组。A组为空白对照组,不做任何处理;B组大鼠每天+5 Gz值暴露5 min,连续暴露5 d;C组大鼠每天+10 Gz值暴露5 min,连续暴露5 d;D组大鼠适应性训练即+4 Gz值每天暴露3 min,连续暴露5 d后+5 Gz值每天暴露5 min,连续暴露5 d;E组大鼠适应性训练即+4 Gz值每天暴露3 min,连续暴露5 d后+10 Gz值每天暴露5 min,连续暴露5 d。试验结束后肉眼和光学显微镜下观察胃黏膜损伤情况,ELISA法检测胃黏膜6-酮-前列腺素F1α(6-Keto-PGF1α)的含量,RT-PCR法检测胃黏膜内COX-1 mRNA 和COX-2 mRNA的相对表达量。结果 B组和C组6-Keto-PGF1α含量低于A组(P<0.05);适应性训练后D组6-Keto-PGF1α含量高于B组,E组6-Keto-PGF1α含量高于C组,差异均有统计学意义(P<0.05)。COX-1 mRNA相对表达量各组间差异无统计学意义。B组COX-2 mRNA表达高于A组(P<0.05),C组COX-2 mRNA表达高于A组和B组(P<0.05)。适应性训练后D组COX-2 mRNA表达高于B组,E 组COX-2 mRNA表达高于 C组(P<0.05)。6-Keto-PGF1α含量与COX-1 mRNA和COX-2 mRNA相对表达量间均无相关性。结论 正加速度适应性训练明显减轻高+Gz值带来的胃黏膜损伤,其机制与前列环素生成及COX-2 mRNA表达增加有关。
正加速度;适应性训练;胃黏膜;环氧合酶1;环氧合酶2;前列环素
网络出版时间:2016-6-6 13:52:31 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160606.1352.014.html
现代高性能战斗机有高机动性、超重和高正加速度(+Gz)增长率等特点,远远超过人体正常的生理耐限,因此,提高高性能战斗机飞行员的抗载荷防护能力是航空医学研究的一个主攻方向。持续的+ Gz离心机适应性训练作为提高抗+Gz耐力的一种手段,其应用已有几十年的历史,目前尚未有相关研究报道其分子机制。研究[1]表明大鼠正加速度适应性训练可明显减轻高+Gz带来的胃黏膜损伤,其机制与胃黏膜内前列腺素物质生成相关,前列环素(prostacyclin,PGI2)为大鼠胃黏膜内含量最为丰富的一型前列腺素类物质,由于PGI2的生物半衰期(T1/2)较短,故通常测定其稳定的代谢产物6-酮-前列腺素F1α(6-Keto-PGF1α)代表其含量的变化[2],环氧合酶(cyclooxygenase,COX)为合成前列腺素类物质的限速酶,该研究拟从COX mRNA水平上探讨正加速度适应性训练提高其抗胃黏膜损伤的机制。
1 材料与方法
1.1实验动物 40只雄性SD大鼠,(180±10)g,SPF级,购自中国人民解放军军事医学科学院实验动物中心,食用由中国航空航天医学研究所提供的全营养颗粒饲料,自由饮食及水,空调下饲养,维持室内恒温、恒湿。
1.2试剂与仪器 小动物离心机、小动物手术器械、游标卡尺、试验动物解剖操作台由航空航天医学实验室提供;TRIzol试剂盒(美国Invitrogen公司);TaqMix、dNTP、M-MLV逆转录酶(大连宝生物工程有限公司);DNaseI(美国Fermentas公司);6×Loading Buffer(美国 MBI公司);GelRed(美国 Biotium公司);Chromo4荧光定量PCR仪(美国BIO-RAD公司);MICRO 17TR离心机(韩国Hanil公司);Image system(EUV-LDUV)凝胶成像系统(韩国KoreaBiotech公司);戊巴比妥钠(美国 Sigma公司);病理切片机及光学显微镜由中国人民解放军空军总医院病理科提供。
1.3动物分组 40只雄性SD大鼠适应性饲养1周后按随机数字表法分为5组,每组8只大鼠,A组为空白对照组,B组为+5 Gz值暴露组,C组为+10 Gz值暴露组,D组为适应性训练后+5 Gz值暴露组,E组为适应性训练后+10 Gz值暴露组。
1.4+Gz暴露及适应性训练 采用由中国航空航天医学研究所提供的小动物离心机模拟+Gz值暴露,离心机半径为1 m,离心全程由电脑进行加速度程序控制。参照本课题组前期试验方法[3]及预实验结果,适应性训练及+Gz暴露处理如下:A组大鼠不做任何处理;B组大鼠每天在+5 Gz值加速度下暴露5 min,连续暴露5 d;C组大鼠每天在+10 Gz值加速度下暴露5 min,连续暴露5 d;D组大鼠适应性训练即每天在+4 Gz值加速度下暴露3 min,连续暴露5 d后每天在+5 Gz值加速度下暴露5 min,连续暴露5 d,E组大鼠适应性训练即每天在+4 Gz值加速度下暴露3 min,连续暴露5 d后每天在+10 Gz值加速度下暴露5 min,连续暴露5 d。
1.5标本采集 各实验组在相应天数正加速度处理完毕后,用2%戊巴比妥钠(2.3 ml/kg)腹腔麻醉后固定,打开腹腔,小心分离大鼠胃脏,贲门和幽门侧离断后取出大鼠胃置于干净纱布上,沿胃大弯侧剪开胃腔,生理盐水冲洗,小刀轻轻刮取适量胃黏膜置于冻存管中-80℃保存。
1.6组织病理切片制备 取胃黏膜损伤最严重处组织(10 mm×10 mm)一块,甲醛固定、组织脱水、透明、浸蜡与包埋、切片、制片、HE染色。光学显微镜下观察胃黏膜组织病理学变化。
1.7胃黏膜6-Keto-PGF1α含量检测 采用ELISA法检测胃黏膜6-Keto-PGF1α的含量,具体操作方法严格按照6-Keto-PGF1α试剂盒说明书进行,测定结果以pg/ml表示。
1.8胃黏膜COX-1 mRNA、COX-2 mRNA实时定量PCR(RT-PCR)法检测 取胃黏膜标本置于研钵中并加入液氮小心研磨,严格按照TRIzol试剂盒说明书提取RNA,向样品RNA中依次加入RNase ⅠInhibitor 4 μl,DNaseⅠbuffer 10 μl,DNaseⅠ10 μl,并加入DEPC至100 μl,混匀90 min,消化样品RNA中的DNA。按照M-MLV逆转录酶试剂盒说明书将RNA反转录为cDNA,引物由北京中美泰和生物技术有限公司合成,见表1。向各样本中加入染料2×Ex Taq Mix 12.5 μl,10 μmol/L引物混合物0.75 μl,对应的cDNA各1 μl,其中一管不加模板用作阴性对照,各管补加水至25 μl,混匀后置于PCR仪中95℃预变性5 min,95℃、30 s,60℃、30 s,72℃、30 s,共40个周期,产物在4℃保存。120 V电压下电泳20 min,电泳结束后在凝胶紫外分析仪照相。整个PCR过程由计算机收集数据,绘制曲线,并以β-actin作为内参,读取数据,各mRNA表达水平用2-ΔΔCt表示。
1.9统计学处理 采用SPSS 18.0软件进行分析,首先对数据进行正态性检验和方差齐性分析,计量资料使用±s表示,多组均数间比较采用单因素方差分析,两变量关系采用线性相关分析。
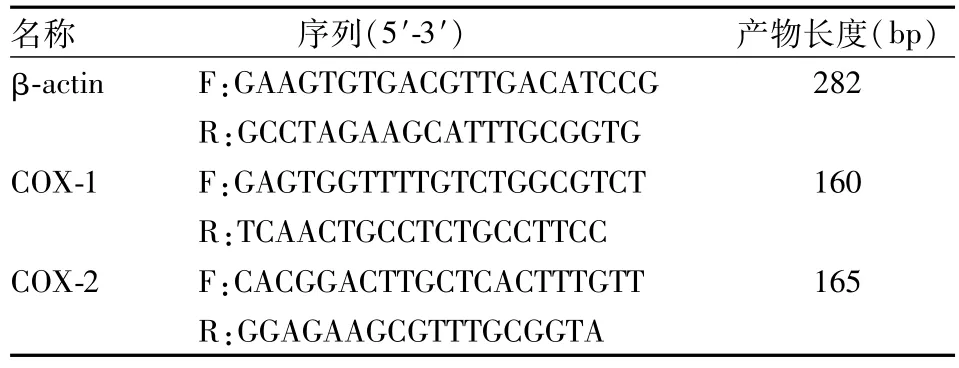
表1 PCR引物系列
2 结果
2.1试验动物基本情况 各组大鼠在整个试验操作过程中均无死亡,每次正加速度处理完毕后出现暂时性行走不稳、精神萎靡,但随着时间推移,各组大鼠逐渐恢复至正常活动和饮食。
2.2组织病理学 A组:胃黏膜组织形态正常,未见损伤性改变,黏膜层、黏膜下层、肌层、浆膜层组织完整。B组:黏膜层及黏膜下层有部分坏死组织,绒毛结构部分脱落,黏膜层可见炎性细胞浸润。C组:损伤深达肌层和浆膜层,腺体结构破坏严重,大量组织脱落、中断,炎性细胞浸润。D组:损伤达黏膜层,腺体部分破坏,绒毛破坏较轻,可见炎性细胞浸润。E组:损伤达黏膜层,黏膜下层有部分损伤,腺体结构部分破坏,可见炎性细胞浸润。见图1。
2.3胃黏膜6-Keto-PGF1α含量 B组和C组6-Keto-PGF1α含量均低于A组(P<0.05);B组和C组间比较差异无统计学意义;适应性训练后,D组6-Keto-PGF1α含量高于B组,E组6-Keto-PGF1α含量高于C组,差异均有统计学意义(P<0.05)。见图2。
2.4胃黏膜COX-1 mRNA、COX-2 mRNA RTPCR检测结果 COX-1 mRNA相对表达量各组差异无统计学意义。B组COX-2 mRNA表达高于 A组(P<0.05),C组COX-2 mRNA表达高于A组和B组(P<0.05)。适应性训练后,D组COX-2 mRNA表达高于B组,E组COX-2 mRNA表达高于C组,差异均有统计学意义(P<0.05)。见表2。

图1 各组大鼠胃黏膜 HE染色结果
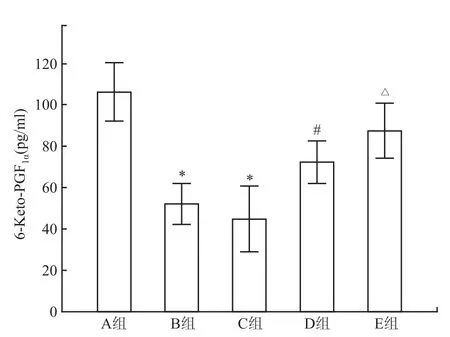
图2 胃黏膜 6-Keto-PGF1α含量变化
表2 大鼠胃黏膜COX mRNA相对表达量(n=8,±s)
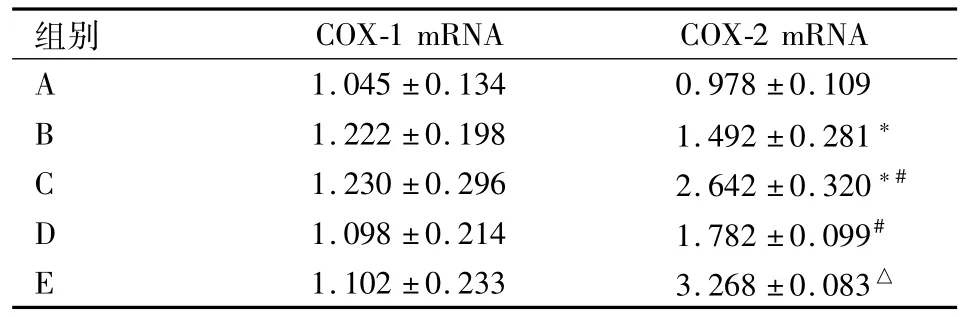
表2 大鼠胃黏膜COX mRNA相对表达量(n=8,±s)
与 A组比较:*P<0.05;与B组比较:#P<0.05;与C组比较:△P<0.05
组别COX-1 mRNA COX-2 mRNA A 1.045±0.134 0.978±0.109 B 1.222±0.198 1.492±0.281*C 1.230±0.296 2.642±0.320*#D 1.098±0.214 1.782±0.099#E 1.102±0.233 3.268±0.083△
2.56-Keto-PGF1α与COX mRNA相对表达量的相关性分析 各组大鼠胃黏膜6-Keto-PGF1α含量与COX-1 mRNA、COX-2 mRNA相对表达量间均无相关性(r=-0.277、-0.135,P>0.05)。见图3。

图3 大鼠胃黏膜6-Keto-PGF1α含量与 COX mRNA表达的相关性分析
3 讨论
PGI2由血管内皮细胞生成,为大鼠胃黏膜中含量最丰富的一型前列腺素类物质,内源性含量降低则可造成胃黏膜损伤[4-5]。研究[6]表明,应激性胃黏膜损伤与胃的高幅和高频收缩密切有关,而PGI2能抑制胃环形肌收缩,刺激纵形肌收缩,从而防止或减轻胃黏膜损伤。研究[7]显示PGI2在适应性细胞保护中有重要作用,能够刺激辣椒素敏感神经元释放降钙素基因相关肽(calcitonin gene-related peptide,CGRP),CGRP可扩张微动脉从而增加胃黏膜血流量,为黏膜细胞提供丰富的氧和营养物质,带走有害物质,增加胃黏液分泌,促进胃黏膜上皮细胞的修复,同时还可以恢复胃黏膜溃疡基底层血管的微循环。本研究结果表明,随着+Gz暴露值的增加,胃黏膜损伤逐渐加重,PGI2含量逐渐降低。在适应性训练后,D组6-Keto-PGF1α含量高于B组,E 组6-Keto-PGF1α含量明显高于C组,且差异均有统计学意义,说明适应性训练后,PGI2合成增加,胃黏膜保护作用加强。
20世纪90年代以来,科学家们发现COX有两个亚型,即结构性表达的COX-1和诱导性表达的COX-2。随着近年来研究的深入,第3种COX被发现,把其命名为COX-3,但随后的研究[8]显示,这种COX亚型没有COX活性,在人体组织中无法催化花生四烯酸生成前列腺素类物质(prostaglandins,PG),大鼠中COX-3同样没有COX活性。COX-1来源的PG在维持胃黏膜的完整性方面有重要作用,而COX-2催化的产物则与炎症反应密切相关。外源性PG能够抵御应激性刺激从而维持胃黏膜的完整性。Robert et al[9]首次提出内源性PG合成和释放在适应性细胞保护中占有重要地位,但是目前仍然不清楚何种COX牵涉适应性保护作用。既往研究[10]已经明确内源性PG的合成依赖于COX的作用,COX是合成PG物质的限速酶。
在正常生理状况下,PG的合成依赖花生四烯酸的存在和COX-1的活动。相反地,COX-2在大多数组织中却不是构成性表达的,COX-2能够被众多刺激因素所诱导,这些刺激因素包括白细胞介素-1、肿瘤坏死因子α、生长因子、脂多糖和氧化应激等。许多刺激物如乙醇、吲哚美辛、水杨酸盐等均能带来COX-2 mRNA和COX-2蛋白的表达[11]。Mizuno et al[12]发现在乙醇致大鼠胃黏膜急性损伤中COX-2 mRNA和COX-2蛋白的显著上升。既往研究[8]显示,在正常胃黏膜中COX-1是持续性表达的,COX-2则不表达或者只有微量表达。在正常胃黏膜和应激性损伤胃黏膜中均检测到COX-1 mRNA的高表达,COX-1在正常胃黏膜中执行“看家”的生理功能[13]。在胃黏膜受到温和或剧烈的刺激后,COX-2 mRNA则高度表达,有利于适应性细胞保护作用的产生。Davies et al[14]认为这种在剧烈刺激时的COX-2 mRNA过度表达可能补充了正常胃黏膜中PG的产生不足。COX-2能够诱导表皮生长因子、肝细胞生长因子、转化生长因子α、血管内皮生长因子等增殖性因子表达,促进上皮细胞增殖和血管生成,参与胃黏膜的防御和修复[15]。COX-2在急性胃黏膜损伤中表达明显增强,从而发挥对胃黏膜的保护作用并促进胃黏膜损伤的愈合。
本研究显示,B组(+5 Gz值暴露组)和C组(+10 Gz值暴露组)大鼠胃黏膜COX-1 mRNA相对表达量较空白对照组差异无统计学意义。适应性训练后,COX-1 mRNA相对表达量亦无明显改变。COX-1 mRNA似乎在正加速度适应性训练中作用不大。COX-2 mRNA在A组(空白对照组)相对表达量较低,B组(+5 Gz值暴露组)和 C组(+10 Gz值暴露组)COX-2 mRNA相对表达均高于A组,且C 组COX-2 mRNA相对表达高于B组,说明+Gz暴露值越大,COX-2 mRNA相对表达越高。适应性训练后,D组COX-2 mRNA相对表达量高于B组,E组相对表达量高于C组,说明适应性训练可刺激COX-2 mRNA表达增加,促进胃黏膜的修复,维持胃黏膜的完整。
6-Keto-PGF1α与COX-1 mRNA和COX-2 mRNA相对表达均无相关性。故推断本研究中PGI2生成是由COX-1和COX-2共同作用的结果,COX-2 mRNA表达增加占主要地位。正常生理状况下,COX-1来源的PGI2促进胃黏液分泌,增加胃血流量,保护胃黏膜。当受到+Gz刺激时,COX-1和COX-2共同作用产生PGI2促进胃黏膜内各种生长因子的大量生成、抗黏膜损伤、增加胃黏膜血流量,发挥适应性细胞保护作用。
综上所述,本研究结果表明,正加速度适应性训练可显著提高+Gz暴露下胃黏膜抗损伤的能力,其机制与 PGI2生成及 COX-2 mRNA表达增加有关,与COX-1 mRNA表达关系不大,为深入研究飞行人员正加速度适应性训练在减少胃肠道损伤方面的研究奠定基础。
[1]刘 昊,陈 英,徐 珊,等.正加速度适应性训练对大鼠胃黏膜PGI2、TXA2含量及TXA2/PGI2比值的影响[J].世界华人消化杂志,2015,23(29):4680-6.
[2]Liu D,Liu B,Luo W,et al.A vasoconstrictor response to COX-1-mediated prostacyclin synthesis in young rat renal arteries that increases in prehypertensive conditions[J].Am J Physiol Heart Circ Physiol,2015,309(5):H804-11.
[3]范 勤,陈 英,杜 斌,等.+Gz暴露对大鼠胃黏膜损伤及胃液表皮生长因子含量的影响[J].胃肠病学和肝病学,2013,22(3):228-31.
[4]Mary C C,Kenneth J O,John V R,et al.COX-derived prostanoid pathways in gastrointestinal cancer development and progression:novel targets for prevention and intervention[J].Biochim Biophys Acta,2012,1825(1):49-63.
[5]Yuan C,Smith W L.A cyclooxygenase-2 dependent prostaglandin E2 biosynthetic system in the Golgi apparatus[J].J Biol Chem,2015,290(9):5606-20.
[6]Weiya M.Chronic prostaglandin E2 teratment induces the synthesis of the pain-related peptide substance P and calcitonin gene-related peptide in cultured sensory ganglion explants[J].J Neurochem,2010,115(2):363-72.
[7]Li N S,Luo X J,Dai Z,et al.Beneficial effects of capsiate on ethanol-induced mucosal injury in rats are related to stimulation of calcitonin gene-related peptide release[J].Planta Med,2012,78 (1):24-30.
[8]Brzozowski T,Konturek P C,Konturek S J,et al.Expression of cyclooxygenase(COX)-1 and COX-2 in adaptive cytoprotection induced by mild stress[J].J Physiol Paris,2000,94(2):83-91.
[9]Robert A,Nezamis J E,Lancaster C,et al.Mild irritants prevent gastric necrosis through“adaptive cytoprotection”mediated by prostaglandins[J].Am J Physiol,1983,245(1):G113-21.
[10]Peskar B M.Role of cyclooxygenase isoforms in gastric mucosal defence[J].J Physiol Paris,2001,95(1-6):3-9.
[11]Villegas I,La Casa C,de la Catalina A,et al.Mucosal damage induced by preferential COX-1 and COX-2 inhibitors:Role of prostaglandins and inflammatory response[J].Life Sci,2004,74(7):873-84.
[12]Mizuno H,Sakamoto C H,Matsuda K,et al.Induction of cyclooxygenase 2 in gastric mucosal lesions and its inhibition by thespecific antagonist delays healing in mice[J].Gastroenterology,1997,12(2):387-97.
[13]Yuan C,Smith W L.A Cyclooxygenase-2 dependent prostaglandin E2 biosynthetic system in the golgi apparatus[J].J Biol Chem,2015,290(9):5606-20.
[14]Davies N M,Sharkley K A,Asfaha S,et al.Aspirin causes rapid up-regulation of cyclooxygenase-2 expression in the stomach of rats [J].Alim Pharmacol Ther,1997,11(6):1101-8.
[15]Haruna H,Shimizu T,Ohtsuka Y,et al.Expression of COX-1,COX-2,and PPAR-gamma in the gastric mucosa of children with Helicobacter pyloriinfection[J].PediatrInt,2008,50(1):1-6.
Effects of positive acceleration adaptive training on the expression of COX-1 mRNA and COX-2 mRNA in gastric mucosa
Liu Hao1,Chen Ying2,Xu Shan2,et al
(1Air Force Clinical Institute,Anhui Medical University,Beijing 100142;
2Cadre Ward,General Hospital of Air Force of Chinese PLA,Beijing 100142)
Objective To study the effects of positive acceleration adaptive training on the expression of COX-1 mRNA and COX-2 mRNA in gastric mucosa.Methods 40 male SD rats were randomly divided into 5 groups:A,B,C,D and E.Group A was the control group,and did not undergo any treatment.Group B was exposed to+5 Gz for 5 minutes per day over 5 consecutive days.Group C was exposed to+10 Gz for 5 minutes per day over 5 consecutive days.Group D was exposed to+4 Gz for 3 minutes per day over 5 consecutive days and+5 Gz for 5 minutes per day over another 5 consecutive days.Group E was exposed to+4 Gz for 3 minutes per day over 5 consecutive days and+10 Gz for 5 minutes per day over another 5 consecutive days.The damage to the gastric mucosa was then observed with the naked eye and under the microscope.The 6-Keto-PGF1αcontent in gastric mucosa was detected by ELISA.The expression of COX-1 mRNA and COX-2 mRNA was assessed with RT-PCR method.Results The content of 6-Keto-PGF1αwas significantly lower in group B than in group A and in group C than group A (P<0.05).After adaptive training,the content of 6-Keto-PGF1αwas significantly higher in group D than in group B and in group E than group C(P<0.05).There was no significant difference on the expression of COX-1 mRNA in all groups.The expression of COX-2 mRNA was significantly higher in group B than in group A and in group Cthan group B and group A(P<0.05).After adaptive training,the expression of COX-2 mRNA was significantly higher in group D than in group B and in group E than group C.The content of 6-Keto-PGF1αand the expression-COX-1 mRNA,and the expression of COX-2 mRNA,had no significant correlation(P<0.05).Conclusion A-daptive training can significantly reduce the gastric mucosal damage caused by high+Gz value,and its mechanism is related to the increase in PGI2content and expression of COX-2 mRNA.
positive acceleration;adaptive training;gastric mucosa;cyclooxygenase 1;cyclooxygenase 2;prostacyclin
R 852.21
A
1000-1492(2016)07-0951-06
2016-03-23接收
全军十二五后勤科研计划基金资助项目(编号:AKJ11J004)
1安徽医科大学空军临床学院,北京 1001422中国人民解放军空军总医院干部病房,北京 100142
刘 昊,男,硕士研究生;杨春敏,男,教授,主任医师,硕士生导师,责任作者,E-mail:Chunmyang9816@163.com
