HIF-1α稳定表达抑制缺血再灌注大鼠心肌细胞凋亡的作用研究
2016-09-11刘艳李玲萍张红霞张炜芳王丽月薛晋红贺忠梅
刘艳 李玲萍 张红霞 张炜芳 王丽月 薛晋红 贺忠梅
HIF-1α稳定表达抑制缺血再灌注大鼠心肌细胞凋亡的作用研究
刘艳 李玲萍 张红霞 张炜芳 王丽月 薛晋红 贺忠梅
目的 探讨低氧诱导因子-1α(HIF-1α)稳定表达对大鼠心肌缺血再灌注细胞凋亡的影响及可能机制。方法 采用结扎冠脉左前降支45 min,再灌注3 h的方法,构建大鼠心肌缺血再灌注损伤模型。实验分为假手术组(Sham)、心肌缺血/再灌注组(MI/R)、HIF-1α活化剂 DMOG+心肌缺血/再灌注组(D+MI/R)、HIF-1α抑制剂YC-1+心肌缺血/再灌注组(YC-1+MI/R),采用全自动生化分析仪测定血清心肌酶(CK-MB,LDH)活性,Western blot检测心脏组织HIF-1α蛋白表达,Evens blue/TTC染色测定心肌梗死面积,TUNEL染色及Caspase-3、8、9活性测定心肌细胞凋亡。结果 ①与MI/R组相比,D+MI/R组的HIF-1α蛋白表达量增加约 4.6倍(P<0.01),心肌酶 CK-MB、LDH 的活性降低(P<0.05),心肌梗死面积减小(P<0.05),并且心肌组织的病理损伤减轻。②D+MI/R组心肌细胞凋亡率为(9.7±0.98)%,明显低于MI/R组的(23.5±1.5)%(P<0.05),且部分逆转了缺血再灌注后心肌组织Caspase-9和Caspase-3的活性升高(P<0.05)。结论 HIF-1α稳定表达可抑制线粒体途径介导的心肌细胞凋亡,从而发挥对缺血再灌注损伤的心脏保护效应。
低氧诱导因子-1α;心肌;缺血再灌注损伤;细胞凋亡
缺血性心脏病是人类发病率和死亡率最高的心血管疾病[1]。随着溶栓、冠脉介入、冠脉搭桥术等治疗手段的及早应用,有效降低了缺血性心脏病的急性期死亡率,但因受累血管再通所致的心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MI/RI)依然是20%的患者发生心力衰竭的重要原因[2]。近年的研究发现,缺血预处理、缺血后处理等机械性调控措施均具有对心肌缺血再灌注损伤的保护作用,并且可能是通过上调低氧诱导因子-1α(hypoxia-inducible factor-1,HIF-1α) 而实现的[3]。HIF-1α是对氧敏感的转录因子,在缺氧状态下能够调控下游促红细胞生成素、血红素氧合酶-1、诱导型一氧化氮合酶等多种促细胞生存基因的转录激活,但在常氧环境中HIF-1α极易被脯氨酸羟化酶(prolyl hydroxylase,PHD)降解失活,使其效应难以发挥[4]。因此提示,通过稳定HIF-1α表达可能起到心肌保护效应,但目前尚无相关报道。由于细胞凋亡是心脏损伤后心肌细胞丢失的主要形式[5],因此本研究拟采用PHD抑制剂DMOG(dimethyloxallyl glycine)阻断HIF-1α降解,观察HIF-1α稳定表达对大鼠缺血再灌注心肌细胞凋亡是否有影响,并探讨其可能机制。
1 材料与方法
1.1 材料 实验动物与分组:SPF级健康雄性Wistar大鼠 40只(体重 280~300 g),由北京维通利华实验动物有限公司提供。大鼠随机分为4组(n=10):假手术组(Sham)、心肌缺血/再灌注组(MI/R)、HIF-1α 活化剂 DMOG+心肌缺血/再灌注组(D+MI/R)、HIF-1α 抑制剂 YC-1+心肌缺血/再灌注组(YC-1+MI/R)。Sham组心脏冠脉左前降支动脉只穿线不结扎;DMOG+MI/R组术前24 h腹腔注射 DMOG(40 mg/kg);YC-1+MI/R 组术前 30 min经股静脉注射HIF-1α抑制剂YC-1(2 mg/kg)。主要试剂:DMOG购自百灵威科技有限公司;YC-1购自Cayman公司;BCA蛋白定量分析试剂盒购自赛默飞科技有限公司;细胞裂解液、Evan′s blue、TTC均购自北京索来宝科技有限公司;Caspase-3,8,9底物Ac-DEVD-pNA购自碧云天生物技术研究所;细胞凋亡检测试剂盒购自博士德生物工程有限公司;β-actin一抗、辣根过氧化物酶标记羊抗小鼠、辣根过氧化物酶标记羊抗兔购自北京中杉金桥生物科技有限公司;HIF-1α一抗购自Cell Signaling Technology公司。
1.2 方法
1.2.1 动物模型建立 大鼠称重,腹腔注射10%水合氯醛麻醉并固定于手术台上,连接心电监测电极记录正常心电图,然后行颈部手术,做气管插管。在胸骨左侧3~4肋间开口钝性分离肋间肌肉,暴露心脏,用止血钳钳压塑料管结扎左冠状动脉,观察心电图改变,若ST段弓背抬高(≥0.15 mV),表明心肌缺血成功。45 min后松开止血钳恢复冠脉血流,心电图示ST段逐渐回落,表明再灌注成功。再灌注3 h后进行采血,随后立即处死动物,并收取标本。
1.2.2 Western blot 将适量大鼠左室前壁心肌组织剪碎,用细胞裂解液提取蛋白,采用BCA蛋白定量试剂盒测定各组蛋白浓度并统一至相同浓度。然后根据SDS-PAGE凝胶制备试剂盒说明书配制12%的分离胶,液封静置20 min后配制5%的浓缩胶,插入齿梳,静置20 min拔出齿梳后,每孔上样60μg,随后进行电泳,电泳条件为80 V。当溴酚蓝到达玻璃板底部时,制备凝胶“三明治”进行半干式转膜,转膜条件:15 V,18 min。室温封闭2 h后一抗孵育过夜,TBST洗膜3次,二抗孵育2 h,TBST洗膜3次。加入化学发光液进行成像,采用Bio-Rad Image Lab 5.2软件进行条带分析。
1.2.3 血清心肌酶活性检测 再灌注3 h后,经腹主动脉采血后,3000 r/min离心10 min,取上清,用全自动生化分析仪检测血清肌酸激酶同工酶(CKMB)和乳酸脱氢酶(LDH)的活性。
1.2.4 HE染色 摘取心脏,用PBS洗净心腔内残余染液,留取左心室用10%甲醛固定24 h,切片脱蜡水化;苏木素染色3 min,流水冲洗1 min;盐酸乙醇分化液(0.5%)分化2 s,流水冲洗10 min;伊红染色液染色5 min,流水冲洗30 s;进入不同浓度乙醇中脱水,分别为80%乙醇和95%乙醇各30 s,100%乙醇1 min;二甲苯Ⅰ、二甲苯Ⅱ各10 min至透明;待标本晾干后加中性树脂及盖玻片,封固。显微镜下观察图像拍片,采用BI-2000图像分析系统对图像进行分析。
1.2.5 Evens blue/TTC染色 术后结扎左冠状动脉,经腹主动脉注入2 ml 0.2%Evan′s blue,待大鼠全身蓝染后摘取心脏,用PBS洗净心腔内残余染液,留取左心室,-80℃冰冻1 h后,将左心室沿垂直于心脏纵轴方向切成6片,平均厚约2 mm。用1%TTC溶液37℃避光孵育30 min,10%甲醛溶液固定1 h,自然光下拍照。计算心肌梗死面积百分比。
1.2.6 心肌组织Caspase-3、8、9活性检测 取适量左室前壁心肌组织剪碎匀浆,提取蛋白并按BCA法测定浓度,用酶标仪检测λ=405 nm处的吸光度。
1.2.7 TUNEL染色 严格按照试剂盒提供步骤操作。具体步骤为:①二甲苯脱蜡水化,PBS冲洗2 min×3次。②室温下用蛋白酶 K消化15 min,PBS冲洗2 min×3次。③配制标记液,每片加20 μl tunel反应液,放于湿盒37℃,孵育2 h。PBS冲洗2 min×3次。④每片加50 μl封闭液,室温孵育30 min,PBS冲洗2 min×3次。⑤每片加50 μl生物素化抗地高辛抗体(1∶100稀释),放于湿盒 37℃,孵育30 min。PBS冲洗2 min×3次。⑥每片加50 μl SABC稀释液(1∶100稀释)37℃孵育 30 min。TBS洗 5 min×4次。⑦滴加DAB混合液,显色10 min。用去离子水洗净显色液。⑧用封片剂封片,置于显微镜下观察。
1.3 统计学方法 采用SPSS 17.0软件进行分析。本研究数据均用±s表示,分类变量用%表示,符合正态分布的计量资料两组间比较采用成组t检验,不符合正态分布的计量资料采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 Western blot检测大鼠心肌组织HIF-1α的蛋白表达结果 Sham组、MI/R组及YC-1+MI/R组的HIF-1α蛋白表达量均为较低水平,且各组之间无明显差异(P>0.05),而 D+MI/R 组的 HIF-1α表达量明显高于MI/R组(P<0.01)。见图1。
2.2 心肌酶CK-MB、LDH活性测定结果 血清CK-MB活性 MI/R 组(1.28±0.02)和 YC-1+MI/R组(1.41±0.01) 均高于 Sham 组(0.77±0.08)(P<0.05);D+MI/R组显著低于MI/R 组(0.66±0.05比1.28±0.02,P<0.05)。LDH 的检测结果呈现出与CK-MB一致的变化趋势。见图2。
2.3 心肌组织HE染色结果 Sham组心肌细胞形态完整,心肌组织结构正常,纤维束状整齐排列,着色均一;MI/R组心肌细胞有大片坏死,心肌组织结构破坏,肌纤维排列紊乱;D+MI/R组心肌细胞仅有少量坏死,心肌组织结构较完整,排列相对整齐;YC-1+MI/R组心肌细胞明显坏死,溶解成片,界限不清,难以分辨,心肌组织排列紊乱,大部分纤维束断裂。见图3。
2.4 心肌梗死面积检测结果 与Sham组[(1.0±1.0)%]相比,MI/R 组[(48.0±1.0)%]和 YC-1+MI/R组[(62.0±2.0)%]的心梗面积明显增加(P<0.01);而D+MI/R 组[(29.0±3.0)%]则较 MI/R 组[(48.0±1.0)%]心梗面积减小 19%(P<0.05),见图 4。
2.5 心肌细胞的凋亡率比较 MI/R组[(23.56±1.50)%]和 YC-1+MI/R 组[(35.10±0.83)%]的心肌细胞凋亡率均明显高于Sham组[(3.2±0.7)%](P<0.01);而 D+MI/R 组[(9.70±0.98)%]与 MI/R组相比,心肌细胞凋亡率明显降低(P<0.05)。见图5。
2.6 Caspase-3、9和 caspase-8活性比较 MI/R组的Caspase-3和Caspase-9活性均显著高于Sham 组(P<0.01);D+MI/R 组 Caspase-3和 Caspase-9的活性明显降低(P<0.05),但Caspase-8的活性则无显著改变。见图6。
3 讨论
有效减少心肌细胞死亡是心脏保护领域的关注焦点。本实验基于建立大鼠心肌缺血再灌注模型上的研究结果发现,与MI/R组相比,使用PHD抑制剂DMOG稳定HIF-1α表达后,心肌梗死面积缩小、CK-MB和LDH活性降低,心肌组织的病理损伤减轻,心肌细胞凋亡率减小,且caspase-3与caspase-9的活性均明显降低。以上结果说明HIF-1α具有减轻缺血再灌注损伤的心肌保护效应,其作用机制与抑制线粒体途径介导的心肌细胞凋亡有关。
HIF-1α是一种对氧极为敏感的转录因子,在常氧环境中被PHD羟化后降解失活,而在缺氧状态下可与HIF-1β结合形成异二聚体,进而转位入核,调控下游200多种基因的转录激活,使缺血的组织器官迅速适应缺氧的环境[4]。本课题组的前期研究发现,缺血后处理的心脏保护作用与HIF-1α的表达上调有关[6]。因此我们利用PHD抑制剂DMOG以阻断HIF-1α的羟化降解,结果发现DMOG组的HIF-1α蛋白表达量约为MI/R组的3倍,说明DMOG可达到稳定HIF-1α蛋白表达的目的。
细胞凋亡为缺血再灌注初期心肌细胞的主要死亡形式[7]。有研究报道,家兔心肌给予单纯缺血处理4.5 h仍未有细胞凋亡的发生,只有在再灌注后才出现心肌细胞凋亡,且大量的凋亡细胞分布于梗死边缘区,因此对该区域凋亡细胞的拯救对于缺血再灌注损伤的保护至关重要[8]。本研究发现,HIF-1α稳定表达后细胞凋亡指数明显降低,表现出了对梗死边缘区细胞的积极挽救。
目前认为,细胞凋亡通路主要有三种:内源性线粒体途径、外源性死亡受体途径及内质网途径,三者都可通过Caspase的顺次激活而实现凋亡。以上三条凋亡途径的执行者分别为Caspase-8、Caspase-9和Caspase-12,而Caspase-3为最终的凋亡执行分子[9]。因此本研究对缺血再灌注心肌组织的Caspase-3、8、9的活性分别进行了检测,发现与MI/R组相比,稳定HIF-1α表达后可明显降低Caspase-3与Caspase-9的活性,而Caspase-8的活性未受影响,提示HIF-1α是通过抑制线粒体途径介导的细胞凋亡而发挥对缺血再灌注心肌的保护作用。鉴于线粒体为细胞的能量中心,HIF-1α的心肌保护作用是否与影响线粒体的结构与功能相关,尚需进一步设计实验给予探讨。
综上所述,本研究采用DMOG预处理以达到稳定HIF-1α蛋白表达,结果发现HIF-1α可通过抑制线粒体途径介导的细胞凋亡而发挥对缺血再灌注心肌的保护作用,这一结果可能对临床缺血性心脏病防治新靶标的研发提供一定的实验依据。
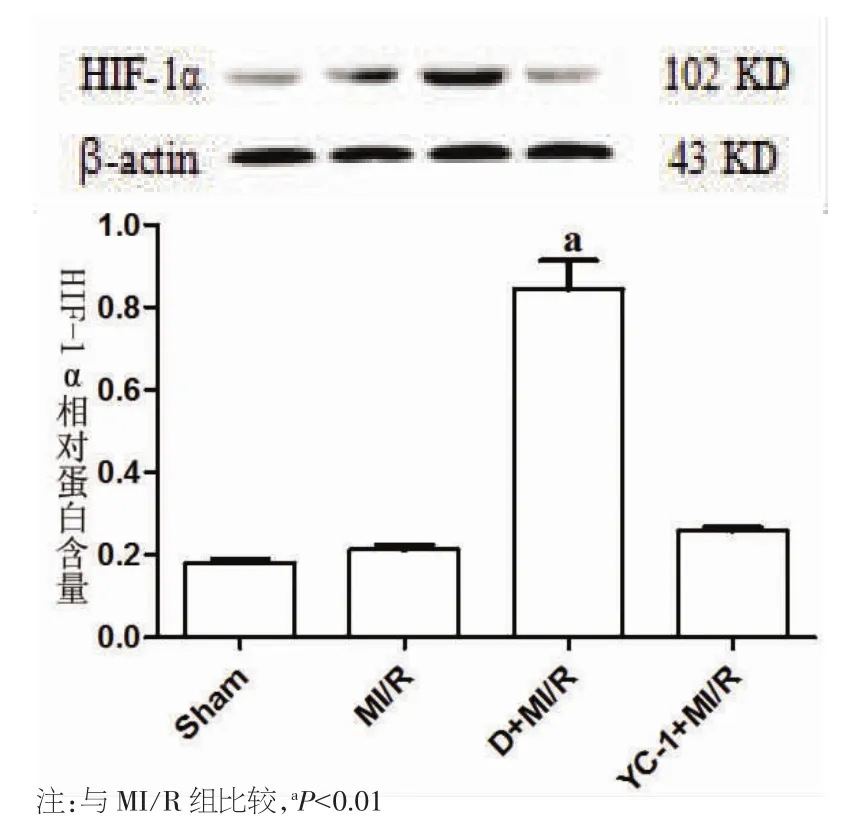
图1 Western blot检测大鼠心肌组织HIF-1α的蛋白表达
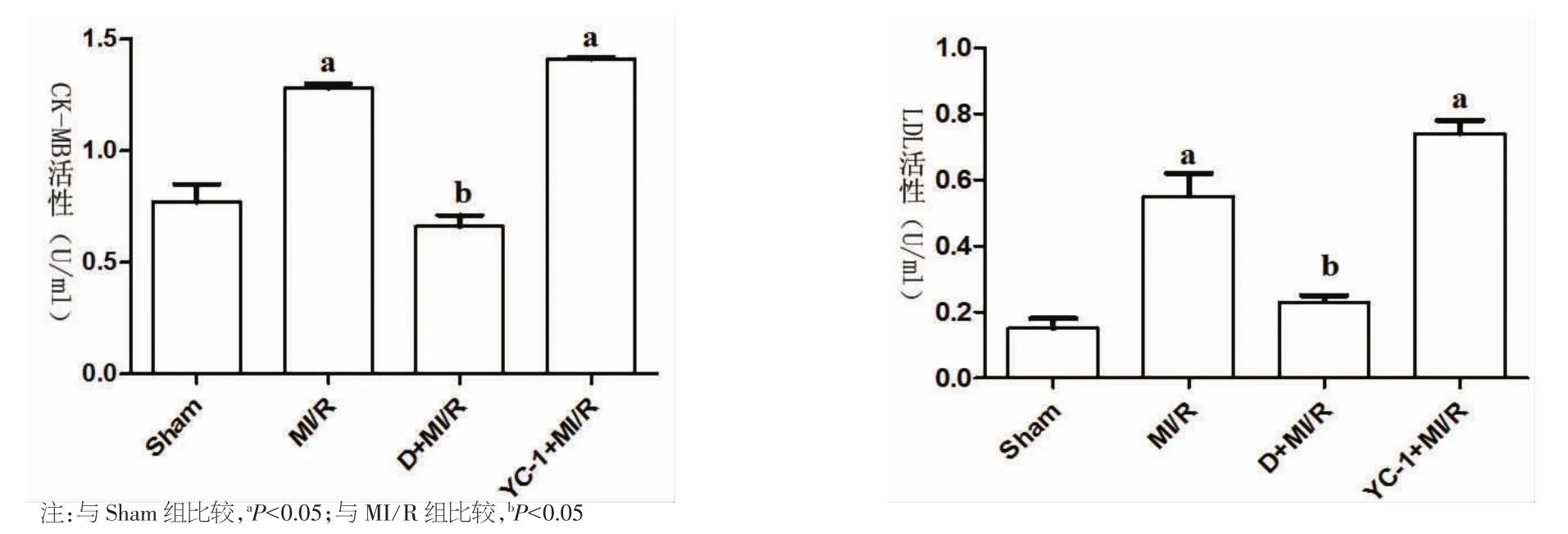
图2 心肌酶CK-MB、LDH活性测定结果
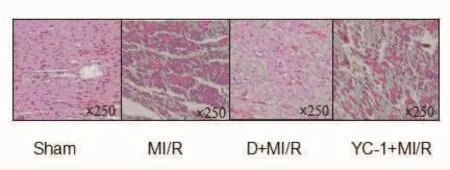
图3 心肌组织HE染色结果
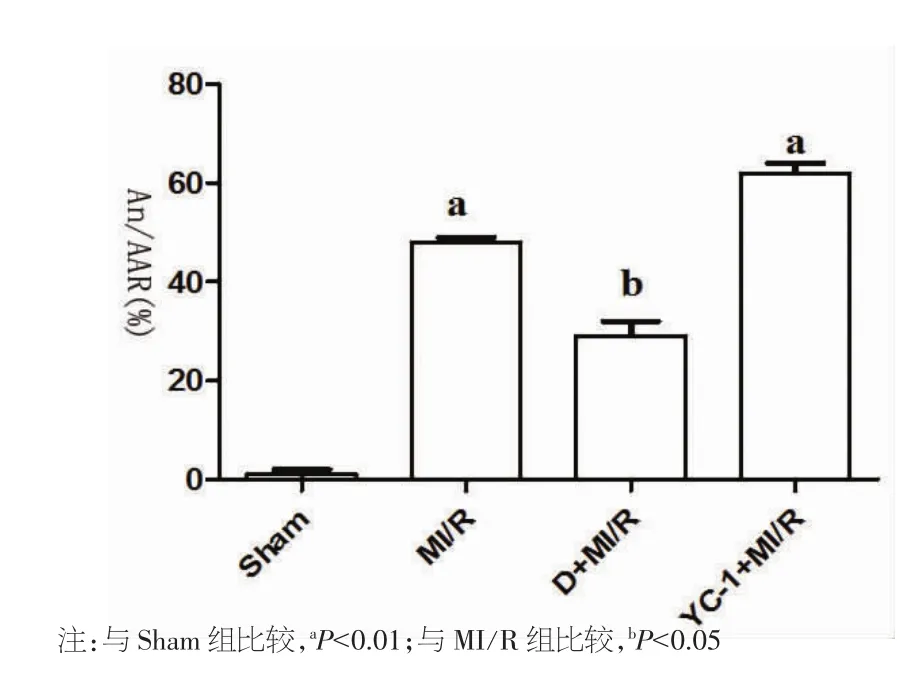
图4 心肌梗死面积检测
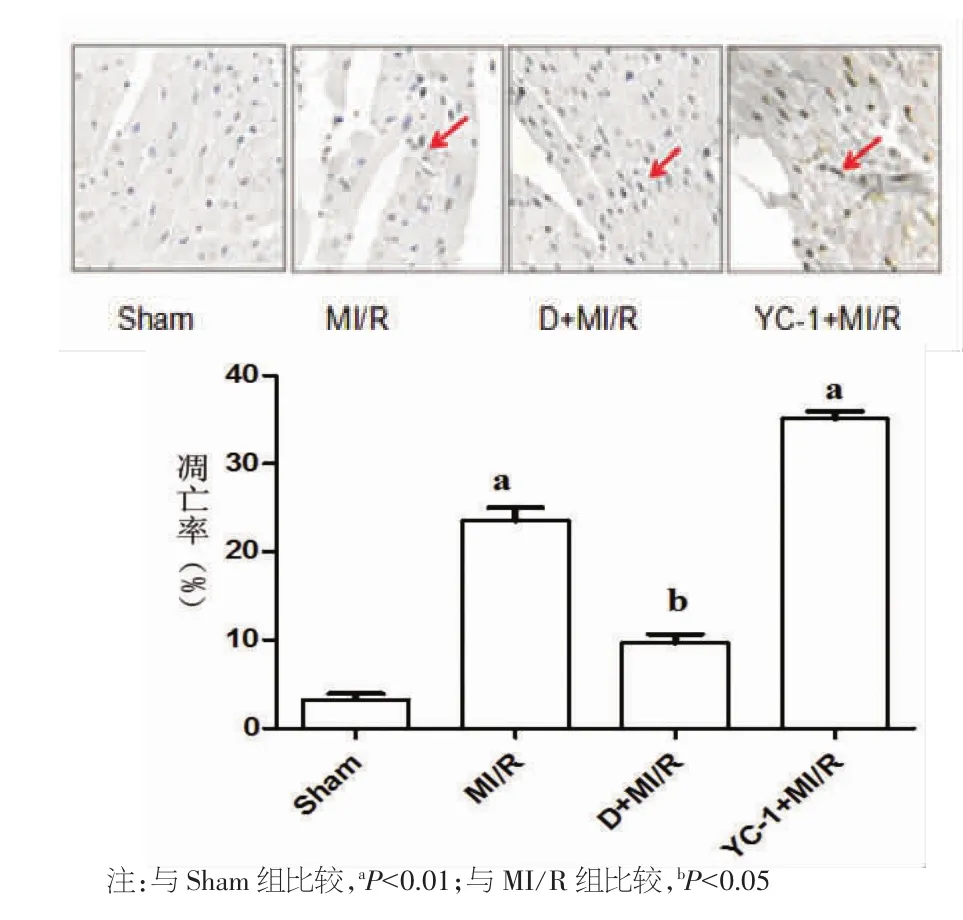
图5 心肌细胞的凋亡率
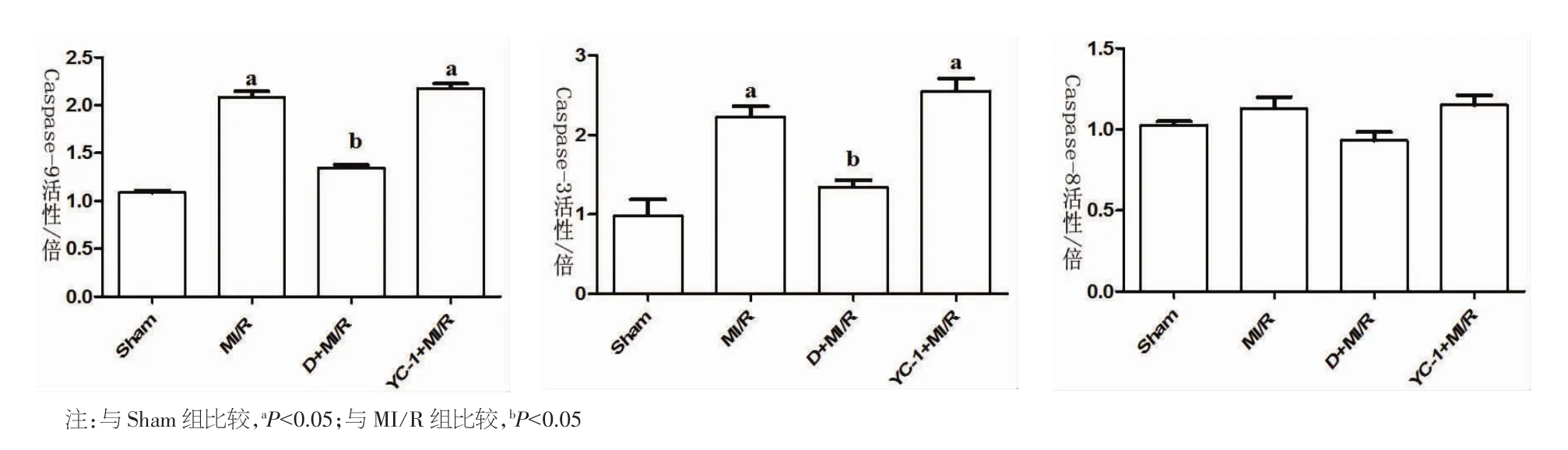
图6 心肌组织Caspase-3,8,9活性检测
[1]Zhang XY,Shu L,Si CJ,et al.Dietary patterns,alcohol consumption and risk of coronary heart disease in adults:a metaanalysis.Nutrients,2015,7:6582-6605.
[2]Go AS,Mozaffarian D,Roger VL,et al.Heart disease and stroke statistics-2013 update a report from the american heart association.Circulation,2013,127:e6-e245.
[3]Eckle T,Kohler D,Lehmann R,et al.Hypoxia-inducible factor-1 is central to cardioprotection:a new paradigm for ischemic preconditioning.Circulation,2008,118:166-175.
[4]Ong SG,Hausenloy DJ.Hypoxia-inducible factor as a therapeutic target for cardioprotection.Pharmacology& therapeutics,2012,136:69-81.
[5]Heusch G.Molecular basis of cardioprotection:signal transduction in ischemic pre-,post-,and remote conditioning.Circulation Res,2015,116:674-699.
[6]Zhao HX,Wang YH,Wu Y,et al.Hyperlipidemia does not prevent the cardioprotection by postconditioning against myocardial ischemia/reperfusion injury and the involvement of hypoxia inducible factor-1α upregulation.Acta Biochim BiophysSin(Shanghai),2009,41:745-753.
[7]张苗苗,于海奕.心肌缺血后适应的保护作用及机制研究进展.中国心血管病研究,2012,10:704-707.
[8]Gottlieb RA,Burleson KO,Kloner RA,et al.Reperfusion injury induces apoptosisin rabbitcardiomyocytes.JClin Invest,1994,94:1621-1628.
[9]张燕,薛晓维,赵晓琴,等.高糖高脂对培养成年大鼠心肌细胞损伤观察及机制初探.中国心血管病研究,2011,9:56-59.
Anti-apoptotic effect of HIF-1α stable expression on myocardial ischemia-reperfusion in rats
LIU Yan,LI Ling-ping,ZHANG Hong-xia,et al.Department of Physiology,School of Basic Medical Sciences,Shanxi Medical University,Taiyuan 030001,China
HE Zhong-mei,E-mail:hezmei@126.com
Objective To investigate the effect of HIF-1α stable expression on myocardial apoptosis in ischemia-reperfusion rats.Methods The rat model of MI/R injury was induced by 45 min of transient vessel occlusion followed by 3 h of reperfusion.Rats were randomised into four equal groups:pseudo surgery group(Sham group),myocardial ischemia/reperfusion group (MI/R group), HIF-1α activator DMOG+myocardial ischemia/reperfusion group(D+MI/R group)and HIF-1α inhibitor YC-1+myocardial ischemia/reperfusion group(YC-1+MI/R group),at the end of the experiment,blood samples were taken for the measurement of serum levels of CK-MB and LDH by fully automatic biochemical analyser,the protein levels of HIF-1α were detected via Western blot analyses,myocardial ischemia and infarct sizes were evaluated using Evans blue/TTC staining, myocardial apoptosis were analyzed by TUNEL staining and the activities of Caspase-3,8,9.Results ⑴Compared with the MI/R group,the protein levels of HIF-1α were increased almost 4.6 folds in the D+MI/R group,while CK-MB and LDH levels in the serum were decreased(P<0.05),the infarct size was reduced(P<0.05)and histological injury was significantly decreased.⑵Compared with the MI/R group(23.5±1.5)%,the rate of the myocardial apoptosis was significantly decreased in the D+MI/R group[(9.7±0.98)%,P<0.05)],with partially counteracted the increase of Caspase-9 and Caspase-3 activities(P<0.05).Conclusion The stable expression of HIF-1α have an anti-apoptotic effect on myocardial ischemia-reperfusion injury,which mediated by mitochondria pathway.
HIF-1α;Myocardium;Ischemia-reperfusion injury;Apoptosis
山西省自然科学基金(项目编号:2012011040-7);医学电生理四川省重点实验室开放基金(项目编号:2011-2);山西医科大学博士启动基金(项目编号:03201106)
作者单位:030001 山西省太原市,山西医科大学基础医学院生理学系,细胞生理学山西省重点实验室
贺忠梅,E-mail:hezmei@126.com
10.3969/j.issn.1672-5301.2016.03.024
Q95-33;R542
A
1672-5301(2016)03-0277-04
2015-12-07)
