丁香有效部位清除超氧阴离子及对LDL糖基化抑制作用
2016-09-10杜余辉蔡志鹏江慎华杨琼玉张良慧马海乐曲文娟张爱琳
杜余辉,蔡志鹏,江慎华,2,3,*,杨琼玉,万 严,张良慧,马海乐,2,曲文娟,2,张爱琳,3
(1.九江学院药学与生命科学学院,江西九江 332000;2.江苏大学食品与生物工程学院,江苏省农产品物理加工重点实验室,江苏镇江 212013;3.天津农学院食品科学与生物工程学院,天津 300384)
丁香有效部位清除超氧阴离子及对LDL糖基化抑制作用
杜余辉1,蔡志鹏1,江慎华1,2,3,*,杨琼玉1,万严1,张良慧1,马海乐1,2,曲文娟1,2,张爱琳1,3
(1.九江学院药学与生命科学学院,江西九江 332000;2.江苏大学食品与生物工程学院,江苏省农产品物理加工重点实验室,江苏镇江 212013;3.天津农学院食品科学与生物工程学院,天津 300384)
为研究丁香对低密度脂蛋白(LDL)的抑制效果,本文通过生物活性追踪法得到丁香有效部位(乙酸乙酯相),并采用分光光度法和荧光分析法对丁香有效部位清除超氧阴离子自由基(SAR)及LDL糖基化终产物(AGEs)和戊糖素的抑制效果进行了研究。结果表明,浓度为50 μg/mL和100 μg/mL的乙酸乙酯相对SAR清除率最高,分别达46.112%±0.820%和69.168%±2.637%,显著高于阳性对照(p<0.05),为有效部位。丁香有效部位(500 μg/mL)对AGEs及戊糖素抑制率可达88.328%±0.037%、84.365%±0.302%,显著高于阳性对照氨基胍(AG)(p<0.01)。本文表明丁香对SAR及LDL糖基化终产物AGEs和戊糖素具有较好的抑制效果,可为后续功能食品研发提供参考。
丁香,超氧阴离子,低密度脂蛋白,糖基化,糖基化终产物
超氧阴离子自由基(Superoxide anion radical,SAR)是一种活性氧,可参与血管功能紊乱的信号传递[1-2],含量过高会导致低密度脂蛋白(Low density lipoprotein,LDL)诱导内皮细胞功能紊乱[3]及晚期糖基化终产物(advanced glycosylation end products,AGEs)形成[4]。戊糖素是已证明的一种特定AGEs荧光产物[5]。体内血糖过高易诱发、促进LDL糖基化修饰,并导致过多SAR及其他活性氧产生[6-7]。植物提取物抑制糖基化修饰活性与其自由基清除及抗氧化性能显著相关[8]。
LDL是人体血液中运载胆固醇及其酯类的主要转运体,其糖基化修饰后会产生和累积AGEs,从而导致糖尿病并发症、细胞和组织损伤[8-9]。因此,研究AGEs抑制剂有望降低因其诱导产生糖尿病并发症的风险。与人工合成抑制剂相比,很多天然产物对蛋白质糖基化修饰的抑制作用更安全、有效[8,10-11]。
丁香,为桃金娘科植物丁香(EugeniacaryophyllaThunb.)的干燥花蕾,又称公丁香,被国家列入第一批既是食品又是药品的名单[12],属于国家公布的药食两用植物[13],具有抑制LDL氧化修饰[12]、抗炎、抗应激、抗菌、抗真菌、抗氧化等众多功能活性[13]。实验室前期研究表明,丁香在国家公布的87种药食两用材料中多酚含量最高、具有最强的抗氧化活性[14-15],其抗氧化功能的主要物质基础是黄酮和多酚类化合物[16-17]。
国内外研究结果表明,很多药用植物的抗糖基化性能对治疗糖尿病及其相关并发症有一定优势[10,18]。有学者发现,丁香可抑制高密度脂蛋白所含apoA-I[19]及牛血清白蛋白(Bovine serum albumin,BSA)[9]糖基化修饰。而本实验室在前期工作基础中发现,乙酸乙酯部位是丁香抗氧化、抑制LDL氧化修饰的有效部位[17,20]。尽管丁香具有很强的抗氧化作用[13,17,20],但是,丁香有效部位对SAR的清除能力及LDL糖基化修饰过程中AGEs产生的抑制效果尚不明确。因此,本文在实验室前期工作基础上,对丁香有效部位清除SAR及其对LDL糖基化终产物(AGEs)产生的抑制效果展开研究,以期为后续研发丁香缓解糖尿病并发症相关功能食品提供参考。
1 材料与方法
1.1材料与仪器
丁香(批号:1409006,生产日期:2014年9月30号),购自江西黄庆仁栈华氏大药房(江西樟树天齐堂中药饮片有限公司分装),产地广西。买回后立即粉碎干燥、过40目筛后置冰箱中备用。LDL从健康人血浆中分离得到。肝素钠(185 U/mg),购自上海阿拉丁生化科技股份有限公司;氨基胍盐酸盐和叠氮化钠,购自成都格雷西亚化学技术有限公司,其余化学试剂均为国产分析纯或优级纯。
DFY-C高速粉碎机温岭林大机械公司;DL-5C离心机上海安亭科学仪器厂;UNIC-7200可见分光光度计尤尼柯(上海)公司;SHA-B恒温振荡器常州国华电器有限公司;FD-1A-50冷冻干燥机北京博医康实验仪器有限公司;RE-52型旋转蒸发仪上海亚荣生化仪器厂;PB-10 pH计Sartorius仪器设备有限公司;CT15RT型高速冷冻离心机上海天美生化仪器设备工程有限公司;LS-55荧光/磷光/发光分光光度计美国Perkin Elmer公司。
1.2实验方法
1.2.1丁香有效部位对SAR清除能力
1.2.1.1丁香不同极性部位及有效部位制备参考文献[20-21]等方法,稍作修改,具体步骤如下。
称取200.00 g丁香原料粉末,采用料液比1∶10(g/mL)、温度60 ℃、水浴振荡提取2次,提取液合并、浓缩。取1/10体积溶液浓缩、冻干后获得丁香粗提物。剩余部分加入适量蒸馏水,超声辅助溶解至悬浊液后,分别采用极性逐渐增大的有机溶剂石油醚、乙酸乙酯和正丁醇依次萃取,最后剩下水相,各萃取液真空浓缩、冷冻干燥后得到丁香粗提物、石油醚相、乙酸乙酯相、正丁醇相和水相干粉,放置干燥箱备用,处理流程如图1所示。各样品均采用甲醇溶解至合适浓度待用。

图1 生物活性追踪法制备丁香有效部位Fig.1 The preparation of clove effective fraction based on bio-assay guided
1.2.1.2丁香不同极性部位对SAR自由基清除率测定采用文献[17,22-23]等方法。
取2.7 mL 14.5 mmol/L蛋氨酸,依次加入0.1 mL 3.0 mmol/L乙二胺四乙酸(Ethylene Diamine Tetraacetic Acid,EDTA),0.1 mL 1.89 mmol/L氯化硝基四氮唑蓝(Nitro Blue Tetrazolium Chloride,NBT),1.0 mL不同浓度(50,100 μg/mL)样液,0.1 mL 39 μmol/L核黄素,振荡混合均匀。2个20 W荧光灯均匀一致地照射20 min,于波长560 nm处测定吸光度。吸光度越小,清除能力越强。以甲醇代替样品作空白对照,计算SAR清除率。其中蛋氨酸、EDTA、NBT、核黄素全部由0.05 mol/L磷酸盐缓冲液(pH7.8)配制。SAR清除率计算公式为:
清除率(%)=(1-(A空白-A背景)/(A样品-A背景))×100
式中:A空白-波长560 nm处空白样品的吸光度;A样品-波长560 nm处样品的吸光度;A背景-波长560 nm处甲醇(背景)不光照的吸光度。
1.2.2LDL制备
1.2.2.1试剂准备沉淀剂A液:0.064 mol/L柠檬酸三钠溶液(肝素钠浓度为50000 U/L),用5 mol/L盐酸溶液,调节pH至5.04;沉淀剂B液:0.064 mol/L柠檬酸三钠溶液,用5 mol/L盐酸溶液,调节pH至5.11;磷酸缓冲高盐溶液(phosphate buffer saline,PBS)溶液:160 g/L NaCl,8.1 mmol/L Na2HPO4·12H2O,1.5 mmol/L KH2PO4,2.7 mmol/L KCl,pH7.4。
1.2.2.2从血浆中沉淀获得LDL参考文献[24-26]等方法制备,稍加改进,具体操作如下。
血浆和沉淀剂A液准确按1∶10体积比充分混匀(取新鲜人血浆300 mL和沉淀剂A液3000 mL充分混匀),磁力搅拌30 s混匀,37 ℃温育静置15 min;4 ℃ 3000 r/min离心10 min后有淡黄色沉淀析出,去上清。汇集每次离心后的沉淀并加入1500 mL沉淀剂B液混匀,洗涤沉淀,4 ℃ 3000 r/min离心10 min,去上清,获得LDL沉淀。在LDL沉淀中加入100 mL PBS溶液(pH7.4,含160 g/L NaCl,8.1 mmol/L Na2HPO4·12H2O,1.5 mmol/L KH2PO4,2.7 mmol/L KCl),37 ℃温育15 min,使LDL沉淀完全溶解后置于再生纤维素透析袋内,用PBS 4 ℃透析24 h(每4小时换一次透析液),即得LDL溶液。以BSA为标准品,采用Lowry’s法测定蛋白浓度,使用PBS溶液稀释获得实验所需浓度,剩余部分4 ℃避光保存。
1.2.3丁香有效部位抑制LDL糖基化修饰作用
1.2.3.1LDL糖基化孵育方法采用Suantawee等[9]方法孵育LDL,稍作修改。
0.9 mL LDL溶液(1 mg/mL)+800 mmol/L葡萄糖+29 mL 0.01 mol/L PBS溶液(pH7.4,包含0.02%叠氮化钠,1 mmol/L EDTA)+0.1 mL各浓度样液(0、0.05、0.1 mg/mL),于37 ℃避光孵育4周后进行荧光测定。孵育体系总体积为30 mL,以上所有浓度均为终浓度。丁香有效部位干粉用甲醇溶解,阳性对照AG[27]用蒸馏水溶解。空白对照分别使用等体积的甲醇和蒸馏水代替丁香和AG溶液进行相同操作。
1.2.3.2荧光波长扫描过程中激发和发射波长的确定参考文献[28]的方法,用LS-55荧光/磷光/发光分光光度计作AGEs激发和发射波长扫描,确定AGEs的激发波长和发射波长(如图2)。首先,固定激发波长370 nm,同时设定发射波长扫描范围300~500 nm后作发射波长扫描并确定最佳吸收峰值[28];然后以其最佳吸收峰值为发射波长固定值,同时设定激发波长范围300~400 nm后扫描激发波长确定其最佳吸收峰;最后确定激发和发射波长340 nm/410 nm测定荧光。
1.2.3.3自然(未修饰)LDL和糖基化修饰LDL荧光波长扫描根据1.2.3.2的结果,固定激发波长340 nm,同时设定发射波长范围300~500 nm后扫描发射波长[28]。
1.2.3.4总AGEs荧光强度及丁香有效部位对其清除率的测定根据1.2.3.2的结果设定激发波长340 nm和发射波长410 nm测定AGEs的荧光强度。对糖基化终末端产物(AGEs)产生的抑制率测定用以下公式计算:
抑制率(%)=(1-F样品/F空白)×100
其中:F空白表示不含样液的荧光强度;F样品表示含各浓度样液的荧光强度。
1.2.3.5特定荧光产物-戊糖素荧光强度及丁香有效部位对其清除率的测定戊糖素是一种氨基酸加合物,也是LDL糖基化终产物(AGEs)主要的荧光产物,由赖氨酸、精氨酸和糖类化合物反应产生,在激发波长335 nm和发射波长385 nm有最大荧光吸收[29-30]。对戊糖素抑制率测定可用以下公式计算:
抑制率(%)=(1-F样品/F空白)×100
其中:F空白表示不含样液的荧光强度;F样品表示含各浓度样液的荧光强度。
2 结果与分析
2.1丁香不同极性部位对SAR清除能力的测定
根据生物追踪方法[17,20],称取200 g丁香原料采用图1所示流程制备获得丁香不同极性部位,浓缩、冻干成干粉后分别得到粗提物6.2851 g、乙酸乙酯相13.5663 g、正丁醇相5.9182 g、水相7.5379 g。
通过光照核黄素使其还原产生SAR,然后还原NBT生成在波长560 nm有最大吸收的蓝色甲臜。样品在波长560 nm处吸光度越小,SAR清除能力越强[17,23]。丁香不同极性部位(50 μg/mL、100 μg/mL)对SAR清除率的测定结果如图1所示。
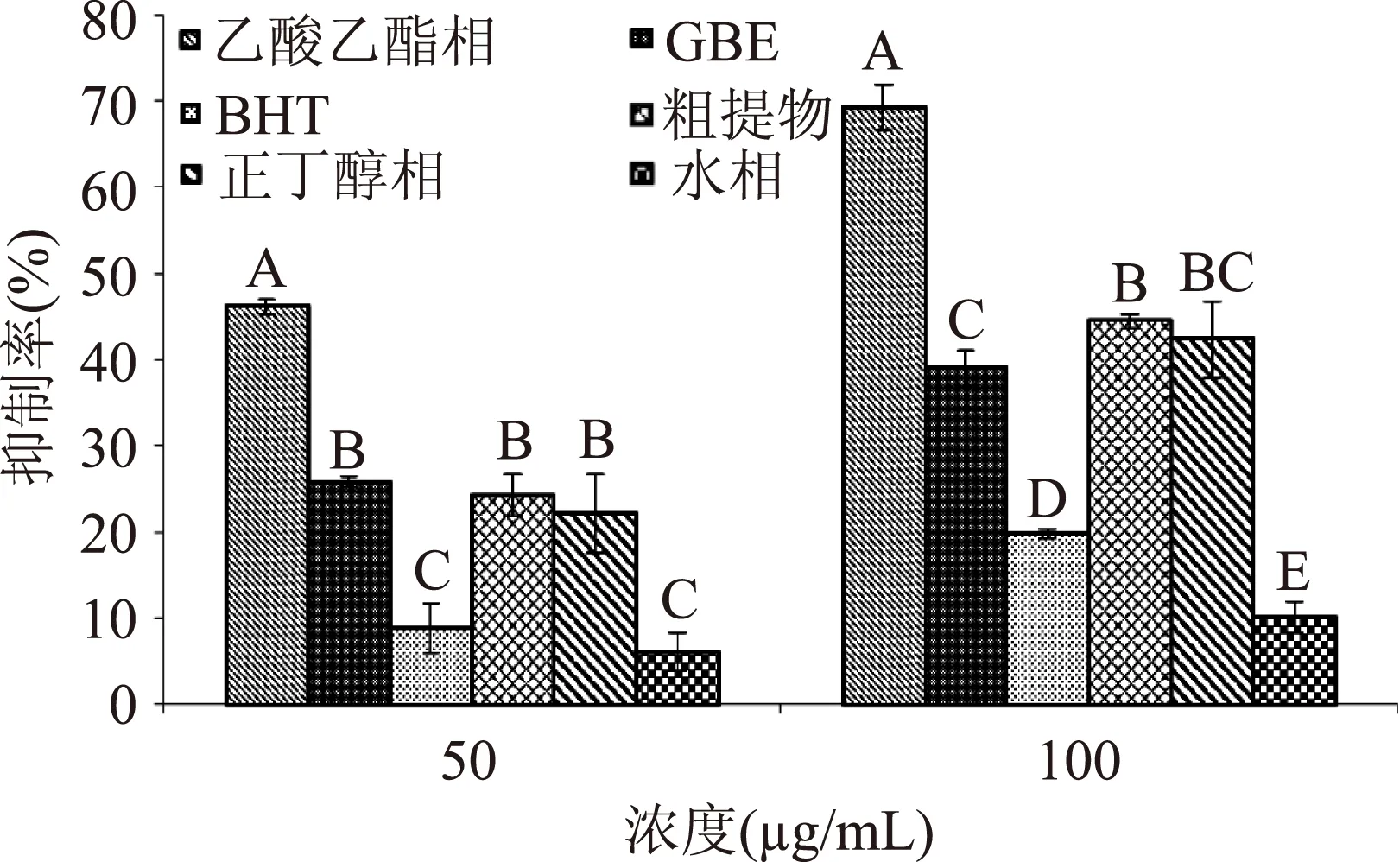
图1 丁香不同极性部位SAR清除率Fig.1 The superoxide anions scavenging activity of different fractions from clove注:不同字母表示差异显著(p<0.05).
图1表明,丁香不同极性部位对SAR均有一定的清除能力。包括两个阳性对照(BHT和GBE)在内,乙酸乙酯相清除率能力最强。当浓度为50 μg/mL和100 μg/mL时,其清除率分别达46.112%±0.820%和69.168%±2.637%,显著高于阳性对照GBE(25.828%±0.620%、39.013%±2.131%)和BHT(8.857%±2.878%、19.777%±0.507%)(p<0.05)。
国内外研究结果表明,体内高血糖环境可产生SAR、过氧化氢、羟基自由基等活性氧可导致氧化应激发生[6],过多的SAR产生会促使AGEs累积[6-7]。植物提取物富含多酚和黄酮类化合物,这些成分可通过其清除自由基及抗氧化作用抑制糖基化过程AGEs的产生[8]。上述测定结果发现丁香有效部位具有很强的SAR清除能力。基于SAR清除能力与AGEs产生的抑制作用显著相关[8],因此,本实验在此基础上进一步对丁香有效部位抑制AGEs产生效果进行了相关测定。
2.2丁香有效部位对LDL糖基化终产物AGEs产生的抑制作用
上述分析表明,高血糖环境累积的AGEs易导致很多并发症的产生[9]。本文对丁香有效部位抑制AGEs及戊糖素产生效果进行了测定,结果如图4~图7所示。
2.2.1LDL糖基化终产物(AGEs)荧光扫描LDL糖基化修饰会导致LDL结构、功能的改变及AGEs积累[30]。AGEs含有多种荧光产物,在一定激发和发射波长中有特定最佳吸收峰[31],使用荧光光度计可确定AGEs激发波长、发射波长及荧光强度。LDL糖基化前后荧光扫描及对比结果如图2、图3所示。
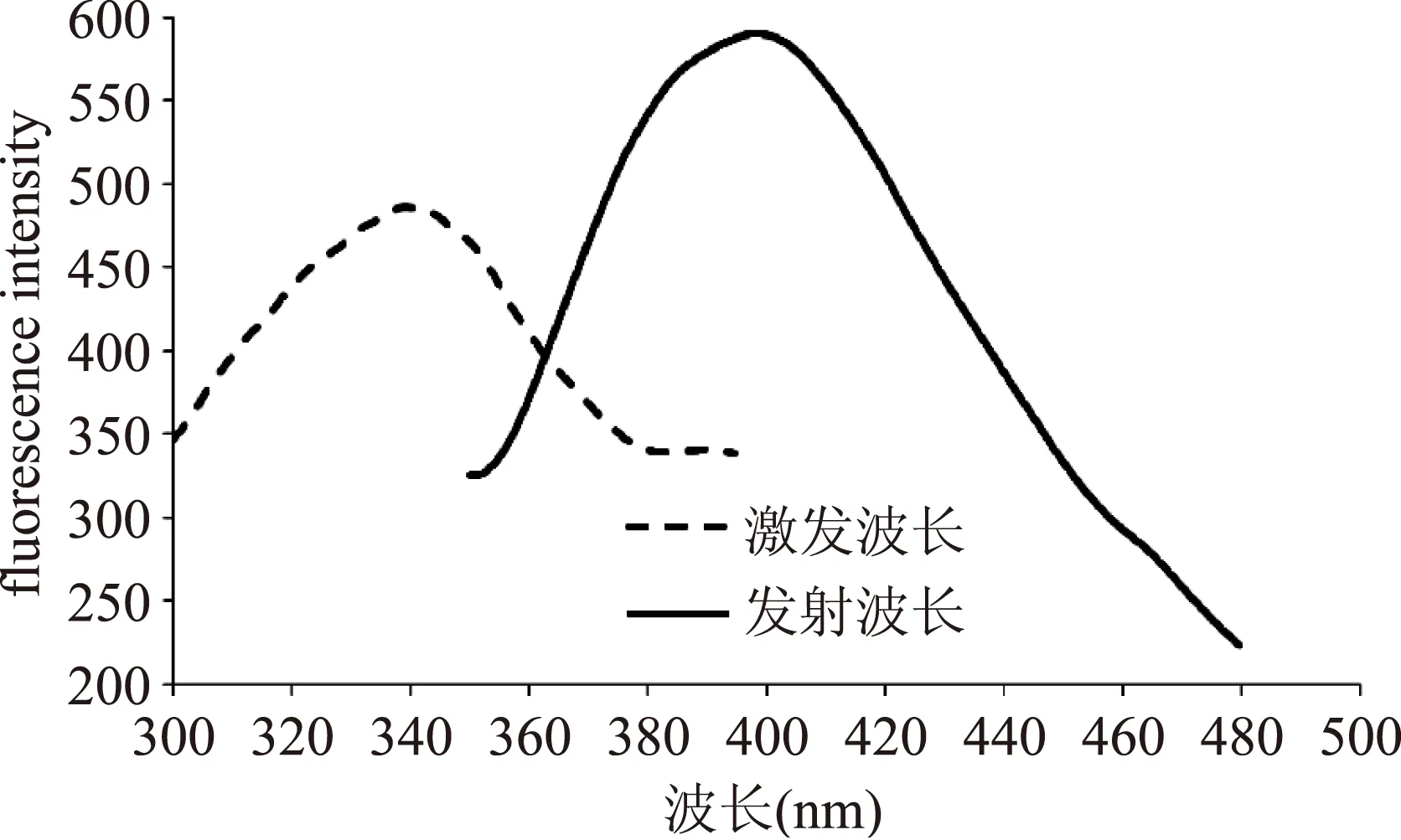
图2 LDL糖基化孵育后AGEs激发和发射波长扫描结果Fig.2 The prescan spectrum of excitation/emission wavelengths for samples of AGEs after glycosylation
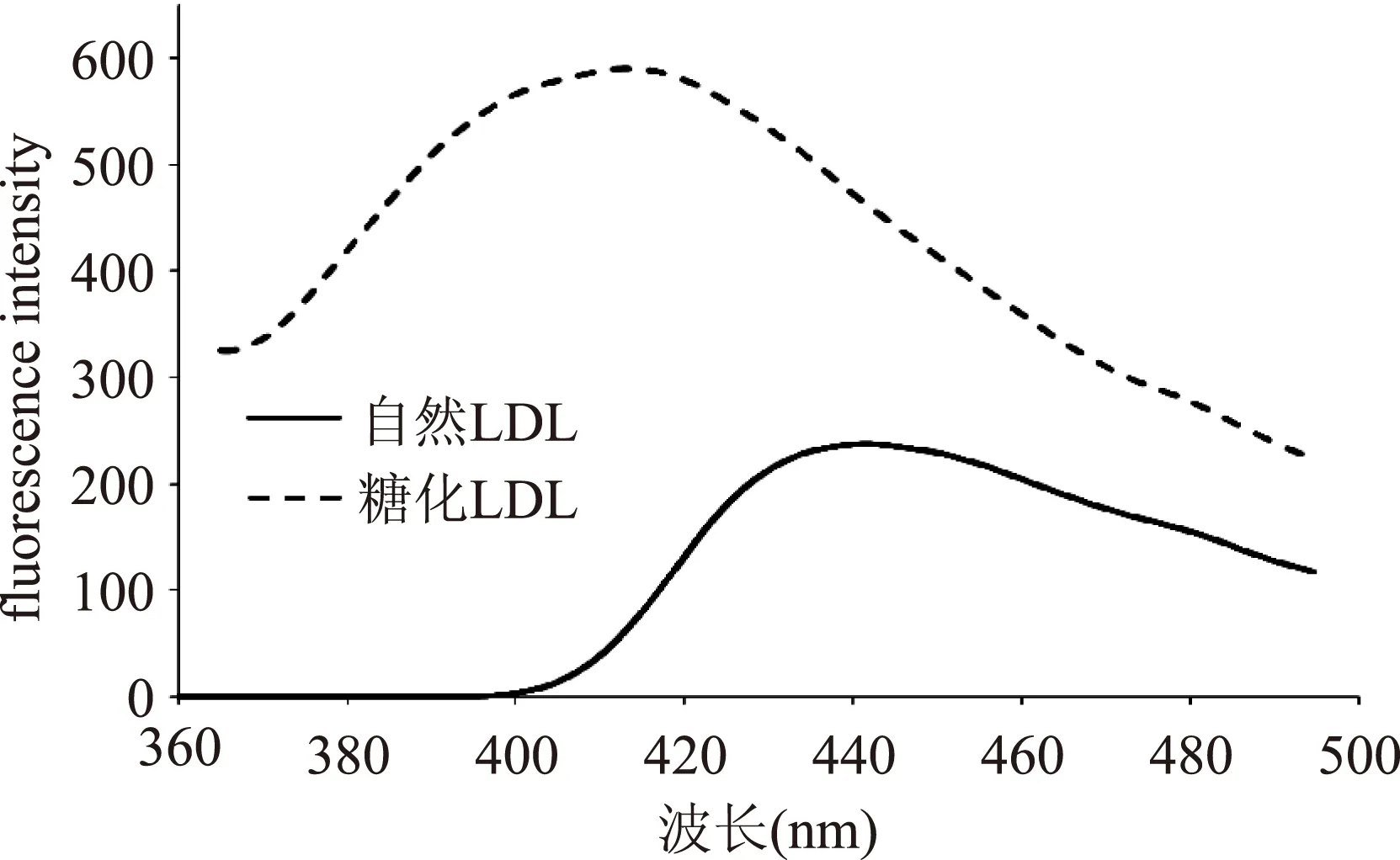
图3 LDL糖基化孵育前、后发射波长扫描结果Fig.3 The spectrum of emission wavelengths for samples of nature or glycosylated LDL
由图2可知,AGEs在激发波长和发射波长分别为340 nm/410 nm时有最佳吸收峰,Sattarahmady等[28]的研究也显示类似结果。有学者报道,LDL在Ex360/Em430处有特定的荧光吸收[32]。从图3可以看出,本实验采用肝素钠沉淀法获得的自然LDL荧光最大吸收(360 nm/430 nm)与前人报道[32]相似。LDL糖基化修饰后其最佳吸收峰发生变化,表明糖化LDL与自然LDL的结构发生改变。
2.2.2丁香有效部位对AGEs荧光强度影响及对其产生的抑制效果根据图2扫描结果,糖基化LDL分别添加丁香有效部位和阳性对照AG共同孵育后对AGEs形成的抑制效果如图4、图5所示。

图4 丁香有效部位及阳性对照对LDL糖基化孵育后 AGEs荧光强度的比较Fig.4 The comparation of fluorescence intensity of AGEs between the effective fraction from clove and positive control after glycosylation注:不同字母表示显著差异(p<0.01),图5~图7同。
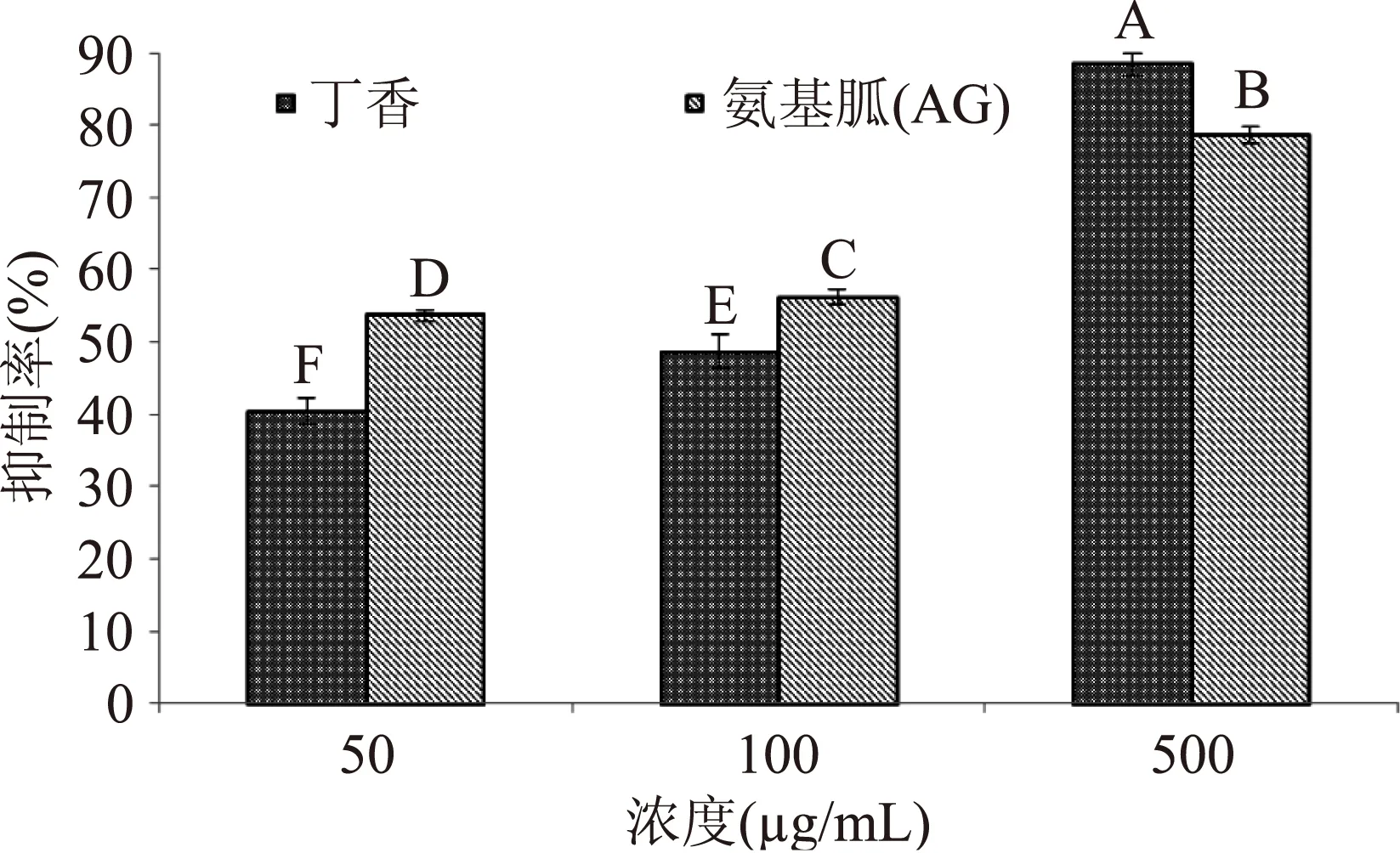
图5 丁香有效部位及阳性对照对LDL糖基化孵育后 AGEs产生量的抑制效果Fig.5 The inhibition efficiency of AGEs production between the effective fraction from clove and positive control after glycosylation
由图4和图5知,丁香有效部位能有效减少AGEs形成,在较低浓度(50 μg/mL和100 μg/mL)时抑制率可达到40.360%±0.184%、48.607%±0.232%,其抑制效果弱于阳性对照AG(53.646%±0.034%、56.152%±0.080%),这表明丁香在较低浓度对AGEs的抑制效果没有阳性对照AG强。但是,当丁香有效部位浓度升高到500 μg/mL时,其对AGEs的抑制效果显著性高于AG(p<0.01),达88.328%±0.03% AG抑制率比丁香有效部位抑制率低9.722%。
2.2.3丁香有效部位对LDL糖基化产物—戊糖素荧光强度影响及对其产生的抑制效果戊糖素是LDL糖基化过程中产生的一种具特定荧光吸收的氨基酸加合物,也是生物组织交联、蛋白质老化、糖氧化应激等发生的标志[29]。丁香和AG对戊糖素产生的抑制作用如图6、图7所示。
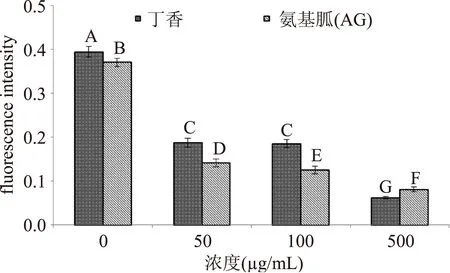
图6 丁香有效部位及阳性对照对LDL糖基化孵育后 戊糖素荧光强度的比较Fig.6 The comparation of fluorescence intensity of pentosidines between the effective fraction from clove and positive control after glycosylation

图7 丁香有效部位及阳性对照对LDL糖基化孵育后 戊糖素产生量的抑制效果Fig.7 The inhibition efficiency of pentosidines production between the effective fraction from clove and positive control after glycosylation
由图6和图7可知,丁香对戊糖素形成的抑制作用也很显著,与抑制AGEs形成效果相似。在低浓度时抑制效果弱于阳性对照AG(p<0.01)。50 μg/mL和100 μg/mL时的抑制率分别为52.443%±2.653%、53.193%±1.591%,与AG(61.931%±1.278%、66.285%±1.575%)相比,分别低9.488%、13.092%。但是,当浓度升高到500 μg/mL时,其抑制率(84.365%±0.302%)比AG抑制率(78.117%±1.416%)高出6.248%。
图4~图7结果分析表明,丁香可显著抑制LDL糖基化修饰产物AGEs和戊糖素的形成。与阳性抑制剂AG相比,丁香在较低浓度时弱于AG;但在较高浓度(500 μg/mL)时抑制作用却显著强于AG(p<0.01)。原因可能是丁香有效部位是一种混合物,其内包含多种物质,而AG是一种分析纯试剂,故丁香有效部位在较低浓度时抑制效果比AG弱;而当丁香有效部位浓度逐渐升高时,其所含对AGEs和戊糖素产生抑制效果的有效成分也升高,导致其抑制效果强于AG。另外,丁香属于国家公布的药食两用植物[12],是天然抗氧化植物[17,20],与人工合成的阳性对照AG相比,对人类更健康、应用更安全。
有前人研究表明,糖基化LDL与未糖基化(自然)LDL相比,可明显增加SAR、过氧化氢和α-酮醛等释放并导致氧化应激产生[33-35]。Peng等[8]分析表明,天然抗AGEs材料包括药用植物、蔬菜、水果、茶、谷类食物、香料、果仁和藻类等,这些材料都富含多酚和黄酮类物质[11]。相关研究表明,多酚和黄酮可抑制AGEs产生[8]。大部分植物抗糖基化功能与其抗氧化性能显著相关[8]。丁香富含黄酮和其他抗氧化活性物质,具有很强抗氧化性能,在国家公布的87种药食两用原料中总多酚含量最高、抗氧化能力最强[13,15,17,20]。本实验表明,丁香具有很强的SAR清除率(如图1),乙酸乙酯相为其SAR有效部位。预示丁香可能通过其强SAR清除能力促进对AGEs和戊糖素产生的抑制作用,图4~图7的测定结果证实了这一点。因此,本实验测定结果表明,丁香具有的强SAR清除能力可加强其对AGEs及戊糖素形成的抑制作用,与前人报道一致[8]。
目前,很多AGEs抑制剂已经被发现,且一些已经处于临床研究阶段。现有的AGEs抑制剂可以分为人工合成和天然两类。AG是主要的人工合成AGEs抑制剂,也是唯一已经达到临床研究第三阶段的蛋白质糖基化抑制剂。但是,其本身同时具有很多毒副作用:如肝毒性、导致胃肠道紊乱、贫血和流感症状等,且由于治疗时使用量很大,因此,氨基胍作为糖基化抑制剂也受到很多限制[8]。本实验测定结果表明,丁香在较高浓度(≥500 μg/mL)时对AGEs和戊糖素产生的抑制效果要显著强于氨基胍(p<0.01),且丁香比氨基胍具有更好的安全性和优越性,可为进一步寻找新的天然AGEs抑制剂提供参考。
3 结论
丁香乙酸乙酯相清除超氧阴离子自由基(SAR)能力最强,为有效部位。
LDL糖基化修饰后其荧光最佳吸收峰会发生明显变化,表明糖化LDL与自然LDL相比其结构和性质改变。
丁香有效部位在低浓度(50、100 μg/mL)时对AGEs及戊糖素产生的抑制效果弱于阳性对照氨基胍;而当浓度升高到500 μg/mL时,其抑制效果却显著强于氨基胍(p<0.01)。
丁香对AGEs和戊糖素产生的抑制作用与其SAR清除能力密切相关。
[1]Pontie M,Bedioui F. Selective and sensitive electrochemical biosensing of superoxide anion production by biological systems:a short overview of recent trends[J]. Analusis,1999,27(7):564-570.
[2]Linnane A W,Kios M,Vitetta L. Healthy aging:regulation of the metabolome by cellular redox modulation and prooxidant signaling systems:the essential roles of superoxide anion and hydrogen peroxide[J]. Biogerontology,2007,8(5):445-467.
[3]Ou Z J,Ou J S,Ackerman A W,et al. L-4F,an Apolipoprotein A-1 Mimetic,Restores Nitric Oxide and Superoxide Anion Balance in Low-Density Lipoprotein-Treated Endothelial Cells[J]. Circulation,2003,107(11):1520.
[4]Nakashima T,Omura S,Takahashi Y. Generation of superoxide anions by a glycation reaction in conventional laboratory media[J]. Journal of Bioscience and Bioengineering,2012,114(3):275-280.
[5]Lapolla A,Traldi P,Fedele D,et al. Importance of measuring products of non-enzymatic glycation of proteins[J]. Clinical Biochemistry,2005,38(2):103-115.
[6]Wu C H,Yen G C. Inhibitory Effect of Naturally Occurring Flavonoids on the Formation of Advanced Glycation Endproducts[J]. Journal of Agricultural and Food Chemistry,2005,53(8):3167-3173.
[7]Shankaraiah G,Tiwari A K,Vijaya K T,et al. New protein glycation inhibitory free radical scavenging compound fromDurantarepensL[J]. Journal of Pharmacy Research,2013,7(2):162-166.
[8]Peng X F,Ma J Y,Chen F,et al. Naturally occurring inhibitors against the formation of advanced glycation end-products[J]. Food And Function,2011,2(6):289-301.
[9]Suantawee T,Wesarachanon K,Anantsuphasak K,et al. Protein glycation inhibitory activity and antioxidant capacity of clove extract[J]. Journal Of The Japanese Society For Food Science And Technology-Nippon Shokuhin Kagaku Kogaku Kaishi,2015,52(6):3843-3850.
[10]Wu C H,Huang S M,Lin J A,et al. Inhibition of advanced glycation endproduct formation by foodstuffs[J]. Food and Function,2011,2(5):224-234.
[11]Xie Y X,Chen X Q. Structures Required of Polyphenols for Inhibiting Advanced Glycation end Products Formation[J]. Current Drug Metabolism,2013,14(4):414-431.
[12]江慎华,赵锦,刘常金,等. 采用超声-微波协同技术提取丁香总多酚工艺优化及其高效原因分析[J]. 食品工业科技,2014,35(24):243-247.
[13]Charles D J. Antioxidant Properties of Spices,Herbs and Other Sources[M]. 2013.
[14]Jiang S H,Li H Q,Ma H L,et al. Antioxidant activities of selected Chinese medicinal and edible plants[J]. International Journal of Food Sciences and Nutrition,2011,62(5):441-444.
[15]刘常金,赵锦,江慎华,等. 丁香抗氧化活性物质超声波-微波协同提取技术,2014,45(11):223-229.
[16]Sultana B,Anwar F,Przybylski R. Antioxidant activity of phenolic components present in barks of Azadirachta indica,Terminalia arjuna,Acacia nilotica and Eugenia jambolana Lam[J]. Food Chemistry,2007,104(3):1106-1114.
[17]沈勇根,蔡志鹏,江慎华,等. 丁香非挥发性成分抗氧化活性[J].农业机械学报,2012,43(10):131-137.
[18]Saraswat M,Reddy P Y,Muthenna P,et al. Prevention of non-enzymic glycation of proteins by dietary agents:prospects for alleviating diabetic complications[J]. British Journal of Nutrition,2009,11(11):1714-1721.
[19]Jin S,Cho K H. Water extracts of cinnamon and clove exhibits potent inhibition of protein glycation and anti-atherosclerotic activityinvitroandinvivohypolipidemic activity in zebrafish[J]. Food and Chemical Toxicology,2011,49(7):1521-1529.
[20]江慎华,肖敏,江春霞,等. 生物活性追踪法对丁香抗低密度脂蛋白氧化修饰的研究[J]. 现代食品科技,2013,29(9):2063-2067.
[21]Jiang S H,Wang C L,Chen Z Q,et al. Antioxidant properties of the extract and subfractions from old leaves of Toona sinensis Roem(Meliaceae)[J]. Journal of Food Biochemistry,2009,33(3):425-441.
[22]江慎华,蔡志鹏,廖亮,等. 丁香抗氧化活性物质提取及人工胃肠液对其活性的影响[J]. 农业机械学报,2012,43(7):149-155.
[23]Duan X W,Jiang Y M,Su X G,et al. Antioxidant properties of anthocyanins extracted from litchi(Litchi chinenesis Sonn.)fruit pericarp tissues in relation to their role in the pericarp browning[J]. Food Chemistry,2007,101(4):1365-1371.
[24]刘仁绿,肖敏,江卫青,等. 诃子粗提物及不同极性部位抑制低密度脂蛋白氧化修饰的研究[J]. 食品工业科技,2013,34(16):100-104.
[25]Wieland H,Seidel D. A simple specific method for precipitation of low density lipoproteins[J]. Journal of Lipid Research,1983,24(7):904-913.
[26]孟凡飞,高士雅,施璐,等. 人血浆低密度脂蛋白分离鉴定及粒径测定[J]. 临床检验杂志,2013,31(12):938-940.
[27]Gugliucci A. A practical method to study functional impairment of proteins by glycation and effects of inhibitors using current coagulation/fibrinolysis reagent kits[J]. Clinical Biochemistry,2003,36(2):155-158.
[28]Sattarahmady N,Khodagholi F,Moosavi-Movahedi A A,et al. Alginate as an antiglycating agent for human serum albumin[J]. International Journal of Biological Macromolecules,2007,41(2):180-184.
[29]Panaskar S N,Joglekar M M,Taklikar S S,et al. Aegle marmelos Correa leaf extract prevents secondary complications in streptozotocin-induced diabetic rats and demonstration of limonene as a potent antiglycating agent[J]. Journal of Pharmacy and Pharmacology,2013,65(6):884-894.
[30]Joglekar M M,Panaskar S N,Chougale A D,et al. A novel mechanism for antiglycative action of limonenethrough stabilization of protein conformation[J]. Molecular BioSystems,2013,9(10):2463-2472.
[31]Wang S H,Chang J C,Pokkaew R,et al. Modified Fast Procedure for the Detection and Screening of Antiglycative Phytochemicals[J]. Journal of Agricultural and Food Chemistry,2011,59(13):6906-6912.
[32]Itakura K,Oya-Ito T,Osawa T,et al. Detection of lipofuscin-like fluorophore in oxidized human low-density Lipoprotein:4-Hydroxy-2-nonenal as a potential source of fluorescent chromophore[J]. FEBS Letters,2000,473(2):249-253.
[33]Graier W F,Posch K,Kostner G M. Effect of glycated LDL on endothelial free radical release and its relevance for vascular dysfunction[J]. Atherosclerosis,1997,130(suppl 1):S2.
[34]Posch K,Simecek S,Wascher T C,et al. Glycated Low-Density Lipoprotein Attenuates Shear Stress-Induced Nitric Oxide Synthesis by Inhibition of Shear Stress-Activated L-Arginine Uptake in Endothelial Cells[J]. Diabetes,1999,48(6):1331-1337.
[35]Yim M B,kang S O,Boon C P. Enzyme-Like Activity of Glycated Cross-Linked Proteins in Free Radical Generation[J]. Annals of the New York Academy of Sciences,2000,899(1):168-181.
Efficiency of scavenging superoxide anions and inhibition on glycosylation of LDL of the effective fraction from clove
DU Yu-hui1,CAI Zhi-peng1,JIANG Shen-hua1,2,3,*,YANG Qiong-yu1,WAN Yan1,ZHANG Liang-hui1,MA Hai-le1,2,QU Wen-juan1,2,ZHANG Ai-lin1,3
(1.School of Pharmacy and Life Science,Jiujiang University,Jiujiang 332000,China;2.School of Food and Biological Engineering,Jiangsu University,Jiangsu Provincal Key Lab of Physical Processing of Agricultural Products,Zhenjiang 212013,China;3.Department of Food Science and Biotechnology,Tianjin agricultural University,Tianjin 300384,China)
In order to determine the inhibition efficiency on glycosylation of Low density lipoprotein(LDL)of clove,the preparation of clove effective fraction(the ethyl acetate fraction)based on bio-assay guided method and the inhibition efficiency on superoxide anion radicals and advanced glycosylation end products(AGEs)and pentosidines of clove effective fraction were studied by spectrophotometry and fluorescence analysis in this article. The results showed that the scavenging percentage on superoxide anions of ethyl acetate fraction was the highest among the different polar fractions of clove,and the scavenging percentages on superoxide anions were 46.112%±0.820% and 69.168%±2.637%,respectively,when the concentrations were 50 μg/mL and 100 μg/mL,which was significantly higher that of the positive control(p<0.05). The ethyl acetate fraction was proved to be the effective fraction of clove. The inhibition efficiencies(88.328%±0.037% and 84.365%±0.302%)were significantly stronger than those of the positive control(AG)when the concentration was 500 μg/mL,this inhibition efficiency was significantly higher than that of the positive control(AG)(p<0.01). The preferable inhibition efficiency on superoxide anions and AGEs was proved in this study,and this study laid the reference for further research and development of functional food.
clove;superoxide anion;Low density lipoprotein;glycosylation;advanced glycosylation end products
2016-01-29
杜余辉(1993-),男,本科,研究方向:天然产物研究与开发,E-mail:429819408@qq.com。
江慎华(1973-),男,博士,副教授,研究方向:天然产物研究与开发,E-mail:jiangshenhua66@163.com。
国家自然科学基金(31360371,31560308;31301423);江西省自然科学基金(20132BAB204030);江西省科技支撑计划(20123BBF60150、20151BBF60026);江西省卫生厅科研计划(2013A017);江苏省农产品物理加工重点实验室开放课题(JAPP2010-5);江西省天然产物与功能食品重点实验室开放基金资助项目;九江市科技支撑计划(201438)。
TS201.4
A
1002-0306(2016)15-0080-06
10.13386/j.issn1002-0306.2016.15.007
