高效液相色谱法测定脂肪酸组成柱前衍生条件的优化研究
2016-09-10严开芹苏可盈许洋珲唐嘉颖
严开芹,苏可盈,许洋珲,唐嘉颖,吴 青
(华南农业大学食品学院,广东省食品质量安全重点实验室,广东广州 510642)
高效液相色谱法测定脂肪酸组成柱前衍生条件的优化研究
严开芹,苏可盈,许洋珲,唐嘉颖,吴青*
(华南农业大学食品学院,广东省食品质量安全重点实验室,广东广州 510642)
目的:制备脂肪酸苯酰肼对照品,通过该对照品计算衍生率,探究脂肪酸最优的高效液相色谱(HPLC)柱前衍生条件。方法:选取正十四碳酸(myristic acid,MA)为代表,以吡啶为催化剂,1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(1-EDC·HCl)为偶联剂,MA与2-硝基苯肼盐酸盐(2-NPH·HCl)反应,合成正十四碳酸苯酰肼(myristic benzhydrazide,MBH);采用硅胶柱层析和重结晶对衍生产物MBH进行分离纯化,MS和1H-NMR进行结构鉴定,TLC和HPLC进行纯度检测;以衍生率为指标,对影响MA衍生为MBH的HPLC的柱前衍生条件进行研究。结果:成功制备了纯度为99.81%的MBH对照品,可用于脂肪酸衍生条件优化研究中衍生率的测定;最优的衍生条件为:2-NPH·HCl浓度为0.04 mol/L,1-EDC·HCl浓度为0.45 mol/L,60 ℃水浴加热15 min,此时MA的衍生率达到99.85%。在此衍生条件下,衍生同摩尔浓度的亚油酸(linoleic acid,LA),经HPLC分析发现,LA衍生产物的峰面积与MA衍生产物的峰面积的相对差值仅为1.3%。结论:获得了脂肪酸最优的HPLC柱前衍生条件,该衍生条件能最大化地衍生脂质中各种脂肪酸。
脂肪酸,衍生,高效液相色谱
目前,食品中脂质的脂肪酸组成常用气相色谱法(GC)检测[1-2]。但是不饱和脂肪酸尤其是多不饱和脂肪酸在高温下分析时其双键易发生异构化甚至碳链断裂,从而影响测定的准确性[3-4]。而高效液相色谱法(HPLC)可避免此问题,而且更具有选择性,可更有效地分离脂肪酸的异构体,如立体异构和双键位置异构[5-6]。但是,脂肪酸在可见和紫外区域没有吸收官能团,也不具有荧光[7],因此需要在HPLC分析前进行柱前衍生,使脂肪酸分子带上在紫外或可见光或荧光下有吸收的基团。
一些文献报道[8-10],2-硝基苯肼盐酸盐(2-NPH·HCl)是一种较好的衍生剂,在吡啶作催化剂、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(1-EDC·HCl)作偶联剂下的衍生反应可在温和条件(弱酸环境,60 ℃加热15 min)且在水相体系中进行,衍生化后的脂肪酸衍生物在400 nm有较强吸收,为此可提高HPLC分析的灵敏度。如何使脂肪酸最大化地衍生,是实现HPLC准确检测的关键和前提。许多学者[11-12]在研究脂肪酸与2-NPH·HCl进行衍生反应的条件时,均以脂肪酸苯酰肼的液相色谱峰面积或峰高为依据进行筛选,峰面积越大或峰高越高,衍生化程度越高,衍生条件越好;但此类方法并不能了解真实的脂肪酸衍生率,判断衍生化程度最准确的指标是衍生率。而要获得衍生率,必须有纯化的脂肪酸苯酰肼为对照品,以其在一定浓度下对应的色谱峰面积为理论值,脂肪酸在一定条件下衍生后经HPLC分析获得的峰面积为实际值,计算衍生率。
本文选取正十四碳酸(MA)为代表,与2-NPH·HCl进行衍生反应,通过萃取、硅胶柱分离和重结晶进行纯化,获得了纯度高的正十四碳酸苯酰肼(MBH)对照品,将其用于衍生条件优化中衍生率的测定。以衍生率为指标,探索了2-NPH·HCl浓度、1-EDC·HCl浓度、水浴温度及时间对MA衍生率的影响,以确定最优的衍生条件;并在此衍生条件下,衍生同摩尔浓度的亚油酸,比较其衍生产物的峰面积与MA衍生产物的峰面积,来验证建立的衍生条件是否能最大化地衍生脂质中各种脂肪酸。
1 材料与方法
1.1材料与仪器
MA(≥99.5%)、1-EDC·HCl(98%)、吡啶(≥99%)阿拉丁生化科技公司;亚油酸(LA,≥98.5%)美国Sigma公司;2-NPH·HCl(98%)安耐吉公司;乙腈(色谱纯)广州绿百草生物科技有限公司;氢氧化钾、盐酸、乙醇、甲醇(均为分析纯)天津大茂化学试剂厂。
LC-20AT高效液相色谱仪(配UV-VIS检测器)日本岛津公司;Sunfire C18色谱柱(250 mm×4.6 mm,5 μm)美国Waters公司;DK-8D三孔电热恒温水槽上海齐欣科学仪器有限公司;KQ-100DE数控超声波清洗器Fisher公司;N1001DWA旋转蒸发仪日本EYELA公司;5424R高速离心机Eppendorf公司;WX-80A混合器上海精科实业有限公司。
1.2实验方法
1.2.1试剂的配制
1.2.1.1MBH对照品合成所用试剂的配制0.02 mol/L 2-NPH·HCl溶液:用体积分数80%乙醇溶解2-NPH·HCl配成;体积分数3%吡啶溶液:用无水乙醇溶解吡啶配成;0.25 mol/L 1-EDC·HCl溶液:用体积分数80%乙醇溶解1-EDC·HCl配成;0.125 mol/L 1-EDC·HCl工作液:将3%吡啶溶液与0.25 mol/L 1-EDC·HCl溶液等体积混合;质量分数15%KOH溶液:用V(甲醇)∶(水)=4∶1溶解KOH制成;3 mol/L HCl溶液:用V(乙醇)∶V(水)=4∶1稀释盐酸制成。
1.2.1.2衍生化条件优化所用试剂的配制1600 nmol/mL MA溶液:用体积分数80%乙醇溶解MA配成;0.04 mol/L 2-NPH·HCl溶液:用体积分数80%乙醇溶解2-NPH·HCl配成;0.45 mol/L 1-EDC·HCl溶液:用体积分数80%乙醇溶解1-EDC·HCl配成;0.225 mol/L 1-EDC·HCl工作液:将3%吡啶溶液与0.45 mol/L 1-EDC·HCl溶液等体积混合;1 mg/mL MBH贮备液:称取MBH对照品10 mg,用甲醇溶解配成。
1.2.2MBH对照品的制备
1.2.2.1MBH的合成称取100 mg十四酸标准品溶于100 mL无水乙醇中,加入 0.02 mol/L 2-NPH·HCl溶液200 mL、0.125 mol/L 1-EDC·HCl工作液400 mL,于80 ℃水浴中反应5 min,然后加入15% KOH溶液100 mL,80 ℃下继续加热5 min以破除副产物和过量试剂,取出用流水冷却,加入3 mol/L HCl溶液250 mL进行中和,得到显黄色的产物混合液,最后加入正己烷进行萃取,萃取2次,合并正己烷层,旋转蒸发干正己烷后,用少量乙酸乙酯溶解。
1.2.2.2MBH的纯化在装有硅胶的750 mm×14.5 mm玻璃柱顶端加入溶有产物的乙酸乙酯溶液,用V(乙酸乙酯)∶V(正己烷)混合液=1∶6 进行洗脱,收集各段有颜色的洗脱液,取少量洗脱液,滴加KOH溶液,若显紫色表明洗脱液含有MBH产物。将该洗脱液浓缩,再分别用甲醇和正己烷溶解,进行两次重结晶,得到黄色针状晶体。
1.2. 3MBH的结构确证
1.2.3.1紫外光谱鉴定取纯化得到的MBH适量,用甲醇配成400 nmol/mL的溶液,采用HPLC-PDA检测器对该化合物进行全波长扫描,采集光谱图,以获得最大吸收波长。
1.2.3.2质谱鉴定称取MBH 10 mg,用甲醇制成1 mg/mL溶液,在负离子模式下采集ESI-MS(高分辨)质谱图,以获得分子质荷比。
1.2.3.3核磁鉴定称取MBH 7 mg、马来酸(内标物)2 mg,用氘代氯仿(CDCl3)溶解,在一定核磁条件下采集氢谱图,以获得1H-NMR(CDCl3)δ数据。
1.2.4MBH的纯度检测
1.2.4.1薄层色谱检测取纯化得到的MBH适量,用甲醇配成1 mg/mL的溶液,在同一硅胶板上以不同点样量点样,用V(乙酸乙酯)∶V(正己烷)=1∶2展开剂进行展开。
1.2.4.2HPLC检测称取MBH10 mg,用甲醇制成1 mg/mL溶液,采用以下色谱条件:Sunfire C18色谱柱(250 mm×4.6 mm,5 μm),流动相V(乙腈)∶V(水)=86∶14,流速1 mL/min,进样量20 μL分别采集254、230和215 nm波长下的色谱图;再改变流动相组成,分别在254、230和215 nm波长下采集色谱图。
1.2.5衍生方法吸取1600 nmol/mL MA溶液100 μL于1 mL刻度试管中,依次加入0.04 mol/L 2-NPH·HCl溶液200 μL和0.225 mol/L 1-EDC·HCl工作液200 μL,涡旋振荡30 s,混匀,置于60 ℃水浴中反应15 min,反应结束后,加入15% KOH溶液100 μL,反应5 min,流水冷却后加入3 mol/L HCl溶液100 μL中和,用80%乙醇定容,涡旋振荡混匀,12000 r/min离心,取上清液经0.22 μm滤膜过滤,4 ℃保存备用。
1.2.6HPLC条件色谱柱:Sunfire C18(250 mm×4.6 mm,5 μm);流动相:V(乙腈)∶V(水)=86∶14,等度洗脱;流速:1 mL/min;柱温:30 ℃;检测波长:400 nm;进样量:10 μL。
1.2.7衍生率的测定
1.2.7.1MBH对照品标准曲线的绘制分别吸取不同体积的MBH贮备液,用甲醇稀释配制成浓度分别为6.25、12.5、25、50、100 μg/mL的系列溶液,用1.2.6中的色谱条件,以各浓度峰面积y对相应浓度x作直线回归,绘制标准曲线。其线性回归方程为:y=5123.1x-867.46,R2=1。
1.2.7.2衍生率的计算上机样液中MBH的质量浓度按下式计算:
式中:W-上机样液中MBH的质量浓度(μg/mL);X-衍生时所用MA的纳摩尔浓度(nmol/mL);100-衍生时所用MA体积(μL);363-MBH的摩尔质量。
将W代入标准曲线获得MBH的理论峰面积B,再按下式计算衍生率D:
式中:D-MA的衍生率;A-MA衍生为MBH的实际峰面积;B-MA衍生为MBH的理论峰面积。
1.2.8衍生条件优化
1.2.8.12-NPH·HCl浓度对衍生率的影响在1-EDC·HCl浓度为0.25 mol/L,水浴温度为80 ℃,水浴时间为5 min的条件下,研究2-NPH·HCl浓度分别为0.02、0.03、0.04和0.05 mol/L水平下对MA衍生率的影响。
1.2.8.21-EDC·HCl浓度对衍生率的影响在2-NPH·HCl浓度为0.04 mol/L,水浴温度为80 ℃、水浴时间为5 min的条件下,研究1-EDC·HCl浓度分别为0.15、0.25、0.35、0.45和0.55 mol/L水平下对MA衍生率的影响。
1.2.8.3水浴温度和水浴时间对衍生率的影响在2-NPH·HCl浓度为0.04 mol/L,1-EDC·HCl浓度为0.45 mol/L的条件下,研究水浴温度分别为40、60、80 ℃水平,水浴时间分别为5、10、15、20 min水平下对MA衍生率的影响。
1.2.9验证最优衍生化条件的适用性以含多不饱和双键的脂肪酸亚油酸LA为代表,采用获得的最佳衍生条件,衍生LA,比较 LA衍生产物的峰面积与同摩尔浓度的MA衍生产物的峰面积的相对差值,来验证建立的衍生条件是否能最大化地衍生脂质中各种脂肪酸。峰面积相对差值计算公式如下:
式中:R-LA与MA衍生产物峰面积的相对差值;S1-LA衍生产物的峰面积;S2-MA衍生产物的峰面积。
1.2.10数据处理采用SPSS 17.0 统计软件进行数据分析,进行组间两两比较时,若方差齐时,采用LSD检验;若方差不齐时,采用Tamhane’s检验,差异显著性水平为p<0.05。
2 结果与分析
2.1MBH的结构确证
纯化得到的MBH为黄色针状晶体,易溶于甲醇、乙醇和乙腈。光谱扫描结果如下:λmax(MetOH):230 nm和400 nm。ESI-MS(高分辨)在负离子模式下获得的分子质荷比m/z:362[M-H]-;以马来酸为内标物,1H-NMR(CDCl3)δ数据如下:10.10(s,1H)、9.18(s,1H)、8.08(dd,J=1.44,8.51 Hz,1H)、7.55(m,1H)、7.05(dd,J=1.05,8.65 Hz,1H)、6.85(m,1H)、6.26(s,4H)、2.21(t,J=7.4 Hz,2H)、1.253(m,22H)、0.845(t,J=7.0 Hz,3H)。其中,δ=6.26为内标物马来酸的H;δ=0.845为MBH分子中甲基上的3个H,δ=2.21为与羰基相连的亚甲基上的H,δ=1.253为其余亚甲基上的H,δ=10.10为与羰基相连的N上的H,δ=9.18为与苯环相连的N上的H,δ=8.08、7.55、7.05、6.85为苯环上的4个H。以上数据可确证该化合物为正十四碳酸苯酰肼MBH,结构见图1。

图1 正十四碳酸苯酰肼的结构Fig.1 The structure of myristic benzhydrazide
2.2MBH的纯度检测
薄层色谱检测结果显示,只见单一的黄色斑点,未见杂质斑点,表明制备的MBH纯度较高。1.2.4.2色谱条件下的HPLC检测结果显示,254 nm波长下的色谱图只见1个主峰(图2),保留时间为13.5 min,质量分数以峰面积归一化法计算为99.81%。在上述色谱条件下采集的230 nm和215 nm下的色谱图,同样也只见1个主峰;改变流动相组成,分别在254、230和215 nm下获得的色谱图亦只见1个主峰,未见其他峰,进一步表明该MBH化合物纯度高。
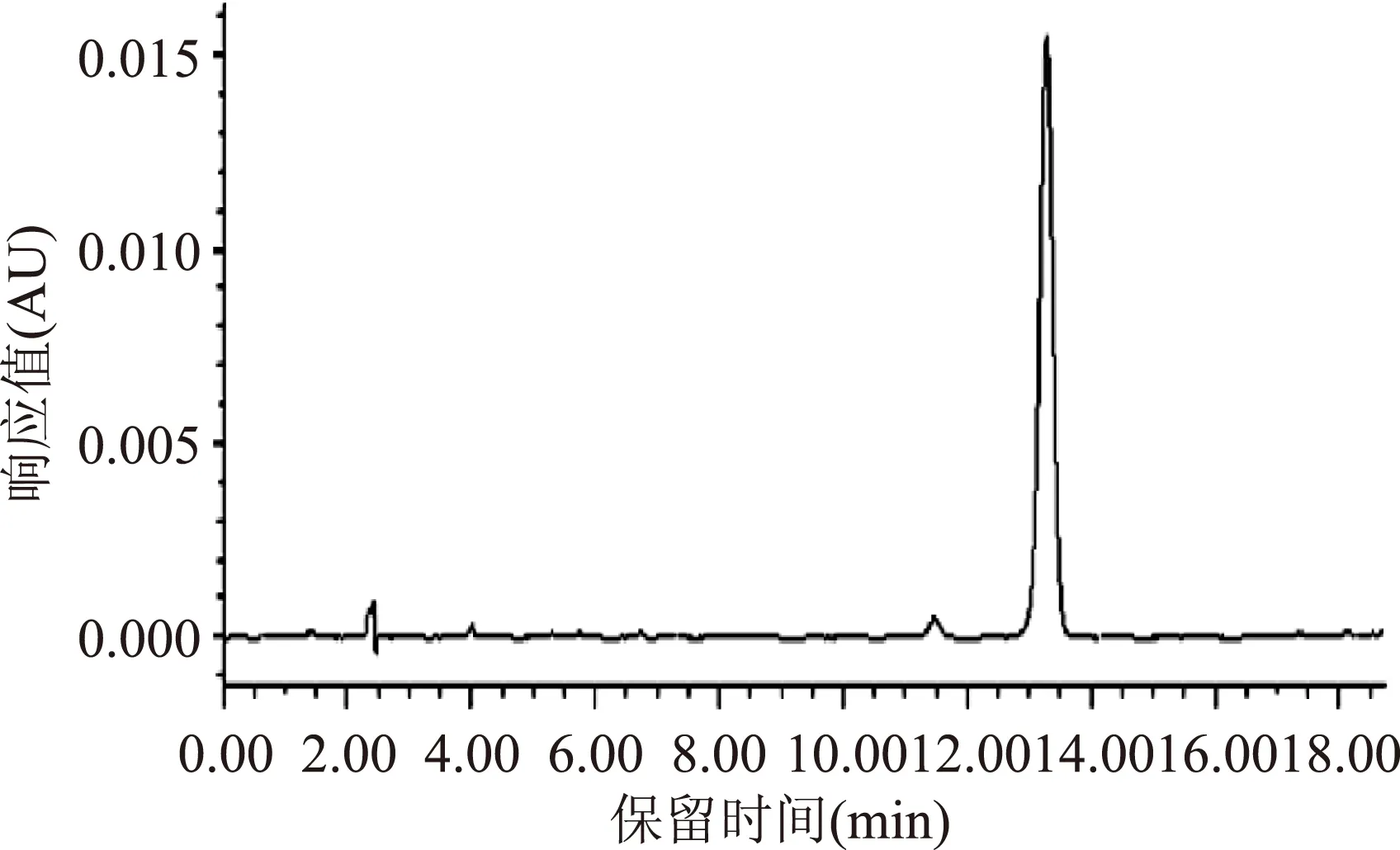
图2 正十四碳酸苯酰肼的色谱图Fig.2 The HPLC of myristic benzhydrazide
2.32-NPH·HCl浓度对衍生率的影响
2-NPH·HCl浓度对MA衍生率的影响见图3。由图可见,MA衍生为MBH的衍生率随着衍生剂2-NPH·HCl浓度的增加而增加。当2-NPH·HCl浓度为0.02 mol/L时,MA的衍生率为75.75%,而浓度增加到0.04 mol/L时,MA的衍生率可增加到87.51%,经差异显著性检验发现,2-NPH·HCl浓度为0.04 mol/L时的衍生率显著高于浓度0.03 mol/L时的衍生率,而与浓度为0.05 mol/L时的衍生率相比较,则无显著性差异,因此选取2-NPH·HCl浓度为0.04 mol/L。

图3 2-NPH·HCl 浓度对衍生率的影响Fig.3 Effect of the concentration of 2-NPH·HCl on derivatization yield 注:图中不同字母代表差异显著(p<0.05);图4、图5同。
2.41-EDC·HCl浓度对衍生率的影响
1-EDC·HCl浓度对MA衍生率的影响见图4。由图4可见,MA衍生化为MBH的衍生率随着偶联剂1-EDC·HCl浓度的增加而增加。当1-EDC·HCl浓度为0.15 mol/L时,MA的衍生率为79.47%,而浓度增加到0.45 mol/L时,MA的衍生率可增加到91.32%。经差异显著性检验发现,1-EDC·HCl浓度为0.45 mol/L时的衍生率显著高于浓度为0.35、0.25、0.15 mol/L时的衍生率,而与浓度为0.55 mol/L时的衍生率相比较,则无显著性差异,因此选取1-EDC·HC浓度为0.45 mol/L。

图4 1-EDC·HCl 浓度对衍生率的影响Fig.4 Effect of the concentration of 1-EDC·HCl on derivatization yield
2.5水浴温度和时间对衍生率的影响
由图5可见,在温度恒定时,衍生率随着衍生反应时间的增加而增加,在反应10 min后,衍生率增加较慢,而当时间一定时,衍生率随着衍生反应温度的升高而增加。但多次实验的结果表明,当温度过高,如选用80 ℃时,衍生反应重现性较差;因此,衍生反应温度选择低于80 ℃为宜。温度为60 ℃,时间为5 min时,MA的衍生率为95.34%,而时间增加到10 min时,MA的衍生率可增加到99.03%。经差异显著性检验发现,时间为10 min时的衍生率显著高于时间5 min时的衍生率,而与时间为15、20 min时的衍生率相比较,则无显著性差异,但为了确保所有的脂肪酸能最大化的衍生,适当延长衍生反应时间为宜。因此选取水浴温度为60 ℃、时间为15 min。

图5 温度和时间对衍生率的影响Fig.5 Effect of the temperature and time on derivatization yield
2.6验证MA最优衍生化条件的适用性
将同纳摩尔浓度(4000 nmol/mL)的LA和MA在衍生条件为0.04 mol/L 2-NPH·HCl、0.45 mol/L 1-EDC·HCl,水浴温度60 ℃、水浴时间15 min下进行衍生,各自衍生产物的峰面积见表1。由表1可知,两者的峰面积相对差值很小,仅为1.3%,说明建立的衍生条件能最大化地衍生脂质中各种脂肪酸。

表1 MA和LA衍生产物的峰面积比较表Table 1 The comparison of peak area between MA derivative and LA derivative
3 结论
本研究合成了衍生产物MBH,采用硅胶柱层析和重结晶对衍生产物进行了分离纯化,经 MS和1H-NMR鉴定,TLC和HPLC检测,显示MBH对照品制备成功,其纯度达到99.81%。以衍生率为指标,研究了影响MA衍生反应的HPLC柱前衍生的条件,确定了最优的衍生条件:2-NPH·HCl浓度为0.04 mol/L,1-EDC·HCl浓度为0.45 mol/L,60 ℃水浴加热15 min,此时MA的衍生率达到99.85%。在此衍生条件下,衍生同摩尔浓度的亚油酸LA,LA衍生产物的峰面积与MA衍生产物的峰面积的相对差值仅为1.3%,说明建立的衍生条件能最大化地衍生脂质中各种脂肪酸。
[1]GB 28404-2012,保健食品中α-亚麻酸、二十碳五烯酸、二十二碳五烯酸和二十二碳六烯酸的测定[S]. 北京:中国标准出版社,2012.
[2]农业部食品质量监督检验测试中心. GB 5413.27-2010,婴幼儿食品和乳品中脂肪酸的测定[S]. 北京:中国标准出版社,2010.
[3]林抗美,马丽娜,朱育菁,等. 乐果液相色谱与气相色谱检测方法的比较[J]. 中国农学通报,2008,24(10):453-456.
[4]Heather M,WU J J. Chromatographic Separation of Bioactive Oxycholesterols by GC,HPLC and SFC[J]. Current Topics in Medicinal Chemistry,2012,2(11):25-28.
[5]邓泽元,余迎利,Kramer J K G. GC和HPLC对共轭亚油酸的测定[J]. 中国油脂,2015,30(3):36-39.
[6]Sehat N,Yurawecz M P,Roach J A G,et al. Silver-ion high performance liquid chromatographic separation and identification of conjugated linoleic acid isomers[J]. Lipids,1998,33(2):217-221.
[7]Ilia B. Development of fatty acid analysis by high performance liquid chromatography,gas chromatography and related techniques[J]. Analytica Chimica Acta,2002,465(1):1-37.
[8]Miwa H,Hiyama C,Yamamoto M. High performance liquid chromatography of short-and long-chain fatty acids as 2-nitrophenylhydrazides[J]. Chromatography,1985(321):165-174.
[9]Miwa H. High performance liquid chromatographic determination of mono-,poly-and hydroxycarboxylic acids in foods and beverages as their 2-nitrophenylhydrazides[J]. Chromatography A,2000,881(1-2):365-385.
[10]Miwa H. High performance liquid chromatographic determination of free fatty acids and esterified fatty acids in biological materials as their 2-nitrophenylhydrazides[J]. Analytica Chimica Acta,2002,465(1/2):237-255.
[11]Peris-Vicente J,Gimeno-Adelantado J V,Doménech-Carbó M T,et al. Identification of drying oils used in pictorial works of art by liquid chromatography of the 2-nitrophenylhydrazides derivatives of fatty acids[J]. Talanta,2004,(64):326-333.
[12]Henderson G C,Tuazon M A. Separation of positional and geometrical fatty acid isomers as 2-nitrophenyl-hydrazide derivatives by high performance liquid chromatography[J]. Analytical Biochemistry,2011,413(1):66-68.
Optimization of pre-column derivatization condition of fatty acid by high performance liquid chromatography
YAN Kai-qin,SU Ke-ying,XU Yang-hui,TANG Jia-ying,WU Qing*
(College of Food Science,South China Agricultural University,Guangzhou 510642,China)
Objective:Fatty acid benzhydrazide was produced which was used as a reference substance for determination of derivatization yield. The best conditions for the pre-column derivatization of fatty acids using high performance liquid chromatography were studied. Methods:Myristic acid(MA)was selected to represent all of fatty acids(FAs)in the experiment. MA reacted with 2-nitrophenylhydrazine hydrochloride(2-NPH·HCl)in the case of 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride(1-EDC·HCl)as coupling agent and pyridine as catalyst,and Myristic benzhydrazide(MBH)was produced. The MBH was separated and purified by silica gel column chromatography and recrystallization. Its structure was identified by MS and1HNMR. Its purity was detected by TLC and HPLC. Derivatization yield as a indicator,the pre-column derivatization conditions of MA using high performance liquid chromatography were studied. Results:MBH was obtained and it purity was 99.81% which could be used as a reference substance for determination of derivatization yield in the study of optimization of derivatization condition of fatty acid. The best conditions for the pre-column derivatization were as follows:the concentration of 2-NPH·HCl was 0.04 mol/L,the concentration of 1-EDC·HCl was 0.45 mol/L,the temperature of the derivatization reaction was 60 ℃,the time of the derivatization reaction was 15 min. The derivatization yield was 99.85% under above the derivatization condition. Linoleic acid derivative was prepared using same derivatization condition. The difference between the peak area of LA derivative and MA derivative was only 1.3%. Conclusion:The optimal pre-column derivatization condition of fatty acid by HPLC was obtained and various fatty acids could be maximum derivatized under above the derivatization condition.
fatty acids;derivatization;HPLC
2016-01-06
严开芹(1991-),女,硕士研究生,研究方向:食品质量与安全,E-mail:flyqsxf@163.com。
吴青(1964-),女,博士,副教授,研究方向:食品质量与安全,E-mail:wuqing@scau.edu.cn。
2014年国家级大学生创新训练项目(201410564175);广东省科技计划项目(2010A032000001-4);广东省教育部产学研结合项目(2010B090400362)。
TS207.3
B
1002-0306(2016)14-0054-05
10.13386/j.issn1002-0306.2016.14.002
