过量表达葡萄糖脱氢酶对E.coli羟基脂肪酸合成能力的影响
2016-09-10王相伟马庆林
王相伟,邢 翔,马庆林
(山东大学(威海)海洋学院,山东威海 264209)
过量表达葡萄糖脱氢酶对E.coli羟基脂肪酸合成能力的影响
王相伟,邢翔,马庆林
(山东大学(威海)海洋学院,山东威海 264209)
在工程大肠杆菌生产羟基脂肪酸的基础上,为解决构建的以葡萄糖为底物合成羟基脂肪酸(HFAs)代谢途径中存在的细胞内还原力(NADPH)不平衡的问题,克隆了来源于巨大芽孢杆菌葡萄糖脱氢酶(GDH)基因,构建了胞内HFAs和NADPH联产的工程菌株;实验结果表明该重组大肠杆菌合成HFAs的产量得到显著提高,摇瓶条件下HFAs产量达到173.9 mg/L。具有较好的工业化开发前景。
羟基脂肪酸,葡萄糖脱氢酶,基因工程,重组大肠杆菌
ω-羟基脂肪酸是羟基位置较靠近首位甲基碳端的羟基脂肪酸,它作为单体在合成高分子聚合物时可提供最长的碳链,使合成材料性能更优越,是当今生物可降解聚合物材料研究开发中最理想的原料之一[1-3],日益受到国内外的高度关注。由于ω-羟基脂肪酸的羟基位于不活泼的碳链端,传统的化学合成工艺反应步骤繁琐,反应条件苛刻,催化剂特异性不高,给后期产物分离造成了很大的困难,限制了化学法合成羟基脂肪酸的工业化应用[4-5]。基于对原料资源、成本、环境效应等综合考虑,以可再生资源如葡萄糖等为原料,利用微生物细胞催化合成羟基脂肪酸已成为近年的研究热点[6-8]。
目前,国内外微生物合成羟基脂肪酸的报道主要集中在菌种的筛选及外源脂肪酸催化方面,酵母[9]、铜绿假单胞菌[10]、芽孢杆菌[11]及大肠杆菌[12]催化合成羟基脂肪酸已有报道,然而,上述合成过程均需添加外源脂肪酸作为催化底物,原料价格昂贵且抑制细胞的生长,不适合用于大规模工业化生产,而以可再生资源如葡萄糖为底物进行羟基脂肪酸生产的报道较少,为解决这一问题,研究者构建了以葡萄糖为底物合成HFAs的代谢途径,但报道的摇瓶产量不高[6],原因之一是由于以葡萄糖为底物生成HFAs过程中,胞内游离脂肪酸羟基化需要供应还原力NADPH,而细胞内产生的NADP+无法及时再生,最终影响了HFAs的合成与产量。作者在前期构建大肠杆菌由葡萄糖合成HFAs途径的基础上,引入来源于巨大芽孢杆菌的葡萄糖脱氢酶(GDH)基因,在氧化葡萄糖为葡萄糖酸内酯的同时,将NADP+持续转化为NADPH[13],作为羟化反应所需的氢供体,用以平衡胞内HFAs生产过程的还原力,从而有效提高了HFAs的产量。
1 材料与方法
1.1材料与仪器

表1 本研究所用的菌株、质粒及引物Table 1 E.coli strains,plasmids and primers used in this study
注:全部引物合成由上海捷瑞生物公司完成。
E.coliBL21(DE3)和BacillusmegateriumATCC 14581Invitrogen公司;质粒pET-28a(+)和pACYCDuet-1Novagen公司;工程菌E.coliBL21(DE3)ΔfadD+pACYCDuet-1-P450BM3+‘tesA,记作WX1本实验室构建并保藏。WX1菌株携带质粒pACYCDuet-1,质粒上携有脂肪酸羟化酶基因P450BM3和硫酯酶‘tesA基因,菌株为脂酰基辅酶A合成酶(fadD)基因敲除型。本研究所用的菌株、质粒及引物见表1。Pyrobest DNA聚合酶、T4 DNA连接酶、dNTP、感受态细胞制备试剂盒等Takara公司;限制性内切酶及胶回收试剂盒,质粒提取试剂盒等Omega公司;胰蛋白胨、酵母提取物及IPTG(异丙基硫代-β-D-半乳糖苷)等上海生工,其余实验试剂国产分析纯。LB液体培养基(g/L):1%蛋白胨,0.5%酵母提取物,1%NaCl。固体培养基为上述成分再加入2%琼脂粉。M9培养基(g/L):2%葡萄糖,磷酸氢二钠6 g/L,磷酸二氢钾3 g/L,氯化铵1 g/L,氯化钠0.5 g/L,硫酸镁1 mmol/L。
LDZM-80KCS型蒸汽灭菌器、ZHWY-1102B恒温摇床上海申安医疗器械厂;Aglient 7890A-5975C气相色谱-质谱联用仪美国Aglient Technologies公司;Mycycler 型PCR扩增仪、PowerPac Basic 核酸电泳仪、Gel Doc XR 凝胶成像系统美国Bio-Rad 公司;I-14型台式离心机、Allegra X-22型冷冻离心机德国Beckman公司。
1.2实验方法
1.2.1外源基因GDH的克隆及质粒的构建根据GenBank中巨大芽孢杆菌(Bacillusmegaterium)葡萄糖脱氢酶基因序列(GenBank:LK055286.1),设计合成PCR引物,并分别引入酶切位点NcoI和EcoR I。PCR反应条件为:预变性3 min,变性30 s,退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。PCR反应产物经1.2%琼脂糖凝胶电泳检测。
切胶回收后的GDH基因和pET-28a(+)质粒均采用NcoI和EcoR I酶切,将纯化后的DNA片段与线性化的pET-28a(+)载体连接,转化大肠杆菌感受态细胞。菌液PCR筛选阳性克隆,提取质粒,酶切鉴定并测序,获得的重组质粒命名为pWX2。
1.2.2重组蛋白的诱导表达质粒pWX2转化工程菌WX1感受态细胞,获得的菌株命名为WX2。以1%接种量将WX2及E.coliBL21(DE3)菌株(对照)接种至添加相应抗生素的LB液体培养基中,恒温振荡培养至OD600为0.6,加入相应浓度IPTG(0.1 mmol/L),诱导蛋白表达15 h。4 ℃,10000 r/min离心15 min收集菌体,细胞超声破壁后上清液即为粗酶液,用于SDS-PAGE蛋白电泳检测。
1.2.3发酵条件工程菌株WX2摇瓶培养前,首先转接到LB培养基中活化,活化后的菌体以1∶100的比例转接至M9培养基的摇瓶中,并加入相应浓度的抗生素(卡那霉素:50 mg/L,氯霉素:34 mg/L),然后置于37 ℃恒温摇床振荡培养至OD600为2.0,加入IPTG(0.1 mmol/L)诱导基因表达,培养温度降为30 ℃,以利于蛋白表达。菌体培养至指数后期,离心收获菌体用0.2 mol/L磷酸钾缓冲液(pH7.4)配成一定浓度菌悬液,同时补加葡萄糖(0.5%),30 ℃,180 r/min反应15 h。
1.2.4代谢产物处理及分析产物处理及检测参考文献[6],发酵液离心收集上清液,6 mol/L盐酸调节上清pH至2.0,等体积氯仿抽提,取上层有机相加入甲酯化试剂(H2SO4/CH3OH),置于60 ℃水浴酯化反应30 min,等体积正己烷萃取三次,0.22 μm滤膜过滤后进行气质检测。利用安捷伦(Agilent)公司GC-7890A-5975C气质联用仪对产物进行定量和定性。色谱条件:HP-5毛细管柱(30 m×0.32 mm×0.25 μm);升温程序:起始80 ℃,持续2 min,5 ℃/min升温至250 ℃,保持10 min。加样器和检测器温度分别为250、300 ℃。以羟基癸酸为内标进行定量。质谱条件:电子轰击(EI)离子源;离子能量70 eV;离子源温度220 ℃;扫描模式:全扫描;质量扫描范围m/z 10~600。
2 结果与分析
2.1重组工程菌株的构建
将从Bacillusmegaterium基因组扩增出的片段连接到表达载体pET-28a(+)上获得重组质粒,重组大肠杆菌进行菌液PCR鉴定,产物经琼脂糖凝胶电泳鉴定,在800 bp处可见一条与预期大小相符条带(图1)。DNA序列分析显示插入的基因片段与GenkBank中已报道的序列一致,二者的基因同源性为100%。表明目的基因已成功插入到pET-28a(+)表达载体上,所获得的重组菌为阳性克隆。

图1 GDH基因的菌液PCR鉴定Fig.1 PCR identification of GDH注:M:DNA marker DL2000;1-3:GDH PCR图谱。
2.2蛋白诱导表达
将重组质粒pWX2转化至WX1感受态细胞中,构建重组菌WX2。表达羟化酶P450BM3和脱氢酶GDH进行SDS-PAGE检测,与对照菌株E.coliBL21(DE3)相比较,重组菌WX2在119和29 ku附近出现两条明显的特异蛋白条带(图2),两条带的大小与预测的一致。检测结果表明,P450BM3和GDH基因在重组菌中均能正常表达。

图2 P450BM3与GDH基因共表达菌株SDS-PAGE图谱Fig.2 SDS-PAGE analyses of recombinant proteins P450BM3and GDH注:M:蛋白分子量标准;1:对照E.coli BL21(DE3); 2、3:WX2全蛋白表达。
2.3重组菌发酵条件优化
菌株发酵条件优化是提高产物产量的一种有效方法。为了进一步提高羟基脂肪酸产量,采用单因素优化法分别对葡萄糖浓度、转化时间及反应体系pH进行了优化,发现在以10 g/L葡萄糖为碳源,转化时间15 h,pH7.5时重组菌具有最大产量,在此条件下,重组菌WX2在摇瓶条件下可产生173.9 mg/L羟基脂肪酸。
2.4GDH基因表达对羟基脂肪酸产量的影响
大肠杆菌转化葡萄糖生成HFAs过程会消耗NADPH,因此在HFAs的合成途径中引入葡萄糖脱氢酶,可以平衡菌体内还原力,增加HFAs产量。在上述基因成功表达的基础上,为验证GDH基因过表达对E.coli产量的促进作用,分别将重组菌WX1和WX2接种至M9基本培养基中,测定细胞HFAs产量的变化情况。结果表明:菌株WX2发酵后HFAs产量为173.9 mg/L,是原始菌株产量的1.5倍(图3)。这一结果证明在E.coli中表达葡萄糖脱氢酶后,对羟基脂肪酸产量有明显的促进作用,提高了E.coli羟基脂肪酸合成能力。
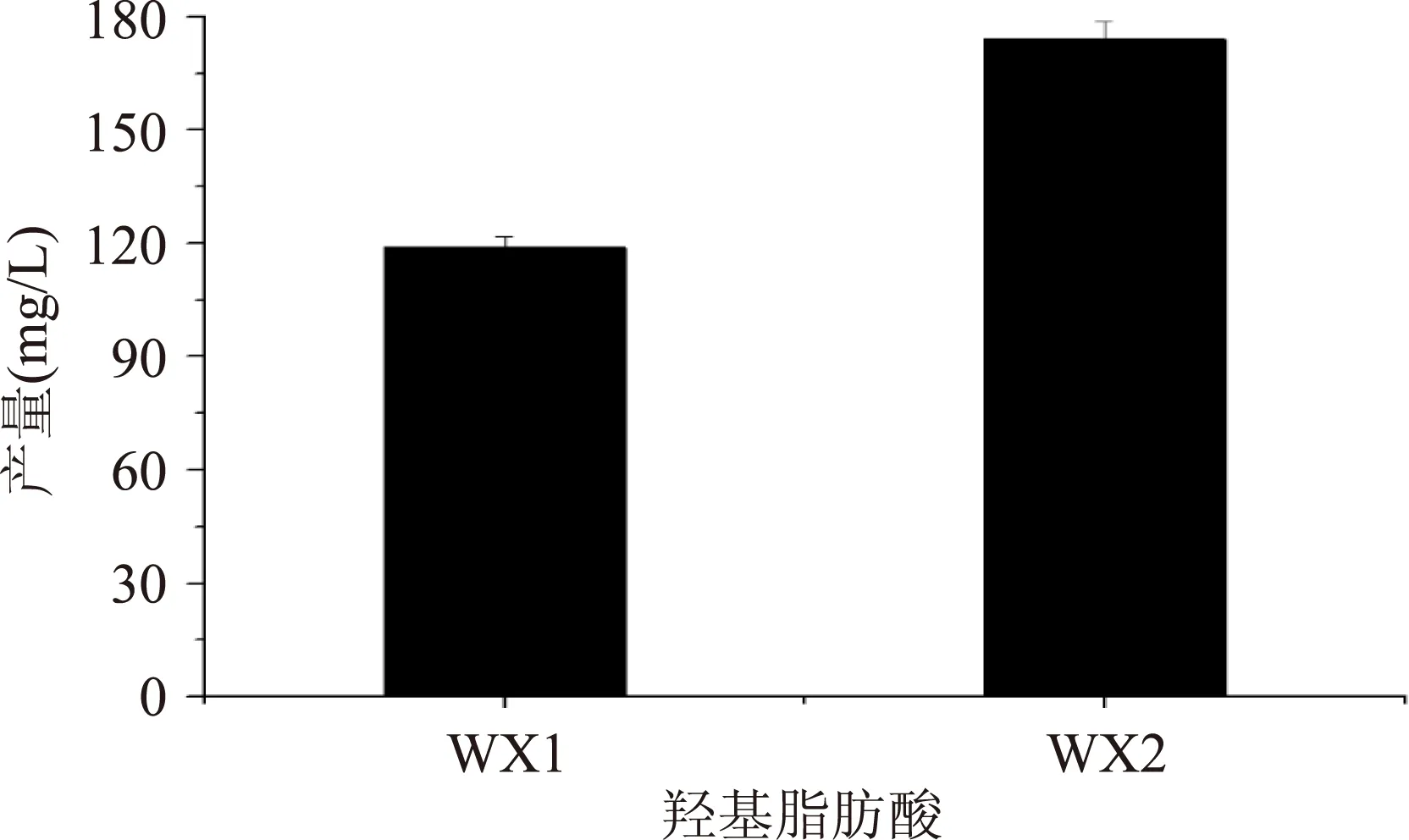
图3 不同菌株羟基脂肪酸产量比较Fig.3 The HFA production of WX1 and WX2 from glucose
2.5GDH基因表达对羟基脂肪酸组成的影响
为进一步验证GDH基因对羟基脂肪酸产物组成的影响,通过GC-MS方法对产物进行鉴定和定量分析,结果如图4所示。工程菌株WX1和WX2产物均含有6种羟基脂肪酸,分别为ω-(1-3)羟基十二酸和ω-(1-3)羟基十四酸。其中,ω-(1-3)羟基十二酸在两种工程菌种产物所占比例较少,含量在14.6%~17.5%之间,无明显差异。在菌株WX1和WX2的产物ω-(1-3)羟基十四酸中,ω-1-C14∶0在HFA总量中所占比例最高,分别为32.8%和34.3%;ω-2-C14∶0和ω-3-C14∶0在HFA中所占比例差别不大,分别为28.6%、24.0%和27.8%、22.9%。上述结果表明来源于巨大芽孢杆菌的GDH基因的过量表达仅影响HFA产量而不能改变羟基脂肪酸的种类和组成。
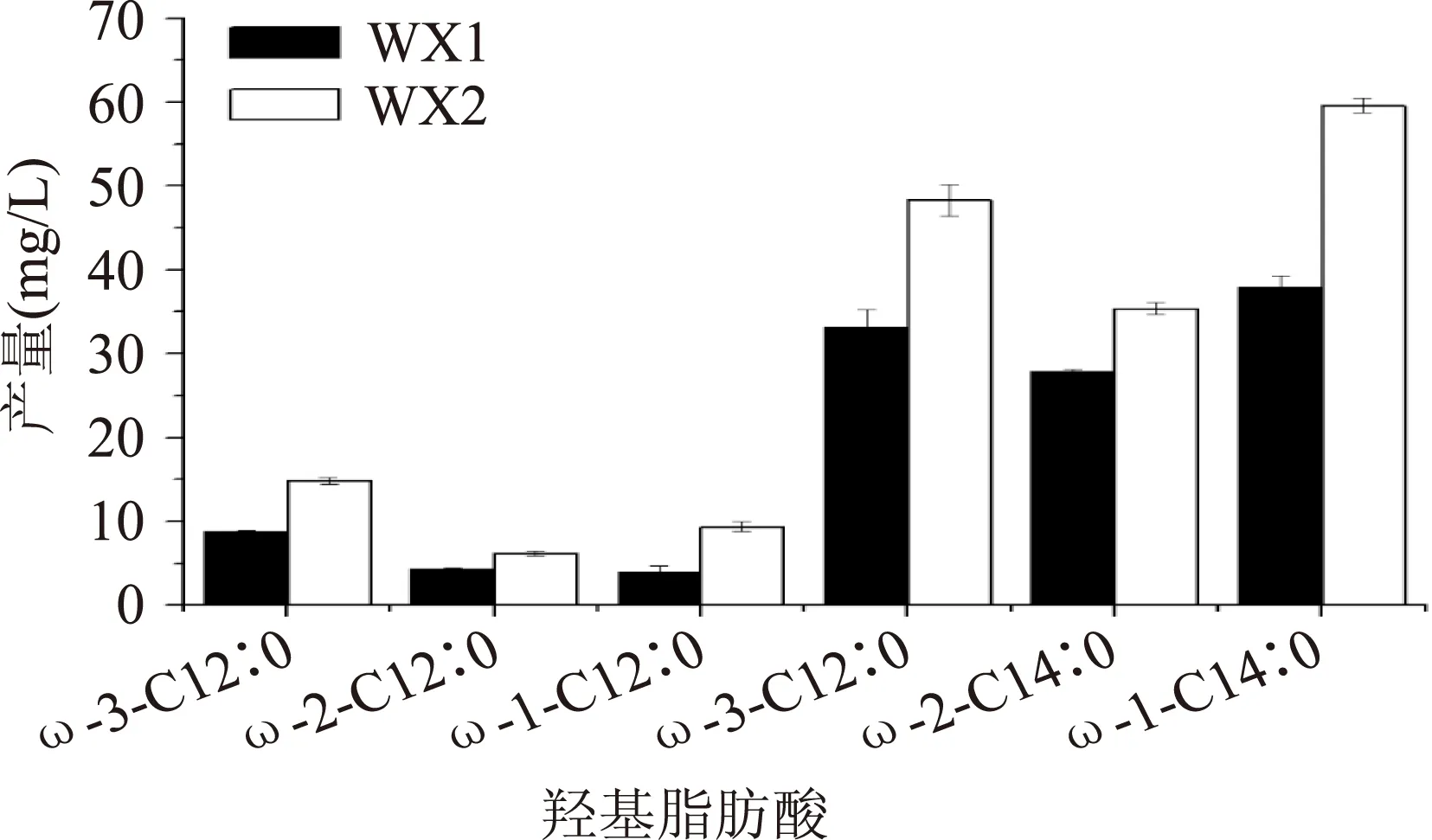
图4 菌株WX1和WX2产物分布Fig.4 The HFA composition of WX1 and WX2
3 结论与讨论
随着传统石化资源的日益枯竭,以生物基为原料,利用生物手段生产生物基化学品已成为近年的研究热点[14-16]。与酵母、霉菌等相比,大肠杆菌具有遗传背景清晰,易于工程调控,可高密度发酵及生长速度快等诸多优点,已成为微生物催化合成化学品和燃料的理想受体菌[17]。实验中构建的工程大肠杆菌能转化葡萄糖生产羟基脂肪酸,代表了羟基脂肪酸生物合成的一个新方向;本研究为解决合成过程中胞内辅酶再生问题,过量表达了来源于巨大芽孢杆菌的葡萄糖脱氢酶基因,以平衡细胞内还原力,经过发酵条件优化后,构建的工程菌株获得了173.9 mg/L羟基脂肪酸产量,相比之前报道的原始菌株有了近1.5倍的提高[6],代表了生物转化葡萄糖合成羟基脂肪酸的一个较高水平。相信在今后的研究中,通过寻找反应性更强的脱氢酶以及对E.coli进行进一步代谢工程改造,羟基脂肪酸产量有望得到进一步的改善和提高。同时需要指出的是,以葡萄糖为底物合成羟基脂肪酸目前研究较少,发酵产量也较低,现阶段还未有工业化生产的可能。本文的研究结果可为工业化生产提供一些理论依据。
[1]翁佩芳,吴祖芳. 脂肪酸微生物转化生产羟基脂肪酸的研究进展[J]. 中国粮油学报,2008,23(1):203-206.
[2]Kim K R,Oh D K. Production of hydroxy fatty acids by microbial fatty acid-hydroxylation enzymes[J]. Biotechnology advances,2013,31(8):1473-1485.
[3]Metzger J O. Fats and oils as renewable feedstock for chemistry[J]. European journal of lipid science and technology,2009,111(9):865-876.
[4]Liu C,Liu F,Cai J,et al. Polymers from fatty acids:poly(ω-hydroxyl tetradecanoic acid)synthesis and physico-mechanical studies[J]. Biomacromolecules,2011,12(9):3291
-3298.
[5]Yokota T,Watanabe A. Process for producing ω-hydroxy fatty acids[M]. Google Patents. 1993.
[6]Wang X,Li L,Zheng Y,et al. Biosynthesis of long chain hydroxyfatty acids from glucose by engineered Escherichia coli[J]. Bioresource Technology,2012,114:561-566.
[7]Bae J H,Park B G,Jung E,et al. fadD deletion and fadL overexpression in Escherichia coli increase hydroxy long-chain fatty acid productivity[J]. Applied microbiology and biotechnology,2014,98(21):8917-8925.
[8]Takeuchi M,Kishino S,Tanabe K,et al. Hydroxy fatty acid production byPediococcussp[J]. European Journal of Lipid Science and Technology,2013,115(4):386-393.
[9]Lu W,Ness J E,Xie W,et al. Biosynthesis of monomers for plastics from renewable oils[J]. Journal of the American Chemical Society,2010,132(43):15451-15455.
[10]Wallen L,Benedict R,Jackson R. The microbiological production of 10-hydroxystearic acid from oleic acid[J]. Archives of biochemistry and biophysics,1962,99(2):249-253.
[11]Kuo T M,Nakamura L K,Lanser A C. Conversion of fatty acids by Bacillus sphaericus-like organisms[J]. Current microbiology,2002,45(4):265-271.
[12]刘强,刘玉珍,刘东杰,等. 利用大肠杆菌工程菌株生物转化脂肪酸的初步研究[M]. 中国粮油学报,2013,28(7):41-45.
[13]Lu Y,Mei L. Co-expression of P450 BM3 and glucose dehydrogenase by recombinant Escherichia coli and its application in an NADPH-dependent indigo production system[J]. J Ind Microbiol Biotechnol,2007,34(3):247-253.
[14]Steen E J,Kang Y,Bokinsky G,et al. Microbial production of fatty-acid-derived fuels and chemicals from plant biomass[J]. Nature,2010,463(7280):559-562.
[15]Liu X,Brune D,Vermaas W,et al. Production and secretion of fatty acids in genetically engineered cyanobacteria[J]. Proceedings of the National Academy of Sciences,2010,107(29):1-6.
[16]Lu X,Vora H,Khosla C. Overproduction of free fatty acids in E. coli:implications for biodiesel production[J]. Metabolic engineering,2008,10(6):333-339.
[17]Chu B C,Lee H. Genetic improvement of Saccharomyces cerevisiae for xylose fermentation[J]. Biotechnology advances,2007,25(5):425-441.
Effect of overexpression of glucose dehydrogenase on hydroxyfatty acids production ofEscherichiacoli
WANG Xiang-wei,XING Xiang,MA Qing-lin
(Marine college of Shandong University(Weihai branch),Weihai 264209,China)
A metabolic pathway to synthesize hydroxyfatty acids(HFAs)from glucose was constructed. But the reducibility(NADPH)imbalance hampers its application. In order to increase the yield of HFAs,the glucose dehydrogenase(GDH)from Bacillus megaterium was cloned and a NADPH and HFAs co-product strains was built to solve the reducibility imbalance in cell. Under shake-flask conditions,this recombinant strain produced 173.9 mg/L HFAs. The research laid the foundation in industrial applications for obtaining engineered Escherichia coli to produce HFAs with high production.
hydroxyfatty acids;glucose dehydrogenase;genetic engineering;recombinantEscherichiacoli
2015-06-03
王相伟(1980-),男,博士,主要从事生物基化学品的相关研究,E-mail:wangxw@qibebt.ac.cn。
威海市科技发展计划(2014DXGJ40)。
TS201.3
A
1002-0306(2016)05-0163-04
10.13386/j.issn1002-0306.2016.05.023
