扩展青霉拮抗菌的选育及抑菌机制初探
2016-09-10付瑞敏邢文会张丽琴陈五岭
付瑞敏,邢文会,张 红,张丽琴,陈五岭
(1.河南教育学院,河南郑州 450046;2.西北大学 生命科学学院,陕西西安 710069)
扩展青霉拮抗菌的选育及抑菌机制初探
付瑞敏1,2,邢文会1,张红1,张丽琴1,陈五岭2,*
(1.河南教育学院,河南郑州 450046;2.西北大学 生命科学学院,陕西西安 710069)
为选育有效抑制扩展青霉(Penicilliumexpansum)的拮抗菌,并初步探讨其抑菌机制。从苹果表面分离到拮抗扩展青霉的菌株BA-16,经形态学、生理生化及16S rRNA基因序列分析,对该菌进行鉴定,并采用低能N+注入技术对其进行诱变选育。采用双酶反应体系检测野生株和突变株对扩展青霉分泌磷脂酶的抑制效果以检测突变效果并探究其抑菌机制。经鉴定,BA-16-8该菌被鉴定为解淀粉芽孢杆菌(Bacillusamyloliquefaciens)。低能N+注入技术诱变选育出的突变株BA-16-8抑菌性能显著提高且遗传性能稳定。磷脂酶活性结果显示,相对于野生株,突变株代谢产物可显著抑制病原菌所分泌的磷脂酶A的活性,且其抑制效果随浓度的增高而增强,故推测拮抗菌可能通过该机制起到抑制扩展青霉的作用。本研究对于苹果采后青霉病的生物防治具有良好应用开发前景。
扩展青霉,解淀粉芽胞杆菌,低能N+注入,磷脂酶A
苹果采摘后病害的感染会造成果实腐烂严重,给苹果种植业及副产品加工行业带来巨大的经济损失。其中,青霉病是苹果采摘后致其腐烂的重要病害之一,该病的有效防治成为苹果产业亟待解决的问题。研究表明,引起青霉病的主要致病菌是扩展青霉(Penicilliumexpansum)[1]。目前控制扩展青霉的主要方式仍是以化学杀菌剂和冷藏等物理手段为主,化学杀菌剂虽然能够有效控制病原菌扩展青霉的生长,但是随着病原菌抗药性能和人们健康环保意识的不断增强,化学防治方法已逐渐不被人们认可。诸如冷藏等物理方法虽然一定程度上可以阻止病原菌的生长但容易影响水果的风味和营养价值,且处理不当会造成冻害,此外,处理成本也相对较高。而采用拮抗性生物抑制病原菌生长从而达到水果防腐和保鲜的生物防治方法作为水果采摘后病害防治的新方法,不仅不会改变水果的营养和风味,还可以消除由于化学药剂对人体健康所造成的隐患,故近几年已成为水果防腐保鲜的研究热点。
近年来已经有不少关于苹果青霉病的生物防治的研究报道,采用的生物防治菌主要集中于生防酵母。Li 等人[2]研究了粘质红酵母防治苹果采后灰霉病和青霉病的机制,发现该酵母通过诱导苹果中过氧化物酶和多酚氧化酶的活性和高度抑制苹果脂质过氧化作用从而诱导苹果中防御机制依赖性酶的活化,此外,该酵母通过和病原菌的空间和营养竞争抑制病原菌生长。后来,人们陆续发现芽孢杆菌属的一些菌株可以抑制扩展青霉的生长。Lee[3]等人从盐生植物根际分离出枯草芽孢杆菌S16并研究了该菌对采摘后苹果和水蜜桃青霉病的生物防治作用,发现该菌可有效抑制扩展青霉的生长。磷脂酶A作为病原性真菌的致病因子,对于真菌在植物表面的定殖和入侵有重要辅助作用,有报道说明芽孢杆菌的代谢产物如丰原素等脂肽类产物可对磷脂酶A的活性产生影响[4]。
本实验室从苹果表面分离筛选到一株对扩展青霉具有拮抗作用的菌株BA-16,结合该菌株的形态特征、生理生化和分子系统发育等特征分析结果对其进行鉴定,并采用低能N+注入技术对其进行诱变,以期获得可有效拮抗青霉病的菌株,为日后将其应用于采摘后苹果青霉病的生物防治奠定理论基础。
1 材料与方法
1.1材料与仪器
致病菌扩展青霉(Penicilliumexpansum)陕西省微生物研究所惠赠,供试苹果采收于陕西洛川县。
N+离子注入机BNU-400中科院北京市辐射中心研制,N+离子能量为25 KeV,束流0.4 mA,真空度为5×10-3Pa。
1.2培养基
牛肉膏蛋白胨培养基(YEB)用于拮抗菌的培养[5]:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂15~20 g,水1000 mL,pH7.4~76.
PDA(马铃薯培养基)用于病原性真菌的培养[5]:马铃薯200 g,葡萄糖20 g,琼脂15~20 g,蒸馏水1000 mL,pH7.2.
摇瓶发酵培养基用于发酵拮抗菌胞外抗菌性脂肽蛋白[6]:葡萄糖20 g,L-谷氨酸钠5 g,MgSO40.5 g,KCl 0.5 g,KH2PO41 g,FeSO40.15 g,MnSO45 g,CuSO40.16 mg,蒸馏水1000 mL,pH7.2.
1.3细菌的分离、筛选
从感染青霉病苹果的果面分离菌株。用无菌水清洗苹果健康部位,将所得液体经过10-1~10-6的梯度稀释,将10-4、10-5、10-6梯度稀释液分别涂布在YEB平板上,37 ℃培养24 h。挑取各平板上的菌株分别进行纯化,得到单克隆,将其分别编号以作进一步研究。
采用平板对峙法[7]对分离菌株进行拮抗能力的筛选。以扩展青霉为指示菌,将待测菌株和病原菌接种于PDA平板上,病原菌接种于平板中央,待测菌株同病原菌间的距离为2.5 cm 28 ℃培养48 h观察其生长状况,并测量抑菌带宽度,实验均重复三次,挑取抑菌条带宽的菌株至YEB平板上,保存备用。
将初筛所得菌株接种于液体发酵培养基中,摇瓶震荡培养72 h(37 ℃,150 r/min)。参照韩欣宇等的方法[8]制备菌株无细胞发酵液,将所制的发酵液200 μL接入牛津杯中,采用牛津杯法[9]检测菌株无细胞发酵液拮抗扩展青霉的能力。28 ℃培养24 h后,测量记录牛津杯周围出现的抑菌圈直径,挑选直径最大的菌株做进一步研究。整个实验以无菌水作为对照,实验均重复三次。
1.4菌株的形态学与生理生化鉴定
将复筛所选菌株经染色、光学显微镜观察菌体个体及群体形态。参照《微生物学实验指导》[10]和《伯杰细菌鉴定手册》[11]就菌株的生理生化特征进行初步鉴定。
1.516S rRNA基因序列分析
提取菌株的总基因组DNA为模板[12],利用细菌16S rRNA基因的通用引物27F(5′-AGAGTTTGATCATGGCTCAG-3′)和1492R(5′-CTACGGTTACCTT GTTACGAC-3′)进行PCR扩增[12]。PCR反应体系25 μL,热循环参数如下:94 ℃预变性3 min,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,循环30次,72 ℃延伸10 min。所得PCR产物经回收纯化后提交至上海生工进行测序,测序结果与NCBI数据库中相关菌种的16S rRNA基因序列用BLAST程序进行比对分析,利用MEGA4.1构建系统发育树[13]。
1.6高效拮抗菌的低能N+注入诱变选育
1.6.1样品处理以复筛所得的菌株为出发菌株,将其转接至新鲜斜面并培养24 h后,用5 mL的生理盐水清洗斜面菌苔,并将其倒入含有玻璃珠的锥形瓶内,充分振荡后,采用分光光度计法测量其600 nm处的光吸收值,调整菌悬液浓度至OD600=0.986,此时菌悬液浓度为108cfu/mL。用微量移液器吸取0.1 mL菌悬液将其接种于90 mm的无菌平皿中,无菌条件下涂布均匀并风干制成菌膜[14]。
1.6.2离子注入将待处理平皿置于离子注入室,打开皿盖,室内抽真空,注入能量为25 KeV的低能,N+离子束,注入剂量分别为1×1015、1.5×1015、2.0×1015、2.5×1015、3.0×1015ions/cm2。
1.6.3突变株的筛选用无菌生理盐水1 mL冲洗离子注入后的平板,将所得液体进行梯度稀释到10-5、10-6和10-7,分别取各稀释的菌悬液0.1 mL将其接种于YEB平板上,37 ℃培养48 h,观察所得突变株的菌落形态并进行菌落计数。
1.6.4计算存活率与正变率将突变株的发酵液接种于PDA平板上,采用牛津杯法检测各突变株抗扩展青霉能力,规定抑菌圈直径大于出发菌株的为正变株,参照下列公式计算存活率与正变率:
存活率(%)=诱变后的活菌数/诱变前的活菌×100
正变率(%)=正突变的菌株数/诱变后的活菌×100
1.7正变株的筛选及遗传稳定性检测
选取抑菌圈直径较大的突变株,将其转接至YEB平板上,37 ℃培养24 h,作为第一代,后每隔24 h传一代,每代均随机选取3个克隆采用牛津杯法检测其无细胞发酵液抗扩展青霉的活性,进行遗传稳定性检测。
1.8扩展青霉菌丝分泌的磷脂酶的提取
将培养了48 h的病原菌扩展青霉培养液10000 g离心10 min,去除菌丝体,所得上清液用70%的饱和硫酸铵沉淀,而后10000×g离心5 min,取沉淀,用磷脂酶A提取液溶解,透析后所得产物即为磷脂酶A粗品。
1.9磷脂酶活性的测定
磷脂酶活力测定参照参考文献[17],具体采用双酶体系:1,2-二亚油酰基卵磷脂10 μL,Tris-Hcl 125 μL,大豆氧合酶5 μL,脱氧胆酸钠溶液50 μL,磷脂酶A粗提液10 μL。双酶反应的基本原理是:以1,2-二亚油酰基卵磷脂为第磷脂酶A的底物,反应后生成亚油酸,亚油酸由脂氧合酶催化发生氧化反应,生成氢过氧化物,其对应的紫外吸收光谱在234 nm有吸收峰,单位时间内(1 h),该波长下的吸光值每增加0.1即为1个酶活力单位。
1.10拮抗菌发酵液对病原菌分泌磷脂酶A的影响
将野生型BA-16和突变株BA-16-8的发酵24 h的菌株发酵液10000×g离心10 min,取上清,用超滤管过滤后即为无细胞发酵液,将所得无细胞发酵液分别做梯度稀释,将不同稀释度的无细胞发酵液分别定量加入双酶反应体系中,各自反应1 h,通过测定各体系在234 nm处的吸光值,以不加无细胞发酵液的磷脂酶反应吸光值为100,通过所得值与其的比值来衡量各稀释度无细胞发酵液作用下的磷脂酶活性。
2 结果与分析
2.1扩展青霉拮抗菌株的分离和筛选
经过初筛从苹果表面分离获得18株菌,其中酵母4株,细菌14株。通过平板对峙实验,筛选出可拮抗扩展青霉的6株。采用牛津杯法检测六株菌的无细胞发酵液抗扩展青霉活性,结果如表1所示。结果表明:六株菌的菌株细胞和无细胞发酵液拮抗扩展青霉的效果表现出了显著的差异。其中,BA-16的拮抗效果最强,故将其挑选出来做后续研究。

表1 扩展青霉拮抗菌筛选结果Table 1 The screening results of antagonistic strains against Penicillium expansum
2.2扩展青霉拮抗菌株的形态学与生理生化鉴定
菌株BA-16经革兰氏染色阳性,显微镜镜检为杆菌,有芽孢,有荚膜,具有运动性。该菌株在LB平板上形成乳白色菌落。菌落边缘不整齐,干燥不透明,中间有凸起。生理生化结果见表2。
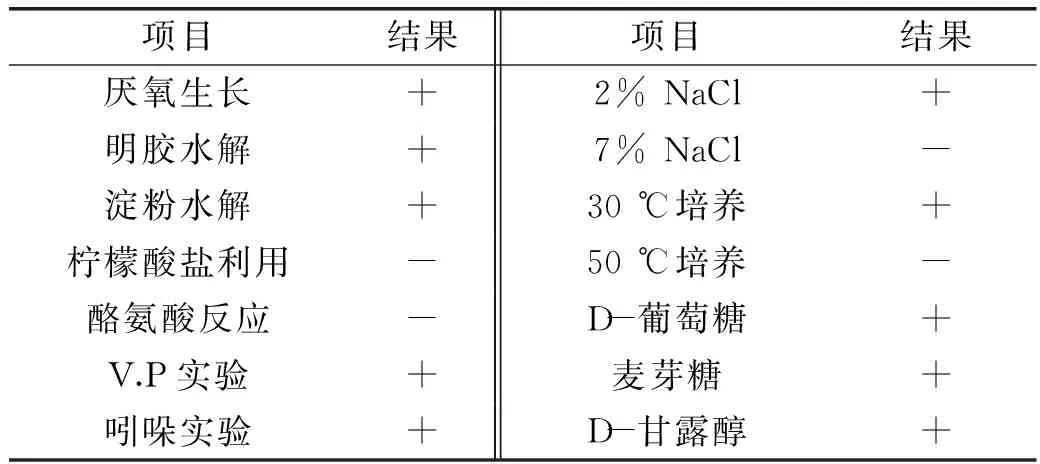
表2 菌株BA-16的生理生化特征Table 2 Characteristics of physiology and biochemistry of BA-16 strains
注:+/-表示在生理生化鉴定中阳性/阴性反应。+:阳性;-:阴性。
参照《常见细菌系统鉴定手册》和《伯杰氏细菌鉴定手册》,结合菌株BA-16的形态、染色及生理生化特征,可将该菌株初步鉴定为解淀粉芽孢杆菌(Bacillusamyloliquefaciens)。
2.316S rRNA 基因序列分析
提取菌株BA-16的总DNA进行PCR扩增,凝胶电泳回收扩增序列,得到一段1468 bp长度的16S rRNA基因,所获序列提交至GenBank,登录号No.KR31430。将其同GenBank中相近种属进行BLAST比对,对BLAST结果进行分析,通过MEGA 4.1软件构建系统发育树(图1)。发现菌株BA-16与BacillusamyloliquefaciensAY603658的相似性达到99%,结合上述的生理生化鉴定结果,可将菌株BA-16最终鉴定为解淀粉芽孢杆菌(Bacillusamyloliquefaciens)。
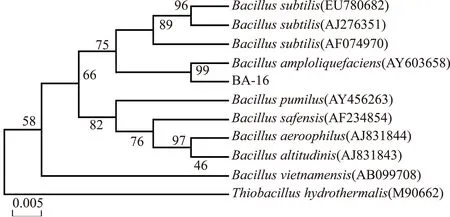
图1 菌株BA-16 16SrRNA基因序列发育进化树Fig.1 Phylogenetic tree of 16s rRNA gene sequences of isolated strain BA-16
2.4离子注入诱变结果
2.4.1最佳诱变剂量的确定采用低能N+注入诱变BA-16,野生株在该离子能量作用下发生突变,不同注入剂量对菌株的存活率和正变率影响如图2所示。
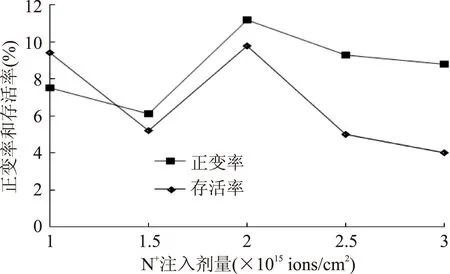
图2 不同N+注入剂量对突变株的影响Fig.2 The effect of different does of N+ implantation on mutants
由图中可以看出,一定范围内,高剂量的离子注入可导致菌株正突变率的增加,同时也会导致菌株存活率的下降,一般认为,诱变菌株存活率在10%~20%,所得菌株正变率相对较高[15]。本实验中,注入剂量在1×1015ions/cm2和2×1015ions/cm2时存活率接近该范围,而后者的正变率远高于前者,综合考虑,以2×1015ions/cm2注入剂量为最佳诱变剂量。
研究发现,刚开始注入离子时,存活率急剧下降和正变率有所上升。推测其原因是带能的氮离子最初作用于菌体细胞,可导致菌体细胞损伤从而导致存活率下降;同时,能量在胞内的积累也可导致菌体发生突变,故正变率有所上升。而当注入剂量到达一定值(1.5×1015ions/cm2)时,本来下降的存活率有了回升,而后又继续下降。推测其原因可能是当离子注入剂量达到一定程度,可通过作用于菌体细胞DNA而激活其修复机制,因而一直下降的存活率会有少量回升。而当离子注入剂量进一步加大,所致损伤已无法修复,故存活率又进一步下降。
2.4.2BA-16突变株的筛选及遗传稳定性分析采用不同剂量的N+注入共筛选出8 株抗扩展青霉高于野生株解淀粉芽孢杆菌BA-16的正突变株,分别对这8 株突变株进行平板对峙实验和牛津杯实验,结果如表3所示。选取抑菌带宽和抑菌圈直径在12以上的2 株突变型菌株:amyloliquefaciensBA-16-7和BacillusamyloliquefaciensBA-16-8进行传代培养,并通过牛津杯法检测各代拮抗病原菌的遗传稳定性,结果如表4所示。
由表4可知,经过传代,突变株BA-16-8抗菌性能差异不显著,说明该突变株的遗传稳定性较好,而BA-16-7的抗菌能力在不同世代差异显著且呈现逐渐下降的趋势,说明该突变株的遗传稳定性较差,菌株退化较为严重。故选取突变株BA-16-8进行后续研究。
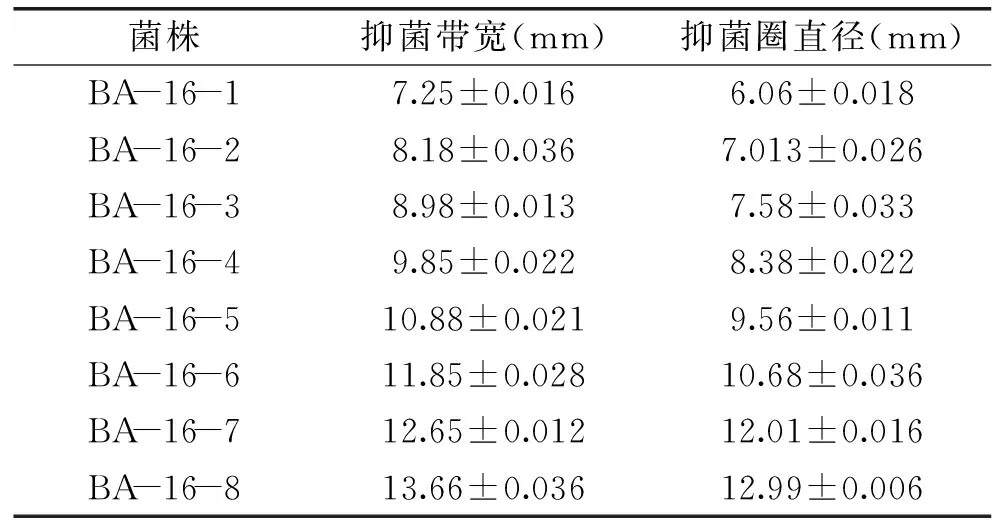
表3 突变株抗扩展青霉筛选结果Table 3 The screening results of mutants against Penicillium expansum
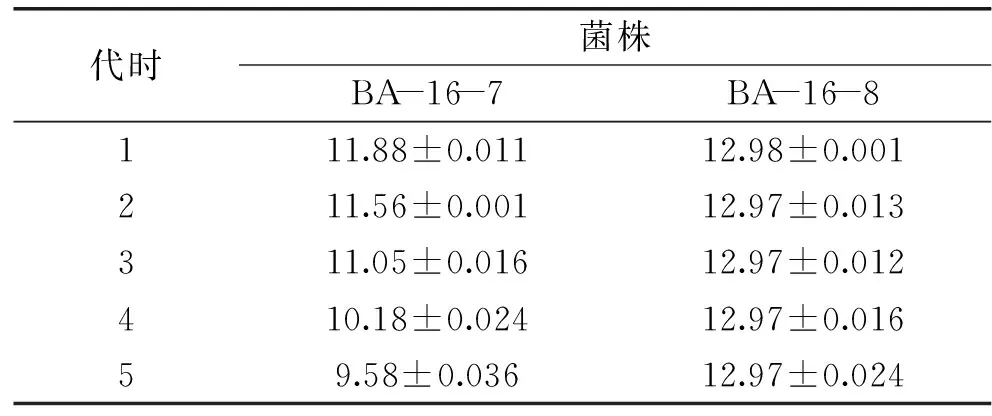
表4 突变株拮抗扩展青霉的遗传稳定性分析结果Table 4 The Results of genetic stability analysis of mutants against Penicillium expansum
2.5磷脂酶A抑制实验
将拮抗菌的野生株和突变株的无细胞发酵液分别以不同梯度稀释度的浓度定量加入磷脂酶反应体系中,测定其酶活力比值,所得结果如图3所示,随着发酵液浓度的减少,所测得病原菌产磷脂酶A的活性直线上升,说明病原菌所产磷脂酶活受拮抗菌无细胞发酵液的抑制,且通过对比突变株和野生株的无细胞发酵液的抑制效果,发现突变株抑制效果显著优于野生株,当用突变株的发酵液原液处理病原菌时,其磷脂酶A活性几乎完全被抑制。
据报道,芽孢杆菌代谢产物如丰原素等可抑制磷脂酶A的活性,本研究中,发现拮抗菌代谢产物对病原菌所产磷脂酶A有抑制作用,且抑制作用随浓度变化而变化,这一定程度上与前人报道结论是一致的[17-18],此外,由于磷脂酶A在病原菌侵染和定殖中起重要作用,因此,拮抗菌代谢产物对磷脂酶的抑制可缓解或阻止作物被病原菌感染的进程。此外,研究发现,与野生株相比,突变株对磷脂酶A的抑制作用要更明显,这说明在诱变过程中突变株的代谢产物比如一些脂肽类抗生素的表达量有了增加,这种猜测将在进一步的研究中加以验证。

图3 不同浓度拮抗菌发酵液 对扩展青霉分泌的磷脂酶A活性影响 Fig.3 Effects of fermentation broth in different concentration on the activity of PLA secreted by Penicillium expansum
3 结论
本研究主要针对苹果采摘后主要致病菌扩展青霉,从苹果表面分离筛选出一株可有效拮抗扩展青霉的细菌BA-16,经鉴定,该菌为解淀粉芽孢杆菌(Bacillusamyloliquefaciens)为进一步提高菌株BA-16防治扩展青霉的能力,我们采用低能N+注入技术对其进行诱变。并研究了不同注入剂量对突变株存活率和正变率的影响。结果显示,2×1015ions/cm2注入剂量为最佳诱变剂量。通过检测突变株的菌体细胞和无细胞发酵液拮抗扩展青霉的能力,筛选出抗菌性能最强且遗传性能稳定的突变株BA-16-8。将所得突变株和野生株的菌悬液和无细胞发酵液分别处理病原菌并检测其对病原菌分泌磷脂酶A活性的影响,结果显示,野生株和突变株均可不同程度地抑制病原菌所分泌磷脂酶的活性,其中突变株的抑制能力要明显高于野生株,此外,随着发酵液浓度的降低其抑制力也逐渐下降,说明,病原菌的代谢产物中有部分物质比如Fengycin可影响磷脂酶A的活性,本研究结果有待进一步实验加以证实。
[1]Zhao L,Zhang H,Lin H,et al. Effect of trehalose on the biocontrol efficacy of pichia caribbica against post-harvest grey mould and blue mould decay of apples[J]. Pest management science,2013,69(1):983-989.
[2]Li R,Zhang H,Liu W,et al. Biocontrol of postharvest gray and blue mold decay of apples with rhodotorula mucilaginosa and possible mechanisms of action[J]. International Journal of Food Microbiology,2011,146(1):151-156.
[3]Hong P,Hao W,Luo J,et al. Combination of hot water,bacillus amyloliquefaciens hf-01 and sodium bicarbonate treatments to control postharvest decay of mandarin fruit[J]. Postharvest Biol Tec,2014,88(1):96-102.
[4]David HE,Tania CS. Hexadecylphosphocholine(Miltefosine)has broad-spectrum fungicidal activity and is efficacious in a mouse model of cryptococcosis[J]. Antimicrob Agents Chemother,
2006,50(2):414-421.
[5]Afsharmanesh H,Ahmadzadeh M,Javan-Nikkhah M,et al. Improvement in biocontrol activity of bacillus subtilis utb1 against aspergillus flavus using gamma-irradiation[J].Crop Protection,2014,60(2):83-92.
[6]姚磊,徐良雄,薛璟花,等. 枝顶孢属真菌的抑菌活性及其代谢产物研究[J]. 热带亚热带植物学报,2012,20(1):192-196.
[7]刘雪,叶婧,穆长青,等. 枯草芽孢杆菌 b-332 菌株发酵条件的研究[J]. 农业科学与技术:英文版,2013,12(1):81-85.
[8]韩立荣,张华姣,高保卫,等. 放线菌 11-3-1 对油菜菌核病的防治作用与菌株鉴定[J]. 植物保护学报,2012,39(1):97-102.
[9]韩欣宇,陈志厚,罗定棋,等. Tpb55菌株发酵液中活性代谢产物的抑菌作用及稳定性测定[J]. 中国农学通报,2012,28(1):260-264.
[10]韦婉,李少英,王梦姣,等. 益生乳酸菌对氟喹诺酮类药物的敏感性检测方法的研究[J]. 食品科技,2013,10(1):22-26.
[11]黄文芳,张松. 微生物学实验指导[M]. 暨南大学出版社:2003.
[12]布坎南,吉本斯. 伯杰细菌鉴定手册,第八版[M],北京:科学出版社:1984.
[13]孙卓,杨利民. 人参病原菌拮抗细菌的分离筛选与鉴定[J]. 植物保护学报,2015,10(1):79-86.
[15]蒋益,郑惠华,刘广建,等. 低能 N+离子注入诱变选育云芝高产抗病菌株的研究[J]. 食用菌,2014,36(1):18-20.
[16]张瑞,周俊,王舒雅,等. 产 γ-聚谷氨酸菌株的诱变选育及其种子液工艺优化[J]. 生物加工过程,2015,13(1):47-53.
[17]Ivanovska N. Phospholipases as a factor of pathogenicity in microorganisms[J]. Journal of Molecular Catalysis B:Enzymatic,2003(22):357-361.
[18]Ganendren R,Widmer F,Singhal V,et al.Invitroantifungal activities of inhibitors of phospholipases from the fungal pathogen cryptococcus neoformans[J]. Antimicrob Agents Chemother,2004(48):1561-1569.
Breeding of antagonistic bacteria againstPenicilliumexpansumand study on its inhibition mechanism
FU Rui-min1,2,XING Wen-hui1,ZHANG Hong1,ZHANG Li-qin1,CHEN Wu-ling2,*
(1.Henan Institute of Education,Zhengzhou 450046,China;2.Northwest University,Xi’an 710069,China)
To breed the antagonistic strain which can inhibitPenicilliumexpansumeffectively,and discuss its antibacterial mechanism preliminarily. An antagonistic strain BA-16,which could inhibitPenicilliumexpansum,was isolated from apple surface and identified based on phenotypic,physiological,biochemical and phylogenetic(16S rDNA)studies. In order to enhance its antagonistic capability,the mutation of BA-16 was carried out by using low energy N+implantation. Double enzyme reaction system was used to detect the phospholipase A(PLA)activity ofPenicilliumexpansumunder the action of wild-type antagonistic strain and its mutant. The strain BA-16 was identified as Bacillus amyloliquefaciens. After the low energy N+implantation,the mutant BA-16-8,which showed the strongest antagonist capability and stable hereditary stability was selected out. In phospholipase activity detection,mutant showed stronger inhibition against PLA activity secreted byPenicilliumexpansumthan its wild-type strain. Moreover,as the concentration of fermentation broth increased,the inhibition effect enhanced,which indicated that it was possibly the inhibitory mechanism of antagonistic strain againstPenicilliumexpansum. The mutant BA-16-8 will be a potential biological control agent against apple blue mold decay.
Penicilliumexpansum;Bacillus amyloliquefaciens;low energy N+implantation;phospholipase A
2015-04-27
付瑞敏(1981-),女,在读博士,讲师,主要从事农业及食品微生物研究,E-mail:angelaminmin@163.com。
陈五岭(1954-),男,硕士,教授,主要从事农业、环境及食品微生物研究,E-mail:wulingchen@yeah.net。
农业部科技成果与转化项目(2012GB2G000451);河南省科技计划项目(132102310253);河南省高等学校重点科研项目(15B180002);陕西省重大科技创新项目(2009ZKC04-16);河南教育学院青年科研课题项目(20100103);河南省基础与前沿技术研究(152300410092)。
TS201.3
B
1002-0306(2016)05-0154-05
10.13386/j.issn1002-0306.2016.05.021
