山杏花总黄酮抗氧化活性及其对酪氨酸酶抑制作用的研究
2016-09-10宁亚萍董施彬李建霞张乔会董洁琼王建中
宁亚萍,董施彬,李建霞,杨 喆,张乔会,董洁琼,王建中
(林业食品加工与安全北京市重点实验室,生物科学与技术学院,北京林业大学,北京 100083)
山杏花总黄酮抗氧化活性及其对酪氨酸酶抑制作用的研究
宁亚萍,董施彬,李建霞,杨喆,张乔会,董洁琼,王建中*
(林业食品加工与安全北京市重点实验室,生物科学与技术学院,北京林业大学,北京 100083)
利用闪式提取法提取山杏花总黄酮,并以X-5大孔树脂进行分离。通过测定分离前后山杏花总黄酮对DPPH自由基、羟基自由基的清除能力,总还原能力和总抗氧化能力,评价了其抗氧化活性;通过测定酪氨酸酶催化L-多巴氧化速率,以VC和β-熊果苷为阳性对照,研究了分离前后山杏花总黄酮对体外酪氨酸酶活性的抑制作用。结果表明,分离前后山杏花总黄酮均具有一定的抗氧化活性,且分离后抗氧化活性得到明显提高;分离前后山杏花总黄酮对酪氨酸酶的抑制能力均强于β-熊果苷弱于VC,其IC50值分别为2.24、3.08 mg/mL。综上所述,分离前后山杏花总黄酮均具有一定的抗氧化活性,且能有效抑制酪氨酸酶的活性。
山杏花总黄酮,抗氧化活性,酪氨酸酶,抑制作用
山杏又称西伯利亚杏(Siberianapricot),蔷薇科杏属植物。山杏在我国分布范围较广,作为山杏附属资源的山杏花,资源丰富[1]。但是,目前由于对山杏花的开发利用研究较少,造成了山杏花资源的极大浪费。
自由基可引起机体衰老,与人体的一些重大疾病例如癌症等有一定的相关性[2-3]。天然植物中的提取物例如茶多酚、黄酮类物质具有良好的抗氧化性,与传统的化学合成的抗氧化剂相比,安全性更高[4],因此具有良好的开发前景。酪氨酸酶在黑色素的合成过程中起着关键性的作用,酪氨酸酶抑制剂可以通过抑制酪氨酸酶活性预防和治疗黑色素瘤、色素沉着等,在医药、化妆品和食品工业等领域有着广阔的应用前景[5-6]。刘杰超等[7]以L-酪氨酸和L-多巴作为酶促反应底物研究了桃花甲醇提取物对酪氨酸酶的抑制作用,研究表明桃花甲醇提取物中总黄酮含量为92.28 mg/g,提取物对酪氨酸酶单酚酶和二酚酶活性IC50分别为0.057,0.030 g/L。任红荣等[8]以L-酪氨酸为底物测定了香水莲花水提物、醇提物及总黄酮提取物对酪氨酸酶的抑制率,结果表明总黄酮提取物抑制作用最强。
本文旨在研究山杏花总黄酮的抗氧化活性以及对酪氨酸酶活性的抑制作用,为山杏花在保健食品、医药、化妆品领域的开发利用提供理论基础,为山杏花资源的开发拓宽思路。
1 材料与方法
1.1材料与仪器
山杏花(采于内蒙古包头);1,1-二苯基-2-苦肼基(1,1-dipheny1-2-picrylhydrazyl,DPPH),Alfa Aesar公司;羟自由基测定试剂盒南京建成生物工程研究所;2,2-联氮-二(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2′-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)北京科百奥生物技术有限公司;酪氨酸酶(25 ku),Worthington公司;磷酸氢二钠、磷酸二氢钠、铁氰化钾、三氯乙酸、三氯化铁、过硫酸钾、无水乙醇,均为分析纯北京科百奥生物技术有限公司;X-5大孔树脂北京科百奥生物技术有限公司;L-多巴,熊果苷,抗坏血酸北京科百奥生物技术有限公司;芦丁标准品国药集团化学试剂有限公司。
JHBE-50S 闪式提取控制器北京金鼐科技发展有限公司;SHZ-D(III)循环水式多用真空泵上海振捷实验设备有限公司;SCIENTZ-12N 冷冻干燥机宁波新芝生物科技股份有限公司;FA2004电子天平上海上平仪器有限公司;紫外可见分光光度计北京普析通用仪器有限责任公司;R-210 旋转蒸发仪上海申顺生物科技有限公司;pHSJ-3F pH计上海泸西分析仪器。
1.2实验方法
1.2.1山杏花的脱脂预处理将山杏花置于30 ℃的鼓风干燥箱中干燥至恒重,经粉碎机粉碎后60目过筛,用石油醚进行索氏抽提,除去其中的油脂和部分色素,自然晾干,于4 ℃冰箱中密封保存,备用。
1.2.2山杏花总黄酮粗提物的制备运用闪式提取器按照液料比100∶1 mL/g,乙醇体积分数76%,闪提温度67 ℃,闪提时间5 min的工艺条件对经预处理的山杏花进行提取得到粗提液,过滤,旋蒸浓缩至水相,冷冻干燥得到山杏花总黄酮粗提物。
1.2.3山杏花总黄酮粗提物的分离利用X-5大孔树脂分离1.2.2得到的粗提物,工艺条件为上样流速1 mL/min、pH2、质量浓度0.7 mg/mL的样品水溶液上样,5 BV水洗和5 BV的95%乙醇溶液以2 mL/min洗脱。洗脱液经旋蒸浓缩至水相,冷冻干燥得到经分离后的粉末状供试样品,简称为山杏花总黄酮提取物。
1.2.4黄酮含量的测定参考文献[9],以芦丁为标准品,采用NaNO2-Al(NO3)3-NaOH法测定并计算粗提物及经分离后提取物中总黄酮的含量。
1.2.5山杏花总黄酮清除DPPH自由基的测定称取5.0 mg粗提物、总黄酮提取物、VC和芦丁,分别用70%乙醇定容至25 mL容量瓶中,配制成0.2 mg/mL的母液,然后用70%乙醇稀释成10、20、30、40、60、80 μg/mL的测定液。
参考崔洁等的方法[10],每个样品重复测定3次,取平均值。
1.2.6山杏花总黄酮清除羟基自由基(·OH)的测定称取50.0 mg粗提物、总黄酮提取物和VC,分别用蒸馏水定容至25 mL容量瓶中,配制成2.0 mg/mL的母液,再用蒸馏水稀释成0.2、0.4、0.6、0.8、1.0、1.2 mg/mL的测定液。
测定方法:按照羟自由基测定试剂盒说明书操作,在550 nm波长处测定各管吸光度。以VC作为对照。加入测定液体积为0.2 mL。每个样品重复测定3次,取平均值。
1.2.7山杏花总黄酮总还原力的测定称取12.5 mg粗提物、总黄酮提取物和VC,分别用蒸馏水定容至25 mL容量瓶中,配制成0.5 mg/mL的母液,再用蒸馏水稀释成20、60、100、140、180、220 μg/mL的测定液。分别取1 mL不同浓度的测定液于10 mL离心管中,加入2 mL磷酸盐(PBS)缓冲液(0. 2 mol/L,pH6. 6)和2 mL 1%铁氰化钾溶液,混匀,50 ℃水浴20 min,加入2 mL10%三氯乙酸溶液,混匀,迅速冷却。然后取2 mL上述混合液于10 mL离心管中,加入2 mL蒸馏水和0. 4 mL 0. 1%的三氯化铁溶液,混匀,在700 nm处测定其吸光度(A700)。以A700表示测定样品的还原能力,以蒸馏水为空白,每个样品重复测定3次,取平均值[11-12]。吸光度越高,说明还原力越强,则抗氧化性越强[13]。
1.2.8ABTS法测定山杏花总黄酮总抗氧化能力称取12.5 mg粗提物、总黄酮提取物和VC,分别用70%乙醇定容至25 mL容量瓶中,配制成0.5 mg/mL的母液,再用70%乙醇稀释成所需浓度梯度的测定液。
ABTS工作液的配制:称取0.0384 g ABTS,蒸馏水定容到10 mL容量瓶;称取0.0331 g过硫酸钾,蒸馏水定容到50 mL容量瓶;取适量上述两种溶液等体积混合,避光放置14 h;取混合液(混合液现配现用),加无水乙醇稀释至其在734 nm处测得的吸光度为0.70±0.02即可使用。
测定方法:取1.0 mL不同浓度的测定液于10 mL离心管中,加4.0 mL ABTS工作液,充分振荡,室温静置6 min,在734 nm测量吸光度。以无水乙醇作为空白,以VC作阳性对照,每个样品重复测定3次,取平均值[14-15]。公式如下:
清除率(%)=(1-A1/A0)×100
式中:A0为空白样的吸光度;A1为测定样的吸光度。
1.2.9山杏花总黄酮对酪氨酸酶的抑制作用酪氨酸酶活力以催化L-多巴氧化反应生成多巴醌的二酚酶活力来衡量,以β-熊果苷和VC作阳性对照。称取100.0 mg的粗提物、总黄酮提取物和VC,分别用蒸馏水定容至10 mL容量瓶中,配制成10.0 mg/mL的母液,再用蒸馏水稀释成所需浓度梯度的测定液。β-熊果苷用无水乙醇溶解配制成10.0 mg/mL的母液,用蒸馏水稀释成所需浓度梯度。L-多巴和酪氨酸酶均用磷酸盐(PBS)缓冲液(0. 2 mol/L,pH6. 8)溶解,分别配制成1.0 mg/mL和186 U/mL。按照表1进行操作:

表1 实验操作表Table 1 Experimental operation table
30 ℃水浴10 min后,加入0.2 mL酪氨酸酶溶液,静置反应1 min,迅速转移至比色皿中在475 nm处测吸光度值[16-17]。计算公式如下:
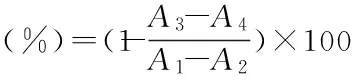
式中,A1、A2、A3、A4分别为实验组1、2、3、4反应体系的吸光度。
1.2.10IC50的计算IC50是指清除率为50%时所需的样品浓度。根据实验计算得到的清除率,运用SPSS17.0软件处理,计算样品的半数清除浓度(IC50)。
1.3数据处理与统计分析
采用Excel2007和SPSS17.0统计软件进行数据分析。
2 结果与分析
2.1粗提物与分离后得到的总黄酮提取物中的总黄酮含量
芦丁标准品的质量浓度(c,mg/mL)与吸光值(A)的回归方程为A=11.929c-0.0059(R2=0.9992)。
根据测定及计算结果可知,1g粗提物中总黄酮含量为0.29g(RSD=1.26%),1g经分离后得到的总黄酮提取物中总黄酮含量为0.93g(RSD=1.92%)。
2.2山杏花总黄酮抗氧化结果分析
2.2.1对DPPH自由基的清除能力测定结果DPPH自由基是一种稳定的以氮为中心的质子自由基,其乙醇溶液在517nm处有强烈吸收。自由基清除剂能提供一个电子与DPPH的孤对电子配对使其褪色,褪色程度与其接受的电子呈定量关系[18]。
由图1可知,分离前后山杏花总黄酮均有一定的清除DPPH自由基的能力。分离前后山杏花总黄酮清除DPPH·的能力均随质量浓度的增大而增强,且在10~60μg/mL的范围内具有一定的线性关系。当质量浓度为60μg/mL时,纯化后的山杏花总黄酮对DPPH·的清除率已达到90.18%。分离后的山杏花总黄酮在质量浓度大于60μg/mL时,对DPPH·的清除能力与VC相接近。分离前后山杏花总黄酮清除DPPH自由基的IC50值分别为71.35、22.10μg/mL,VC的IC50值为10.09μg/mL。可知经过分离,山杏花总黄酮清除DPPH自由基的能力得到了明显提高,其具有较强的清除DPPH·的能力。

图1 分离前后山杏花总黄酮清除DPPH自由基的能力Fig.1 The scavenging effect of separated and unseparated total flavonoids from Siberian apricot flowers on DPPH·
2.2.2对羟基自由基(·OH)的清除能力测定结果从图2可以看出,在0.2~1.2 mg/mL的范围内,VC、分离前后的山杏花总黄酮对·OH的清除率随质量浓度的增大不断增大,在0.2~0.6 mg/mL范围内上升较快。在0.6~1.2 mg/mL的范围内随质量浓度的增大,分离前后山杏花总黄酮对·OH的清除率之间的差异逐渐减小。当质量浓度为1.2 mg/mL时,分离前后山杏总黄酮的清除率分别达到80.88%、85.66%,其清除·OH的IC50值分别为0.48、0.27 mg/mL,VC的IC50值为0.24 mg/mL。说明分离前后山杏花总黄酮都具有较强的清除·OH的能力,且分离后的山杏花总黄酮的清除能力得到了很大提高,且IC50值与VC相近,但两者均弱于VC。
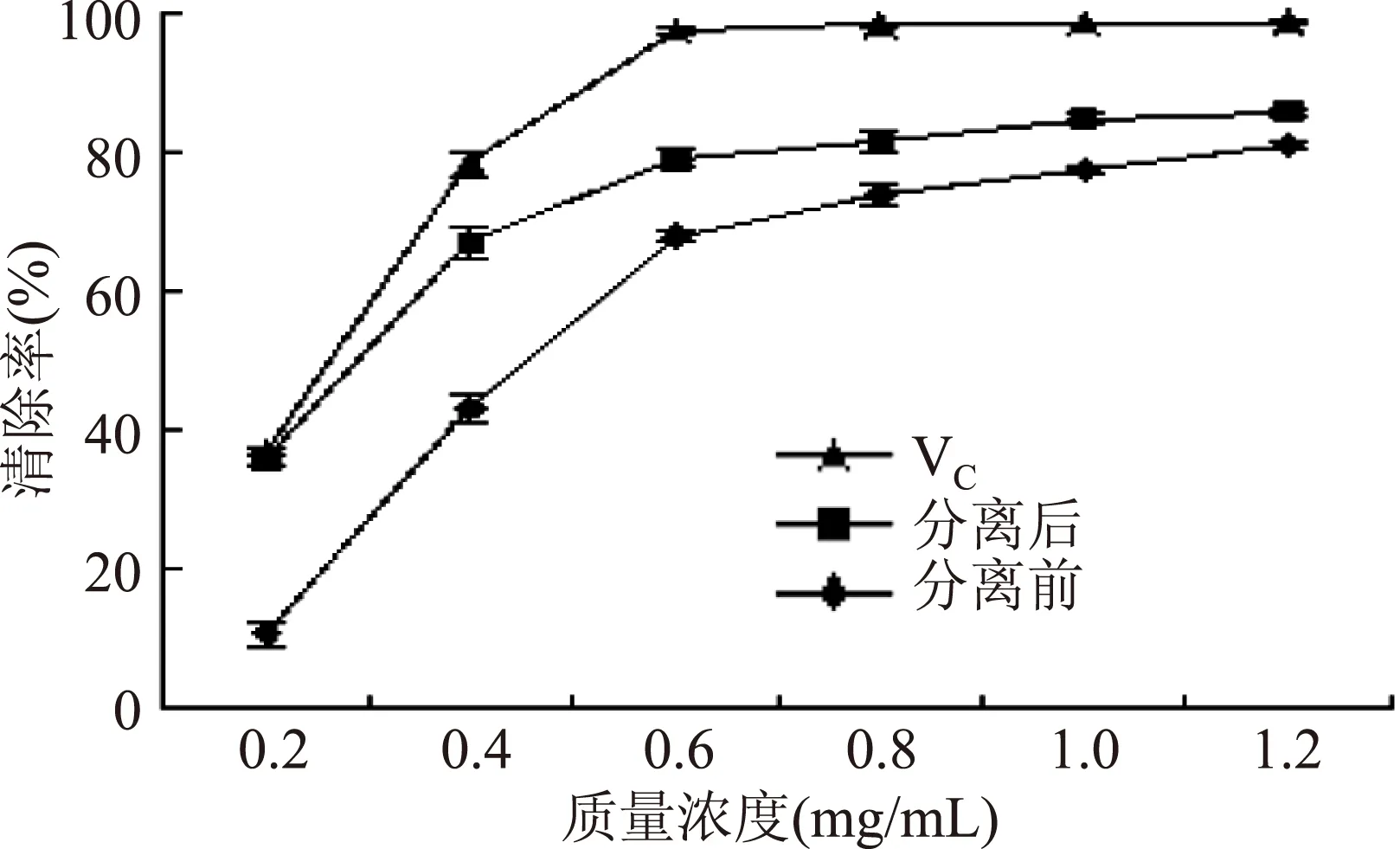
图2 分离前后山杏花总黄酮清除羟基自由基的能力Fig.2 The scavenging effect of separated and unseparated total flavonoids from Siberian apricot flowers on·OH
2.2.3总还原力测定结果由图3可知,各质量浓度分离前后的山杏花总黄酮、VC均具有一定的还原能力,其还原能力与质量浓度在20~220 μg/mL范围内均具有一定的线性相关性。随着质量浓度的增大,三者的还原能力均不断增大,且分离后山杏花总黄酮的还原能力始终优于纯化前,但弱于VC。
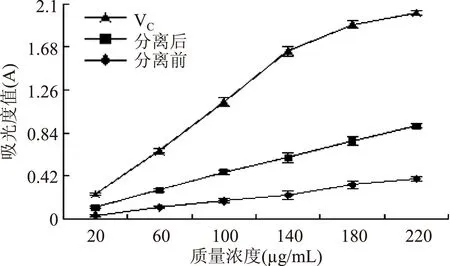
图3 分离前后山杏花总黄酮的总还原能力Fig.3 Total reduction capacity of separated and unseparated total flavonoids from Siberian apricot flowers
2.2.4总抗氧化能力测定结果ABTS经活性氧氧化可生成稳定的蓝绿色阳离子自由基ABTS+·,当存在自由基清除剂时,会与ABTS+·发生反应而使反应体系褪色。ABTS+·在734 nm处有最大吸收,可检测其吸光度的变化[19]。
从图4可以看出,在10~50 μg/mL的质量浓度范围内,分离前后山杏花总黄酮的质量浓度与对ABTS+·的清除率有明显的量效关系。随着质量浓度的增加,清除率均呈上升趋势,但分离前的山杏花总黄酮清除ABTS+·始终弱于纯化后的。VC清除ABTS+·极强,当质量浓度为20 μg/mL时,清除率已达99.24%。当质量浓度为50 μg/mL时,分离后的山杏花总黄酮对ABTS+·的清除率为95.48%,与VC相当,说明分离后的山杏花总黄酮对ABTS+·的清除能力也是很强的。从图4可知,分离后山杏花总黄酮及VC的IC50值分别为20.61、5.99 μg/mL。
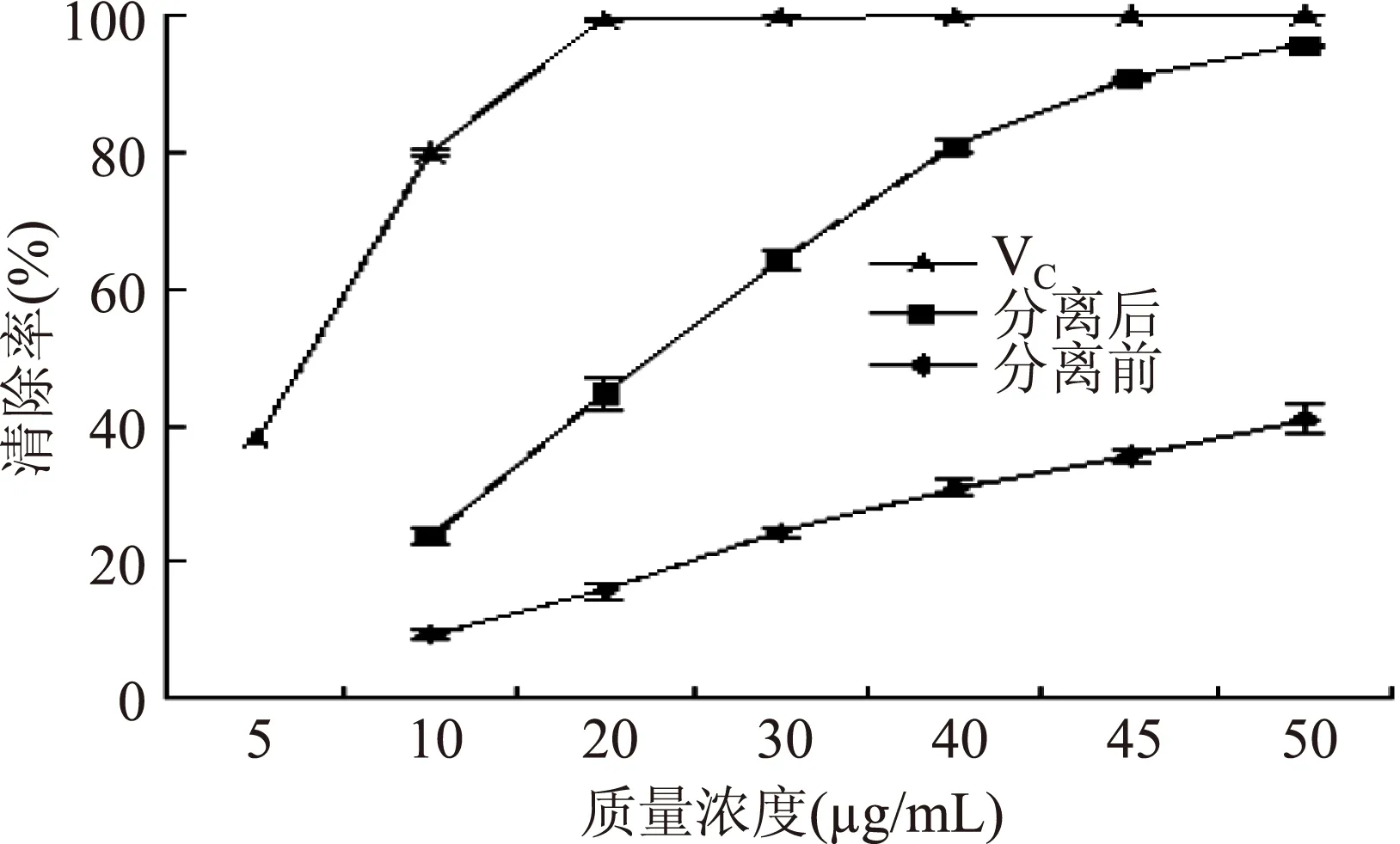
图4 分离前后山杏花总黄酮的总抗氧化能力Fig.4 Total antioxidant capacity of separated and unseparated total flavonoids from Siberian apricot flowers
2.3对酪氨酸酶活性抑制能力的测定结果
从图5c可以看出,在1.0~6.0 mg/mL范围内,随着质量浓度的增大,分离前后山杏花总黄酮对酪氨酸酶活性的抑制能力均逐渐增大。当质量浓度小于3.0 mg/mL时,分离前的山杏花总黄酮对酪氨酸酶的抑制效果优于分离后,其原因可能是在低质量浓度下分离前的粗提物里还含有多糖等物质,某些多糖与黄酮类物质在协同作用下抑制酪氨酸酶的能力更强。当质量浓度大于4.0 mg/mL时,分离后的山杏花总黄酮的抑制效果优于分离前,其原因可能是随着浓度的增大,相比于分离前,分离后山杏花总黄酮中具有较强抑制酪氨酸酶能力的某些黄酮类物质的浓度相对增大。
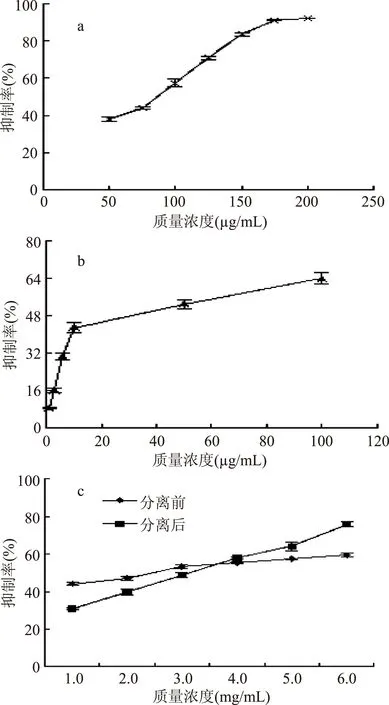
图5 四种物质对酪氨酸酶活性的抑制能力Fig.5 The inhibitory effect of four substances on tyrosinase activity注:a:VC;b:β-熊果苷;c:分离前后山杏花总黄酮。
由图5根据计算得出四种物质的IC50值如表2所示,可知分离后的山杏花总黄酮的IC50值是β-熊果苷的10.3%,是VC的40.5倍。说明分离前后山杏花总黄酮均有较强的抑制酪氨酸酶活性的能力。

表2 四种物质抑制酪氨酸酶的IC50值Table 2 The concentration of four substances required to inhibit tyrosinase activity by 50%
3 结论
分离前后的山杏花总黄酮均具有一定的抗氧化活性,且在一定质量浓度范围内,随浓度的增大活性逐渐增强。经X-5大孔树脂分离后,山杏花总黄酮的抗氧化活性得到了明显提高,但分离前后山杏花总黄酮的抗氧化活性均低于天然类的抗氧化剂VC;分离前后的山杏花总黄酮对酪氨酸酶活性均具有一定的抑制能力,在一定范围内随着质量浓度增大,抑制率逐渐升高,其IC50值分别为2.24、3.08 mg/mL,且抑制能力强于β-熊果苷弱于VC。
鉴于山杏花总黄酮具有较好的体外抗氧化活性以及对酪氨酸酶的抑制能力,今后可以对其进一步分离纯化、进行结构鉴定以及体内动物实验,为山杏花在医药、化妆品、保健食品等领域的开发利用提供更多的科学依据与理论指导。
[1]孟辉. 山杏资源概况及国内外研究进展[J]. 中国林副特产,2009,101(4):100-101.
[2]崔剑,李兆陇,洪啸吟. 自由基生物抗氧化与疾病[J]. 清华大学学报,2000,40(6):9-12.
[3]Harman D. Aging:a theory based on free radical and radiation chemistry[J]. Journal of gerontology,1956,11(3):298-300.
[4]李文林,黄凤洪. 天然抗氧化剂研究现状[J]. 粮食与油脂,2003,(10):10-13.
[5]Momtaz S,Lall N,Basson A. Inhibitory activities of mushroom tyrosine and DOPA oxidation by plant extracts[J]. South African Journal of Botany,2008,74(4):577-582.
[6]邹先伟,蒋志胜. 植物源酪氨酸酶抑制剂研究进展[J]. 中草药,2004,35(6):702-705.
[7]刘杰超,张巧莲,焦中高,等. 桃花提取物对酪氨酸酶的抑制作用及其动力学分析[J]. 果树学报,2014,31(5):836-841.
[8]任红荣,单承莺,姜洪芳,等. 香水莲花提取物抑制酪氨酸酶活性的研究[J]. 天然产物研究与开发,2011,23:1122-1126.
[9]韩帅,李淑燕,陈芹芹,等. 响应面分析法优化闪式提取胡柚皮中黄酮类化合物工艺[J]. 食品科学,2011,32(10):52-56.
[10]崔洁,顾欣,黄昆,等. 山杏果肉可溶性膳食纤维的抗氧化活性与红外光谱分析[J]. 食品与发酵工业,2012,38(1):123-127.
[11]Dorman H J D,Kosar M,Kahlos K,et al. Antioxidant properties and composition of aqueous extracts from Mentha species,hybrids,varieties and cultivars[J]. Journal of agricultural and food chemistry,2003,51(16):4563-4569.
[12]江慎华,周勇,肖通奋,等. 荷叶不同极性部位抗氧化活性及酸水解对有效部位抗氧化活性的影响[J]. 现代食品科技,2014,30(12):92-99.
[13]王晓静,陈莉华,莫宇婷. 红果参黄酮与VC的协同抗氧化活性[J]. 食品与发酵工业,2014,30(12):111-115.
[14]陈伟,杨英士,杨海燕. 昆仑雪菊结合型黄酮类化合物的分离与鉴定[J]. 食品科学,2014,35(11):72-78.
[15]Xican Li,Jing Lin,Yaoxiang Gao,et al. Antioxidant activity and mechanism of Rhizoma Cimicifugae[J]. Chemistry Central Journal,2012,6(1):140.
[16]段玉清,刘睿,谢笔钧. 莲房原花青素对酪氨酸酶活力和黑色素生物合成影响的初步研究[J]. 食品科学,2004,25(3):169-174.
[17]Jung-Hee Hwang,Byung Mu Lee. Inhibitory effects of plant extracts on tyrosinase,L-DOPA oxidation,and melanin synthesis[J]. Journal of toxicology and environmental health,2007,70(5-6):393-407.
[18]Yildirim A,Mavi A,Kara A A. Determination of antioxidant and antimicrobial activities of Rumex crispus L. Extracts[J]. Journal of agricultural and food chemistry,2001,49(8):4083-4089.
[19]朱玉昌,焦必宁. ABTS法体外测定果蔬类总抗氧化能力的研究进展[J]. 食品与发酵工业,2005,31(8):77-80.
Antioxidant activity and inhibitory activity on Tyrosinase of total flavonoids fromSiberianApricotflowers
NING Ya-ping,DONG Shi-bin,LI Jian-xia,YANG Zhe,ZHANG Qiao-hui,DONG Jie-qiong,WANG Jian-zhong*
(Beijing Key Laboratory of Forest Food Processing and Safety,College of Biological Sciences and Biotechnology,Beijing Forestry University,Beijing 100083,China)
Total flavonoids fromSiberianapricotflowers were extracted with the method of flash extraction and purified with X-5 macroporous resins.The antioxidant activity of separated and unseparated total flavonoids fromSiberianapricotflowers were investigated by measuring scavenging effect on DPPH·and OH·,total reduction capacity,total antioxidant capacity and the inhibitory effect on tyrosinase activity was studied by measuring the rate of tyrosinase catalyzedL-DOPA oxidation taking VCandβ-arbutin as positive controls. The results showed that separated and unseparated total flavonoids fromSiberianapricotflowers had a certain antioxidant activity. After separation,the antioxidant activity was improved obviously,the inhibitory effect on tyrosinase of separated and unseparated total flavonoids fromSiberianapricotflowers was better thanβ-arbutin but worse than VC. Their half maximal inhibitory concentration(IC50)were 2.24,3.08 mg/mL,respectively. In conclusion,separated and unseparated total flavonoids fromSiberianapricotflowers had a certain antioxidant activity and can effectively inhibit tyrosinase activity.
total flavonoids fromSiberianapricotflowers;antioxidant activity;tyrosinase;inhibitory effect
2015-07-09
宁亚萍(1989-),女,硕士,研究方向:天然产物开发与利用,E-mail:nypszb@163.com。
王建中(1952-),男,硕士,教授,研究方向:林产品加工利用,E-mail:w62338221@163.com。
林业公益性行业科研专项(201004081)。
TS201.1
B
1002-0306(2016)05-0104-05
10.13386/j.issn1002-0306.2016.05.012
