TiO2负载Cu-Mn复合氧化物催化燃烧正己醛
2016-09-09张婷婷
李 悦 张婷婷 王 娟 朱 圳 贾 冰 余 江
(北京化工大学化学工程学院环境催化与分离过程研究中心,北京100029)
TiO2负载Cu-Mn复合氧化物催化燃烧正己醛
李悦张婷婷王娟朱圳贾冰余江*
(北京化工大学化学工程学院环境催化与分离过程研究中心,北京100029)
通过调控Cu负载量及Cu/Mn原子比,探究其对TiO2负载Cu-Mn复合氧化物(CuxMny/TiO2)催化材料中活性组分间相互作用的影响,结果表明,铜负载量为15%(w,质量分数)和Cu/Mn原子比为1:1时有利于类铜锰尖晶石相Cu1.5Mn1.5O4的形成,随着Cu负载量的增加促使氧物种从晶格氧向表面吸附氧转移。复合催化材料中铜负载量的变化及Cu/Mn原子比对活性组分和催化活性间的相互作用影响显著。结果发现Cu15Mn15/ TiO2在225°C时使正己醛转化率达到90%(T90),材料良好的性能归因于其具有较高的Cu2+与Oads含量,并可与Mn2+实现双还原氧化过程。结果表明,Cu15Mn15/TiO2复合材料中的类铜锰尖晶石活性组分可完成redox循环,以保持催化材料较高的稳定性。
铜负载量;铜锰原子比;CuxMny/TiO2;活性组分;催化氧化;正己醛
www.whxb.pku.edu.cn
1 引言
载体对活性组分起支撑作用,可使催化剂具有合适的形状和粒度,有利于提高活性组分的分散度。Mori等1通过研究无载体的V2O5、V2O5/TiO2和V2O5/Al2O3催化苯的性能实验,发现采用TiO2做载体催化剂的催化活性较好。尽管很多情况下TiO2载体表现出一定的催化活性2,但活性组分是催化剂的催化活性的主要来源,揭示活性组分的微观结构与其催化效能之间的关联性至关重要。
锰是一种多价态的过渡金属元素,常用作氧化催化剂或脱氢催化剂的活性成分。Li等3发现用醋酸锰为原料制备的催化剂的表面具有更多的Mn氧化物,表现出更优的催化活性。Park等4研究表明,当MnOx负载量为20%(w)时,表现出最优的选择性催化还原(SCR)活性和N2选择性。Li等5采用反相微乳法制备了含Mn系列的二元金属复合催化剂Mn-CuOx、Mn-ZrOx、Mn-FeOx、Mn-CoOx等,结果表明,Mn-CuOx对甲苯完全转化的活性最高。因而,Cu-Mn复合氧化物作为一类反应活性高且易于制备的低成本催化材料,用于催化燃烧易挥发有机物(VOCs)的研究越来越受到关注6,7,且在催化燃烧反应中Cu-Mn复合氧化物的活性优于单组元氧化物8。并且,添加Cu物种可以阻止Mn氧化物晶化,有助于为形成的Cu-Mn复合氧化物提供氧空位,从而提高对乙醇的催化燃烧活性9。李玮等10认为Cu-Mn/TiO2催化材料降解甲醛活性时有以下影响顺序:Cu-Mn负载量>Cu-Mn原子比>煅烧时间。林性贻等11发现适量铜物种的存在极大改善了Cu/Fe2O3催化剂的水煤气变换反应性能。随着Cu负载量的增加,Fe-Al-Cu催化剂水煤气变换反应的催化活性及其活性组分γ-Fe2O3的表观结构都得到较大程度优化12。由此可见,复合催化剂中Cu负载量及Cu/Mn原子比是影响催化材料结构与催化性能的关键因素之一,其活性组分之间必定通过一定的相互作用而达到优化催化剂的结构和提高催化性能的复合效应,但目前有关这种活性组分结构与催化活性之间的微观机制报道较少。
本文以纳米TiO2为载体,以Cu和Mn为二元活性组分通过共沉淀法制备复合催化材料,通过调控催化材料中Cu的负载量及Cu-Mn原子比,探究催化剂结构及价态变化的内在规律性和催化降解活性之间的关联,选取VOCs中的正己醛作为降解对象,它易导致肺炎,对人体和环境的危害较大13,14,并进行CuxMny/TiO2复合催化材料组成结构的优化,以期为以Cu-Mn复合氧化物为活性组分进行的催化燃烧降解VOCs提供现实意义。
2 实验部分
2.1实验材料
纳米级TiO2(P25),纯度>99%,德国德固赛公司;醋酸锰(分析纯),醋酸铜(分析纯),天津市福晨化学试剂厂产品;氢氧化钠(分析纯),乙醇(分析纯),北京化工厂产品。
2.2催化材料的制备
将醋酸锰、醋酸铜按照不同Cu/Mn原子负载比例溶于200 mL去离子水中,然后加入4 g纳米TiO2,45°C条件下搅拌0.5 h,然后以3 mL·min-1的速率向上述悬浊液中滴加饱和氢氧化钠溶液至混合液pH=12,离心过滤,用去离子水洗涤三次,乙醇洗涤一次,120°C下真空干燥6 h,研磨后过40目筛,置于马弗炉中在空气气氛下于500°C焙烧7 h,得到锰理论负载量一致,铜理论负 载 量 变 化 的 Cu6.7Mn15/TiO2、 Cu8.3Mn15/TiO2、Cu15Mn15/TiO2;以及铜锰理论负载总量相等,铜锰原 子 比 变 化 的 Cu5Mn25/TiO2、 Cu10Mn20/TiO2、Cu15Mn15/TiO2、Cu20Mn10/TiO2等系列CuxMny/TiO2催化材料(x%、y%分别代表Cu和Mn的质量分数(w),由于Mn和Cu具有相似的原子量所以w近似等于原子百分比9)。
2.3催化材料的表征
晶相结构分析使用了D8MAX-2400型X射线衍射仪,日本Rigaku公司,采用了Cu靶Kα射线实行扫描速率为2(°)·min-1的扫描,角度为10°-90°。
催化材料的形貌结构分析采用扫描电镜(SEM),SUPRA55型,德国Carl Zeiss公司。
催化材料元素进行价态判断及分析采用美国X射线光电子能谱仪(XPS),以C为基准(284.9 eV),ESCALAB250型,美国ThermoFisherScientific公司。
可还原特性H2程序升温还原(H2-TPR)在Micromeritics RS232 Auto Chem II型全自动化学吸附仪上进行。采用Ar进行150°C的1 h吹扫,再变更为H2吹扫并持续1 h,然后以10°C·min-1的速率升温至800°C,使用热传导检测器(TCD)检测耗氢量。
2.4活性测试评价
催化活性评价装置为固定床微型反应装置,装置如图1所示,反应均在常压下进行;反应器为微型固定床式石英管反应器(内径为9 mm),催化剂用量为0.2 g,热电偶固定在石英管反应器内催化剂床层中央,正己醛溶液经由微量注射泵注入管路,与载气(空速为25000 h-1,VN2:VO2=4:1)在预热器中进行混合预热,之后进入反应炉中进行反应,各气体流量均用质量流量计控制,反应温度160-300°C,反应气进口和出口浓度测试均采用气相色谱-氢火焰离子化检测器(GC-FID)进行分析;反应物正己醛降解率计算公式为:

图1 正己醛的催化氧化反应装置Fig.1 Experimental setup for oxidation of n-hexanal
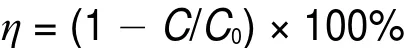
其中η为正己醛的转化率,C为出口浓度,C0为进口浓度。
3 结果及讨论
3.1CuxMny/TiO2催化材料活性评价测试
图2(a)是在铜锰负载总量均在30%的条件下,调节不同铜锰原子比所制备的CuxMny/TiO2对正己醛的催化转化效果。通过对比可知,在改变铜锰比例为Cu20Mn10/TiO2后正己醛转化率大大降低。Cu15Mn15/TiO2材料的低温活性和高温活性最高,90%转化率的对应温度(T90)为225°C,而Cu10Mn20/ TiO2的T90为250°C,Cu5Mn25/TiO2的T90为260°C,说明Cu含量与Mn催化活性的提升有密切的关联性。
恒定锰的负载量,图2(b)反映出不同铜负载量的催化材料对正己醛的催化降解能力。显然在Mn负载量恒定的情况下,随Cu的负载量及Cu/Mn原子比值的增加,正己醛的催化转化效率在相同的反应温度下均有明显的增加,表明CuxMny/TiO2的催化性能与Cu-Mn之间的协同作用密切相关,而Cu-Mn之间的协同作用不仅仅与两组分之间的量的比值相关,Cu-Mn组分间的微观作用机制可能起到关键作用。
3.2CuxMny/TiO2催化材料的XRD表征
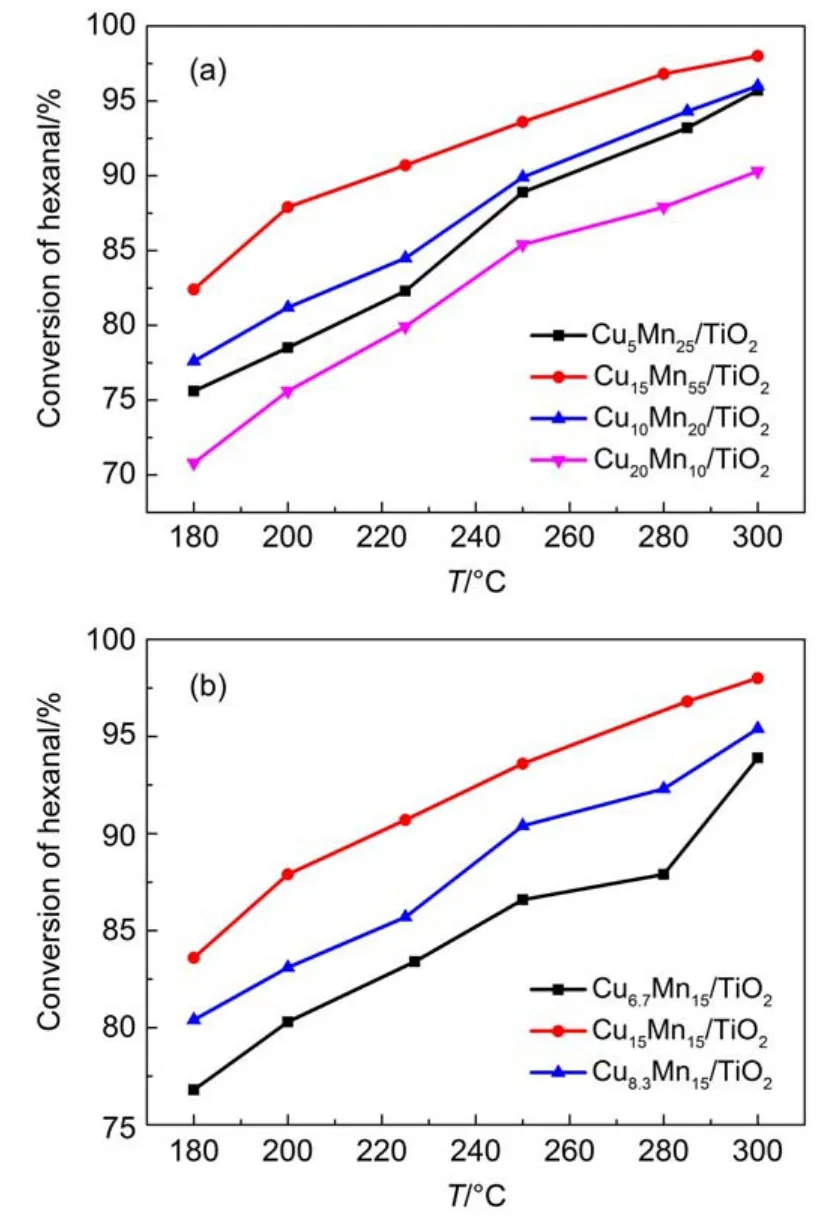
图2 CuxMny/TiO2催化降解正己醛的催化活性Fig.2 Catalytic activity of CuxMny/TiO2fordegradation n-hexanal
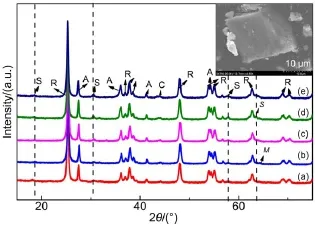
图3 不同Cu负载量下制备CuxMny/TiO2的XRD图Fig.3 XRD patterns of CuxMny/TiO2under different Cu loadings
图3是制备的CuxMny/TiO2的XRD图。对照JCPDS粉末衍射卡片,不同条件下制备的CuxMny/ TiO2材料中均存在锐钛矿(anatase)以及金红石相(rutile)的TiO2,以锐钛矿TiO2为主。在2θ为18.33°、30.46°、43.66°、57.78°、63.33°处出现了类铜锰尖晶石(Cu1.5Mn1.5O4,spinel,PDF 35-1172)的衍射峰(右上插图为Cu15Mn15/TiO2的SEM图);在2θ=44.08°出现CuO(C,PDF 44-0706)的衍射峰,在2θ=64.13°出现MnO(M,PDF 41-1442)的衍射峰。由图3中可知,随着Cu负载量的增加,类铜锰尖晶石Cu1.5Mn1.5O4的衍射峰逐渐增强,在Cu15Mn15/TiO2催化材料中达到最强,此时更易形成类铜锰尖晶石结构。仝长水等15曾报道类铜锰尖晶石相是MnCeOx催化剂降解苯酚反应中氧化-还原循环进行的关键,因此,类铜锰尖晶石可能在正己醛催化反应过程中扮演重要角色。
3.3CuxMny/TiO2催化材料的H2-TPR表征
催化材料的活性与催化材料中活性组分的还原行为密切相关。图4是CuxMny/TiO2以及无载体的Cu-Mn-O催化材料的H2-TPR图,其对应的还原峰峰温数据列于表1。由图4和表1可知,Cu-Mn-O还原温度远远高于CuxMny/TiO2系列负载型催化材料,说明活性组分与载体TiO2间也存在一定的相互作用。MnOx一般在327-527°C范围产生宽还原峰,CuOx在377-477°C范围产生宽还原峰16,图4表明,Cu-Mn氧化物结合后,还原温度相较MnOx、CuOx都有大幅降低,说明Cu-Mn氧化物之间产生较强作用力,使催化材料整体还原温度下降,类铜锰尖晶石的存在能促进CuO的还原17。当锰负载量恒定时,随着Cu负载量的增加,催化材料的还原温度逐渐降低,这是由于CuO具有和贵金属类似的活化H―H键的能力18,当活化的H+溢出时,氧化物得到还原。戴越等19研究发现第一个还原峰的峰温(Tp1)与其催化活性密切相关,Tp1较低的催化材料具有较高的催化氧化活性,而还原峰温相近的催化材料具有相似的催化活性。可看出在锰负载量恒定时,随铜负载量的增加,催化剂还原温度呈降低趋势。
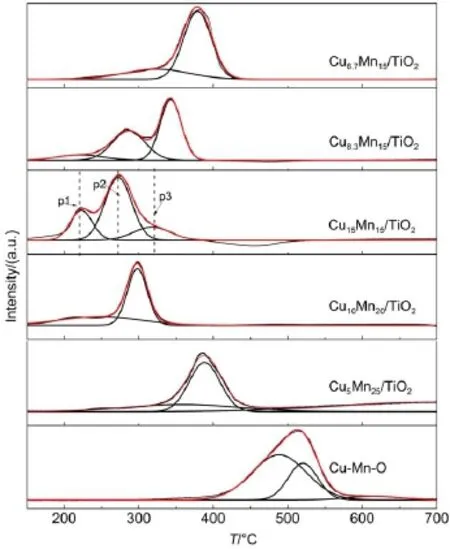
图4 CuxMny/TiO2催化材料的H2程序升温还原曲线Fig.4 Temperature-programmed reduction of H2(H2-TPR)profiles of CuxMny/TiO2catalysts
固定铜锰负载总量,变化铜锰原子比,进行比较发现,Cu15Mn15/TiO2在222.3°C时出现第一个还原峰,应为类铜锰尖晶石中CuO→Cu0所产生的还原峰p120;272.4°C时出现第二个峰形较窄峰强较高的还原峰p2,可认为是锰氧化物的分布还原过程MnO2/Mn2O3→Mn3O4→MnO(20),而在317°C出现的峰可认为是孤立Cu2+物种的还原峰p321。Cu15Mn15/TiO2催化材料具有最低的还原温度,具有较高的还原峰面积,可与其具有最高正己醛催化活性相关联。由图4中可知,Cu/Mn原子比为1:5时还原温度最高,表1显示其MnO2还原峰比例较高,但是总体的还原峰面积在样品中较低,推测由于过量的Mn负载可能不利于催化材料的类铜锰尖晶石活性相形成,导致催化活性的降低22,所以导致Cu5Mn25/TiO2在可还原性能表征中处于劣势,并具有较低的高温活性。
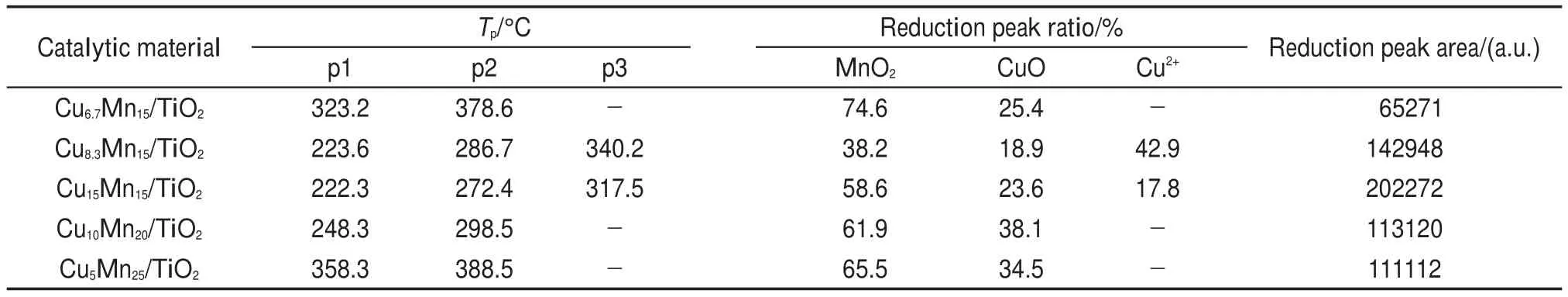
表1 CuxMny/TiO2的H2-TPR数据拟合Table 1 H2-TPR data fitting of CuxMny/TiO2
3.4CuxMny/TiO2催化材料的XPS表征
图5―图7分别为CuxMny/TiO2中元素Cu、Mn 和O的XPS图谱,遵循解卷积一般规律,经过分峰拟合处理得到CuxMny/TiO2的表面活性组分的相对比值列于表2,文献23的相关数据也列于表2中。
图5为CuxMny/TiO2的Cu 2p的XPS谱图,位于933.1 eV处的特征峰归属于Cu2+,930.9 eV的特征峰归属于Cu+。由表2可知,当锰负载量恒定时,Cu2+的比值在铜负载量为8.3%(w)(Cu8.3Mn15/TiO2)时最高,说明在该负载量下催化材料表面的Cu电荷向高能级跃迁能力最强24。张佳瑾等23制备的具有最高含量的Cu2+的Cu-Mn-Zr-O/Al2O3/COR整体式催化剂具有最高的催化燃烧甲烷活性,因此,在不同铜锰原子比的催化材料中Cu15Mn15/TiO2具有最低比值的Cu+/Cu2+,也具有最高的催化活性,表明催化活性与Cu+/Cu2+有关。

图5 CuxMny/TiO2中Cu 2p的XPS图谱Fig.5 Cu 2p XPS spectra of the CuxMny/TiO2
图6为CuxMny/TiO2的Mn 2p的XPS谱图,在640.7和642.4 eV处分别出现Mn2+和Mn4+的特征峰。Cu15Mn15/TiO2具有最高的Mn2+/Mn4+比值,说明其具有更多的还原态Mn2+,郭金玲等25发现铜锰尖晶石结构中较多的Mn2+对去除NO的有利。在Cu-Mn双金属过渡金属氧化物催化剂中,金属阳离子Cu2+作为氧化态活性位承担目标污染物分子的活化与氧化功能,它们依靠沿晶格传递的O2-离子进行再氧化;另一种金属阳离子Mn2+作为还原态活性位处于还原态并接受气相氧O2,符合双还原氧化(dual-redox)机理26。
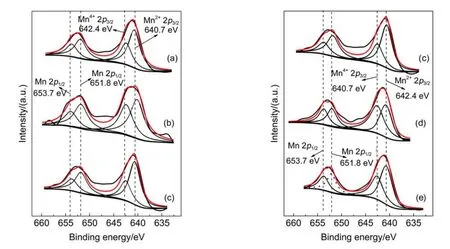
图6 CuxMny/TiO2中Mn 2p的XPS图谱Fig.6 Mn 2p XPS spectra of the CuxMny/TiO2
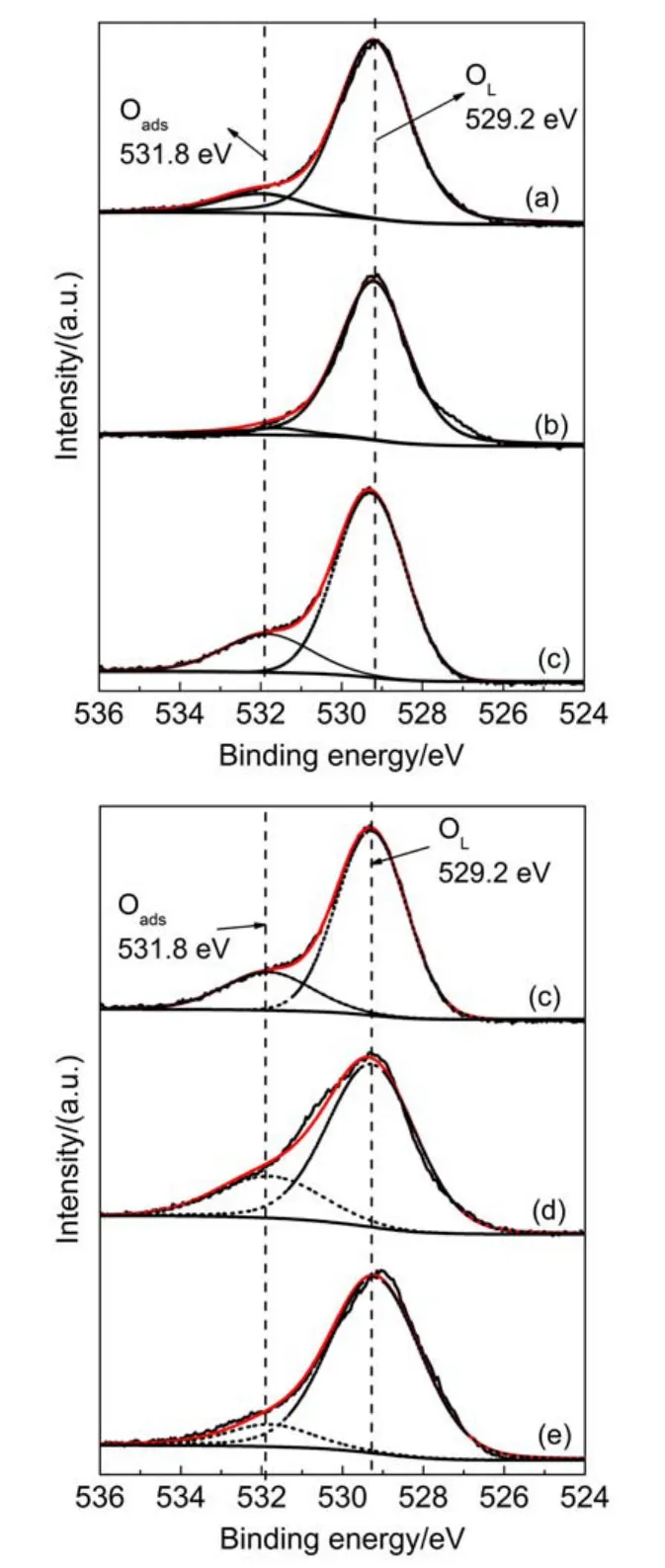
图7 CuxMny/TiO2中O 1s的XPS谱图Fig.7 O 1s XPS spectra of the CuxMny/TiO2

表2 CuxMny/TiO2在XPS表征下得到的表面活性组分相对比值Table 2 Relative ratio of elements on the surface of CuxMny/TiO2catalysts
图7为CuxMny/TiO2中O 1s的XPS谱图,在529.2 eV处的峰归属于晶格氧(OL),在531.8 eV处的峰归属于吸附氧(Oads),吸附氧在催化燃烧的过程中能提高氧物种的流动性从而提高催化活性27。由图3的XRD表征可知,Cu负载量的增加利于类铜锰尖晶石Cu1.5Mn1.5O4物相的形成,该物相被认为是表面活性吸附氧的主要贡献者28,Cu1.5Mn1.5O4被认为能产生大量的氧空位以及晶格缺陷29,在产生大量的活性氧的同时还能提供活性氧物种转移的通道。从表2及图7可看出,锰负载量恒定时随着Cu负载量的增加,Oads/O 1s的比例增加,利于氧物种从晶格氧向吸附氧转移30,减弱晶格氧与活性组分的相互作用31,有利于氧化还原反应的进行,在Cu15Mn15/TiO2时达到最高,故该材料催化氧化活性较高,其结果与文献23的报道结果相一致。
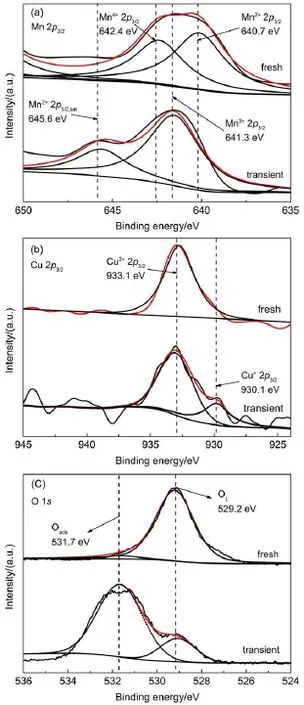
图8 新鲜及反应瞬态Cu8.3Mn15/TiO2XPS表征Fig.8 XPS characterization of fresh and under transient Cu8.3Mn15/TiO2
由此可以推断,Cu15Mn15/TiO2在较宽温度范围都具有较高催化活性的原因是该催化材料由于Mn2+及Cu2+间相互作用具有晶相完整的类铜锰尖晶石(Cu1.5Mn1.5O4),最高含量的Oads,以及最低的可还原温度,而Cu8.3Mn15/TiO2则具有最低比例的Cu+/ Cu2+。为了探究Cu组分在催化反应中的作用,选取Cu8.3Mn15/TiO2进行表面催化机理研究。
3.5CuxMny/TiO2催化降解正己醛机理探究
图8是新鲜的及反应瞬态的Cu8.3Mn15/TiO2催化剂的XPS谱图,对应的元素分析结果见图9。从图8可以看出,642.4 eV处Mn4+的特征峰在反应后消失,并且在反应瞬态时于645.6 eV处出现Mn2+的卫星峰32,在641.3 eV处出现Mn3+的特征峰。由图9可知,Mn2+作为气相氧的承担者部分被氧化为Mn3+,而Mn4+则部分作为氧化剂被还原为Mn3+。 Cu2+则承担正己醛分子的活化与氧化功能被还原为Cu+,因此在催化氧化反应过程中,类铜锰尖晶石活性组分可能发生如下的氧化还原反应:
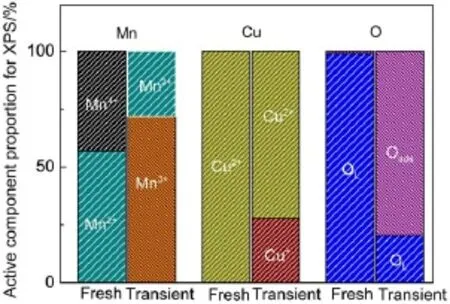
图9 新鲜及反应瞬态Cu8.3Mn15/TiO2在XPS表征下的活性组分比例Fig.9 Proportion of the active components of fresh and under transient Cu8.3Mn15/TiO2of the XPS characterization
Cu2++Mn2++Mn4+⇌Mn3++Cu+
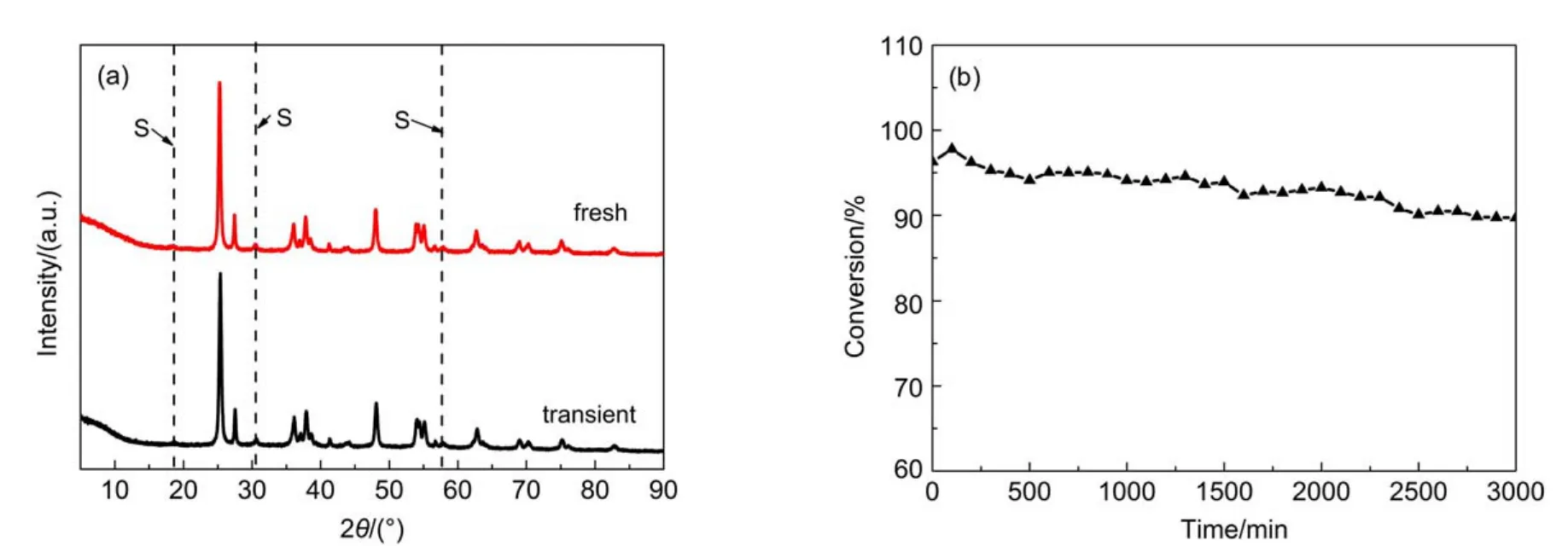
图10 新鲜及反应瞬态Cu8.3Mn15/TiO2的XRD表征(a)以及稳定性评价(b)Fig.10 XRD patterns(a)of Cu8.3Mn15/TiO2of fresh and under transient and stability evaluation(b)

图11 正己醛在CuxMny/TiO2催化剂上的氧化-还原反应机理Fig.11 Possible red-oxd ways of n-hexanal combustion using CuxMny/TiO2
比较O 1s可知,反应瞬态时晶格氧被大量消耗,产生较多表面吸附氧,有利于正己醛在催化材料表面被持续催化氧化,随着反应的进行,表面氧物种减少,此时催化剂晶格体相氧扩散到表面形成表面氧物种与正己醛反应,形成氧空位,然后气相中的氧进入氧空位,气相氧将Mn2+部分氧化到高价态Mn3+,并补充晶格氧,保证类铜锰尖晶石结构不坍塌(如图10(a)所示),晶格氧在反应过程中又向表面吸附氧转移,完成如图11所示的redox循环。经连续催化实验验证,催化材料在反应48 h后仍保持良好的催化活性如图10(b)所示,证明该循环具有一定的可持续性。
4 结论
在Cu-Mn复合氧化物为活性组分的催化材料中,随着Cu负载量的增加,有助于形成类铜锰尖晶石相(Cu1.5Mn1.5O4)。铜锰原子比为1:1时有利于催化材料活性组分的分散,使氧物种从晶格氧向表面吸附氧转移,得到较多含量的Cu2+以及表面吸附氧,共同作用促使Cu15Mn15/TiO2在较低的温度下就表现出高的催化降解正己醛的活性。在降解正己醛过程中,类铜锰尖晶石活性组分及晶格氧、吸附氧完成redox循环,保证催化材料优良的稳定性。
References
(1)Inomata,M.;Mori,K.;Miyamoto,A.;Murakami,Y.J.Phys. Chem.1983,87(5),754.doi:10.1021/j100228a013
(2)Li,P.;Tong,Z.Q.;Huang,Y.Acta Sci.Circum.2008,28(3), 468.[李鹏,童志权,黄妍.环境科学学报,2008,28(3), 468.]doi:10.3321/j.issn:0253-2468.2008.03.010
(3)Li,J.H.;Chen,J.J.;Ke,R.;Luo,C.K.;Hao,J.M.Catal. Commun.2007,8(12),1896.doi:10.1016/j.catcom.2007.03.007
(4)Park,K.H.;Sang,M.L.;Kim,S.S.;Dong,W.K.;Hong,S.C. Catal.Lett.2013,143(3),246.doi:10.1007/s10562-012-0952-8
(5)Li,W.B.;Chu,W.B.;Zhuang,M.;Hua,J.Catal.Today 2004, 93-95,205.doi:10.1016/j.cattod.2004.06.042
(6)Tanaka,Y.;Utaka,T.;Kikuchi,R.;Sasaki,K.;Eguchi,K. J.Catal.Today 2003,242(2),287.doi:10.1016/S0926-860X (02)00529-X
(7)Li,W.B.;Gong,H.Acta Phys.-Chim.Sin.2010,26,885.[黎维彬,龚浩.物理化学学报,2010,26,885.]doi:10.3866/PKU. WHXB20100436
(8)Shu,J.;Wu,S.L.;Wang,R.Chin.J.Catal.1989,10(3),244.[束骏,吴善良,汪仁.催化学报,1989,10(3),244.]
(9)Morales,R.M.;Barbero,P.B.;Cadús,E.C.Fuel 2008,87(7), 1177.doi:10.1016/j.fuel.2007.07.015
(10)Li,W.;Huang,L.L.;Qu,Y.C.;Ning,X.Y.;Zou,K.H. Petrochem.Technol.2014,43(11),1319.[李玮,黄丽丽,翟友存,宁晓宇,邹克华.石油化工,2014,43(11),1319.]doi: 10.3969/j.issn.1000-8144.2014.11.015
(11)Lin,S.Y.;Ma,J.T.;Chen,C.Q.Acta Phys.-Chim.Sin.2014, 30(1),157.[林性贻,马俊涛,陈崇启.物理化学学报,2014,30 (1),157.]doi:10.3866/PKU.WHXB201311271
(12)Zhang,L.;Millet,J.M.;Ozkan,U.S.Appl.Catal.A 2009,357 (1),66.doi:10.1016/j.apcata.2009.01.011
(13)Zhu,X.;Wang,K.;Zhu,J.;Koga,M.J.Agr.Food.Chem.2001, 49(10),4790.doi:10.1021/jf001084y
(14)Chen,C.Y.;Liu,T.;Wang,H.;Yu,Q.Q.;Fang,J.;Xiao,L.P.; Zheng,X.M.Chin.J.Catal.2012,33(6),941.[陈春雨,刘彤,王卉,于琴琴.范杰,肖丽萍,郑小明.催化学报, 2012,33(6),941.]doi:10.1016/S1872-2067(11)60391-4
(15)Tong,C.S.;Tong,X.X.;Jin,M.G.;Ye,N.J.Chin.J.Catal. 2010,31(9),1185.[仝长水,仝晓霞,靳孟贵,叶念军.催化学报,2010,31(9),1185.]doi:10.3724/SP.J.1088.2010.00214
(16)Einaga,H.;Maeda,N.;Yamamoto,S.;Teraoka,Y.Catal.Today 2014,245,22.doi:10.1016/j.cattod.2014.09.018
(17)Li,W.B.;Zhuang,M.;Xiao,T.C.;Green,M.L.H.J.Phys. Chem.B 2006,110(43),21568.doi:10.1021/jp063580g
(18)Vu,V.H.;Belkouch,J.;Ould-Dris,A.;Taouk,B.AIChE J. 2008,54(6),1585.doi:10.1002/aic.11482
(19)Dai,Y.;Li,S.S.;Tang,C.J.Chin.J.Inorg.Chem.2012,28(8), 1555.[戴越,李珊珊,汤常金.无机化学学报,2012,28(8), 1555.]
(20)Cai,L.N.;Hu,Z.H.;Branton,P.Chin.J.Catal.2014,35(2), 159.[蔡丽娜,胡臻皓,Peter Branton,李文翠.催化学报,2014, 35(2).159.]doi:10.1016/S1872-2067(12)60699-8
(21)Nagase,K.;Zheng,Y.;Kodama,Y.;Katuta,J.J.Catal.1999, 187(1),123.doi:10.1006/jcat.1999.2611
(22)Yang,L.;Bo,L.L.;Sun,J.Y.;Liang,X.X.;Hu,X.J.;Meng,H. L.Chin.J.Environ.Eng.2014,11(8),4871.[杨力,卜龙利,孙剑宇,梁欣欣,虎雪姣,孟海龙.环境工程学报,2014,11(8), 4871.]
(23)Zhang,J.J.;Li,J.W.;Zhu,J.Q.;Wang,Y.;Chen,B.H.Chin.J. Catal.2011,32(8),1380.[张佳瑾,李建伟,朱吉钦,王越,陈标华.催化学报,2011,32(8),1380.]doi:10.3724/SP. J.1088.2011.10323
(24)Lu,H.F.;Kong,X.X.;Huang,H.F.;Zhou,Y.;Chen,Y.F. J.Environ.Sci.2015,32,102.doi:10.1016/j.jes.2014.11.015
(25)Guo,J.L.;Jia,M.L.;Zhaori,G.T.;Shen,Y.N.Acta Chim.Sin. 2011,69,555.[郭金玲,贾美林,照日格图,沈岳年.化学学报, 2011,69,555.]
(26)Xu,M.Y.Preparation and Catalytic Performance for Toluene Combustion of CuMn2CenOx/Cord Cell-type Catalysts.M.S. Dissertation,South China University of Technology, Guangzhou,2011.[徐铭遥.单元式CuMn2CenOx/Cord催化剂的研制及其对甲苯催化燃烧性能[D].广州:华南理工大学, 2011.].
(27)Cao,H.Y.;Li,X,S.;Chen,Y.Q.;Gong,M.C.;Wang,J.L. J.Rare Earth 2012,30(9),871.doi:10.1016/S1002-0721(12) 60148-3
(28)Wang,X.Y.;Lu,G.Z.;Wang,R.;Wu,S.L.Chin.J.Catal. 1994,15(2),103.[王幸宜,卢冠忠,汪仁,吴善良.催化学报,1994,15(2),103.]
(29)Wang,D.;Zhang,L.;Li,J.H.;Kamasamudram,K.;Epling,W. S.Catal.Today 2014,231,64.doi:10.1016/j.cattod.2013.11.040
(30)Hosseini,S.A.;Niaei,A.;Salari,D.;Alvarez-Galvanc,M.C.; Fierro,J.L.G.Ceram.Int.2014,40(4),6157.doi:10.1016/j. ceramint.2013.11.068
(31)Yan,Y.Z.;Guo,J.W.;Chen,Y.Z.J.Mol.Catal.2015,29(1), 82.[晏耀宗,郭谨玮,陈亚中.分子催化,2015,29(1),82.]
(32)Li,D.Studies on the Characterization and the Properties of CuO-MnxOy/γ-Al2O3Catalyst for NO Catalytic Reduction.Ph.D. Dissertation,Nanjing University,Nanjing,2011.[李丹.CuOMnxOy/γ-Al2O3催化剂的制备表征及其催化还原的性质研究[D].南京:南京大学,2011.]
Catalytic Combustion of n-Hexanal Using Cu-Mn Composite Oxide Supported on TiO2
LI YueZHANG Ting-TingWANG JuanZHU ZhenJIABingYU Jiang*
(Research Center for Environmental Catalysis&Separation Process,College of Chemical Engineering, Beijing University of Chemical Technology,Beijing 100029,P.R.China)
In this study,we regulated copper loading and the atomic ratio of Cu/Mn and investigated the influence on interaction of the active species of Cu-Mn composite oxide catalyst supported on TiO2(CuxMny/ TiO2).The results indicate that 15%(w,mass fraction)copper loading and a 1:1 atomic ratio of Cu/Mn favors formation of analogous Cu-Mn spinel(Cu1.5Mn1.5O4).With increasing loading of copper,oxygen transfers from the lattice oxygen species to defect oxygen.The changes in copper loading and the Cu/Mn atomic ratio have a large influence on the interaction between the active components and the catalytic activity.We found that 90%n-hexanal can be degraded by Cu15Mn15/TiO2at 225°C(T90).The excellent performance of Cu15Mn15/TiO2is attributed to the higher contents of Cu2+and Oads,which can achieve a dual redox process with Mn2+in Cu15Mn15/TiO2.The analogous Cu-Mn spinel active ingredient can maintain high catalytic stability by redox cycles.
Copper loading capacity;Cu/Mn atomic ratio;CuxMny/TiO2;Active component; Catalytic oxidation;n-Hexanal
February 18,2016;Revised:May 3,2016;Published on Web:May 4,2016.
O643
10.3866/PKU.WHXB201605041
*Corresponding author.Email:jyu0017@aliyun.com;Tel:+86-10-64438933.
The project was supported by the National Natural Science Foundation of China(21207003)and Beijing Science and Technology Plan ofAction for Blue Sky Capital Projects,China(Z141100001014016).
国家自然科学基金(21207003)及北京市科技计划首都蓝天行动培育专项(Z141100001014016)资助项目
©Editorial office ofActa Physico-Chimica Sinica
[Article]
