外源性雌激素对人牙周膜干细胞骨分化能力影响的实验研究
2016-09-08潘峰丁寅李宝勇
潘峰 丁寅 李宝勇
·论著·
外源性雌激素对人牙周膜干细胞骨分化能力影响的实验研究
潘峰丁寅李宝勇
目的检测外源性雌激素对人牙周膜干细胞(PDLSCs)骨分化能力的影响。方法将体外培养的PDLSCs加入无酚红成骨诱导培养液和不同浓度的17β-E2[分为E10-7、E10-8、E10-9组和对照组(成骨诱导培养液+无水乙醇(0.01%)]-雌二醇[分为E10-7、E10-8、E10-9组、ICI组(成骨诱导培养液+ICI182780)、E10-7+ICI组(成骨诱导培养液+1×10-717β-E2+1×10-7ICI182780)],观察各组细胞形态、测定其增值水平、碱性磷酸酶(ALP)活性、Ⅰ型胶原合成能力。结果添加外源性雌激素后,细胞增殖加快,生长密集,呈螺旋状排列。PDLSCs的增殖发生变化,与对照组相比,第3、5天雌激素干扰组细胞增殖受到抑制(P<0.05),此后雌激素干扰组细胞增殖高于对照组(P<0.05),在不同药物浓度组间,E10-7组对细胞增殖影响最为明显,其细胞增殖水平高于E10-8、E10-9组(P<0.05)。ALP表达显示动态变化,自第3天开始,各组ALP表达均升高,而雌激素干扰组ALP表达量高于对照组(P<0.05),在不同药物浓度组间E10-7组ALP表达增加高于E10-8、E10-9组(P<0.05),与ICI组、E10-7+ICI组比较,差异无统计学意义(P>0.05); PDLSCsⅠ型胶原合成表达与对照组相比有增加趋势,且与药物浓度有剂量依赖关系。结论雌激素对PDLSCs成骨分化过程有促进作用,该作用与雌激素浓度密切相关。
干细胞;人牙周膜干细胞;雌激素;成骨分化
近年来,作为研究热点的干细胞,为牙周疾病的治疗提供了新思路。现已有研究证实人牙周膜内存在干细胞[1],具备多向分化及增殖潜能,在牙周疾病及骨质疏松的患者牙周组织改建中承担重要角色。而牙周疾病及骨质疏松的发生与体内雌激素水平低下密切相关[2-5],牙周膜干细胞(periodotal ligament stem cells,PDLSCs)是牙周改建和修复中主要的细胞类型,发挥重要作用,其在体内增殖及成骨分化时会受到雌激素怎样的影响,日益受到临床关注。本研究通过观察PDLSCs成骨分化过程中,雌激素对其增殖和碱性磷酸酶活性的影响,从而明确雌激素对牙周改建及再生产生影响的生理作用机制,为牙周病的临床治疗提供一定的实验依据。
1 材料与方法
1.1仪器与材料胶原酶,胰蛋白酶,Dispase酶,1%PBS,基质蛋白-l单克隆抗体(STRO-1,R&D,美国),α-MEM培养基(Gibco,美国),地塞米松、维生素C(Sigma,美国),β-甘油磷酸钠、胎牛血清(FBS,杭州四季青生物工程有限公司,中国),羊抗小鼠磁珠试剂盒(Dynalbiotech,美国), 70 μm细胞筛网(Falcon,美国),YJ-875型超静工作台(苏州净化设备厂,中国),CO2孵箱(Heraeus,德国),倒置相差显微镜及照相系统(Olympus,日本)。17β雌二醇(17β-E2),MTT,ICI182780(Sigma,美国),无酚红α-MEM培养基(GIBCO,美国),羟脯氨酸试剂盒(南京建成生物工程研究所),DMSO(AMRESCO,美国),活性炭及葡聚糖处理过的胎牛血清(杭州四季青公司),碱性磷酸酶(ALP)活性检测试剂盒(北京中山生物技术公司),酶联免疫检测仪(DG3022A)
1.2实验方法
1.2.1PDLSCs的筛选及培养方法参见文献[6]。
1.2.2PDLSCs增殖的测定(MTT):应用无水乙醇+粉剂17β-E2醇配制原液,浓度为1×104mol/L,-20℃冰箱保存待用。使用时取1×104mol/L原液10 ml,按浓度梯度稀释法用无水乙醇依次配成1×10-7、1×10-8、1×109mol/L 3个试验药物浓度,将不同浓度17β-E2工作液按照0.01%比例加入无酚红成骨诱导培养液(无酚红α-MEM+100 U/ml青霉素+5%活性炭及葡聚糖处理过的胎牛血清+100 μg/ml 链霉素+10 nmol/L地塞米松+10 mmol/L β-甘油磷酸钠松+50 μg/ml抗坏血酸),对照组加入浓度0.01%的无水乙醇,分组如下:①E10-7组:成骨诱导培养液+17β-E2(1×10-7mol/L);②E10-8组:成骨诱导培养液+17β-E2(1×10-7mol/L);③E10-9组:成骨诱导培养液+17β-E2(1×10-9mol/L);④对照组:成骨诱导培养液+无水乙醇(0.01%);取第三代生长良好的PDLSCs及牙周膜细胞,胰酶消化,离心收集后加入普通培养液吹打混匀,制成单细胞悬液,细胞密度1×103cells/ml,每孔200 μl接种于96孔塑料板,24 h后细胞贴壁,弃培养液,PBS清洗3次,加入对照及不同浓度17β-E2无酚红成骨诱导培养液,每组设6个重复孔,每孔180 μl。4组每2天加1次药,同时换液。MTT法测定药物作用后第1、3、5、8、11天的细胞增殖情况:每孔加入5%MTT 20 μl, 置入CO2孵箱继续孵育4 h,吸弃培养液及MTT,加入DMSO 150 μl,置于水平震荡仪充分震荡5 min后分光光度仪 (波长:490 nm)测光吸收值(OD值),以时间为横轴、OD值为纵轴绘制生长曲线,反映其对细胞增殖的影响。
1.2.3碱性磷酸酶(ALP)活性测定:雌激素浓度设定同前,将不同浓度17β-E2工作液按照0.01%比例加入无酚红成骨诱导培养液(无酚红α-MEM+100 U/ml青霉素+5%活性炭及葡聚糖处理过的胎牛血清+100 μg/ml 链霉素+10 nmol/L地塞米松+10 mmol/L β-甘油磷酸钠松+50 μg/ml抗坏血酸),对照组加入浓度0.01%的无水乙醇,分组如下:①对照组:成骨诱导培养液+无水乙醇(0.01%);②E10-7组:成骨诱导培养液+17β-E2(1×10-7mol/L);③E10-8组:成骨诱导培养液+17β-E2(1×10-8mol/L);④E10-9组:成骨诱导培养液+17β-E2(1×10-9mol/L);⑤ICI组:成骨诱导培养液+ICI182780(1×10-7mol/L);⑥E10-7+ICI组:成骨诱导培养液+17β-E2(1×10-7mol/L)+ICI182780(1×10-7mol/L)。取第三代生长良好的PDLSCs及牙周膜细胞,胰酶消化,离心收集后加入普通培养液吹打混匀,制成单细胞悬液,细胞密度1×104cells/ml,每孔200 μl接种于96孔塑料板,24 h后细胞贴壁,吸弃培养液,PBS清洗3次,加入对照及不同浓度17β-E2的无酚红成骨诱导培养液,每孔180 μl,每组设8个重复孔。6组每2天加药1次,并同时换液。测定药物作用后各组第1、3、5、8、11、14天碱性磷酸酶活性。具体步骤为:吸弃培养液,PBS洗涤2次,再加入0.2% TritonX-100 50 μl,4℃环境温度下过夜,按试剂盒说明先后加入缓冲液、基质液各50 μl,充分混匀,37℃孵育15 min,加入显色剂150 μl,置于分光光度计(520 nm波长)测OD值,确定其对细胞分化的影响。
1.2.4Ⅰ型胶原合成能力测定(羟脯氨酸含量的测定):雌激素浓度设定及分组同前,取第三代生长良好的PDLSCs及牙周膜细胞,胰酶消化,离心收集后加入普通培养液吹打混匀,制成单细胞悬液,细胞密度5×104cells/ml,每孔100 μl接种于96孔塑料板,24 h后细胞贴壁,吸弃培养液,PBS清洗3次,加入对照及不同浓度17β-E2的无酚红成骨诱导培养液,每组设8个重复孔,每孔180 μl,隔日换液加药1次。细胞培养3 d 后,按照羟脯氨酸试剂盒进行检测。
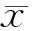
2 结果
2.1雌激素作用下PDLSCs形态学观察添加外源性雌激素后,细胞增殖加快,生长密集,呈螺旋状排列。见图1。

E2干扰前(HE×40)E2干扰后(HE×40)
图1雌激素干扰前后PDLSCs形态学观察
2.2PDLSCs增殖水平测定在生理浓度17β-E2作用下,PDLSCs的增殖发生变化,与对照组相比,前3 d雌激素干扰组细胞增殖受到抑制,此后雌激素干扰组细胞增殖高于对照组,在不同药物浓度组间,1×10-7mol/L组对细胞增殖影响最为明显,其细胞增殖水平高于其余2组。见图2,表1。
2.3碱性磷酸酶(ALP)活性测定生理浓度17β-E2醇作用下,PDLSCs ALP的表达发生动态变化,自第3天开始,各组ALP表达均升高,而雌激素干扰组ALP表达量高于对照组,在不同药物浓度组间E10-7组ALP表达增加高于其余2组。见图3,表2。
2.4Ⅰ型胶原合成能力测定在不同生理浓度17β-E2作用下,PDLSCsⅠ型胶原合成表达与对照组相比有增加趋势,且与药物浓度有剂量依赖关系,在不同药物浓度组间1×10-7组作用最为明显。见图4。
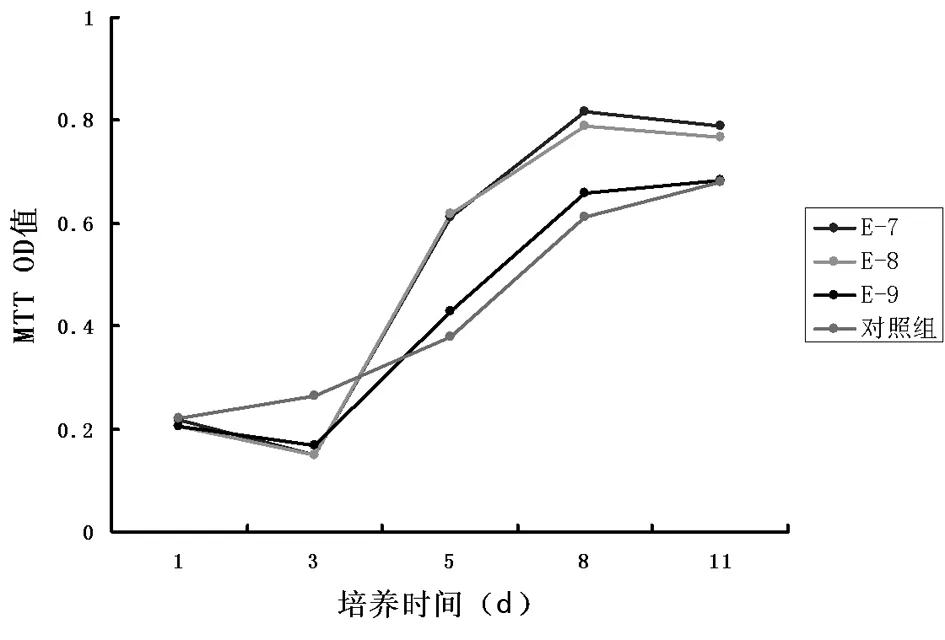
图2 不同浓度雌激素作用下PDLSCs的增殖效应

±s

图3 不同浓度雌激素作用下PDLSCs的ALP表达变化

表2 不同浓度雌激素作用下PDLSCs的ALP表达变化 ±s
注:不同浓度组间方差分析F=5.21,P=0.0231
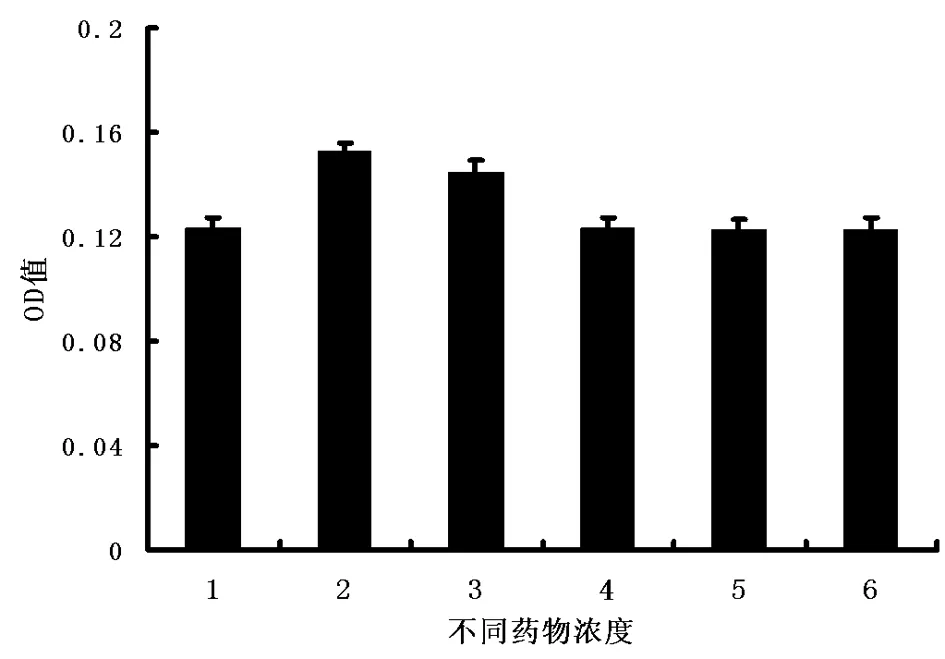
图4 不同浓度雌激素作用下PDLSCs胶原合成的变化
3 讨论
牙周膜内含有多种细胞,其中成牙骨质细胞、成骨细胞、成纤维细胞是其主要功能细胞,负责生成牙骨质、牙槽骨及牙周韧带,完成牙周组织结构的更新及再生。牙周膜内存在少量未分化间充质细胞PDLSCs,是上述功能细胞的前体细胞,Seo等[1]的研究证实牙周膜干细胞具有横向分化能力,可分化为牙髓母细胞、脂肪细胞及纤维母细胞,在体外微环境下,可分化成为成牙骨质细胞或成骨细胞,把牙周膜干细胞植入免疫缺陷小鼠体内后可形成牙骨质-牙周膜样结构。在明确PDLSCs在牙周改建及再生过程中的重要性之后,雌激素在牙周改建和牙周疾病的发病及治疗过程中,对PDLSCs有何影响是雌激素对牙周组织功能作用机制中的重要环节。由此,在本实验中我们以不同浓度的外源性雌激素17β-E2对处于成骨分化诱导中的PDLSCs进行干扰,以MTT法测定细胞增殖变化,并检测ALP的表达变化,以明确在成骨过程中不同生理浓度的雌激素对PDLSCs的增殖及成骨活性的影响。在前述实验中,我们证实了在PDLSCs中有ER的两种亚型:ERα及ERβ表达,而且在雌激素作用下,两种受体的表达量均增加,雌激素对雌激素受体的表达有上调作用,据此,在本研究的碱性磷酸酶测定中,我们设立了ER抑制剂ICI182780及ICI182780+17-βE2 2组对照,以此进一步明确在成骨过程中ER的功能作用。结果显示:(1)在生理浓度17β-E2作用下,PDLSCs的增殖发生变化,与对照组相比,第3天雌激素干扰组细胞增殖受到抑制,此后雌激素干扰组细胞增殖高于对照组,各组在第8天进入平台期。在不同药物浓度组间,E10-7组对细胞增殖影响最为明显,其细胞增殖水平高于其余2组,在第1天各组差异无统计学意义(P>0.05),在第3天、第5天、第8天、第11天各组差异有统计学意义(P>0.05)。(2)在生理浓度17β-E2作用下,PDLSCs ALP的表达发生动态变化,自第3天开始,各组ALP表达均升高,而雌激素干扰组ALP表达量高于空白对照、ICI182780及ICI182780+17β-E2组,第8天达到峰值,在不同药物浓度组间E10-7组ALP表达增加高于其余2组。空白对照、ICI组及E10-7+ICI组在各时间点差异均无统计学意义(P>0.05),说明在PDLSCs成骨过程中,ER发挥了关键作用。
雌激素在人体内作用广泛,除全身作用外,雌激素对正常牙周组织及其细胞成分也有重要的功能作用,Tanaka等[7]研究发现,大鼠去卵巢组切除双侧卵巢60 d 后,与对照组相比,骨小梁体积和数量减少明显,同时,密度明显下降,牙槽骨变薄,骨吸收及形成参数明显高于对照组,在骨吸收表面可见大量破骨细胞,这一结果提示雌激素水平的降低将诱发牙槽骨呈骨质疏松化,并加重骨组织的破坏。还有学者用免疫组化染色方法观察不同条件下雌性SD大鼠在第一磨牙牙周组织中的骨形成蛋白(BMP) 染色阳性强度[8],与正常对照组比较,雌激素治疗组在牙周组织中的BMP染色增强,其中张力区染色改变最为明显,而骨质疏松组的染色减弱。另外,破骨细胞染色在骨质疏松组明显增强,在雌激素治疗组减弱,说明雌激素能够促进成骨细胞及骨细胞分泌BMP,从而增强成骨作用,并同时抑制破骨细胞的活性。Morishita等[9]在体外培养的人牙周膜细胞中加入雌激素,发现细胞的骨钙素分泌增多, 在进一步的研究中,还发现雌激素可促进牙周膜细胞碱性磷酸酶的表达以及矿化结节的形成[10],提示雌激素有影响牙周组织的再生能力。也有学者研究发现雌激素对牙周膜细胞的增殖,以及其胞外基质的合成不起作用[11]。在本研究中,17β-E2呈剂量依赖性促进PDLSCs的增殖,由于PDLSCs在牙周再生和改建中有重要作用,提示对于绝经后女性,由于雌激素水平降低,不仅导致骨丢失增加,而且可能会影响到牙周干细胞的增殖,进而影响牙周组织改建,牙周附着丧失风险加大。
ALP分布于体内几乎所有器官,其作用机制为通过水解磷酸酶、破坏矿化抑制剂,并作为钙结合蛋白和磷酸基转运子,从而促进矿化。ALP是生物矿化和成骨样细胞的特征性标记,因此,其活性的高低能够反映相应细胞向成骨方向转化的趋势[12-14]。已有研究显示:在牙周膜细胞前体细胞中ALP阳性细胞比率与矿化组织形成量成正比[15]。因而ALP活性已成为观察牙周膜细胞分化功能的一项重要指征。羟脯氨酸是前胶原、胶原蛋白合成所必需的前体氨基酸,在胶原蛋白中羟脯氨酸占13.4%,在弹性蛋白中含量极少,而在其他蛋白中均不存在,因此,羟脯氨酸可较为灵敏地反映Ⅰ型胶原的分泌情况[16]。Plant等[17]对雌性小鼠成骨细胞在雌激素作用下的胶原表达进行了研究,发现雌激素可明显促进小鼠成骨细胞Ⅰ型胶原的分泌。由于ALP和Ⅰ型胶原分别是成骨细胞早期及晚期分化的重要指标[18,19],本研究结果显示17-β雌二醇表现为剂量依赖性增加ALP活性及Ⅰ型胶原的分泌,说明雌激素可促进PDLSCs向成骨细胞的分化,以及基质矿化的形成。在本研究中我们还设立了ER抑制剂ICI182780及ICI182780+17β-E2对照组,以此探讨ER在雌激素促进PDLSCs成骨分化过程中的作用,结果表明,抑制剂组与空白对照组在各检测时间点差异均无统计学意义(P>0.05),提示雌激素对PDLSCs的成骨分化的促进作用依赖于ER。在前述实验中我们证实PDLSCs表达ER两种亚型:ERα及ERβ,且ERα表达高于ERβ,两种受体在PDLSCs成骨分化中的作用有何差异尚不清楚,需要在后续研究中进一步探讨。
综上所述,雌激素能够促进PDLSCs的成骨分化过程,这一促进作用和ER及雌激素浓度密切相关。
提示我们,绝经后女性易患牙周疾病可能不仅与雌激素缺乏导致的骨丢失相关,而且与雌激素缺乏引发的局部牙周组织代谢及改建功能障碍有密切联系,前者是全身因素,后者为局部因素,而在局部因素中,PDLSCs的相关研究可能会为牙周病和正畸临床及基础研究提供一种新的思路。
1Seo BM, Miura M, Gronthos S, et al. Investigation of multipotent postnatal stem cells from human periodontal ligament. Lancet,2004,364: 149-155.
2朱宪彝,郭世绂主编.代谢性骨病学.第1版.天津:天津科学出版社,1989.161-163.
3Ronderos M,Jacobs DR,Himes JH,et al.Associations of periodontal disease with femoral bone mineral density and estrogen replacement therapy: cross-sectional evaluation of US adults from NHANES III.J Clin Periodontol,2000,27:778-786.
4Hildebolt CF, Pilgram TK, Yokoyama- Crothers N, et al. The pattern of alveolar crest height change in healthy postmenopausal women after 3 years of hormone/estrogen replacement therapy.J Periodontol,2002,73:1279-1284.
5Civitelli R, Pilgram TK, Dotson M, et al. Alveolar and postcranial bone density in postmenopausal women receiving hormone/estrogen replacement therapy: a randomized, double-blind, placebo-controlled trial. Arch Int Med,2002,162:1409-1415.
6高秦,刘宏伟,金岩. 免疫磁珠法分离纯化人牙周膜干细胞. 临床口腔医学杂志,2006,22:520-522.
7Tanaka M, Ejiri S, Toyooka E, et al. Effects of ovariectomy on trabecular structures of rat alveolar bone. J Periodontal Res,2002,37:161-165.
8金作林,丁寅,李潇,等. 骨质疏松大鼠雌激素治疗后牙周组织中骨形成蛋白的分布. 牙体牙髓牙周病学杂志,2000,10:204-206.
9Morishita M, Yamamura T, Bachchu MA, et al. The effects of oestrogen on osteocalcin production by human periodontal ligament cells. Arch Oral Biol,1998,43:329-333.
10Morishita M, Yamamura T, Shimazu A, et al. Estradiol enhances the production of mineralized nodules by human periodontal ligament cells.J Clin Periodontol,1999,26:748-751.
11Jonsson D, Wahlin A, Idvall I,et al. Differential effects of estrogen on DNA synthesis in human periodontal ligament and breast cancer cells. J Periodontal Res,2005,40:401-406.
12Arceo N, Sauk JJ, Moehring J, et al. Human periodontal cells initiate mineral - like nodules in vitro.J Periodontol,1991,62:499-503.
13Nojima N, Kobayashi M, Shionome M, et al. Fibroblastic cells derived from bovine periodontal ligaments have the phenotypes of osteoblasts.J Periodont Res,1990,25:179-185.
14许彦枝,邹慧儒. 新生牛牙周膜细胞的生物学特性研究.牙体牙髓牙周病学杂志,2006,16: 330-332.
15Liu HW,Yacobi R,Savion N,et al.A collagenous cementum-derived attachment protein is a marker for progenitors of the mineralized tissue-forming cell lineage of the periodontal ligament. J Bone Miner Res,1997,12:1691-1699.
16王春先,周磊,周东风,等.雌激素对大鼠骨髓基质细胞增殖和分化的影响.口腔颌面修复学杂志,2005,6:246-248.
17Plant A, Tobias JH. Characterisation of the temporal sequence of osteoblast gene expression duringEstrogen-induced osteogenesis in female mice. J Cell Biochem,2001,82:683-691.
18Maccarinelli G, Sibilia V, Torsello A, et al. Ghrelin regulates proliferation and differentiation of osteoblastic cells. J Endocrinol, 2005,184:249-256.
19Byers BA,Garcia AJ.Exogenous Runx2 expression enhancesin vitro osteoblastic differentiation and mineralization in primary bone marrow stromal cells. Tissue Eng,2004,10:1623-1632.
Experimental study on the effects of exogenetic estrogen on the ability of human periodontal ligament stem cell osteogenic differentiation
PANFeng*,DINGYin,LIBaoyong.
*DepartmentofStomatology,Xi’anTrafficUniversityStomatologicalHospital,Xi’an710004,China
ObjectiveTo investigate the effects of exogenetic estrogen on the differentiation ability of human periodontal ligament stem cell (PDLSCs) in vitro.MethodsThe PDLSCs were cultured in non-phenol red osteogenesis induction medium with different concentrations of 17β-E2 (E10-7,E10-8,E10-9),moreover, which were cultured in osteogenesis induction medium+0.01% dehydrated alcohol (control group), besides,-which were cultured in the medium with different concentrations of estradiol (E10-7,E10-8,E10-9) and were cultured in osteogenesis induction medium+ICI182780 (ICI group), and osteogenesis induction medium+ 10-7β-E2+10-7ICI182780 (10-7+ICI group),respectively.The cell shape, cell proliferation activity,alkaline phosphatase (ALP) activity,the synthesis ability of typeⅠcollagen were detected in every group.ResultsAfter treated by exogenetic estrogen,the cell proliferation was speeded up,cell growth was intensived,with spiral arrangement. As compared with that in control group, the cell proliferation on 3 days,5 days in estrogen intervention group was obviously inhibited (P<0.05),moreover, the cell proliferation in estrogen intervention group was higher than that in control group (P<0.05). Among difeerent drug concentration groups, the effects in E10-7group on cell proliferation were the most obvious,and the cell proliferation levels in E10-7group were significantly higher than those in E10-8group and E10-9group (P<0.05). The espression of ALP showed dynamic changes, the levels of ALP from the third day in all the groups were increased,however,which in estrogen intervention group were significantly higher than those in control group (P<0.05). Among different drug concentration groups, the levels of ALP in E10-7group were significantly higher than those in E10-8group and in E10-9group (P<0.05). However there were no significant differences between ICI group and E10-7+ICI group (P>0.05). As compared with that in control group,the type Ⅰ collagen synthesis of PDLSCs had an enhancement trend,moreover,with a drug dose-dependent way.ConclusionThe estrogen can promote osteogenic differentiation process in PDLSCs,moreover, its action is closely correlated to estrogen concentration.
stem cell;human periodontal ligament stem cell;estrogen;osteogenic differentiation
10.3969/j.issn.1002-7386.2016.17.015
710004西安市,西安交通大学口腔医院正畸科(潘峰);中国人民解放军第四军医大学口腔医院正畸科(丁寅);中国人民解放军第401医院口腔科(李宝勇)
R 781.4
A
1002-7386(2016)17-2611-05
2016-02-15)
