基因检测在结直肠癌患者术后化疗中的临床意义
2016-09-05高峰畏雷泽华蒋康怡张英毅王志旭乐山市人民医院普通外一科四川614000
高峰畏,雷泽华,陈 雷,蒋康怡,张英毅,王志旭(乐山市人民医院普通外一科,四川614000)
基因检测在结直肠癌患者术后化疗中的临床意义
高峰畏,雷泽华△,陈雷,蒋康怡,张英毅,王志旭(乐山市人民医院普通外一科,四川614000)
目的探讨结直肠恶性肿瘤组织的切除修复交叉互补基因1(ERCC1)、胸腺嘧啶合成酶(TS)mRNA表达水平及尿苷二磷酸葡萄糖醛酸转移酶1A1(UGT1A1)基因多态性检测在结直肠癌患者术后化疗中的临床意义。方法选取该院2012年8月至2015年3月收治的进展期结直肠癌患者178例,分为研究组(93例)和对照组(85例)。对照组采用常规化疗方法,研究组采用个体化化疗方法,分别进行术后化疗。研究组通过检测UGT1A1基因多态性及ERCC1、TS mRNA表达水平,决定患者选用安全、有效的化疗方案。比较两组患者化疗后不良反应发生率、无病生存率(DFS)和无进展生存期(PFS)。结果研究组患者中位PFS长于对照组,化疗后2年DFS高于对照组,肝功能损害、腹泻、血液毒性和血尿素氮升高发生率较对照组低,差异均有统计学意义(P<0.01);而神经毒性、心脏毒性和血肌酐升高发生率与对照组比较,差异均无统计学意义(P>0.05)。结论ERCC1、TS mRNA表达水平及AUGT1A1基因多态性检测能使进展期结直肠癌患者在临床个体化化疗中获益,延长PFS,提高DFS,降低部分毒性反应发生率。
基因;多态现象,遗传;结直肠肿瘤;手术后期间;抗肿瘤药/毒性
尽管近年来结直肠癌发病率和致死率呈下降趋势[1],但在我国男、女性发病率分别居癌症第5位和第3位,病死率分别居第5位和第6位[2]。手术、化疗和靶向治疗是目前治疗结直肠癌的主要方法,其中化疗作为局部根治术后辅助治疗或姑息手术后的主要治疗手段对提高患者生存率具有重要意义。如何选择最佳化疗方案,避免使用无效、不良反应大的化疗药物一直长期困扰着临床医生。近年来,通过检测癌特异性基因mRNA表达水平,可反映患者对化疗药物的敏感性和降低不良反应风险,从而实现结直肠癌化疗用药的个体化,提高疗效,降低不良反应发生率。本研究通过对93例结直肠肿瘤患者进行基因检测,采用个体化化疗方案,并与采用常规化疗方法的85例结直肠癌患者进行比较,观察相关指标的差异,现报道如下。
1 资料与方法
1.1一般资料选取本院2012年8月至2015年3月收治的进展期结直肠癌患者93例作为研究组,其中男62例,女31例;年龄32~85岁;肿瘤分化程度:高分化21例,中分化61例(包含中-低分化、高-中分化),低分化11例;分期:Ⅱ期4例,Ⅲ期89例;部位:直肠癌55例,结肠癌38例。选取同期收治的进展期结直肠癌患者85例作为对照组,其中男49例,女36例;年龄36~78岁;分化程度:高分化12例,中分化65例,低分化8例;分期:Ⅱ期6例,Ⅲ期79例;类型:直肠癌46例,结肠癌39例。两组患者一般资料比较,差异均无统计学意义(P>0.05)。纳入研究的Ⅱ期患者均伴不确定切缘阳性等高危因素,需进行术后化疗[1]。
1.2材料与试剂
1.2.1DNA提取和定量患者的病理活检组织。QIA-amp DNA Mini Kit(50)购自Qiagen公司,5424R台式高速冷冻离心机购自Eppendorf公司,NanoDrop 2000超微量分光光度计购自Thermo Scientific公司,无RNA酶枪头购自Axygen公司,无RNA酶1.5 mL的EP管购自Eppendorf公司。
1.2.2PCR反应One-Step Real-Time RT-PCR Master Mixes购自ABI公司,TaqMan®Universal Master MixⅡ,withUNG购自ABI公司,96孔板和封口膜购自Axygen公司,针对目标基因和内标基因设计的特异性引物和探针购自ABI公司,ABI7500荧光定量PCR仪购自ABI公司。
1.3方法
1.3.1化疗方法对照组患者采用常规化疗方法。研究组患者采用个体化化疗方法,通过检测患者的切除修复交叉互补基因1(ERCC1)、胸腺嘧啶合成酶(TS)mRNA表达水平及尿苷二磷酸葡萄糖醛酸转移酶1A1(UGT1A1)多态性,指导临床选择最佳化疗方案:(1)ERCC1 mRNA低表达者选用奥沙利铂,TS mRNA低表达者选用氟尿嘧啶或卡培他滨类药物;(2)UGT1A1基因多态性检测无突变者选用伊立替康。
1.3.2检测方法基因表达水平检测采用荧光定量PCR进行相对定量检查,以内参基因GAPDH在体内的表达量为基数,通过ΔCt(ΔCt=Ct目标基因-Ct内参基因)判断目标基因表达水平。
1.3.2.1基因表达水平检测(1)RNA提取:参照试剂盒说明书进行RNA提取和定量;(2)RT-PCR:PCR的组分分别为RT-PCR反应混合物(Mix),针对目标基因设计的上、下游引物,针对目标基因设计的荧光探针,针对内参基因设计的上、下游引物,针对内参基因设计的荧光探针、肿瘤组织RNA等(组分用量需参照《One-Step Real-Time RT-PCR Master Mixes使用手册》优化确定)。PCR反应条件:50℃15 min、95℃2 min;95℃15s、60℃ 1 min 40循环;60℃1 min,其中60℃1 min的温度需根据探针的解链温度(TM)值进行优化调整。
1.3.2.2基因突变检测(1)DNA提取:参照试剂盒说明书进行DNA提取和定量;(2)荧光定量PCR:PCR的组分分别为PCR Mix,针对目标基因设计的上、下游引物,针对目标基因设计的荧光探针,针对内参基因设计的上、下游引物,针对内参基因设计的荧光探针、肿瘤组织DNA等(组分用量需参照《TaqMan®Universal Master MixⅡ,with UNG使用手册》优化确定,内标基因可选取一个管家基因)。PCR反应条件:50℃2 min、95℃10min;95℃15 s、60℃1 min 40循环;60℃1 min,其中60℃1 min中的温度需根据探针的TM值进行优化调整。
1.3.2.3检测结果判定标准以ΔCt为指标进行结果判读,ΔCt<2.9为高表达,ΔCt>6.05为低表达,ΔCt为2.9~6.05为中表达。
1.3.3观察指标观察两组患者不良反应发生情况、无病生存率(DFS)、无进展生存期(PFS)等。
1.3.4化疗不良反应分级根据世界卫生组织2003年化疗不良反应分级标准分为0、Ⅰ、Ⅱ、Ⅲ、Ⅳ级,见表1。
1.4统计学处理应用SPSS17.0统计软件进行数据分析,计数资料以率或构成比表示,采用χ2检验、Fisher确切概率法,Kaplan-Meier法描绘生存曲线,Log-rank法进行相关性分析;采用Cox比例风险回归模型进行多因素分析。检验水准α=0.05,P<0.05为差异有统计学意义。

表1 化疗不良反应分级
2 结 果
2.1研究组患者ERCC1、TS mRNA表达情况研究组患者ERCC1、TS mRNA均以低表达为主,见表2。
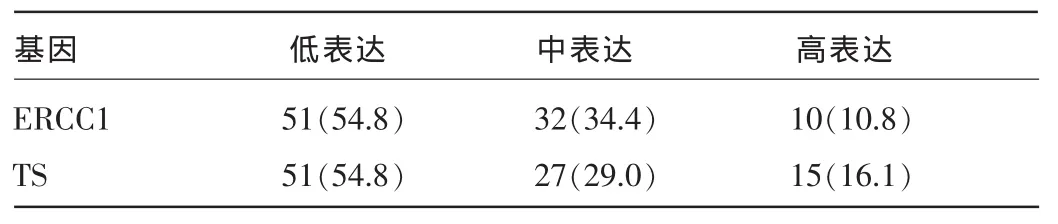
表2 研究组患者ERCC1、TS mRNA表达情况[n(%),n=93]
2.2研究组患者UGT1A1多态性检测结果93例患者中低度风险(6/6 TA无突变)66例(71.0%),中度风险(6/7 TA杂合突变)26例(28.0%),高度风险(7/7 TA纯合突变)1例(1.1%)。
2.3两组患者化疗方案比较研究组患者根据基因检测结果选择化疗方案,对照组根据美国国立综合癌症网络(NCCN)结直肠癌治疗指南(2016年版)[1]选择化疗方案。两组患者采用的化疗方案见表3。
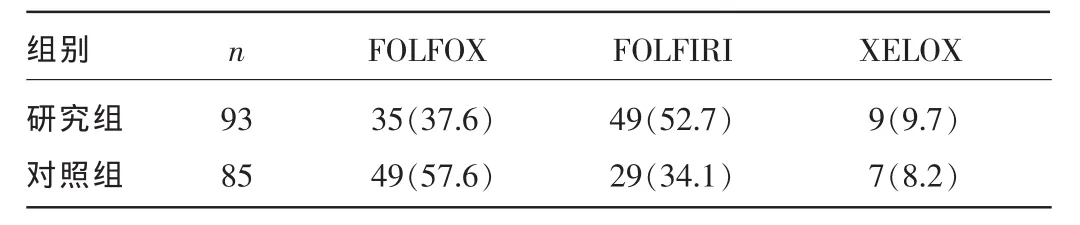
表3 两组患者化疗方案比较[n(%)]
2.4两组患者化疗后PFS比较研究组患者PFS长于对照组,差异有统计学意义(P<0.01)。见表4。两组患者化疗后无进展生存曲线图见图1。

表4 两组患者化疗后PFS比较
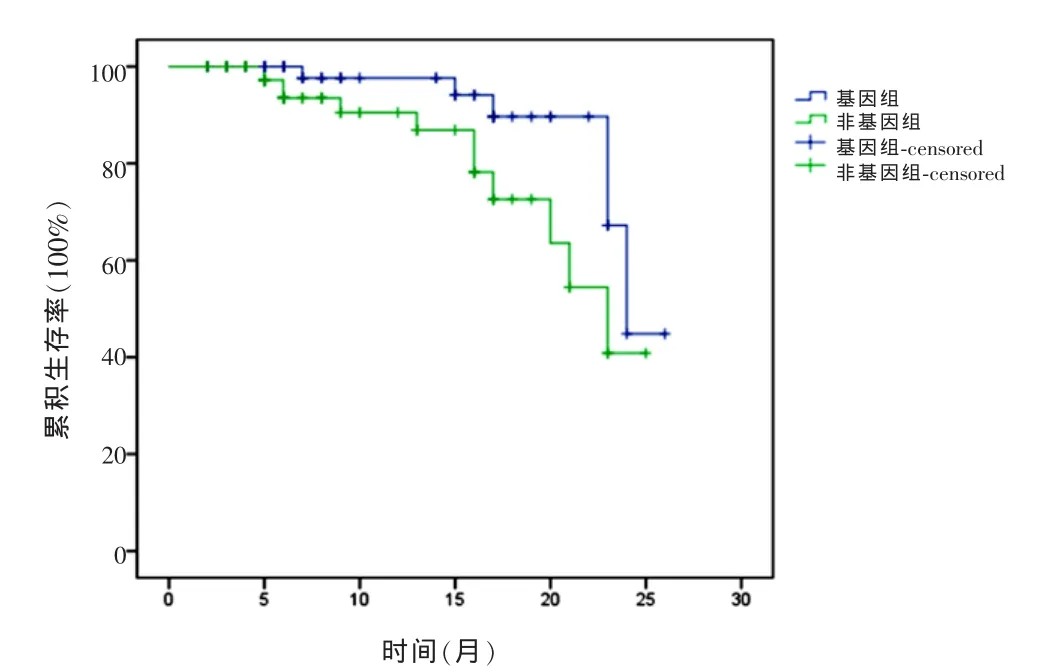
图1 两组患者化疗后无进展生存曲线图
2.5两组患者化疗后DFS比较研究组1年(包括1年内)无病生存人数92例,DFS为98.9%;2年(包括2年内)无病生存人数87例,DFS为93.5%;对照组对应数据为80(94.1%)、73(85.9%)。两组化疗后2年DFS比较,差异有统计学意义(χ2=5.420,P<0.05)。
2.6两组患者不良反应发生情况比较研究组患者腹泻、白细胞减少、血尿素氮升高和肝功能损害发生率较对照组低,差异均有统计学意义(P<0.01);而血肌酐升高、心脏毒性和神经毒性发生率与对照组比较,差异均无统计学意义(P>0.05)。见表5。

表5 两组患者不良反应发生情况比较
3 讨 论
高危Ⅱ、Ⅲ期结直肠癌手术联合辅助化疗可使患者在长期生存方面获益[1]。对该类结直肠癌患者的术后化疗,2015版NCCN指南明确提出,不具有高危因素的Ⅱ期患者可选择临床观察或考虑给予卡培他滨或氟尿嘧啶/甲酰四氢叶酸治疗;高危Ⅱ、Ⅲ期患者考虑给予辅助化疗方案包括氟尿嘧啶/甲酰四氢叶酸、卡培他滨、FOLFOX(Ⅲ期优选)、CapeOX(卡培他滨方案,Ⅲ期优选)或FLOX(5-氟尿嘧啶、亚叶酸钙,奥沙利铂方案)[1]。但对患者而言,选择哪种化疗方案更安全、有效,最大限度地减少对生活质量的影响,避免不断调整方案,降低治疗成本,是应该被关注的问题[3]。由表3可见,研究组患者中直接选择FOLFOX方案35例(ERCC1 mRNA低表达),选择FOLFIRI方案49例(UGT1A1基因多态性检测为低风险),选择XELOX方案9例(TS mRNA低表达)。对照组患者中选择FOLFIRI方案29例(因肿瘤分期相对较晚),常规选择FOLFOX方案49例,选择XELOX方案5例(因患者年龄大、其余方案不良反应大或其他原因而选用)。
经验性化疗中只有30%~40%患者受益明显[4],原因在于这些与化疗疗效相关的基因表达在不同个体中存在很大差异[5],按基因检测结果可选择安全、有效、不良反应最小的化疗方案,从而使患者在术后化疗中更加获益。
DNA修复是铂类药物耐药性产生的主要原因[6-8]。ERCC1参与修复铂类化疗药物而导致肿瘤细胞DNA损伤。临床研究已证实,其表达水平与多种癌症铂类化疗疗效和患者生存期呈负相关,即ERCC1低表达患者对铂类药物更敏感[9-11]。
TS在正常细胞代谢情况下催化脱氧尿苷酸转变为脱氧胸苷酸,当氟尿嘧啶进入体内即活化为氟尿嘧啶脱氧核苷酸,氟尿嘧啶脱氧核苷酸代替脱氧尿苷酸与TS结合,使TS失活,不能合成脱氧胸苷酸,从而影响DNA合成,该途径也是氟尿嘧啶发挥抗癌作用的主要途径[12-13]。TS基因多态性使TS蛋白功能和表达存在差异,造成不同患者应用氟尿嘧啶治疗的疗效差别很大[14-16]。
有研究发现,位于UGT1A1基因启动子区的插入缺失多态与伊立替康引起的中性粒细胞减少或腹泻具有明显相关性;插入多态UGT1A1*28(7 TA)可降低转移酶活性,携带UGT1A1*28(7 TA)的结直肠癌患者对伊立替康产生严重不良反应[17]。对中国人群的研究显示,携带该遗传多态7/7 TA基因型的个体较少,携带6/7TA基因型的患者较6/6 TA患者在接受伊立替康一线化疗后易出现不良反应,该研究建议杂合基因型患者接受治疗时应减少伊立替康用量[18];另一项以伊立替康为基础的二线联合化疗治疗进展期结直肠癌患者的研究也得出了类似结论[19]。
本研究选择178例进展期结直肠癌患者进行分析,对其中93例患者ERCC1、TS mRNA表达水平及UGT1A1基因启动子多态性进行检测,根据检测结果选择安全、有效、不良反应低的化疗方案,与另外85例患者比较,肝功能损害、腹泻、血液毒性和血尿素氮升高发生率较低,差异均有统计学意义(P<0.05)。因随访时间较短,本研究无法统计总生存期和总生存率,研究组患者PFS长于对照组,化疗后2年DFS高于对照组,在随访期内虽然差异不太明显,但均有统计学意义(P<0.05),不良反应发生率明显改善,患者在个体化化疗中获益。
随着肿瘤基因相关科学领域的交融、转化,肿瘤患者个体化差异正逐渐被了解,从而使特异性靶点检测和靶向治疗在肿瘤治疗方面有所突破。通过基因检测可指导制定治疗计划。如UGT1A1基因多态性检测及胸苷酸合成酶基因(TYMS)、乳腺癌1号基因(BRCA1)、微管蛋白β3[17-18]、ERCC1、微管解聚蛋白1、TS mRNA表达水平检测[20],以此反映结直肠癌化疗方案的安全性、有效性及不良反应风险。NCCN结直肠癌治疗指南(2015年版)明确建议[1]:应用铂类药物化疗方案前进行ERCC1 mRNA检测,根据检测结果决定是否采用该方案化疗可提高化疗效果。这已成为肿瘤个体化化疗的风向标,促使包括结直肠癌在内的肿瘤化疗更趋向个体化治疗。
综上所述,对高危险因素的Ⅱ、Ⅲ期结直肠癌患者实施UGT1A1基因多态性检测和ERCC1、TS mRNA表达水平检测,根据检测结果制定化疗方案能延长患者生存时间,有效提高化疗效果,降低化疗不良反应发生率,使患者获益。但更为确切的效果尚需更长时间的随访和更多的多中心大样本量随机对照研究证实。
[1] Bichakjian CK,Olencki T,Aasi SZ,et al.Basal Cell Skin Cancer,version 1.2016,NCCN clinical practice guidelines in oncology[J].J Natl Compr Canc Netw,2016,14(5):574-597.
[2]陈万青,张思维,曾红梅,等.中国2010年恶性肿瘤发病与死亡[J].中国肿瘤,2014,23(1):1-10.
[3]王征,周志祥.结直肠癌综合治疗的个体化原则[J].实用肿瘤杂志,2013,28(1):1-5.
[4]蒋蔚茹,刘杰.结直肠癌化疗进展[J].中国肿瘤,2011,20(3):200-203.
[5]乔艳,张捷.结直肠癌化疗的药物遗传学研究进展[J].肿瘤,2014,34 (11):1069-1074.
[6]Hong J,Han SW,Ham HS,et al.PhaseⅡstudy of biweekly S-1 and oxaliplatin combination chemotherapy in metastatic colorectal cancer andpharmacogenetic analysis[J].Cancer Chemother Pharmacol,2011,67(6):1323-1331.
[7]Ruzzo A,Graziano F,Loupakis F,et al.Pharmacogenetic profiling in patients with advanced colorectal cancer treated with first-line FOLFOX-4 chemotherapy[J].J Clin Oncol,2007,25(10):1247-1254.
[8]Li HY,Ge X,Huang GM,et al.GSTP1 ERCC1 and ERCC2 polymorphisms,expression and clinical outcome of oxaliplatin-based adjuvant chemotherapy in colorectal cancer in Chinese population[J].Asian Pac J Cancer Prev,2012,13(7):3465-3469.
[9]Chai H,Pan J,Zhang X,et al.ERCC 1 C118T associates with response to FOLFOX4 chemotherapy in colorectal cancer patients in Han Chinese[J]. Int J Clin Exp Med,2012,5(2):186-194.
[10]Yin M,Yan J,Martinez-Balibrea E,et al.ERCC1 and ERCC2 polymorphisms predict clinical outcomes of oxaliplatin-based chemotherapies in gastric and colorectal cancer:a systemic review and meta-analysis[J].Clin Cancer Res,2011,17(6):1632-1640.
[11]Lee KH,Chang HJ,Han SW,et al.Pharmacogenetic analysis of adjuvant FOLFOX for Korean patients with colon cancer[J].Cancer Chemother Pharmacol,2013,71(4):843-851.
[12]Popat S,Matakidou A,Houlston RS.Thymidylate synthase expression and prognosis in colorectal cancer:a systematic review and meta-analysis[J].J Clin Oncol,2004,22(3):529-536.
[13]Sulzyc-Bielicka V,Bielicki D,Binczak-Kuleta A,et al.Thymidylate synthase gene polymorphism and survival of colorectal cancer patients receiving adjuvant 5-fluorouracil[J].Genet Test Mol Biomarkers,2013,17(11):799-806.
[14]Qiu LX,Tang QY,Bai JL,et al.Predictive value of thymidylate synthase expression in advanced colorectal cancer patients receiving fluoropyrimidine-based chemotherapy:evidence from 24 studies[J].Int J Cancer,2008,123(10):2384-2389.
[15]Wang YC,Xue HP,Wang ZH,et al.An integrated analysis of the association between Ts gene polymorphisms and clinical outcome in gastric and colorectal cancer patients treated with 5-FU-based regimens[J].Mol Biol Rep,2013,40(7):4637-4644.
[16]Jang MJ,Kim JW,Jeon YJ,et al.Polymorphisms of folate metabolism-related genes and survival of patients with colorectal cancer in the Korean population[J].Gene,2014,533(2):558-564.
[17]Liu X,Cheng D,Kuang Q,et al.Association of UGT1A1*28 polymorphisms with irinotecan-induced toxicities in colorectal cancer:a meta-analysis in Caucasians[J].Pharmacogenomics J,2014,14(2):120-129.
[18]Cai X,Cao W,Ding H,et al.Analysis of UGT1A1*28 genotype and SN-38 pharmacokinetics for irinotecan-based chemotherapy in patients with advanced colorectal cancer:results from a multicenter,retrospective study in Shanghai[J].J Cancer Res Clin Oncol,2013,139(9):1579-1589.
[19]蔡讯,曹卫国,丁红华,等.UGT1A1*28基因多态性联合SN-38药代动力学检测在进展期结直肠癌以伊立替康为基础的二线治疗中的应用[J].肿瘤,2013,33(2):181-189.
[20]曾令海,王亚旭,谢凯,等.ERCC1 BRCA1 TYMS的mRNA表达水平和UGT1A1多态性检测在结直肠癌患者个体化化疗中的临床意义[J].现代医药卫生,2014,30(12):1761-1764.
Clinical significance of gene detection in postoperative chemotherapy in patients with advanced colorectal cancer
Gao Fengwei,Lei Zehua△,Chen Lei,Jiang Kangyi,Zhang Yingyi,Wang Zhixu(First Department of General Surgery,Leshan Municipal People′s Hospital,Leshan,Sichuan 614000,China)
ObjectiveToinvestigatetheclinicalsignificanceofdetectionofexcisionrepaircrosscomplementing1(ERCC1)gene,thymidylatesynthetase(TS)mRNAexpressionlevelsandgene polymorphism ofuridine diphosphate glucuronyltransferase1A1 (UGT1A1)of colorectal malignant tumor tissue in postoperative chemotherapy of the patients with advanced colorectal cancer. MethodsTotally 178 patients with advanced colorectal cancer in our hospital from August 2012 to March 2015 were selected and divided into the study group(n=93)and the control group(n=83)according to different chemotherapy schemes.The control group adopted the routine chemotherapy and the study group adopted the individualized chemotherapy.The two groups were respectively given postoperative chemotherapy.The study group determined to select safe and effective chemotherapy scheme by detecting the UGT1A1 gene polymorphism and the expression levels of ERCC1 and TS mRNA.the incidence rate of adverse reactions,disease free survival(DFS)and progression free survival(PFS)after chemotherapy were compared between the two groups. ResultsThe median PFS in the study group was longer than that in the control group,DFS after 2 years of chemotherapy in the study group was higher than that in the control group,and the incidence rates of liver function damage,diarrhea,hematotoxicity and increase of blood urea nitrogen in the study group were significantly higher than those in the control group,the differences were statistically significant(P<0.01),while the incidence rates of neurovirulence,cardiotoxicity and increase of serum creatinine had no statistically significant difference between the two groups(P>0.05).ConclusionThe detection of expression levels of ERCC1 and TS mRNA,and UGT1A1 gene polymorphism benefits the patients with advanced colorectal cancer in clinical individualized chemotherapy,prolongs PFS,enhances DFS and reduces the incidence rate of partial toxic reactions.
Genes; Polymorphism,genetic; Rectal neoplasms;Postoperative period;Antineoplastic agents/toxicity
10.3969/j.issn.1009-5519.2016.13.011
A
1009-5519(2016)13-1985-04
高峰畏(1985-),硕士研究生,主治医师,主要从事消化道肿瘤相关研究。
△,E-mail:707850255@qq.com。
(2016-02-17)
