采用DNA条形码技术检测马铃薯4种细菌病害
2016-09-02闵凡祥高云飞董学志王文重
魏 琪,闵凡祥,张 抒,高云飞,董学志,王文重,杨 帅
(黑龙江省农业科学院植物脱毒苗木研究所,黑龙江哈尔滨150086)
病虫防治
采用DNA条形码技术检测马铃薯4种细菌病害
魏琪*,闵凡祥,张抒,高云飞,董学志,王文重,杨帅
(黑龙江省农业科学院植物脱毒苗木研究所,黑龙江哈尔滨150086)
马铃薯易受到多种细菌病害的侵染,特别是检疫性病害和土传性病害,对马铃薯种薯进行全面的细菌病害检测势在必行。将检测检疫性细菌病害的DNA条形码技术应用在马铃薯4种细菌性病害(环腐病、青枯病、疮痂病和黑胫病)的检测中,探讨该项技术的应用可行性。采用已知菌株以明确该项技术的应用效果,结果表明,该项DNA条形码技术检测马铃薯环腐病和疮痂病的结果良好;检测青枯病可以确定到属;检测黑胫病时配合特异性基因,可获得良好的检测结果。该DNA条形码技术是标准性操作规程与测序技术相结合的一种方法,检测结果的准确性高,同时可以在大规模样品的检测工作中缩减工作量,提高检测效率。
DNA条形码技术;马铃薯;环腐病;青枯病;疮痂病;黑胫病
中国是世界第一大马铃薯生产国。马铃薯在实际生产中会受到多种病原细菌的影响而导致减产、甚至绝产。这些病原细菌引起的马铃薯病害分为2类:一类为允许率为“0”检疫性病害,如马铃薯环腐病和青枯病;另一类为非检疫性病害,但严重影响马铃薯生产的病害,如马铃薯黑胫病、软腐病及疮痂病。马铃薯种薯传播方式是上述细菌性病害大范围传播的重要途径之一。因此,对于马铃薯种薯进行主要细菌病害的检测势在必行。
1 材料与方法
1.1材料
供试菌株及待检马铃薯样品来源见表1。

表1 样品来源Table 1Source of sample
1.2方法
1.2.1DNA提取、PCR扩增及测序
采用北京天根生化科技(北京)有限公司的新型植物基因组提取试剂盒(DP320)提取所有样品的DNA。分子生物学试剂均为Takara公司产品。
扩增及测序引物、扩增体系及扩增条件参考欧盟内检疫性有害生物的DNA Barcoding数据库网站(www.q-bank.eu)内细菌鉴定流程中所推荐的方法,并进行必要的调整。所用引物均由英潍捷基(上海)贸易有限公司合成,其序列见表2和表3。
获得的扩增序列由英潍捷基(上海)贸易有限公司和华大基因科技股份有限公司进行测序。
根据最新流行病学资料显示[7-8],全球糖尿病患者人数在3.8亿左右,是目前最为严重的代谢性疾病之一,严重影响患者的生活质量和生活健康。糖尿病患者往往存在多饮、多食、多尿以及身体消瘦等临床症状,对糖尿病患者进行中医护理具有重要意义。中医认为人体是一个有机的整体,强调人与自然、环境的相互统一,中医学中,糖尿病(消渴)病机是阴津亏损、禀赋不足以及燥热偏盛等,所以强调在疾病的治疗和康复中保证患者的生活护理质量,从整体的角度出发。其次,中医特色护理具有个性化特征,针对不同个体患者和患者疾病的不同阶段[9],在中医辨证的基础上进行个体化指导,能够让治疗具有针对性,促进患者的康复。
1.2.2病害检测流程
本研究中主要检测的马铃薯细菌性病害种类有环腐病、青枯病、黑胫病和疮痂病,引起这4种病害的病原菌分别来自Clavibacter属、Ralstonia属、Pectobacterium属和Streptomyces属。研究中采用欧盟内检疫性有害生物的DNA Barcoding数据库网站(www.q-bank.eu)推荐的病害检测流程见图1。首先,根据16S rDNA的测序及Blast比对结果,初步判断各样品所含病原菌的属。在这个结果的基础上,分别使用其他基因,进行病原菌的进一步鉴定。其中,Clavibacter属和Streptomyces属采用DNA促旋酶B亚单位基因(GyrB);Ralstonia属采用DNA错配修复基因(mutS),Pectobacterium属采用基因组的基因。
1.2.3序列比对及同源性分析
由于采用的检测样品存在多种病原菌共同侵染的情况以及马铃薯块茎组织内含物相对复杂等情况,因此在DNA提取、PCR扩增和测序的过程中,均有可能会出现结果不佳的情况,所以本研究对结果不佳的样品进行汰出,以最终获得有效的病原菌基因序列的个体来进行分析。

表2 3种细菌扩增引物及测序引物Table 2Three kinds of primers used for PCR-sequencing bacteria

表3 Pectobacterium属细菌扩增引物及测序引物Table 3Primers used for PCR-sequencing Pectobacterium
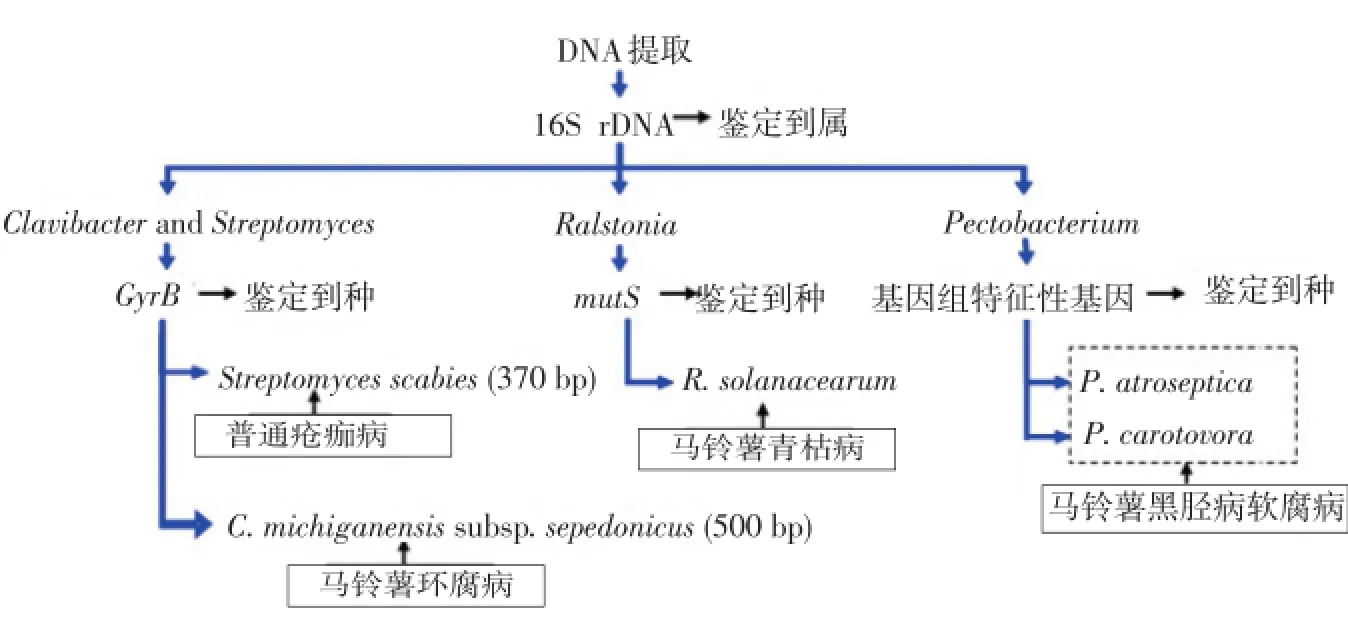
图1 马铃薯细菌病害检测方案Figure 1Detection scheme for potato bacterial diseases
采用Chromas软件对获得的碱基序列进行峰值图的检查,确定序列的准确性及截取有效片段长度,将确定有效测序结果与GenBank中的现有数据库进行Blast比对和分类学比较,判断被测样品中病原菌的属。利用MEGA6软件分析序列间的相似度,并构建系统发生树。
2 结果与分析
2.116S rDNA检测结果及分析
将供试样品进行16S rDNA序列扩增,YA-6无PCR产物,其他样品经琼脂糖凝胶电泳检测PCR产物情况(图2)。每个样品的PCR产物分别经过2条引物进行测序后,分析二者的重合序列,用该重合序列进行Blast比对,比对结果见表4。其中,样品1-1、HJ1、QK3、YA-4、ZN-1的测序结果不能获得有效的重合序列,因此不能进行16S rDNA的比对分析。
图2 供试样品16S rDNA-PCR结果Figure 216S rDNA-PCR results
2.2后续基因扩增及测序
根据表4中所示的16S rDNA序列比对结果,进行后续基因检测分析。
2.2.1Clavibacter属和Streptomyce属的GyrB基因扩增
样品HF1、YA-3、YA-5、28-2、YA-4进行550 bp的GyrB基因扩增,电泳结果见图3,从图3中可知,Streptomyce属的28-2也获得了扩增产物,其条带大小明显小于500 bp;Clavibacter属的HF1、YA-3、YA-5及YA-4均获得了550 bp左右的产物。YA-4的16S rDNA未获得重合序列,因此,仅进行GyrB基因的PCR扩增,未测序。样品HF1、YA-3、YA-5以及28-2进行GyrB基因序列测定。

表4 7个样品的16S rDNA序列比对结果Table 4Blast comparison with 16S rDNA sequences of seven samples

图3 Clavibacter属和Streptomyce属的GyrB基因扩增Figure 3GyrB-PCR results of Clavibacter and Streptomyce
2.2.2Ralstonia属的mutS基因扩增
样品QK1、QK3及1-1进行767 bp的mutS基因扩增,电泳结果见图4,从图4中可知,1-1未产生目的条带,而QK1和QK3均获得了与预期相似的目的条带,其中对QK1的mutS基因扩增产物进行测序分析。

图4 Ralstonia属的mutS基因扩增Figure 4mutS-PCR results of Ralstonia
2.2.3Pectobacterium属的基因扩增
样品HJ2和FL-1分别进行P.atrosepticum基因组和P.carotovorum基因组的特异性引物扩增及测序,电泳结果见图5和图6。从电泳图5中可知,HJ2扩增出P.atrosepticum基因组的特异性目的片段,而FL-1并未获得任何PCR产物。因此,HJ2的P.atrosepticum-PCR产物进行测序。从电泳图6中可知,样品HJ2和FL-1均未扩增出P.carotovorum基因组的特异性片段。

图5 P.atrosepticum基因组特异性扩增Figure 5PCR of P.atrosepticum by special primers
2.2.4序列比对分析
将样品HF1、YA-3、YA-5和28-2的GyrB基因序列测定结果、QK1的mutS基因测序结果和HJ2的P.atrosepticum基因组PCR产物的测序结果在GenBank进行Blast的比对分析,分析结果见表5。从表5可知,样品HF1、YA-3、YA-5的病害类型均为C.michiganensis subsp.sepedonicus;样品QK1为R.pickettii;样品HJ2为P.atrosepticum;样品28-2为S.scabiei。

图6 P.carotovorum基因组特异性扩增Figure 6PCR of P.carotovorum by special primers
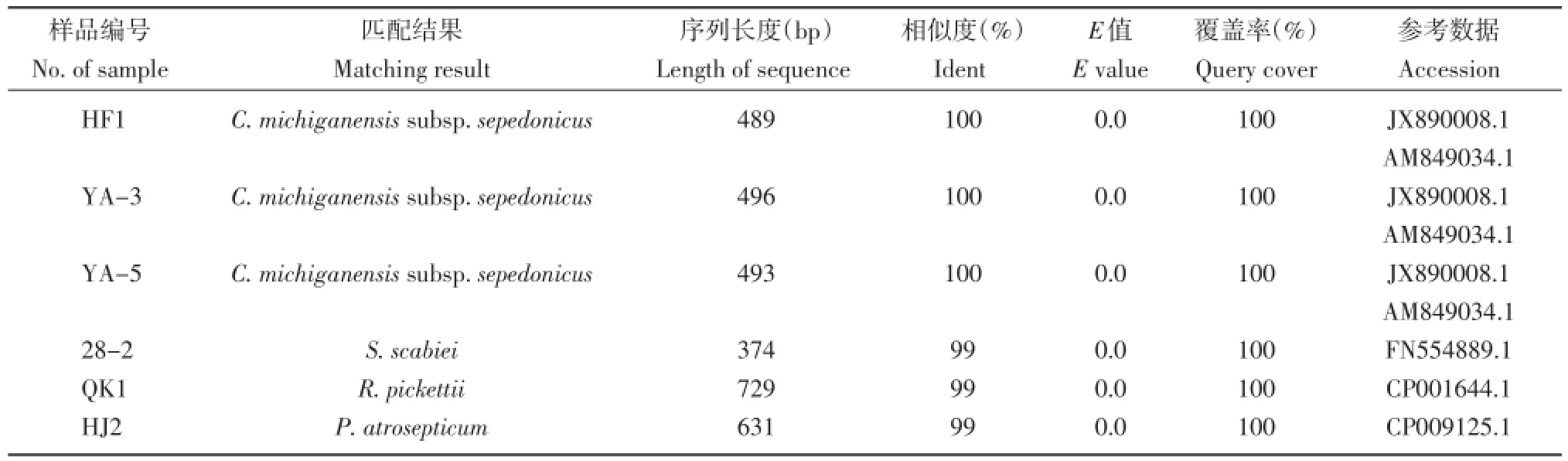
表5 6个样品的其他基因序列比对结果Table 5Blast comparison with other gene sequences of six samples
3 讨论
3.1DNA条形码技术检测结果的比较
4种病害的已知菌液中,HF1、HJ2和28-2的16S rDNA序列比对结果、GyrB基因鉴定结果与已知结果相一致;QK1的样品原为R.solanacearum,而本研究所使用的条码技术鉴定结果却为R.pickettii,该样品在“种”鉴定方面存在差异。
在病害待检的样品鉴定中,YA-3的16S rDNA序列比对结果与GyrB基因扩增及测序结果差异很大,YA-5的16S rDNA序列比对结果是未知菌株,但是,YA-3和YA-5的GyrB基因扩增的电泳图中可明显看出二者与HF1一致,经过测序后比对发现,二者确实为C.michiganensis subsp.sepedonicus,与HF1结果一致。而且,YA-3、YA-4和YA-5经环腐病Real-Time PCR方法验证均为C.michiganensis subsp.sepedonicus[14],与应用DNA条形码技术的检测结果一致。因此,本研究应用的DNA条形码技术检测C.michiganensis subsp.sepedonicus时,采用16S rDNA序列与GyrB基因相结合,其中GyrB基因鉴定结果良好,田茜等[12]的分析认为cpn60基因具备作为Clavibacter属内亚种级别区分鉴定用基因的潜力。但是,在实际应用中,GyrB基因即可满足马铃薯病害检测的要求。主要原因是,该基因可以将2种革兰氏阳性菌引起的马铃薯环腐病和疮痂病区分开来,获得准确的马铃薯疮痂病检测结果。
3.2复合侵染样品对DNA条形码技术检测结果的影响
DNA条形码技术在应用的过程中对被测样品的DNA质量要求较高,特别是在16S rDNA序列的比对中[12]。在本研究中,采用的供试马铃薯块茎样品可能存在多种细菌病害复合侵染的情况,导致16S rDNA序列的测定后无法获得足够长度的重合序列。因此,在应用该DNA条形码技术检测马铃薯细菌病害时,需要对待检样品提取DNA时应确保是单一菌株侵染并保证提取的DNA质量良好。如果无法保证待检样品是单一病害侵染时,应先对待检样品进行菌株的分离培养,再逐一挑取病原菌进行16S rDNA序列的扩增等检测工作。同时,在检测过程中务必设立空白对照,以保证PCR反应未发生污染现象。
3.3DNA条形码技术检测马铃薯细菌病害的可行性
本文所应用DNA条形码技术是根据欧盟地区的检疫性细菌病害DNA条形码技术进行必要的改良后建立的。在本研究中,该技术在马铃薯环腐病检测的应用效果良好,可以作为马铃薯环腐病的一种检测体系在实际工作中应用。然而,该DNA条形码技术检测马铃薯青枯病时,可以获得“属”的鉴定结果,但是在“种”的鉴定中未能获得理想的检测结果,因此,该方法需要进一步对mutS基因或其他特异性基因进行筛选研究后,以获得更加准确的检测鉴定结果。
在马铃薯疮痂病的检测上,借鉴了马铃薯环腐病的检测方法,本研究发现该方法可检测S.scabiei(马铃薯普通疮痂病菌),而对于其他种的马铃薯疮痂病菌还将继续进行应用研究。在马铃薯黑胫病的检测中,虽然已知样品在16S rDNA序列中获得了准确的检测结果,但是在待检样品的检测中未获得良好的检测结果,因此,该DNA条形码技术在马铃薯黑胫病检测中应用需要配合以该病原菌特异性基因。
除2种马铃薯检疫性病害之外,本研究拓展了该DNA条形码技术的检测范围,将其应用在非检疫性病害的病原细菌(疮痂病和黑胫病菌)等方面。本研究初步构建的马铃薯4种细菌病害DNA条形码技术检测流程使得马铃薯种薯质量检测中独立的待检样品进行多种细菌性病害检测得以实施,待检样品首先经过16S rDNA序列的分类后,再进行具体病原菌种类的鉴定。而且标准操作和测序技术的相结合使得检测结果准确性高,还可以避免待检样品按照不同病害种类多次进行特异性PCR扩增的工作,大大缩减工作量。该项技术既可保证操作的标准性和结果的准确性,还大大提高马铃薯病害的检测效率,因此,该项技术在马铃薯种薯生产中应用潜力巨大。
[1]Hebert P D,Ratnasingham S,Waard J R.Barcoding animal life:cytochrome coxidase subunit 1 divergences among closely related species[J].Proc Biol Sci,2003,270(s1):96-99.
[2]Jordaens K,Goergen G,Virgilio M,et al.DNA barcoding to improve the taxonomy of the Afrotropical hoverflies(Insecta: Diptera:Syrphidae)[J].PLoS One,2015,10:1-15.
[3]Sizhu Z,Jialin L,Yihan W,et al.DNA barcoding identification of Dermestidae species[J].Mitochondrial DNA,2015,5:1-5.
[4]朱惠敏,连一阳,王中铎,等.基于cox1条形码的鱼肚DNA分子鉴定[J].广东海洋大学学报,2014,34(6):1-5.
[5]周美玉,陈骁,杨圣云.采用DNA条形码技术对厦门海域鱼卵、仔稚鱼种类的鉴定[J].海洋环境科学,2015,34(1): 120-125,135.
[6]王晓明,姬可平,牛宪力,等.DNA条形码与动植物分类学的研究[J].生物信息学,2012,10(2):83-86.
[7]陈士林,庞晓慧,罗焜,等.生物资源的DNA条形码技术[J].生命科学,2013,25(5):458-466.
[8]Liu Y,Sun W,Liu C,et al.Identification of Hippophae species (Shaji)through DNA barcodes[J].Chin Med,2015,10:1-11.
[9]Andreakis N,Hθj L,Kearns P,et al.Diversity of marine-derived fungal cultures exposed by DNA barcodes:the algorithm matters[J]. PLoS One,2015,10:1-22.
[10]陈岩,张立,刘力,等.我国检疫性有害生物DNA条形码信息系统建设[J].植物检疫,2014,28(1):1-5.
[11]张穗生,陈英,陈小玲.微生物DNA条形码技术的研究进展[J].广西科学,2015,22(1):27-30.
[12]田茜,张美,胡洁,等.植物病原细菌DNA条形码检测技术[J].植物检疫,2014,28(6):1-7.
[13]Humphris S N,Cahill G,Elphinstone J G,et al.Detection of the bacterial potato pathogens Pectobacterium and Dickeya spp.using conventional and Real-time PCR[J].Plant Pathology:Method in Molecular Biology,2015,1302:1-16.
[14]魏琪,胡林双,董学志,等.马铃薯环腐病菌Real-time Taqman-PCR检测体系的建立[J].中国马铃薯,2010,24(5): 301-305.
Detection of Four Bacterial Diseases of Potato by DNA Barcoding
WEI Qi*,MIN Fanxiang,ZHANG Shu,GAO Yunfei,DONG Xuezhi,WANG Wenzhong,YANG Shuai
(Virus-free Seedling Research Institute,Heilongjiang Academy of Agricultural Sciences,Harbin,Heilongjiang 150086,China)
ract:Potato is vulnerable to infection by a variety of bacterial diseases,especially quarantine diseases and soil-borne diseases,and to advance a comprehensive detection of bacterial diseases for seed potato bacterial disease is imperative.In this research,four bacterial diseases of potato,including potato ring rot,bacterial wilt,potato common scab, and black leg,were detected using DNA barcoding technique to investigate the application feasibility of the technology for potato bacterial disease testing.Known strains were used to assess the detection results.The DNA barcoding technique was good for potato ring rot and potato scab detection.Bacterial wilt was determined to genus level.Black leg could also be detected by combination of DNA barcode technology and specific gene.The DNA barcoding technique includes a standard method of operating procedures,and sequencing technology,which could achieve high accuracy of testing,reduce the workload of large-scale work in potato bacterial diseases testing,and improve the detection efficiency.
rds:DNA barcoding;potato;ring rot;bacterial wilt;common scab;black leg
S532
A
1672-3635(2016)02-0105-07
2016-01-15
黑龙江省青年科学基金项目(QC2012C063);现代农业产业技术体系专项资金资助(CARS-10-P14);国际合作项目(2013DFA31970);国家科技支撑项目(2012BAD06B02);公益性行业科研专项经费项目(201303015-9)。
魏琪(1981-),女,博士,副研究员,主要从事马铃薯病害检测技术的研发工作。
(Corresponding author):魏琪,E-mail:weiqi1981917@126.com。
